过表达BCL-2对急性脑梗死大鼠神经细胞凋亡及相关基因的影响
2017-07-01彭静华张育德张鸿日闫俊强
彭静华,张育德,张鸿日,闫俊强
过表达BCL-2对急性脑梗死大鼠神经细胞凋亡及相关基因的影响
彭静华,张育德,张鸿日,闫俊强
目的 探讨采用慢病毒介导BCL-2在急性脑梗死大鼠脑组织过表达对神经细胞凋亡及凋亡基因的影响。方法 45只大鼠随机分为假手术组、模型组和观察组。假手术组大鼠只分离血管不插入线栓,后两组采用线栓法建立大鼠大脑中动脉脑梗死模型。假手术组和模型组分别于手术前10 d通过颅内动脉给予慢病毒空载体,观察组给予慢病毒BCL-2过表达载体。在线栓法制作大鼠大脑中动脉脑梗死模型72 h后,分析大鼠脑组织中凋亡相关基因(caspase-3,Bax)的表达以及脑细胞凋亡情况。结果 慢病毒介导的BCL-2表达质粒可在大鼠脑组织中表达。观察组大鼠脑组织中BCL-2的水平明显高于假手术组和模型组。与假手术组相比,模型组、观察组大鼠脑组织caspase-3和Bax蛋白表达水平明显升高(均P<0.05),观察组大鼠脑组织中caspase-3和Bax蛋白的表达水平较模型组明显降低(均P<0.05),但仍显著高于假手术组(均P<0.05)。与假手术组比较,模型组和观察组脑组织神经细胞凋亡明显增加(均P<0.05)。结论 过表达BCL-2可降低大鼠脑组织神经细胞caspase-3和Bax蛋白的表达,降低凋亡水平,对神经具有一定保护作用。
脑梗死;BCL-2;细胞凋亡;caspase-3;Bax;大鼠
急性脑梗死具有高发病率、高死亡率、高致残率的特点,已经成为严重威胁人类健康的疾病类型之一[1]。急性脑梗死脑组织血液供应发生障碍,导致局部脑组织因缺血发生坏死、软化,在缺血中心不可逆坏死区域与正常脑组织之间存着缺血半暗带区,该区域的组织在功能上呈现可逆性损害,这部分神经细胞仍呈现正常的组织结构,但是在形态学上表现为凋亡状态[2]。而细胞的凋亡则是由基因调控细胞程序性死亡的过程,其中BCL-2是一个重要的与细胞凋亡相关的蛋白,其由239个氨基酸组成,在抑制细胞凋亡的过程中发挥着重要作用[3]。目前研究显示BCL-2基因和蛋白在急性脑梗死脑组织中表达下调,导致BCL-2家族成员Bax形成同源二聚体,使脑梗死细胞凋亡水平明显增加,加剧了脑梗死神经功能的损伤程度[4]。通过抑制脑梗死半暗带细胞的凋亡,则可达到保护神经功能的作用。本研究采用慢病毒介导BCL-2载体,探讨BCL-2在急性脑梗死大鼠脑组织特异性高表达,对大鼠脑神经细胞凋亡及凋亡相关基因的影响,现报道如下。
1 资料和方法
1.1 实验仪器和材料 SD大鼠(体质量180~200 g)购自上海斯莱克动物中心,HRP-羊抗鼠二抗购自北京中杉有限公司,Triozol购自Invitrogen公司,BCL-2、caspase-3和Bax鼠单克隆抗体购自美国Santa公司,TUNEL凋亡检测试剂盒购自南京诺唯赞生物有限公司。
1.2 急性脑梗死大鼠模型构建 采用LONGA的方法[5]建立大鼠大脑中动脉脑梗死模型。在手术后2 h内大鼠表现出精神萎靡、同侧霍纳氏症、对侧前肢下垂、内收内旋并自发性向患侧转圈说明建模成功。若无此表现说明构建模型失败,则剔除该大鼠。实验分为3组:假手术组、模型组和观察组,每组15只。假手术组大鼠只分离血管不插线栓,假手术组和模型组分别于手术前10 d通过颅内动脉给予慢病毒空载体(GC-FU-BCL-2),观察组给予慢病毒BCL-2过表达载体(GC-FU-EGFP)。
1.3 caspase-3和Bax蛋白的变化 大鼠建模72 h立即取出脑组织,置于液氮中,采用研钵将组织研碎,然后置于1×loading buffer中在100 ℃金属浴中煮沸10 min,样品12 000 r·min-1离心5 min,然后进行SDS-PAGE并将蛋白转移至PVDF膜上,用5%的脱脂奶粉封闭,然后用caspase-3和Bax一抗包被过夜,PBST洗涤3次,然后用HRP偶联的羊抗鼠二抗室温包被1 h,PBST洗涤3次,每次5 min,然后加发光液,显色,拍照。同时以β-actin作为内参,采用灰度计算软件分析目的蛋白条带灰度,计算目的蛋白的相对表达量。
1.4 TUNEL分析脑组织细胞凋亡水平 大鼠建模72 h后处死大鼠,脑组织采用OCT包埋,然后采用冰冻切片机将脑组织切成厚度为7 μm的切片,黏附于玻片上。然后按照TUNEL试剂盒说明书进行操作。大体操作流程如下:玻片采用4%多聚甲醛溶液(溶于PBS)固定,用2 mg·mL-1的Proteinase K溶液处理玻片,然后滴加100 μL1×Equilibration Buffer于标本区域,孵育30 min后弃液体,在玻片上滴加50 μL TdT孵育缓冲液。37 ℃孵育60 min。PBS洗涤3次,每次5 min,用滤纸轻轻擦掉样本周围及背面的PBS溶液。立即在荧光显微镜下分析样本。观察时标本放大400倍,随机选取梗死区周边的区域10个视野,计算凋亡细胞占总细胞的比例作为脑细胞的凋亡指数。
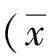
2 结果
2.1 BCL-2表达水平比较 与假手术组和模型组比较,观察组大鼠经慢病毒介导的BCL-2载体在脑组织中表达高水平的BCL-2蛋白。对3组大鼠脑组织中BCL-2蛋白的水平分析显示:观察组(0.936±0.218)大鼠脑组织中BCL-2的表达水平明显高于假手术组(0.390±0.118)和模型组(0.345±0.191)(P<0.05),见图1。
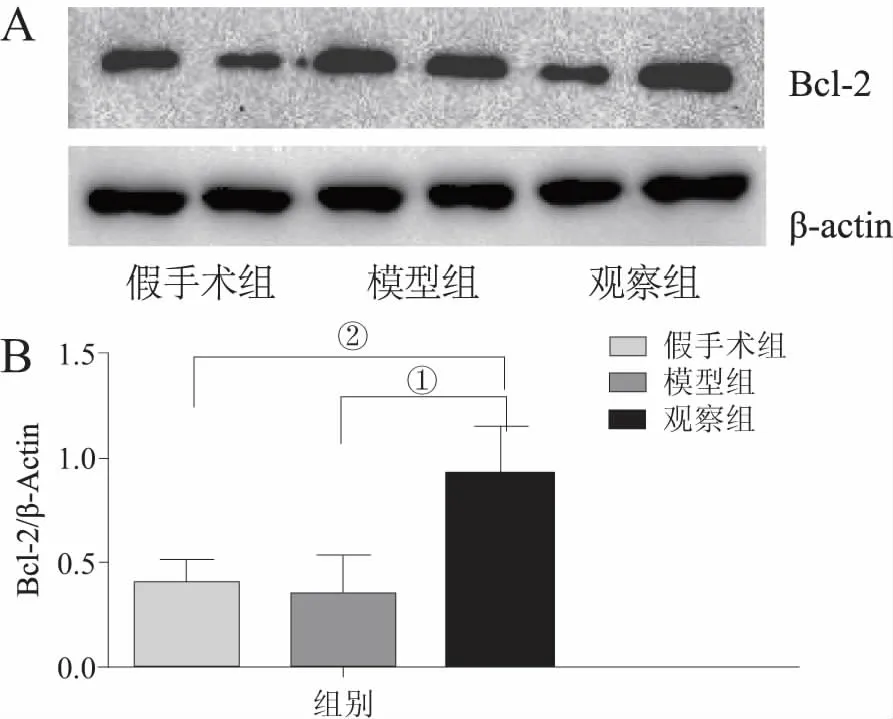
①与模组比较,P<0.05;②与假手术组比较,P<0.05。A:3组大鼠脑组织BCL-2表达B:3组大鼠脑组织BCL-2表达定量分析图1 3组大鼠脑组织中BCL-2蛋白的表达水平变化
2.1 不同处理组大鼠脑组织中caspase-3和Bax水平比较 与假手术组(0.225±0.179)比较,模型组(1.211±0.338)和观察组(0.585±0.216)大鼠脑组织中caspase-3的表达水平显著升高(P<0.05)。与假手术组(0.303±0.207)比较,模型组(1.500±0.408)和观察组(0.782±0.310)大鼠脑组织中Bax蛋白的表达水平显著升高(P<0.05)。而在慢病毒介导的BCL-2高表达的大鼠中,其脑组织中caspase-3和Bax蛋白的表达水平较模型组明显下降(P<0.05),见图2。

①与假手术组比较,P<0.05。A:3组大鼠脑组织caspase-3和Bax蛋白表达情况B:3组大鼠脑组织Caspase-3和Bax蛋白表达定量分析图2 3组大鼠脑组织中Caspase-3和Bax蛋白的表达水平变化
2.2 3组大鼠脑组织神经细胞凋亡比较 大鼠建模后72 h脑组织细胞凋亡指数和梗死范围明显增加,而在过表达BCL-2的大鼠脑组织中细胞凋亡指数降低,(如图3A所示)。对凋亡水平进行定量分析显示,与假手术组(2.95±1.93)比较,模型组(41.05±3.58)大鼠脑组织中细胞凋亡指数显著增加(P<0.05)。而观察组(12.84±2.32)大鼠脑组织中细胞凋亡指数较模型组(41.05±3.58)则显著性下降(P<0.05),但是其水平仍然显著高于假手术(2.95±1.93)组(P<0.05)(如图3B)。

①与假手术组比较,P<0.05。A:3组大鼠脑细胞凋亡情况 (TUNEL荧光染色 x400)B:3组大鼠脑细胞凋亡指数变化图3 3组大鼠脑组织细胞凋亡指数情况比较
3 讨论
细胞凋亡是指细胞在一定生理或者病理条件下,由许多基因精密调控的程序化死亡过程,是细胞维持自我稳定的重要机制[6]。目前研究发现急性脑梗死过程中半暗带区域细胞凋亡是治疗急性脑梗死的关键,这部分细胞具有可逆性,可通过抑制细胞凋亡使其恢复功能。因此有效抑制该区域细胞的凋亡对降低脑组织细胞凋亡,降低神经功能损伤具有重要的意义[7]。BCL-2是细胞凋亡调控中主要的调控蛋白,是主要的凋亡抑制蛋白。研究发现急性脑梗死BCL-2的表达水平明显下降,说明机体抗凋亡能力下降,细胞凋亡的稳态被打破[8]。因此通过重建脑组织中凋亡稳态环境,可能抑制脑梗死半暗带区域细胞的凋亡,对脑组织起到保护作用。
本研究采用慢病毒介导BCL-2在大鼠脑组织中过表达BCL-2,Western bolt显示观察组大鼠脑组织中BCL-2的表达水平明显增加,说明采用慢病毒作为传输载体可实现BCL-2在脑组织中的过表达。本研究进一步论证了过表达BCL-2对大鼠其他凋亡相关基因表达的影响。caspase-3是caspase级联反应下游最关键的凋亡直接介导者,其激活依赖于cyt-c的释放,而BCL-2家族包括BCL-2可通过线粒体途径介导cyt-c等物质的释放[9-10]。目前研究证实急性脑梗死大鼠和患者脑组织或外周血中caspase-3和Bax水平明显升高[11-12]。BCL-2可抑制细胞凋亡的发生,本研究发现BCL-2高表达后大鼠脑组织中caspase-3和Bax蛋白水平较模型组显著下降,说明BCL-2高表达具有抑制大鼠脑组织细胞凋亡的作用。这一现象通过TUNEL染色得到了进一步的确认。
综上所述,急性脑梗死大鼠脑组织高表达BCL-2可显著减少凋亡相关基因caspase-3和Bax的表达,抑制脑细胞凋亡,为急性脑梗死治疗药物研发提供了一定的理论基础。
[1]Arboix A,Alio J.Acute cardioembolic cerebral infarction: answers to clinical questions[J].Curr Cardiol Rev,2012,8(1):54-67.
[2] Hsieh FI,Chiou HY.Stroke:morbidity, risk factors, and care in taiwan[J].J Stroke,2014,16(2):59-64.
[3]Theofilas P,Bedner P,Hüttmann K,et al.The proapoptotic BCL-2 homology domain 3-only protein Bim is not critical for acute excitotoxic cell death[J].J Neuropathol Exp Neurol,2009,6(8):102-110.
[4] Youle RJ,Strasser A.The BCL-2 protein family:opposing activities that mediate cell death[J].Nat Rev Mol Cell Biol,2008,9(1):47-59.
[5] Sasaki M,Honmou O,Kocsis JD.A rat middle cerebral artery occlusion model and intravenous cellular delivery[J].Methods Mol Biol,2009,54(9):187-195.
[6] Elmore S.Apoptosis:a review of programmed cell death[J].Toxicol Pathol,2007,35(4):495-516.
[7] Ouyang L,Shi Z,Zhao S,et al.Programmed cell death pathways in cancer: a review of apoptosis, autophagy and programmed necrosis[J].Cell Prolif,2012,45(6):487-498.
[8] Liang K,Ye Y,Wang Y,et al.Formononetin mediates neuroprotection against cerebral ischemia/reperfusion in rats via downregulation of the Bax/BCL-2 ratio and upregulation PI3K/Akt signaling pathway[J].J Neurol Sci,2014,344(1):100-104.
[9] Salakou S,Kardamakis D,Tsamandas AC,et al.Increased Bax/BCL-2 ratio up-regulates caspase-3 and increases apoptosis in the thymus of patients with myasthenia gravis[J].In Vivo,2007,21(1):123-132.
[10]Yang B,Ye D,Wang Y.Caspase-3 as a therapeutic target for heart failure[J].Expert Opin Ther Targets,2013,17(3):255-263.
[11]Manabat C,Han BH,Wendland M,et al.Reperfusion differentially induces caspase-3 activation in ischemic core and penumbra after stroke in immature brain[J].Stroke,2003,34(1):207-217.
[12]Qiao H,Dong L,Zhang X,et al.Protective effect of luteolin in experimental ischemic stroke:upregulated SOD1,CAT,BCL-2 and claudin-5,down-regulated MDA and Bax expression[J].Neurochem Res,2012,37(9):2014-2024.
Effects of BCL-2 Overexpression on Neuronal Apoptosis and Related Genes in Rats with Acute Cerebral Infarction
PENG Jing-hua, ZHANG Yu-de, ZHANG Hong-ri, YAN Jun-qiang
(First Affiliated Hospital,Henan University of Science and Technology,Luoyang 471003,China)
ObjectiveTo investigate the effects of BCL-2 overexpression mediated bylentivirus on neuronal apoptosis and related genes in rats with acute cerebral infarction.Methods45 rats were randomly divided into sham group (only isolated vascular suture unplugged), model group and observation group. At 10 days before operation, rats in sham group and model group were treated with empty vector mediated by lentiviral;rats in observation group were treated with BCL-2 overexpression mediated by lentivirus null carrier. After middle cerebral artery infarction model were constructed at 72 h, the caspase-3, BCL-2, Bax protein apoptosis index of rat brain were analyzed.ResultsBCL-2 protein mediated by lentivirus could be expressed in rat brain. BCL-2 protein levels in observation group was significantly higher than that of sham group and model group(allP<0.05). Caspase-3 and Bax protein levels in model group was significantly higher than that of sham group(allP<0.05), while caspase-3 and Bax protein levels in observation group were significantly lower than that of model group(allP<0.05) , but it were significantly higher than that of sham group(allP<0.05). Apoptosis in model group and observation group was significantly higher than that of sham group (allP<0.05).ConclusionOverexpression of BCL-2 could reduce the level of apoptosis in rat of acute cerebral infarction and have a protective effect on brain.
cerebral infarction;BCL-2;apoptosis;caspase-3;Bax;rat
1672-688X(2017)02-0085-04
10.15926/j.cnki.issn1672-688x.2017.02.002
1.国家自然科学基金(U1304809) 2.河南洛阳市青年医学科技创新联合专项资金项目(1503008A-15)
2017-04-12
河南科技大学第一附属医院,河南洛阳 471003
彭静华(1980—),女,河南洛阳人,主治医师,从事神经内科临床工作。
张鸿日,男,副主任医师,E-mail:hongrizhang@126.com
R743.33
A
