蛋白激酶C epsilon信号通路介导褪黑素抗H9C2细胞缺血再灌注损伤的机制研究
2017-06-22翟蒙恩李步潆刘振华陈正希余鹏飞于立明梁宏亮段维勋金振晓俞世强
张 彬,翟蒙恩,李步潆,刘振华,陈正希,余鹏飞,于立明,梁宏亮,段维勋,金振晓,俞世强
·基础研究·
蛋白激酶C epsilon信号通路介导褪黑素抗H9C2细胞缺血再灌注损伤的机制研究
张 彬,翟蒙恩,李步潆,刘振华,陈正希,余鹏飞,于立明,梁宏亮,段维勋,金振晓,俞世强
目的 探讨褪黑素(Mel)在H9C2细胞缺血再灌注损伤过程中的保护作用及其机制,明确蛋白激酶C epsilon(PKCε)信号通路在此过程中的作用。方法 H9C2细胞经Mel(100 μmol/L)预处理12 h后,接受模拟缺血再灌注(SIR)损伤(缺血45 min,再灌注4 h),采用CCK-8法和TUNEL法分别检测细胞活力和凋亡率,使用酶活性测定法检测细胞中超氧化物歧化酶(SOD)的活性和丙二醛(MDA)的释放量,使用Western blot法检测细胞膜PKCε、细胞质PKCε、Bcl-2、Bax、Caspase-3和gp91phox蛋白的表达情况,并使用PKCε特异性阻断剂εV1-2观察PKCε信号通路在这一过程中发挥的作用。结果 经SIR处理后,H9C2细胞活力显著降低,凋亡率明显增加,PKCε膜转位减少,Bcl-2/Bax比例下调,Caspase-3与gp91phox蛋白表达量增加,细胞中MDA含量上升,SOD活力下降。Mel预处理可显著提高SIR处理后H9C2细胞活力,降低细胞凋亡率,促进 PKCε膜转位,上调细胞中SOD活性及降低MDA含量,并可降低Caspase-3与gp91phox蛋白表达量。而使用εV1-2阻断PKCε信号通路可逆转Mel的上述保护作用(均P<0.05)。 结论 Mel可通过激活PKCε保护性信号通路减轻SIR引起的H9C2细胞氧化应激损伤与凋亡。
褪黑素;缺血再灌注损伤;蛋白激酶C epsilon;氧化应激;凋亡
缺血性心脏病严重危害人类健康,其首要治疗策略是及时恢复缺血心肌的血流灌注,然而血流再灌注易加重心肌组织结构损伤及能量代谢障碍,诱发心肌缺血再灌注损伤(myocardial ischemia/reperfusion injury, MI/RI)[1-2]。这种损伤可导致血流障碍、心功能异常、炎症反应、内皮细胞损伤、心肌细胞坏死和凋亡,是由多种触发物、媒介物和效应器共同参与的复杂生物反应过程[3-4]。褪黑素(melatonin,Mel)是由松果体分泌的一种激素,近年来研究发现,Mel具有抗氧化应激进而减轻I/R损伤的作用,成为心肌保护研究领域的研究热点[5],然而其具体作用机制有待于进一步阐明。有研究报道,激活PKCε信号通路可显著减轻MI/RI,降低氧化应激水平[6],然而其是否介导Mel的心肌保护效应尚未见报道。同时,H9C2细胞系是来源于大鼠胚胎心脏组织的亚克隆细胞株,被广泛用于模拟心肌细胞进行心肌保护的药理学研究。本研究采用H9C2细胞系模拟缺血再灌注(simulated ischemia reperfusion,SIR)损伤模型,旨在研究Mel抗SIR损伤引发的氧化应激作用及其与PKCε信号通路的关系,并进一步探讨其潜在的心肌保护机制。
1 材料和方法
1.1 材料 H9C2细胞系(深圳百恩维公司);褪黑素,DAPI染液(Sigma-Aldrich公司),原位缺口末端标记法(TUNEL)检测试剂盒(Roche公司);质膜分离试剂盒(Thermo scientific公司);CCK-8细胞毒性检测试剂盒(七海生物公司);超氧化物歧化酶(SOD)检测试剂盒和丙二醛(MDA)检测试剂盒(南京建成生物工程研究所);Anti-PKCε和Anti-gp91phox(Santa Cruz公司);Anti-Bcl-2、Anti-Bax、Anti-Caspase-3抗体(Cell Signaling公司);Anti-β-actin抗体(CMCTAG公司);辣根过氧化物酶标记的羊抗兔、羊抗鼠IgG二抗(北京中杉金桥生物技术有限公司)。
1.2 仪器 CO2细胞培养箱(Thermo公司);超净工作台(苏州净化设备仪器厂);激光扫描共聚焦显微镜、倒置显微镜(Olympus公司);细胞用低速离心机(Saitexiangyi公司);Western blot电泳、转膜及发光成像设备(Bio-Rad公司);酶标仪(SpectraMax公司)。
1.3 方法
1.3.1 H9C2细胞的培养及SIR模型的建立 H9C2细胞的培养用含10%胎牛血清的DMEM细胞培养液在37℃,5%CO2培养箱内培养;SIR损伤通过模拟缺血液实现。缺血液配方为KCl 12 mmol/L、NaCl 137 mmol/L、CaCl2·2H2O 0.9 mmol/L、MgCl20.49 mmol/L、 HEPES 4 mmol/L、连二亚硫酸钠0.75 mmol/L、脱氧葡萄糖10 mmol/L、乳酸钠20 mmol/L,pH值调至6.5。加入缺血液的细胞培养板或培养瓶置于5% CO2的培养箱内培养45 min,缺血完成后更换正常DMEM在5%CO2的细胞培养箱中再灌注继续孵育4 h。
1.3.2 实验分组及CCK-8法细检测各组H9C2细胞活力 实验一:为探究Mel在SIR模型中的作用,将实验分为4组,分别为①Con组;②SIR组;③Mel+SIR组;④Mel+Con组,每组n=8,在SIR损伤前,Mel药物(100 μmol/L)预处理时间为12 h。实验二:为观察蛋白激酶C epsilon(PKCε)信号通路是否介导Mel抗SIR损伤的作用,在Mel处理前用PKCε特异性阻断剂εV1-2预处理1 h以阻断PKCε通路,实验分组如下:①SIR组;②Mel +SIR组;③εV1-2+Mel+SIR组;④εV1-2+SIR组,观察εV1-2对Mel抗H9C2细胞SIR损伤的影响,εV1-2浓度为10 μmol/L(已证实该浓度本身对SIR后细胞活力无明显影响)。各组处理后将培养液弃掉,用磷酸盐缓冲液(PBS)清洗3次,再加入100 μl无血清培养液和10 μl CCK-8检测液,避光置于37℃细胞培养箱孵育2 h,用酶标仪(波长为450 nm)检测各孔OD值。
1.3.3 细胞凋亡的TUNEL法检测 各组细胞处理后用PBS小心振荡洗涤3遍, 5 min/次。用0.1%的Triton X-100打孔5 min后再用PBS洗涤3遍,5 min/次。按照TUNEL检测试剂盒说明,将1号和2号液按照1∶9混合配制,避光37℃孵育1 h后用PBS振荡洗涤3遍,5 min/次。DAPI染细胞核避光37℃孵育5 min,PBS振荡洗涤3遍,5 min/次。激光扫描共聚焦显微镜照像。以发绿色荧光的细胞数占蓝色荧光的细胞数的百分比(%)表示细胞的凋亡率(apoptotic index)。
1.3.4 细胞中SOD活力及MDA含量检测 各组处理结束后,收集细胞,用PBS作为匀浆介质破碎后离心取上清,按照南京建成生物公司检测试剂盒说明书进行操作,检测细胞中SOD活性及MDA含量。
1.3.5 Western blot法检测细胞PKCε通路及相关蛋白表达水平变化 ①细胞总蛋白的提取:各组细胞处理结束后,用预冷的PBS小心洗涤1遍,用细胞刮刮下并收集细胞,加入含有PMSF(phenylmethanesulfonyl fluoride,苯甲基磺酰氟)的细胞裂解液,置于冰上作用30 min,随后以12 000 r/min离心20 min,取上清液用BCA(Bicinchoninic Acid,二辛可酸)法测定蛋白浓度进行蛋白定量,并调整至一致。②细胞膜、细胞质蛋白的提取:参照Thermo公司质膜分离试剂盒的方法进行,分别提取H9C2细胞细胞质和细胞膜蛋白,用BCA方法测定蛋白浓度进行蛋白定量,并调整至一致。各组蛋白经聚丙烯酰胺变性凝胶电泳(SDS-PAGE)分离蛋白,并用湿转法将蛋白转移到聚偏二氟乙烯膜(PVDF膜),5%脱脂牛奶室温封闭2 h后,分别孵育在PKCε(1∶500)、gp91phox(1∶500)、Bcl-2(1∶1 000)、Bax(1∶1 000)、Caspase-3(1∶1 000)、β-actin(1∶2000)中,4℃过夜孵育。TBST(Tris Buffered Saline,with Tween-20)洗脱3次后加入对应1∶5 000辣根过氧化物酶标记的羊抗兔、羊抗鼠IgG二抗,室温孵育2 h,TBST洗脱3次,通过Bio-Rad照相系统采集照片,用Image Lab软件对其进行分析,以β-actin作为内参,分别检测胞膜PKCε、胞质PKCε、gp91phox、Bcl-2、Bax和Caspase-3蛋白表达情况。
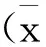
2 结 果
2.1 Mel对SIR损伤后H9C2细胞活力、凋亡率的影响 与Con组相比,SIR处理显著降低了H9C2细胞活力,且凋亡率明显增加(P<0.05),而Mel预处理显著提高了SIR损伤后H9C2的细胞活力,且凋亡率明显减少(P<0.05)。见图1、、Ⓒ。
2.2 Mel对SIR损伤后H9C2细胞中SOD活性和MDA含量的影响 与Con组相比,SIR损伤后H9C2释放的SOD的活性显著下降,而MDA含量显著上升(P<0.05)。给予Mel预处理后,一定程度上减少了SIR损伤后MDA的释放,提高了SOD活性(P<0.05)。见图1,。
2.3 Mel对SIR损伤后H9C2细胞PKCε蛋白及凋亡、氧化应激相关蛋白表达的影响 Western blot结果显示,与Con组相比,SIR处理显著降低了PKCε的膜转位水平,同时降低了抗凋亡蛋白Bcl-2表达,上调了凋亡蛋白Bax、Caspase-3及氧化应激标志蛋白gp91phox表达(P<0.05)。与SIR组相比,Mel预处理显著上调了PKCε的膜转位水平,同时增加了抗凋亡蛋白Bcl-2表达,下调了凋亡蛋白Bax、Caspase-3及氧化应激标志蛋白gp91phox表达(P<0.05)。见图2。
2.4 Mel与εV1-2共处理对SIR损伤后H9C2细胞的影响 给予PKCε阻断剂后检测细胞活力值发现,与Mel+SIR组相比,εV1-2+Mel+SIR组细胞活力显著下降,凋亡率明显增加(P<0.05);并且细胞中MDA含量明显增多,SOD活力显著下降(P<0.05)。与SIR组相比,εV1-2+SIR组对H9C2细胞活力、凋亡率及细胞中MDA含量、SOD活力均没有显著影响(P>0.05)。见图3。
2.5 Mel与εV1-2共处理对SIR损伤后H9C2细胞的影响 Western blot结果显示:与Mel+SIR组相比,εV1-2+Mel+SIR组PKCε的膜转位显著下降,氧化应激标志蛋白gp91phox表达显著增加(P<0.05);同时抗凋亡蛋白Bcl-2表达下降,凋亡蛋白Bax、Caspase-3表达增加(P<0.05)。与SIR组相比,εV1-2+SIR组未引起各蛋白表达显著变化(P>0.05)。见图4。
3 讨 论
缺血性心脏病严重危害人类的健康,其治疗核心是重新恢复缺血心肌的血液供应[4],然而,在恢复血流再灌注后,早期缺血心肌损伤加重,引起更多心肌细胞凋亡,心肌梗死面积变大,进一步损害心功能[7-8]。MI/RI损伤的机制复杂,钙超载、内质网应激、氧自由基损伤、能量代谢障碍、细胞凋亡自噬等均参与MI/RI损伤的发生发展过程[9-11]。其中氧化应激损伤在MI/RI损伤中扮演重要角色。Mel是松果体分泌的一种吲哚类激素,研究发现Mel对心血管系统的生理和病理作用具有明确的调节作用,尤其是具有显著抗MI/RI损伤的作用,且没有外源性药物的毒性和致突变性[5]。前期研究发现Mel对MI/RI损伤和血管内皮细胞氧化应激损伤有明确的拮抗作用[12-13]。因此,有效抗MI/RI损伤的策略之一是减轻再灌注诱发的氧化应激损伤。
PKC作为细胞内信号传导的重要递质,迄今发现至少有12种以上的亚型。PKC在细胞内分布为胞质和胞膜两部分,生理条件下胞质PKC没有活性,当受到一定条件的刺激后,胞质PKC转位到胞膜,作为酶活化的标志。其中,PKCε在众多亚型中发挥抗心肌缺血损伤的作用很明显。有研究报道,活化后的PKCε可由细胞质向细胞膜转位,最终导致细胞膜ATP依赖的钾通道(K-ATP)的开放,从而减少MI/RI[14]。另有研究称激活的PKCε能维持线粒体功能,减少细胞死亡[15-16]。PKCε可被外膜移位酶20(TOMM20)和热休克蛋白90(HSP90)诱导入线粒体,受G蛋白偶联受体、Akt或活性氧簇等刺激,PKCε能直接促使细胞色素C氧化酶等磷酸化,减少缺血预适应时ATP水解,保证呼吸链能量供应[17]。并且该信号通路同Bax和Bcl-2凋亡信号通路密切相关,可增加Bcl-2/Bax比例,最终抑制凋亡的发生[18]。
注: *与Con组相比P<0.05;#与SIR组相比P<0.05;$与Mel+SIR组相比P<0.05;Bcl-2、Bax、Caspase-3、gp91phox各蛋白表达量均以β-actin作为内参;PKCε转位以胞膜蛋白表达量与胞质蛋白表达量的比值为参照。图2 Mel对SIR处理的H9C2细胞胞质PKCε、胞膜PKCε、Bcl-2、Bax、Caspase-3、gp91phox等蛋白表达的影响
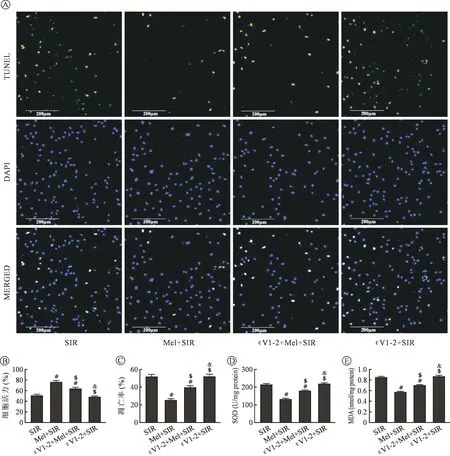
注: εV1-2+Mel+SIR:先阻断PKCε通路后,再进行药物处理及模拟缺血再灌注损伤组;εV1-2+ SIR:单纯阻断PKCε通路后,进行模拟缺血再灌注损伤组;εV1-2:PKCε特异性阻断剂;#与SIR组相比P<0.05;$与Mel+SIR组相比P<0.05;&与εV1-2+Mel+SIR组相比P<0.05。图3 εV1-2与Mel共处理对SIR处理后的H9C2细胞活力、凋亡率、SOD及MDA的影响
在本研究中笔者发现H9C2细胞SIR处理后细胞活力下降,凋亡率增加,PKCε膜转位减少,Bcl-2/Bax比例下调,Caspase-3、gp91phox蛋白表达量上升,细胞中MDA含量上升,SOD活性下降。Mel处理后可以逆转这些效应的发生,保护SIR损伤后的H9C2细胞。并且Mel的保护效应可以被PKCε阻断剂εV1-2抵消,进一步肯定了PKCε信号通路介导Mel对H9C2细胞的保护作用。
综上,本研究证实了Mel可以保护H9C2细胞抵抗MI/RI,其机制是激活PKCε保护性信号通路,减轻氧化应激损伤,抑制H9C2细胞的凋亡。

注: #与SIR组相比P<0.05;$与Mel+SIR组相比P<0.05;&与εV1-2+Mel+SIR组相比P<0.05;Bcl-2、Bax、Caspase-3、gp91phox各蛋白表达量均以β-actin作为内参;PKCε转位以胞膜蛋白表达量与胞质蛋白表达量的比值为参照。图4 εV1-2与Mel共处理对SIR处理后的H9C2细胞胞质PKCε、胞膜PKCε、Bcl-2、Bax、Caspase-3、gp91phox等蛋白表达的影响
[1] Hausenloy DJ, Yellon D M. Myocardial ischemia-reperfusion injury: a neglected therapeutic target[J]. J Clin Invest, 2013,123(1):92-100.
[2]赵国龙,张秋芳,翟蒙恩,等. 褪黑素受体对大鼠心肌缺血再灌注损伤的调控及其机制研究[J]. 中国体外循环杂志, 2015, 13(2):113-118.
[3]Buja LM. Myocardial ischemia and reperfusion injury[J]. Cardiovasc Pathol, 2005, 14(4):170-175.
[4] Yellon DM1, Hausenloy DJ. Myocardial reperfusion injury[J]. N Engl J Med, 2007, 357(11):1121-1135.
[5] Yang Y, Duan W, Jin Z,etal. JAK2/STAT3 activation by melatonin attenuates the mitochondrial oxidative damage induced by myocardial ischemia/reperfusion injury[J]. J Pineal Res, 2013, 55(3): 275-286.
[6] Simkhovich BZ, Przyklenk K, Kloner RA. Role of protein kinase C in ischemic "conditioning": from first evidence to current perspectives[J]. J Cardiovasc Pharmacol Ther, 2013,18(6): 525-532.
[7] Hou X, Guo L, Zhan Q,etal. Extracorporeal membrane oxygenation for critically ill patients with 2009 influenza A (H1N1)-related acute respiratory distress syndrome: preliminary experience from a single center[J]. Artif Organs, 2012,36(9):780-786.
[8] ARDS Definition Task Force, Ranieri VM, Rubenfeld GD,etal. Acute respiratory distress syndrome: the Berlin Definition[J]. JAMA, 2012, 307(23): 2526-2533.
[9]赵慧娟, 龙明智. 心肌缺血再灌注损伤机制的研究近况 [J]. 中西医结合心脑血管病杂志, 2005,3(3):240-242.
[10]徐志广, 卢绮萍. 内质网应激在缺血再灌注损伤中的研究进展 [J]. 华南国防医学杂志, 2012,26(2):186-188.
[11] 张文静, 崔丽艳, 张捷. 自噬与缺血再灌注损伤[J]. 检验医学, 2014,29(2):182-185.
[12] Patrono C, Garcia Rodriguez LA, Landolfi R,etal. Low-dose aspirin for the prevention of atherothrombosis[J]. N Engl J Med, 2005, 353(22):2373-2383.
[13] Warner TD, Nylander S, Whatling C. Anti-platelet therapy: cyclo-oxygenase inhibition and the use of aspirin with particular regard to dual anti-platelet therapy[J]. Br J Clin Pharmacol, 2011, 72(4):619-633.
[14] Pravdic D, Sedlic F, Mio Y,etal. Anesthetic-induced preconditioning delays opening of mitochondrial permeability transition pore via protein Kinase C-epsilon-mediated pathway[J]. Anesthesiology, 2009, 111(2):267-274.
[15] Dorn GW, Mochly-Rosen D. Intracellular transport mechanisms of signal transducers[J]. Annu Rev Physiol, 2002,64:407-429.
[16] Zhong GQ, Tu RH, Zeng ZY,etal. Novel functional role of heat shock protein 90 in protein kinase C-mediated ischemic postconditioning[J]. J Surg Res, 2014,189(2):198-206.
[17]周隆书,赵国龙,李明亮,等. 氧化苦参碱预处理对大鼠缺血再灌注损伤心肌保护作用及其机制研究[J]. 宁夏医科大学学报, 2015, 37(6):650-656.
[18]Yonekawa H, Akita Y. Protein kinase Cepsilon: the mitochondria-mediated signaling pathway[J]. FEBS J, 2008, 275(16):4005-4013.
Melatonin protects H9C2 cells against ischemia-reperfusion injury via protein kinase C epsilon signaling pathway
Zhang Bin, Zhai Meng-en, Li Bu-ying, Liu Zhen-hua, Chen Zheng-xi, Yu Peng-fei, Yu Li-ming,Liang Hong-liang, Duan Wei-xun, Jin Zhen-xiao, Yu Shi-qiang
DepartmentofCardiovascularSurgery,XijingHospital,FourthMilitaryMedicalUniversity,Shaan’xiXi’an710032,China
YuShi-qiang,Email:yushiq@fmmu.edu.cn
Objective To investigate the underlying mechanisms of the protective effect of melatonin (Mel) on simulated ischemia/reperfusion (SIR) injury in H9C2 cells and the role of PKC epsilon (PKCε) signaling pathway in this process. Methods The cultured H9C2 cells were pretreated with Mel (100 μmol/L) for 12 h and then subjected to SIR (45 min ischemia, 4 h reperfusion). Cell viability and apoptotic index were detected by CCK-8 and TUNEL methods, and the intracellular malondialdehyde (MDA) content and superoxide dismutase (SOD) activity were assessed by specialized kits. The translocation of protein kinase C epsilon (PKCε) and the expression levels of Bcl-2, Bax, Caspase-3 and oxidative stress marker gp91phoxwere detected by Western blotting. PKCε specific inhibitor εV1-2 was used to study the role of PKCε in this process. Results We found that SIR treatment reduced cell viability and increased apoptotic index, inhibited PKCε translocation and reduced the Bcl-2/Bax ratio. Mel pretreatment significantly increased cell viability and reduced apoptotic index, down-regulated the MDA content and up-regulated the SOD activity. In addition, Mel pretreatment significantly increased PKCε translocation and Bcl-2/Bax ratio and decreased the expression levels of Caspase-3 and gp91phox. However, these protective effects of Mel mentioned above were largely abolished by εV1-2 administration. Conclusion Mel pretreatment may protects H9C2 cells against SIR injury via attenuating oxidative stress and apoptosis in a PKCε-dependent manner.
Melatonin; Ischemia reperfusion injury; Protein kinase C epsilon; Oxidative stress; Apoptosis
10.13498/j.cnki.chin.j.ecc.2017.02.13
国家自然科学基金(81570230,81470415,81570231)
710032 西安,第四军医大学第一附属医院心血管外科
俞世强 Email: yushiq@fmmu.edu.cn
2017-02-14)
2017-03-22)
