对体外生命支持组织的抗凝指南解读
2017-06-22刘宏宇
邓 丽,刘宏宇,李 欣
·专家论坛·
对体外生命支持组织的抗凝指南解读
邓 丽,刘宏宇,李 欣
体外生命支持;抗凝;指南
过去的50年中,体外生命支持(extracorporeal life support,ECLS)相关设备和技术得到了很大程度的提高。但是,组织相容性、炎性反应和凝血激活导致出血以及血栓并发症还未得到有效解决。在ECLS期间, 为了抑制凝血活性、阻止血栓形成,必须进行抗凝治疗。最佳抗凝是最小程度的减少血栓形成,最大程度的保留内源性促凝活性减少患者出血。但实际上维持这种平衡是非常困难的。作者根据2014年Extracorporeal Life Support Organization(ELSO)网站发布的抗凝指南进行重点解读,希望对广大ECLS工作者有所帮助[1]。
1 ECLS前的血液检测
符合ECLS的适应证的患者,应进行血液检测获得相关信息,检测包含血常规(CBC),凝血酶原时间/国际标准化比率(PT/INR),部分凝血酶原时间(APTT),纤维蛋白原(Fibrinogen),D-二聚体(D-dimer),激活凝血时间(ACT),抗凝血酶(AT),血栓弹力图/旋转血栓弹力描记法(TEG/ROTEM)。如患者已经表现出凝血功能障碍,建议输入冰冻血浆(FP),血小板(Plt),冷沉淀以及维生素K来纠正凝血功能异常,这有利于后期的抗凝管理。
2 ECLS管路预充
红细胞以及新鲜FP可选择性应用于ECLS管路预充,每单位红细胞添加50~100 U肝素。紧急情况下可以先使用晶体预充,然后根据红细胞比容(Hct)结果进行调整。在未明确是否需要成分输血前可根据经验输注FP(10~20 ml/kg)和Plt(10~20 ml/kg)。
3 最佳肝素给予方式
肝素是ECLS中最常用的抗凝剂。其抗凝效果由两个内源性的抗凝剂相互作用来调节:AT和组织因子途径抑制物(TFPI)。肝素与AT-III相结合加速抑制凝血因子。肝素能抑制已形成的凝血酶,但是不能预防凝血酶的形成也不能抑制已结合纤维蛋白的凝血酶。
3.1 肝素弹丸式注射 ECLS插管时,给予肝素50~100 U/kg,然后持续泵入。如存在出血、近期接受过体外循环手术,无论是否经过鱼精蛋白中和都应调整相应肝素泵入剂量。建议患者做抗-Xa因子活性实验(手术室或者ICU)来评估肝素残留情况。
3.2 最小及最大肝素剂量范围 严重出血或刚接受心脏手术的患者不要立即启动肝素。给予20~50 U/(kg·h)肝素一般可维持ACT范围为180~220 s。输入Plt、尿量增加、使用肾替代治疗等,应增加肝素用量来维持目标ACT值。婴幼儿由于自身特殊凝血状况会使ACT值过高或者过低,导致抗凝过度的出血或者抗凝不足的血栓形成。因此,在一些新生儿/婴幼儿ECLS中心已采取最小肝素剂量10~20 U/(kg·h)以及最大肝素剂量40~50 U/(kg·h)剂量区间,而不完全按照ACT值来调整肝素剂量。
3.3 补充AT AT由肝脏产生,是所有丝氨酸蛋白酶内源性抑制剂(VIIa 蛋白质C除外),其主要的抗凝作用通过抑制凝血酶和凝血因子Xa 来实现。ECLS下肝素抗凝最佳AT水平仍不明确。同儿童以及成人相比,婴幼儿有较低的AT活性和抗原水平。婴幼儿和儿童ECLS中肝素需求增加。肝素剂量超过35~40 U/(kg·h)仍出现抗凝不足,应考虑获得性的AT功能缺陷而导致患者肝素抵抗。如果可以确认AT活性低(AT活性低于30%~80% 或是有临床证据发现肝素效应下降,或存在低水平ACT、低抗Xa因子水平并且高岭土与肝素酶TEG检测肝素效应不足),那么应该考虑补充AT浓缩物(血浆分离或者重组)。由于存在增加肝素抗凝效应的风险,因此输注AT浓缩物应降低肝素用量。对可疑或者确定低水平AT患者给予输注新鲜FP,然而,给予标准剂量的FP不易获得足够量的AT水平,主要是因为FP中的AT浓度只有(1 U/ml)。由于缺乏相关研究数据,因此在危重儿童中使用AT浓缩物的临床预后仍不清楚。
4 肝素监测
由于“标准化”的问题,每一种抗凝监测指标都有一定的局限性。因此找出最适合自己中心和患者的肝素监测方法是非常重要的。
4.1 ACT监测 ACT目前仍是ECLS下监测肝素最常用、有效的检测方式之一。ACT方便、快捷反应整体凝血功能。但其结果受多种因素影响,例如低体温、血液稀释、贫血、低纤维蛋白原血症、血小板减少症以及凝血因子缺陷等。不同ACT设备也呈现出结果的差异性。
4.2 抗-Xa监测 除了ACT监测外,建议采用抗-Xa因子活性(抗-Xa)实验作为检测和调整管理肝素以及最低剂量低分子肝素治疗的金标准。抗-Xa因子检测的不是肝素的浓度,而是基于肝素催化AT抑制Xa因子的能力来检测肝素的效果。抗-Xa因子实验不受凝血功能障碍、血小板减少以及稀释的影响,实验检测中不需要加入任何外源性AT,随着肝素剂量增加而抗-Xa因子浓度没有相应增加时应考虑到AT缺乏。高脂血症、高胆红素血症、以及高游离血红蛋白(溶血)会影响实验结果,尤其是在重症患者以及ECLS患者中。
研究表明[2-3]:抗-Xa因子水平与肝素有很好的剂量相关性,而抗-Xa因子水平与ACT的相关性较差。在凝血方面抗-Xa因子水平最大程度反应肝素效果。因为还有其它因素影响整体凝血而不仅是纤维蛋白形成,因此抗-Xa因子检测有时候被误读。尽管如此,抗-Xa因子检测指导抗凝应用的越来越频繁,比起其它方法有拥有更多的优势。建议ELSO中心使用抗-Xa因子检测作为其抗凝常规监测的一部分,维持目标值水平在0.3~0.7 IU/ml。但是由于缺乏“标准化”,抗-Xa因子检测对于肝素的反应也存在差异性。如果有出血或血栓的临床证据,应加强抗-Xa因子检测频率。
4.3 APTT监测 APTT是一种基于血浆的测试,使用一种激活剂(硅土、鞣花酸),钙、磷脂,在无血细胞成分的情况下检测纤维蛋白的形成时间。应用中等剂量肝素的成人患者中,APTT是一种有效的检测方法,婴幼儿患者的APTT基线值比较长,因此用它作为婴幼儿肝素抗凝指导可靠性较差。随着年龄的增长APTT和肝素剂量相关性更好。
4.4 TEG®和ROTEM TEG®是全血床旁检测项目,检测的血栓形成的黏弹性,用来评价整个凝血级联反应从纤维蛋白原形成到血栓溶解的整个过程。另外,还可以评价血小板的功能。TEG®/ROTEM提供全血凝血多个阶段的相关信息。TEG®/ROTEM普通和添加肝素酶(kTEG/hTEG or APTEM/HEPTEM)配对样本可以用来评估肝素抗凝情况。因此,通过普通与肝素酶试剂配对样本进行TEG®/ROTEM检测R 或者CT-时间的差异来反应肝素使用效果。特别是怀疑肝素抵抗时(ACT的水平与抗-Xa实验存在差异)尤为便利。使用TEG®还可用于评价花生四烯酸以及二磷酸腺苷对血小板的抑制程度。TEG®/ROTEM其他功能包括可以分析纤维蛋白原的功能以此来评估存在活动性出血的患者是否需要输入纤维蛋白原(冷沉淀或者纤维蛋白原浓缩物)。TEG®/ROTEM也同样可以评估纤溶亢进,与早期的DIC进行鉴别。早期DIC最主要的治疗是增大肝素剂量,而纤溶亢进需要抗纤溶治疗,例如使用氨甲环酸。
5 新型抗凝药潜在应用
5.1 直接凝血酶抑制剂(DTIs) DTIs是直接与凝血酶活性位点相结合的一类相对较新的短效抗凝剂。与肝素相比可以更好的预测其药代动力学,更多的减少凝血酶的形成。①DTIs是直接与凝血酶相结合,不依赖AT,在低水平或者AT活性不稳定的患者中更加可靠。②DTIs不结合其他血浆蛋白或者细胞,其结果不会因为每日血浆成分或者细胞计数而发生变化。因此,与肝素相比,DTIs具有更稳定的剂量与抗凝效应关系,这样能够保证持续的抗凝效应又使出血最少,在ECLS中使用非常的有利。③DTIs同时抑制血栓的结合和循环中的凝血酶,提高其工作效能。④DTIs不引起免疫调节血小板减少,例如,肝素诱导的血小板减少症(heparin induced thrombpenia, HIT)。因此,DTIs是未来几年中最值得期待药物。DTIs因没有拮抗剂,故限制其在常规体外循环中使用。然而,与体外循环不同,在ECLS中很少需要逆转全身抗凝。如果在严重出血的病例中需要,由于其半衰期相对较短的特性,可采取减量和暂停的措施来降低抗凝强度。目前已上市三种合成DTIs,阿加曲班(Argathoban),比伐卢定(Bivalirudin),重组水蛭素(Lepirudin)已经应用在体外循环,ECLS以及心室辅助装置(VAD)中。阿加曲班是ECLS中应用最多的药物,起始用量为0.5~1 mg/(kg·min),调节维持APTT 在基础值的1.5~2.5倍。在儿童ECLS中使用比伐卢定的起始推注剂量0.05~0.5 mg/kg 以及随后的泵入剂量维持在0.03~0.1 mg/(kg·h),随后调节维持APTT在基础值的1.5~2.5倍或者在医生的规定范围内。在长时间需要使用ECMO或者使用持续肾替代治疗的ECMO中,剂量需求可能会增加。使用任何抗凝剂应当考虑其潜在的出血风险。
5.2 新型口服抗凝药物 直接Xa因子抑制剂(利伐沙班、达比加群、阿哌沙班等)是一种新型的抗凝药物,可以直接抑X因子而不需要使用AT作为调节。目前只有利伐沙班(Xeralto®)上市,但是胃肠道的给药方式以及缺乏婴幼儿研究数据将限制它们在婴幼儿ECLS中的应用。
5.3 XIIa 因子抑制剂 有动物实验研究[4]在ECLS管路中使用XIIa因子抗体来抗凝,并与肝素抗凝进行比较。XIIa因子抗体阻止纤维素沉积以及血栓进展方面同肝素一样有效。然而,与肝素不同,这种抗体疗法并不损害凝血功能,也不增加伤口的临床出血风险。
5.4 一氧化氮(NO)和其他管路释放的物质 在体外循环管路中加入的外源性前列腺素以及NO可与肝素一道协同作用抑制血小板与异物表面间的相互作用,研究表明[5]可以降低血小板的激活和消耗。42 MAHAMA/NO是第一个NO释放多聚体,可加入高分子聚合物材料中用于制造体外循环管路中,可持续释放NO于循环血液中,不需要全身肝素化。在肝素化以及非肝素化对照研究中,这种含有MAHAMA/NO物质的体外循环管路明显降低血小板的消耗。
6 预防和管理出血和血栓并发症
6.1 关于输血指征的把握 ECLS中因为出血需要输入更多的红细胞,但同样也增加了输血并发症和死亡率风险,因此需要根据出血的严重程度决定输血指征和输血的量。
6.2 优化血制品应用 维持接近或者正常的红细胞比容(Hct)(0.35~0.40), PT/INR值不会因使用肝素明显延长,可用于评估外源性凝血途径。当INR 1.5~2.0 和/或出现明显的出血时,需要时可以输注FFP 10 ml/kg。 当出现肝素抵抗时,可以输注FP来补充AT,但是最好输入AT浓缩物。当纤维蛋白原水平低于1.0~1.5 g/L,可以输入冷沉淀。多次输入血小板10 ml/kg,维持血小板计>100×109/L,特别是在新生儿中尤为重要。老年患者合并低风险颅内出血患者,如在ECLS中病情稳定,血小板的输注指征可以降低。血小板功能试验可以评估血小板活性、聚集。出血危及生命者,推荐使用大量输血方案。在大量出血需要输血情况下可以考虑输入全血。
6.3 抗纤溶治疗 纤溶蛋白溶解剂,例如纤溶抑制物氨基已酸(6-氨基已酸),氨甲环酸(TXA)都用于外科术野出血(2011 STS and SCA guidelines,IIa-B)[6]。TEG®/ ROTEM 实验可以检测是否存在纤溶亢进,以作为抗纤溶治疗的指征。TEG®/ ROTEM 同样的也用于判断抗纤溶治疗是否为禁忌。
6.4 重组活化因子VII(rVIIa)和凝血酶原复合物 建议在难治性出血病例中使用rVIIa(2011 STS and SCA guidelines,IIb-C)。给予40~90 μg/kg的rFVIIa可以加强凝血酶的生成。但因有少数病例报告在ECLS中输注rFVIIa产生致命性血栓,因此应小心使用。主张低剂量rFVIIa(25~50 μg/kg),如果需要再次给予,输注时间应大于2~4 h。如认为输注rFVIIa风险较大者,也可输注凝血酶原复合物(PCC),它包含II、 VII、 IX 、X 因子(因为没有激活所以血栓形成风险小),还有一些包含蛋白质C和S。在ECLS患者合并活动性出血的患者中,为了矫正延长的PT以及肝素化的APTT,可以输入25~50 IU/kg的PCC。当使用了3个PCC时应当输入FP来补充VII因子避免DIC,尽量维持一个正常的AT活性。
6.5 管路中血栓并发症 血栓可以发生在管路的任何部位,特别是在血流瘀滞或者湍流部位,静脉管路(氧合器前)比动脉管路(氧合器后)更容易发生。大面积的血栓形成特别是合并严重溶血征象,须替换全部管路。ECLS支持时间越长,越容易出现血栓栓塞并发症。
6.6 HIT 可以使用疑似HIT患者临床研究(4Ts)评分系统(表1)用来预测HIT[7]。如果高度怀疑存在HIT、免疫试验阳性以及在未来有可能使用肝素,应进行验证性试验(流程参见图1)[8]。使用ELISA法检测抗肝素-血小板4因子复合物抗体。然而,只有少数的活化抗肝素-血小板4因子抗体亚群可以导致HIT,因此,此实验敏感性高但缺乏特异性,可能妨碍了一些本可以安全接受肝素抗凝的患者。另外由于技术难度比较高,只有很少的中心可以实施,限制了其应用。
建议对HIT需要使用ECMO 的患者,抗凝剂应改用达那肝素或凝血酶直接抑制剂来匹卢定,比伐卢定或阿加曲班(2011 STS and SCA guidelines,Ⅰ-C)。
7 管路组件
肝素涂层或者其他表面涂层处理的管路和组件可以允许数小时到几天内使用最小量或者不用肝素,

表1 4Ts评分系统
注:6~8分高度可能(21.4%~100%);4~5分中度可能(7.9%~28.6%);0~3分低度可能(0~1.6%)。
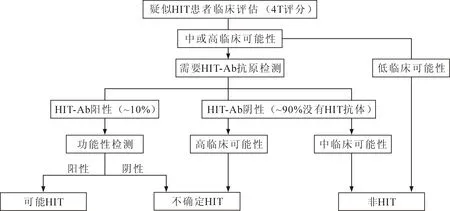
图1 HIT临床验流程图
有利于减少或者控制患者出血;特别适合于体外循环心脏手术后及或者其它外科操作。使用聚甲基戊烯(poly-methyl pentylene,PMP)设备,耐用并且炎性反应轻微,降低输血要求,这种材料制造的氧合器适合长期ECLS使用。
8 总结
每一个ECLS团队都应该提出最适合他们中心的ECLS患者的肝素抗凝监测方案。同时,与传统ECLS设备相比,新型ECLS管路和组件产生较少的血栓、溶血以及其他管路相关并发症。简化和改善ECLs设备,可减少ECLS相关并发症,改善患者预后。同样,请区别对待不同患者的抗凝策略以获得更加详细的抗凝指导,可参阅ELSO出版的抗凝资料获取详细信息[9]。
[1]Lequier L, Annich G, Ibrahim OA,etal. ELSO Anticoagulation Guideline. The Extracorporeal Life Support Organization (ELSO),2014. https://www.elso.org/Portals/0/Files/elsoanticoagulationguideline8-2014-table-contents.pdf.
[2]Nguyen T, Musick M, Teruya J. Anticoagulation monitoring during ECMO: Is anti-factor Xa assay (heparin level) a better test[J]? Pediatr Crit Care Med, 2014,15(2):178-179.
[3]Bembea MM, Schwartz JM, Shah N,etal. Anticoagulation monitoring during pediatric extracorporeal membrane oxygenation[J]. ASAIO, 2013,59(1):63-68.
[4]Larsson M, Rayzman V, Nolte MW,etal. A factor XIIa inhibitory antibody provides thromboprotection in extracorporeal circulation without increasing bleeding risk[J]. Sci Transl Med, 2014, 6(222):222.
[5]Jacobson J. Nitric oxide: platelet protectant properties during cardiopulmonary bypass/ECMO[J]. J Extra Corpor Technol, 2002, 34(2):144-147.
[6]Society of Thoracic Surgeons Blood Conservation Guideline,TaskForce, Ferraris VA,etal. 2011 update to the society of thoracic surgeons and the society of cardiovascular anesthesiologists blood conservation clinical practice guidelines[J]. Ann Thorac Surg, 2011, 91(3): 944-982.
[7]Lo GK, Juhl D,Warkentin TE,etal. Evaluation of pretest clinical score (4 T's) for the diagnosis of heparin-induced thrombocytopenia in two clinical settings[J]. J Thromb Haemost, 2006, 4(4):759-765.
[8]Arepally GM,Ortel TL. Clinical practice. Heparin-induced thrombocytopenia[J]. N Engl Med, 2006, 355(8):809-817.
[9]Lequier L, Annich G, Massicotte P. Anticoagulation and bleeding in ECLS. Extracorporeal cardiopulmonary support in critical care, fourth edition[J]. ELSO, 2012, Ann Arbor Michigan.
10.13498/j.cnki.chin.j.ecc.2017.02.03
国家临床重点专科建设项目
150006 哈尔滨,哈尔滨医科大学附属第一医院 心外科(体外循环)
李欣, Email: li.xin3@zs-hospital.sh.cn
2016-09-26)
2016-09-10)
