低氧条件下缺氧诱导因子-1对胎鼠心肌细胞内钙离子转运的影响
2017-06-22邓春玉邝素娟章晓华周成斌
张 力,邓春玉,邝素娟,章晓华,庄 建,周成斌
·基础研究·
低氧条件下缺氧诱导因子-1对胎鼠心肌细胞内钙离子转运的影响
张 力,邓春玉,邝素娟,章晓华,庄 建,周成斌
目的 观察低氧条件下缺氧诱导因子-1(HIF-1)对胎鼠心肌细胞内钙离子(Ca2+)转运的影响,探索胎儿心肌保护新方法。方法 取胎龄14~18 d Sprague-Dawley(SD)大鼠胎鼠的心肌细胞置于含5% CO2,3% O2和92% N2的三气培养箱在37℃下培养24 h,分3组进行干预:对照组;HIF-1激动剂(DMOG)100 μM(DMOG组);HIF-1抑制剂(Acriflavine)10 μM(Acriflavine组)。共同作用24 h后,分别进行实时荧光定量PCR(real time-PCR, RT-PCR)和免疫印迹分析(Western-blot)检测胎鼠心肌细胞HIF-1α、L型Ca2+通道(LCa)、T型Ca2+通道(TCa)、钠钙交换蛋白(NCX)、Ryanodine受体和肌质网Ca2+-ATP酶(SERCA2a) mRNA表达及蛋白水平。在激光共聚焦显微镜下观察心肌细胞内Ca2+浓度的变化。结果 RT-PCR结果显示HIF-1α的mRNA表达量DMOG组较对照组显著升高,Acriflavine组较对照组和DMOG组显著降低,TCa的mRNA表达量DMOG组较Acriflavine组显著升高、NCX的mRNA表达量DMOG组较对照组显著升高,Acriflavine组较对照组和DMOG组显著降低,Rynaodine受体的mRNA表达量Acriflavine组较对照组显著降低,DMOG组较Acriflavine组显著升高,SERCA2α的mRNA表达量Acriflavine组较对照组和DMOG组显著升高(P<0.05,n=5);Western-blot结果显示HIF-1α的蛋白表达量DMOG组较对照组及Acriflavine组均显著升高,LCa的蛋白表达量DMOG组较对照组及Acriflavine组显著升高(P<0.05,n=5)。激光共聚焦显微镜下测定钙荧光量,DMOG组较对照组及Acriflavine组显著增加(P<0.001,n=12)。结论 在低氧条件下,DMOG过度激活HIF-1,使胎鼠心肌细胞内Ca2+超载明显,Acriflavine抑制HIF-1活性,减轻胎鼠心肌细胞Ca2+超载,增强心肌细胞调节Ca2+的能力,对未成熟心肌起保护作用。
低氧;缺氧诱导因子-1;SD胎鼠;心肌细胞;钙离子转运
低氧是胎儿心脏发育过程中不可或缺的生长条件,研究显示低氧激活缺氧诱导因子(hypoxia-inducible factor-1,HIF-1),参与早期胎儿心脏的形成、冠脉血管的生长、流出道的成形和中后期的胎儿心脏发育等[1]。胎儿心肌细胞内钙离子(Ca2+)转运与心功能的改变密切相关。为了了解低氧条件下HIF-1对未成熟心肌细胞内Ca2+转运的影响,本研究通过对胎鼠心肌细胞在低氧条件下进行培养,并采用药物对HIF-1的活性进行干预,检测其对心肌细胞内Ca2+转运的影响,旨在探讨HIF-1在胎儿心肌保护中的作用。
1 材料与方法
1.1 实验药物 麻醉药物为地西泮注射液(10 mg/2 ml,上海旭东海普药业有限公司),氯胺酮注射液(100 mg/2 ml,福建古田药业有限公司);三抗、DMEM/F-12(1∶1)、PBS、胎牛血清(gibco公司,美国);二甲基乙二酰氨基乙酸(DMOG,Selleck),盐酸吖啶磺(Acriflavine,aladdin);氯仿、异丙醇、无水乙醇(广州中南化工);DEPC、Trizol、Premix EX TaqTM(Probe qPCR)、Prime ScriptTMRT reagent Kit、Oligod(T) Primer、Random Primer(TaKaRa);一抗试剂:NCX1、HIF-1-α-ChIP Grade、TPCN1、SERCA2 ATPase、GAPDH(内参)(Abcam);二抗试剂:Goat anti-rabbit IgG-HRP(SANTA CRUZ);PageRuler Prestained Protein Ladder(SM0671)(Fermentas);BeyoECL Plus(超敏ECL化学发光试剂盒)(P0018)(碧云天公司);SDS、TEMED(Sigma);丙烯酰胺、过硫酸铵、甘氨酸(Amresco);甲叉双丙烯酰胺(Fluka);Tris(Roche);1.5 mol/L Tris-HCl pH 8.8、1.0 mol/L Tris-HCl pH 6.8、TBST缓冲液、还原型SDS-PAGE 5×Loading Buffer(广州蓝吉生物技术有限公司);5×7胶片(柯达);PVDF膜(Millipore);脱脂奶粉(Biotoped);显影粉、定影粉(天津世纪奥博有限公司);甲醇(天津诺克有限公司)。
1.2 实验动物 Sprague-Dawley(SD)孕鼠,孕14~18 d,体质量约400 g,购于广州中医药大学实验动物中心,许可证号:SCXK(粤)2013-0034。
1.3 实验仪器 Stemi DV4型体式显微镜(ZEISS公司,德国);Spectrafuge 6C型高速离心机(Labnet公司,美国);二氧化碳培养箱(多气体型,SANYO,日本);荧光实时定量仪7300(ABI公司,美国);C1000 Thermal cycler PCR仪、Mini型蛋白电泳系统(BIO-RAD公司,美国);制冰机(Scotsman公司,美国);Scanspeed 1730R低温离心机(Labogene,丹麦);QL-901微型振荡器、旋涡振荡器(海门市麒麟医用仪器厂);脱色摇床(海门市其林贝尔仪器制造有限公司);LG2000数码凝胶图像分析系统(杭州朗基科学仪器有限公司);X射线摄影暗匣AX-Ⅱ(127 mm×178 mm)(广东粤华医疗器械厂有限公司);JJ100电子天平(常熟市双杰测试仪器厂);TGL-18R冷冻高速离心机(珠海黑马医学仪器有限公司);DK-8D电热恒温槽(上海-恒科技有限公司);岛津UV-1750紫外分光光度仪(日本)。
1.4 胎鼠心肌细胞原代培养 SD孕鼠,给予地西泮5 mg,氯胺酮50 mg肌注麻醉,按照常规无菌操作原则进行开腹,剖开子宫取出胎鼠。剪开胎鼠胸部取其心脏,放入含DMEM/F-12培养基的培养皿,去除外周血管、脂肪和结缔组织,用DMEM/F-12洗3遍,用眼科剪剪成1 mm3的块状组织,置于含1%胰酶液的离心管中,轻轻吹打后进行低速离心,弃上清。再加入1%胰酶液5 ml,反复吹打1 min,收集吹打消化后的液体,放入含10%胎牛血清5 ml的离心管中终止消化。依次反复,直至组织块完全溶解。将收集的液体用筛网过滤,1 000 rpm室温离心10 min。弃上清,加入4 ml含DMEM/F-12 45 ml+10%胎牛血清5 ml+三抗0.5 ml的不完全培养基,吹打成单细胞悬液,接种于培养皿内,于含5%CO2,3%O2和92%N2的三气低氧培养箱内37℃差速贴壁2 h,分离非心肌细胞,所得未贴壁细胞即心肌细胞。
1.5 分组加药处理 实验采取随机对照分组,分为三组:①对照组;②DMOG 100 μM(DMOG组);③Acriflavine 10 μM(Acriflavine组)。加药后置于含5% CO2,3% O2和92% N2的三气低氧培养箱中与药物共同作用24 h。
1.6 荧光实时定量PCR(RT-PCR) 测定HIF-1α、L型Ca2+通道(LCa)、T型Ca2+通道(TCa)、钠钙交换蛋白(NCX)、Ryanodine受体和肌质网Ca2+-ATP酶(SERCA2a) mRNA表达。参照文献[2-3]方法,用Trizol法提取总RNA,根据逆转录试剂盒提供方法进行逆转录,所得cDNA进行荧光实时定量PCR,反应体系见表1,引物设计及反应条件见表2,根据PCR反应的溶解曲线及曲线特征,评价引物增殖反应的特异性记录各样本反应的阈值(Threshold cycle,Ct),样本mRNA表达量计算:第一步:⊿Ct=Ct目的基因-Ct内参基因;第二步:⊿⊿Ct=⊿Ct-⊿Ct对照组/最大值;第三步:样本的相对表达量=2-⊿⊿Ct。
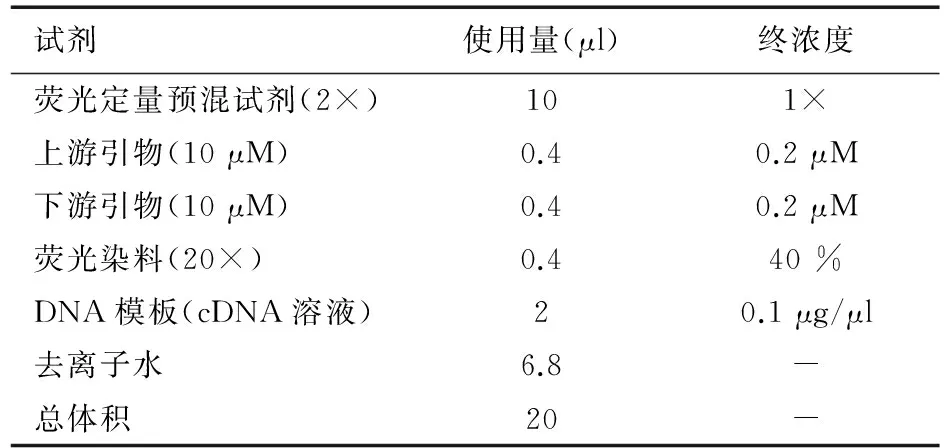
表1 RT-PCR反应体系
1.7 蛋白免疫印迹 检测胎鼠心肌细胞HIF-1α、LCa、NCX 和SERCA2a的蛋白表达。将上述分组培养的细胞去除培养液,加入细胞裂解液,离心后取上清进行蛋白定量。随后进行SDS-PAGE电泳,样品经过分离胶及浓缩胶,待溴酚蓝至分离胶下缘时停止电泳,随后进行转膜,将样品蛋白湿转至NC膜上。封闭后加入稀释后的抗体依次进行一抗孵育(抗体浓度分别为HIF-1α、LCa、NCX抗体1∶1 000,SERCA2a抗体1∶2 000)和二抗孵育(各抗体浓度均为1∶5 000),最后在暗室中进行ECL显色。显色结果拍照后采用灰度分析进行半定量分析。
1.8 Ca2+浓度动态变化测定 将细胞接种于专用的激光共聚焦培养皿,在培养箱内与10 μmol/L的fluo-4 AM(2 μl)避光37℃孵育30 min,孵育完毕后用HEPEs液漂洗3次,最后加入含钙的HEPEs液,通过激光共聚焦显微镜连续监测心肌细胞内Ca2+浓度变化,参照相关文献[4]设置参数,激发光为氩激光,波长488 nm,分辨率为512×512,扫描速度为400 Hz,选择时间序列xyt扫描模式,采图所需的总时间Duration为15 min,采集相邻两帧图像的时间间隔为1.5 s,在40倍长工作距离的物镜下动态观察Fluo 4-AM指示Ca2+的变化。图像采用软件IDL处理,钙荧光量⊿F/F0=(F-F0)/F0(F和F0分别代表某一时间点的荧光强度和本底的荧光强度)。
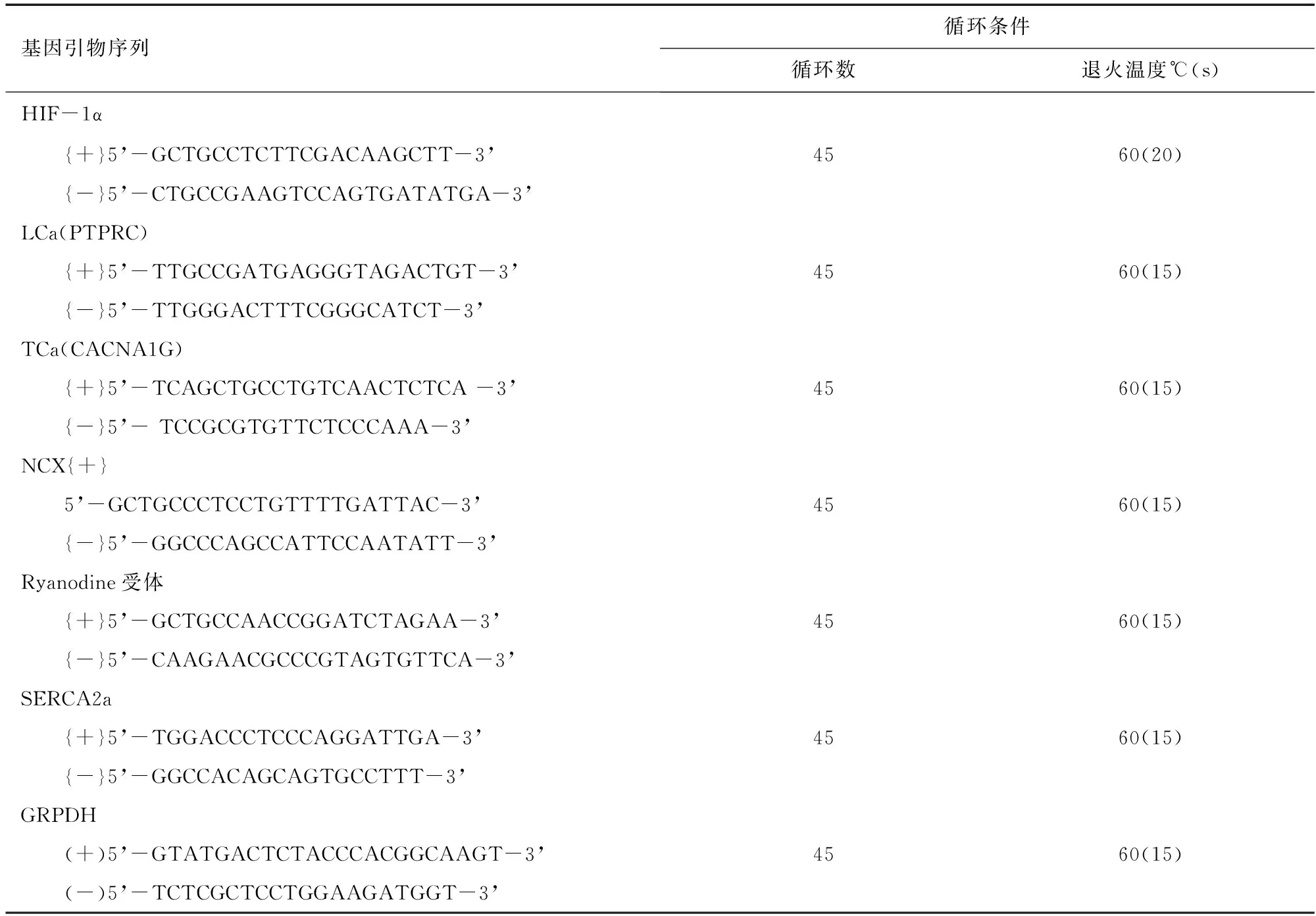
表2 RT-PCR寡核苷酸引物及扩增条件
1.9 统计学方法分析 所有实验数据以均数±标准差表示,应用SPSS 17.0软件进行统计分析,多组样本均数比较采用单因素ANOVA分析和LSD多重比较法。P<0.05为差异具有统计学意义。
2 结 果
2.1 胎鼠心肌细胞原代培养 在含5%CO2,3% O2,92% N2混合气体的低氧培养箱内37℃培养24 h后,于40×显微镜下可见心肌细胞贴壁生长,初为圆形,后变为梭形,单个细胞开始搏动。细胞逐渐在培养板铺展,伸出伪足,相互接触交织成网(见图1)。
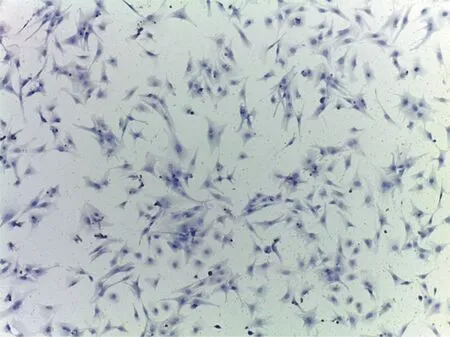
图1 心肌细胞原代培养(40×)
2.2 与药物共同作用后 分组加入药物后培养24 h,40×显微镜下观察细胞生长情况,DMOG作用下,细胞生长活跃,收缩有力,Acriflavine作用下,细胞生长缓慢,且收缩减弱(见图2)。
2.3 荧光实时定量PCR检测各基因mRNA表达量 RT-PCR结果显示HIF-1α的mRNA表达量DMOG组较对照组显著升高,Acriflavine组较对照组和DMOG组显著降低,TCa的mRNA表达量DMOG组较Acriflavine组显著升高、NCX的mRNA表达量DMOG组较对照组显著升高,Acriflavine组较对照组和DMOG组显著降低,Rynaodine受体的mRNA表达量Acriflavine组较对照组显著降低,DMOG组较Acriflavine组显著升高,SERCA2α的mRNA表达量Acriflavine组较对照组和DMOG组显著升高(P<0.05,n=5),见表3。
2.4 蛋白免疫印迹分析各基因蛋白水平 Westernblot结果显示HIF-1α的蛋白表达量DMOG组较对照组及Acriflavine组均显著升高,LCa的蛋白表达量DMOG组较对照组及Acriflavine组显著升高(P<0.05,n=5),见表4。蛋白电泳见图3。
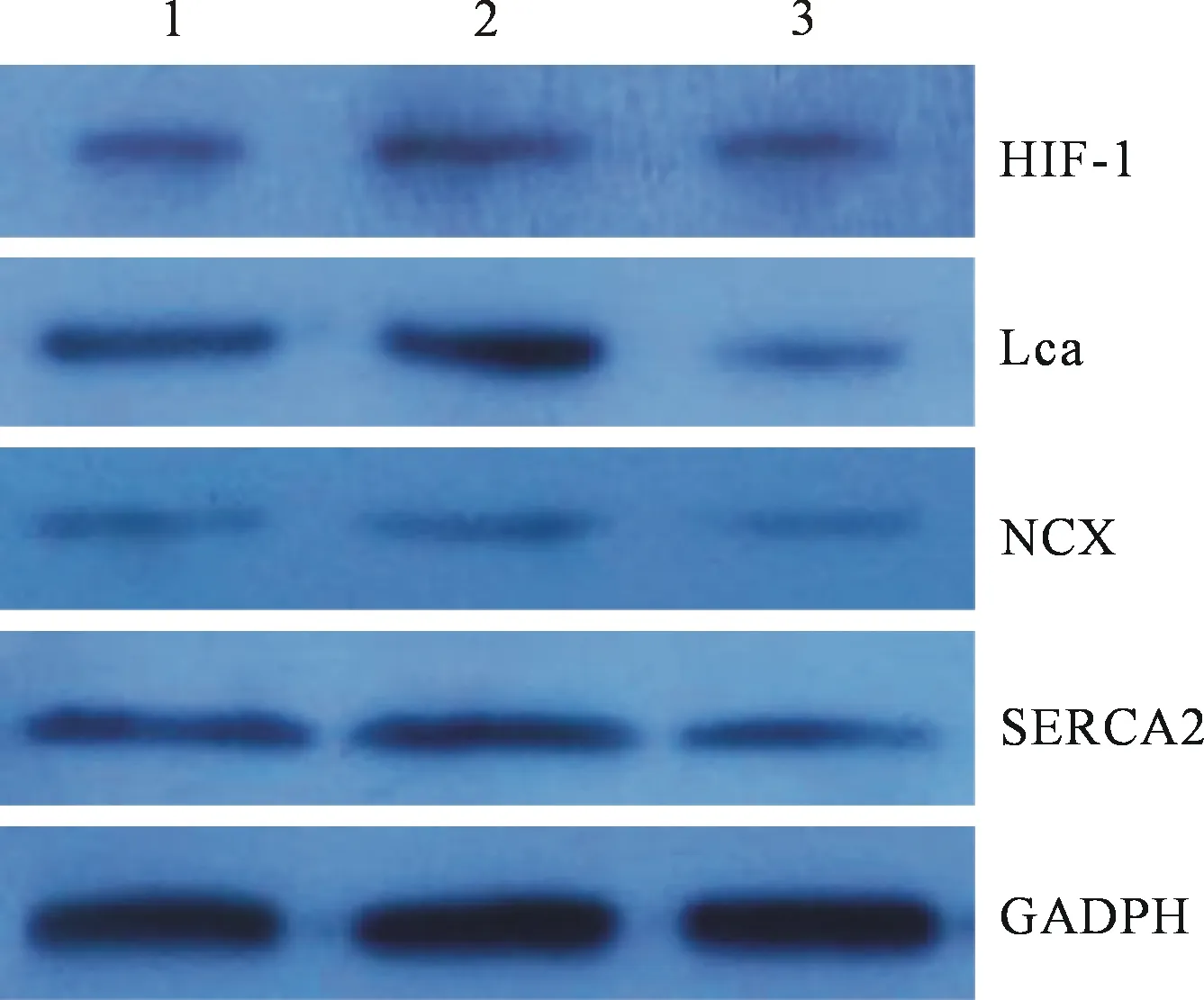
图3 Western-blot 检测各基因蛋白表达
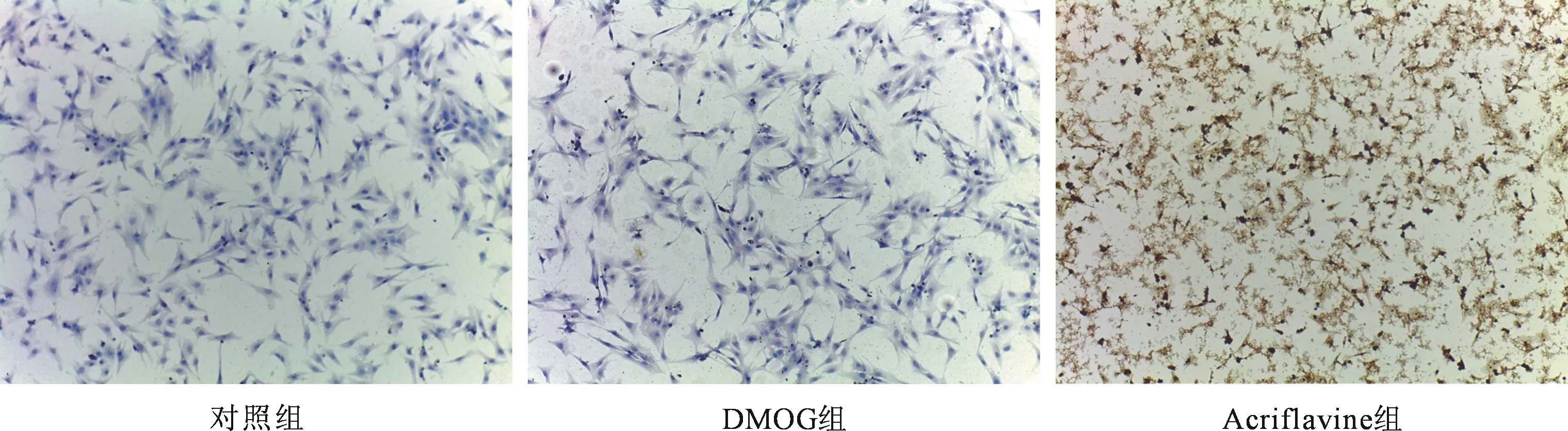
图2 药物作用后的心肌细胞(40×)

HIF-1αLCaTCaNCXRynaodine受体SERCA2α对照组1*111*1*1*DMOG组1.862±0.516*3.664±3.1101.736±0.976*1.814±0.652*1.123±0.191*2.539±0.769*Acriflavine组0.261±0.114*2.684±3.5270.242±0.270*0.300±0.149*0.282±0.114*16.577±6.767*
注:*表示组间两两比较有统计学意义P<0.05。
表4 Western-blot检测各基因蛋白表达
注:*表示组间两两比较有统计学意义P<0.05。

图4 心肌细胞钙瞬变
2.5 Ca2+浓度测定 激光共聚焦显微镜下可见钙瞬变,见图4。测量钙瞬变荧光量结果显示:DMOG组(14.054±3.236)显著大于对照组(8.062±1.350)和Acriflavine组(1.708±0.175),(P<0.001,n=12),见图5。
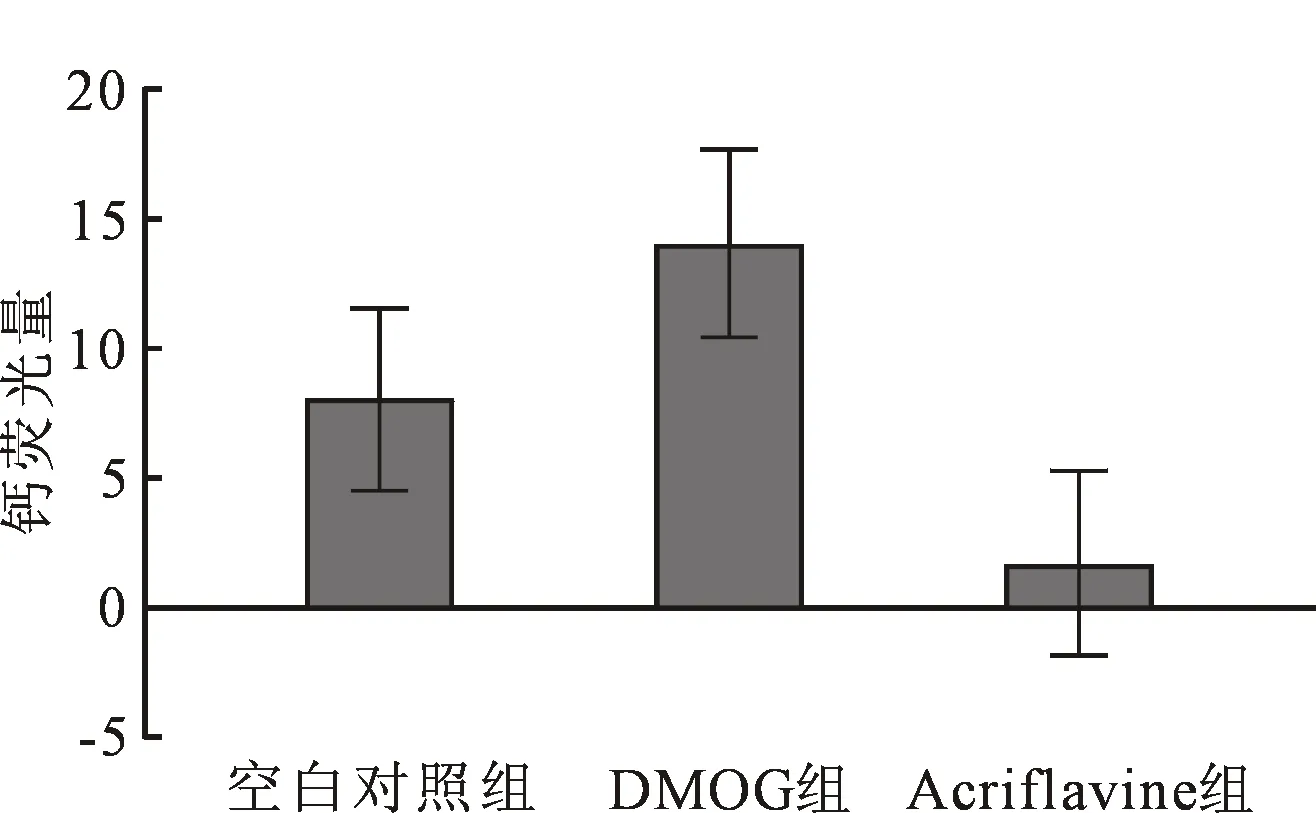
注:*表示组间比较有显著性差异P<0.001。图5 钙瞬变荧光量测定
3 讨 论
HIF-1是一个由氧敏感的α亚基和结构性表达的β亚基组成的异源二聚体。HIF-1β在细胞内的表达水平相对稳定,而HIF-1α的活性和表达水平受氧浓度的影响[5]。HIF-1α是细胞最早感受缺氧刺激的因子之一,常氧条件下HIF-1无DNA结合活性,而在低氧条件下其表达显著升高[6]。常氧下HIF-1α被脯氨酸羟化酶(prolyl hydroxylase,PHD)作用后,经泛素-蛋白酶体途径迅速被降解;低氧下PHD受到抑制,HIF-1α稳定性增强,转移到细胞核与HIF-1β形成HIF-1,作用于靶基因的缺氧反应元件,激活转录过程,其调控基因涉及胎儿心脏发育的多个环节[7]。
心肌细胞内Ca2+转运与心功能密切相关。尽管胎儿心肌细胞肌质网(sarcoplasmic reticulum,SR)的Ca2+储备较少,但是SR仍然是钙诱导钙释放(calcium induced caldium release,CICR)机制中Ca2+释放和回收的重要细胞器。通过Ca2+通道进入细胞内的Ca2+作用于SR膜上的Ryanodine受体,启动 CICR机制,SR释放Ca2+,与细胞外进入的Ca2+一起产生钙瞬变,促进肌丝的滑动,发生心肌收缩现象;达到钙瞬变的峰值后,SERCA2a、 NCX等转运蛋白将胞浆内增多的Ca2+回收到SR内或泵出细胞外,使胞浆内Ca2+浓度迅速下降,肌丝滑动复员,心肌舒张[8]。Ryanodine受体参与了心肌的兴奋收缩耦联、心脏起搏和心率失常的过程,维持了心肌细胞ATP的生产和生存[9],其表达随着HIF-1活性的增加而上调。SERCA2a基因在钙回摄中有重要作用,在SERCA2a编码基因的启动子上有HIF-1结合的缺氧反应元件,研究显示低氧和HIF-1抑制胚胎心肌细胞SERCA2a的表达和活性[10]。NCX在心肌细胞膜上是一个非ATP依赖的双向钙离子转运蛋白,低氧下细胞内氢离子增多,促进钠氢交换和NCX转运,增加Ca2+内流,细胞内Ca2+超载是缺血心肌在再灌注过程中细胞凋亡、坏死、以及心功能降低的重要原因。
在既往研究[11-15]的基础上,笔者使用DMOG来减少HIF-1α的降解,促进HIF-1的活性,而Acriflavine可以干扰HIF-1α和HIF-1β的结合,抑制HIF-1的活性。经本研究分析,DMOG过度激活HIF-1,使Ca2+通道及Ryanodine受体表达增强,抑制了SERCA2a的表达,降低SR摄取Ca2+的能力,同时上调NCX的表达,NCX促进Ca2+内流,减少Ca2+排出,从而产生Ca2+超载,激活Ca2+依赖的蛋白酶,影响心肌收缩蛋白的功能,产生心功能不良。相反,Acriflavine抑制了HIF-1的活性,Ca2+通道及Ryanodine受体表达减弱,SERCA2a的表达上调,SR摄取Ca2+的能力增强,钙瞬变现象不明显,减少心功能损害。
综上所述,在低氧条件下,DMOG过度激活HIF-1,使胎鼠心肌细胞内Ca2+超载明显,Acriflavine抑制HIF-1活性,减轻胎鼠心肌细胞Ca2+超载。因此,笔者认为HIF-1在调节低氧条件下的胎鼠心肌细胞内Ca2+的转运发挥重要作用,抑制HIF-1活性可以对未成熟心肌起保护作用。
[1]Patterson AJ, Zhang L. Hypoxia and fetal heart development [J]. Curr Mol Med, 2010, 10(7): 653-666.
[2]梁赅,杜伟,李爽,等. 抑制HIF-1α表达对低氧培养SGC-7901胃癌细胞CD44表达的影响 [J]. 实用癌症杂志,2015, 30(9):1269-1272.
[3]Zhang H, Liu LH, Shi M,etal. Sphingosine kinase 1 promotes glioma cell proliferation under hypoxia via calcium signaling[J]. Nan Fang Yi Ke Da Xue Xue Bao, 2015,35(7):1014-1018.
[4]管倩楠,段斐,吴银玲,等. 用于钙信号研究的小鼠心室肌细胞急性分离的优化 [J]. 医学研究与教育,2016,33(2):6-11.
[5]Zampino M, Yuzhakova M, Hansen J,etal. Sex-related dimorphic response of HIF-1α expression in myocardial ischemia[J]. Am J Physiol Heart Crie Physiol, 2006, 291(2): 957-964.
[6]王苹苹,孔繁平,陈学群. 低氧细胞应激的HIF-1信号通路[J]. 浙江大学学报(医学版),2011, 40(5):559-566.
[7]Hashmi S, Al-Salam S. Hypoxia-Inducible factor-1 alpha in the heart: A double agent[J]? Cardiol Rev, 2012, 20(6): 268-273.
[8]Endoh M. Signal transduction and Ca2+ signaling in intact myocardium[J]. J Pharmacol Sci, 2006, 100(5):525-537.
[9]Bround MJ, Wambolt R, Luciani DS,etal. Cardiomyocyte ATP production, metabolic flexibility, and survival require calcium flux through cardiac ryanodine receptors in vivo[J]. J Biol Chem, 2013, 288(26):18975-18986.
[10]Ronkainen VP, Skoumal R, Tavi P. Hypoxia and HIF-1 suppress SERCA2a expression in embryonic cardiac myocytes through two interdependent hypoxia response elements[J]. J Mol Cell Cardiol, 2011, 50(6): 1008-1016.
[11]Reddy VM, Liddicoat JR, Klein JR,etal. Long-term outcome after fetal cardiac bypass: fetal survival to full term and organ abnormalities[J]. J Thorac Cardiovasc Surg, 1996, 111(3): 536-544.
[12]Fenton KN, Zinn HE, Heinemann MK,etal. Long-term survivors of fetal cardiac bypass in lambs[J]. J Thorac Cardiovasc Surg, 1994, 107(6): 1423-1427.
[13]Duffy JY, Petrucci O, Baker RS,etal. Myocardial function after fetal cardiac bypass in an ovine model[J]. J Thorac Cardiovasc Surg, 2011, 141(4): 961-968.
[14]Heeb EA, Baker RS, Lam C,etal. Role of natriuretic peptides in cGMP production in fetal cardiac bypass[J]. Ann Thorac Surg, 2009, 87(3): 841-847.
[15]周成斌, 张镜芳, 庄建, 等. 胎羊心脏转流对胎羊心功能的影响[J]. 中华胸心外科杂志. 2007; 23(5): 329-331.
Effects of hypoxia-inducible factor-1 on intracellular calcium transport in fetal rat cardiomyocytes under hypoxia
Zhang Li, Deng Chun-yu, Kuang Su-juan, Zhang Xiao-hua, Zhuang Jian, Zhou Cheng-bin
GuangdongCardiovascularInstitute,DepartmentofCardiovascularSurgeryofGuangdongGeneralHospital,GuangdongAcademyofMedicalSciences,Guangzhou510080,China
ZhouCheng-bin,Email:zcbwwww@163.com
Objective This study aimed to investigate the effects of hypoxia-inducible factor-1 (HIF-1) on intracellular calcium (Ca2+) transport in fetal rat cardiomyocytes under hypoxia and to explore new methods of myocardial protection. Methods Cardiomyocytes from Sprague-Dawley (SD) rat aged 14~18 days were isolated and placed in a tri-gas incubator containing 5% CO2, 3% O2, and 92% N2. Cell culture was maintained at 37℃ for 24 h and divided into , control group, the group treated with HIF-1 agonist (DMOG group), and the group treated with HIF-1 inhibitor (Acriflavine group). Real-time fluorescent quantitative PCR (RT-PCR) and Western blotting were used 24 hours after treatment to detect the mRNA and protein expression of HIF-1α, L-type Ca2+channels, T-type Ca2+channels, sodium-calcium exchanger (NCX), ryanodine receptors, and Ca2+-ATPase of sarcoplasmic reticulum (SERCA2a) . The change of intracellular Ca2+concentration in cardiomyocytes was monitored by a laser scanning confocal microscope.
Results mRNA expression of HIF-1α in the DMOG group was significantly higher and that of Acriflavine group was lower than control group. T-type Ca2+channels mRNA in the DMOG group was higher than Acriflavine group. DMOG group had a increased level of NCX, where as the Acriflavine group showed a significantly reduced level. Acriflavine group had lower expression of ryanodine receptors but higher SERCA2a mRNA expression (P<0.05, n=5). Western blotting results showed an enhance dexpression of HIF-1α and L-type Ca2+channels in DMOG group. (P<0.05, n=5). The amount of calcium fluorescence in DMOG group was significantly higherthan control and Acriflavine group (P<0.001, n=10). Conclusions Under hypoxia, DMOG over activates HIF-1 and can lead to significant intracellular Ca2+overload inside cardiomyocytes of fetal rats. Acriflavine is capable of inhibiting the activity of HIF-1 and reducing the intracellular Ca2+load inside the cardiomyocytes,which may protect immature myocardium.
Hypoxia;Hypoxia-inducible factor-1;SD rat fetus;Cardiomyocyte;Calcium transport
10.13498/j.cnki.chin.j.ecc.2017.02.12
国家自然科学基金项目(81370274)
510080 广州,南方医科大学,广东省心血管病研究所,广东省华南结构性心脏病重点实验室(张 力,周成斌);广东省人民医院医学研究中心,广东省心血管病研究所(邓春玉,邝素娟);广东省心血管病研究所,广东省华南结构性心脏病重点实验室,广东省医学科学院(章晓华,庄 建)
周成斌,E-mail: zcbwwww@163.com
2016-12-22)
2017-01-16)
