生物炭对温室黄瓜根际土壤真菌丰度和根系生长的影响
2017-06-05李发虎刘金泉张清梅赵恒栋
李发虎 李 明 刘金泉 胡 云 张清梅 赵恒栋
(内蒙古农业大学职业技术学院, 包头 014109)
生物炭对温室黄瓜根际土壤真菌丰度和根系生长的影响
李发虎 李 明 刘金泉 胡 云 张清梅 赵恒栋
(内蒙古农业大学职业技术学院, 包头 014109)
利用玉米秸秆生物炭,以日光温室黄瓜为试验对象,以土壤分别施入20、40、60 t/hm2生物炭为处理,研究玉米秸秆生物炭施用对黄瓜根际土壤真菌群落和根系生长的影响及其机制。试验结果表明:土壤中生物炭施用量为20~60 t/hm2时,在黄瓜结果期可不同程度提高根系数、根系体积和根系活力,显著提高真菌中子囊菌门和接合菌门的丰度,增加担子菌门、壶菌门和球囊菌门丰度而极大降低杂菌比例,明显提高子囊菌门Incertaesedis27、毛壳菌科、小子囊菌科、毛球壳科、假散囊菌科等11个科以及接合菌门被孢霉科、球囊菌门球囊霉科、担子菌门粪锈伞科、壶菌门小壶菌科的丰度;生物炭处理土壤后,子囊菌门Incertaesedis27、毛球壳科、假散囊菌科、黄丝菌科和接合菌门被孢霉科的真菌在促进根系生长方面的作用最为明显,主要通过根被组织聚集、促进根系对营养元素吸收、提高土壤中有机质和养分含量、促进土壤中有机物质分解等而最终有利于黄瓜的根系生长。综合分析认为,生物炭施用量20 t/hm2处理效果最为明显,与对照相比,根系数、根系体积和根系活力分别提高20.52%、50.73%和16.11%。
黄瓜; 生物炭; 真菌丰度; 根系生长; 根际土壤; 温室
引言
我国是农业秸秆产出大国,利用农业秸秆制备生物炭并在农业生产中应用,有利于资源的合理化应用和优化作物的根际生长微环境[1],符合我国农业生产的生态、绿色和可持续发展方向。生物炭丰富的表面积和官能团可改善土壤理化性质和生物学特性,提升土壤肥力[2],增加土壤营养元素,改善离子交换量,为有益微生物提供良好生态环境[1]。研究表明,土壤中施用生物炭后可促进番茄、胡椒、芹菜等蔬菜作物的生长发育,最终提高这些作物的产量[2]。真菌是土壤微生物的重要成员,推动着土壤生态系统能量流动和物质循环,在土壤中发挥着重要的分解作用,研究表明,青霉属(Penicillium)真菌能分解土壤中纤维素、果胶、木质素、淀粉等物质[3],接合菌门(Zygomycota)中的毛霉属(Mucor)、根霉属(Rhizopus)、被孢霉属(Mortierella)等真菌能分解土壤中的糖类和简单多糖物质[4],而毛壳属(Chaetomium)、镰刀菌属(Fusarium)、木霉属(Trichoderma)等真菌是土壤中常见的纤维素分解者[5]。JIN[6]对农田施用0~30 t/hm2生物炭发现,生物炭处理使土壤中多核体真菌逐渐成为优势种,该种类真菌能降解土壤中的简单糖类,推测可能与生物炭表面吸附的有机碳诱导有关。
由秸秆转化成的生物炭可以改善土壤肥力,提高肥料利用效率,使作物稳产和增产的同时可修复农田生态环境,实现农业可持续发展[7]。目前关于生物炭影响作物生长方面的研究较多,但是影响土壤真菌菌群生长的研究较少。本文利用玉米秸秆生物炭改良日光温室土壤,研究生物炭影响黄瓜结果期根际土壤真菌群落和根系生长因子变化及其机制,以期为生物炭在日光温室土壤改良和黄瓜绿色生产中的应用提供理论依据。
1 试验材料和方法
1.1 试验材料
试验于2016年3—7月份在内蒙古农业大学日光温室基地开展,试验用日光温室使用年限18年,南北跨度7 m,脊高3.2 m,东偏南8°,东西长52 m,供试黄瓜品种为“津春改良2号”。土壤性质为砂壤土,容重1.26 g/cm3,速效养分碱解氮、速效磷和速效钾质量比分别为140.34、155.44、57.57 mg/kg。生物炭在玉米秸秆高温缺氧下制成,C、N和H质量分数分别为47.17%、0.71%和3.83%,碳氮比为0.670 3,pH值9.04,有机质、碱解氮、速效磷和速效钾质量比分别为925.74 g/kg、159.15 mg/kg、394.18 mg/kg和783.98 mg/kg,购于辽宁金和福农业开发有限公司。
1.2 试验方法
采用田间试验法,以土壤不施入生物炭为对照(CK),设3种处理:分别在黄瓜定植前土壤表层0~30 cm处均匀施入20、40、60 t/hm2生物炭,依次记为C20、C40和C60处理。黄瓜苗4月10日定植,种植密度42 000株/hm2,各处理小区面积14 m2,重复3次,各处理生长期水肥等管理措施一致。在黄瓜结果期(6月15日),用抖落法分别取各处理的6处样地根际0~20 cm处土壤均匀混合,测定真菌物种群落。同时,测定黄瓜植株根系数、根冠比、根系体积和根系活力,重复测定6次。
1.3 测定方法
真菌菌群用ITS(Internal transcribed spacer)序列高通量测定,遵循Illumina测序仪文库构建方法,以ITS2为目标区域进行引物设计,使用DNA模板50 ng和25 μL的PCR体系,Phusion酶扩增25~35个循环,一轮PCR扩增反应后引物两端分别加上不同Barcode以区分不同样品,扩增后PCR产物使用Beads纯化,用AxyPrepTMMag PCR Normalizer作归一化处理,构建好的文库上样到cBots或簇生成系统,用于簇生成及MiSeq测序,测序的双端数据首先根据Barcode信息进行样品区分,然后根据Overlap关系进行Merge拼接成Tag,接着进行数据过滤、Q20和Q30质控分析,对最终Clean数据进行物种分类学分析。根系数为长度超过0.5 cm的一级和二级侧根的总和,根冠比为植株地下部和地上部干质量的比值,根系活力用TTC法测定,根系体积采用将根系均匀平铺于Epson Perfv700型扫描仪扫描并保存为JPG文件,用WinRHIZO Pro 2009a软件分析测得。
1.4 数据处理及分析
试验数据用Excel 2003处理;处理间根系生长指标差异用SPSS 19.0 进行单因素方差分析(One-way ANOVA),显著性水平为P<0.05,以平均值±标准差的形式来表达;用SPSS 19.0 做数据间Pearson相关分析;用11.3版本的RDP(Ribosomal database project)数据库进行真菌物种分类分析。
2 结果与分析
2.1 生物炭对黄瓜结果期根际土壤真菌多样性的影响
图1为各处理土壤真菌物种进化关系的系统发育进化树,可概括各处理真菌物种间亲缘关系。进化树环形部分文字为分类等级,由内到外等级为由低到高,节点大小表示丰度高低,绿色覆盖区域表示低丰度,红色覆盖区域表示高丰度。从图中对比分析可知,与对照相比,C20、C40、C60处理丰度相对较多,其中C20处理内外的红色覆盖区域最多,说明该处理真菌的低级和高级物种丰度都相对最高,效果较为明显。

图1 不同处理根际土壤真菌物种系统发育进化树Fig.1 Phylogenetic trees of fungal species of rhizosphere soil for different treatments
表1为各处理在门和科2个分类水平上的真菌菌群的比例。由表1可知,门分类水平上构成日光温室黄瓜结果期根际土壤的优势真菌群落为子囊菌门(Ascomycota),占全部群落的93.8%,其他为接合菌门(Zygomycota)、担子菌门(Basidiomycota)、壶菌门(Chytridiomycota)和球囊菌门(Glomeromycota),分别占全部群落的0.6%、0.6%、0.3%和0.1%,而其他杂菌占3.1%,与对照相比,C20、C40、C60处理可显著提高子囊菌门和接合菌门的真菌丰度,并且增加了担子菌门、壶菌门和球囊菌门真菌群落的丰度,极大地降低了杂菌比例。科分类水平上构成黄瓜根际土壤优势群落为子囊菌门未分类或未识别科、Incertaesedis27、毛壳菌科(Chaetomiaceae)、小子囊菌科(Microascaceae)、毛球壳科(Lasiosphaeriaceae)、假散囊菌科(Pseudeurotiaceae)、爪甲团囊菌科(Onygenaceae)、裸囊菌科(Gymnoascaceae)、丛赤壳科(Nectriaceae)、Incertaesedis3、黄丝菌科(Cephalothecaceae)、毛孢壳科(Coniochaetaceae)以及接合菌门被孢霉科(Mortierellaceae)、球囊菌门球囊霉科(Glomeraceae)、担子菌门粪锈伞科(Bolbitiaceae)、壶菌门小壶菌科(Spizellomycetaceae),分别占全部菌落的比例为68.4%、5.1%、4.9%、2.3%、2.1%、1.7%、1.5%、1.0%、1.0%、0.6%、0.5%、0.5%以及0.6%、0.4%、0.1%、0.1%,与对照相比,C20、C40、C60处理均可显著提高或新增上述真菌不同科的丰度。综合门和科分类水平上的比较可知,C20处理效果最为显著。
2.2 生物炭对黄瓜结果期根系生长的影响
表2为不同处理对黄瓜结果期根系生长相关指标的影响。由表2可知,对于根系数,C20和C60处理分别显著高出对照20.52%和16.00%,而C40处理与对照差异不显著;对于根系体积,C20、C40和C60处理分别显著高出对照50.73%、15.67%和25.09%;对于根冠比,C20、C40和C60处理均与对照差异不显著;对于根系活力,C20和C40处理分别显著高出对照16.11%和12.44%,而C60处理与对照差异不显著。
2.3 生物炭处理下黄瓜根系生长和真菌菌落比例相关性分析
表3为土壤真菌群落比例和根系生长指标间的
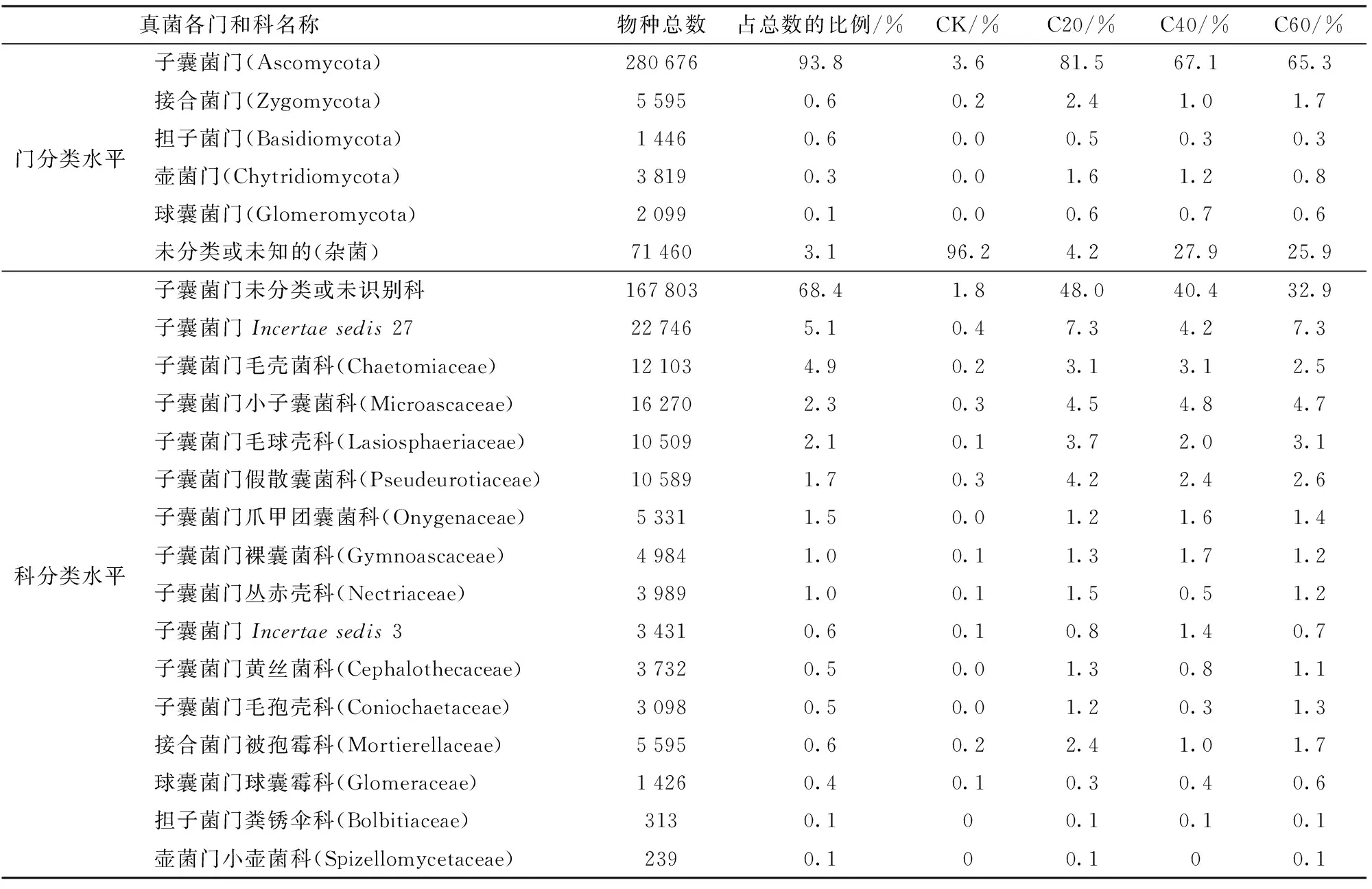
表1 不同处理真菌在门和科分类水平的丰度比较

表2 不同处理对结果期根系数、根系体积、根冠比和根系活力的影响
注:同列数值后不同小写字母表示达到显著性差异(P<0.05)。
相关性分析。由表3可知,在门分类水平上,子囊菌门、接合菌门、担子菌门、壶菌门、球囊菌门比例均与根系数、根系体积、根冠比和根系活力呈一定的正相关关系,而未知的杂菌比例与上述根系生长指标呈一定的负相关关系,其中根系数与子囊菌门和担子菌门比例、根系体积与接合菌门比例、根系活力与壶菌门比例均显著正相关,未知杂菌与根系数显著负相关;在科分类水平上,表中所列的真菌各科比例大多与根系数、根系体积、根冠比和根系活力呈一定的正相关关系,其中,根系数与子囊菌门Incertaesedis27、毛球壳科、假散囊菌科、黄丝菌科比例均显著正相关,根系体积与子囊菌门假散囊菌科、接合菌门被孢霉科比例均显著正相关。
3 讨论
生物炭施入后由于其对土壤生物、物理及化学特性的影响和改变,在不同程度上可调控并提升许多作物的生长,最终可提高作物的产量和品质[2]。STEINER等[8]在亚马逊河流域中将木炭以11 t/hm2比例与肥料混合施入土壤发现可使水稻和高粱产量提高到单施肥料的2倍,并且该处理土壤中碳流失率远低于对照土壤。张伟明等[9]用盆栽试验每1 kg干土加入生物炭10~40 g后种植水稻,发现生物炭处理3个月后水稻平均增产25.28%,同时使水稻根系体积、鲜质量、总吸收面积和活跃吸收面积显著增加,其中以每1 kg干土加20 g生物炭处理产量最高,比对照提高33.21%。勾芒芒等[7]采用室内盆栽试验研究砂壤土中施加生物炭对番茄产量的影响,表明每1 kg干土加生物炭40 g可极大增加番茄产量并有效提高水肥利用效率。本试验中,经过20~60 t/hm2范围内的生物炭处理土壤后,在黄瓜结果期均可不同程度提高根系数、根系体积和根系活力,这与上述[7-9]试验结果一致。

表3 土壤真菌群落比例和根系生长指标之间的相关系数
注:*表示在P<0.05水平显著相关。
微生物是土壤有机质形成和养分转化循环的重要动力,并影响和调控土壤养分转化[1-2,8]。研究表明,生物炭改良土壤后,接合菌门和球囊菌门的真菌数量增加,而担子菌门和变型菌门真菌的丰度却有所降低[6],另一些试验表明,生物炭处理可使豌豆根系固氮量由对照的50%提高到72%,并使作物根部真菌繁殖能力增强,生物炭用量30%时菌根菌侵染量显著提高[10-11],生物炭通过发挥其空间保护作用可影响土壤中腐生菌、病原菌和菌根菌等真菌类型的多样性[12]。生物炭对病原真菌结构和功能影响方面的报道较少,MATSUBARA 等[13]发现生物炭能加强芦笋幼苗对尖孢镰刀菌(Fusariumoxysporum)的耐受性。由于菌根真菌互利共生方式在植物生长中发挥着重要作用,所以生物炭影响菌根真菌方面的研究相对较多,如SOLAIMAN等[14]每年添加桉木生物炭0.6~6 t/hm2,2年后小麦根部丛生菌根(AM) 提高20%~40%,而未添加的土壤中AM 仅提高5%~20%,RILLIG等[15]发现生物炭能促进真菌共生并有效促进AM 孢子萌发,WARNOCK等[11]认为生物炭主要通过改变土壤的养分利用率、调控土壤细菌溶磷作用及黄酮类代谢产物、吸附真菌与寄主植物间CO2及萜烯类等信息素影响二者间信号传输等方面的作用,促进外生菌根菌丝的生长和繁殖,从而提高土壤质量。在本试验中,生物炭施用量20~60 t/hm2处理范围内可显著提高根际土壤中真菌子囊菌门和接合菌门丰度,增加担子菌门、壶菌门和球囊菌门真菌群落的丰度而极大降低杂菌比例,并可显著提高子囊菌门Incertaesedis27、毛壳菌科、小子囊菌科、毛球壳科、假散囊菌科、爪甲团囊菌科、裸囊菌科、丛赤壳科、Incertaesedis3、黄丝菌科、毛孢壳科以及接合菌门被孢霉科、球囊菌门球囊霉科、担子菌门粪锈伞科、壶菌门小壶菌科的丰度,该研究在一定程度上丰富并补充了前人的研究成果。
本试验中,根系数与子囊菌门Incertaesedis27、毛球壳科、假散囊菌科、黄丝菌科比例均显著正相关,根系体积与子囊菌门假散囊菌科和接合菌门被孢霉科比例均显著正相关,说明上述真菌的5个科在促进根系方面的作用更为显著。黄丝菌科真菌可在一些植物根被组织聚集,促进植株根系和总生物量增长,并可显著促进根系对Ca、Mn、Zn元素的吸收[16],根系数与黄丝菌科比例显著正相关,说明施入生物炭后增加土壤中黄丝菌科真菌比例,促进黄瓜根系吸收和生长;被孢霉科真菌是土壤中有机质和养分含量丰富的标志类群[17],黄瓜根系体积与被孢霉科比例显著正相关,说明施入生物炭后增加了被孢霉科真菌比例,可促进土壤有机质和养分含量的提高,从而利于黄瓜根系生长并提高根系体积;对于子囊菌门的Incertaesedis27、毛球壳科、假散囊菌科真菌,目前鲜见有直接促进植物根系生长相关方面的报道,但上述3个科的真菌多为寄生于土壤动植物残体真菌,这3个真菌科的比例与根系数或根系体积显著正相关,可能与其促进土壤中有机物质分解而间接促进根系生长有关;此外,赤壳科的一些真菌能显著提高一些植物根系活力和生长代谢活性[18],毛壳菌科的许多真菌能产生纤维素酶、木聚糖酶、漆酶并可降解纤维素和木质素,生成一些生物活性物质,有利于植物生长[19],在本试验中,子囊菌门丛赤壳科、毛壳菌科比例与黄瓜根系数或根系体积之间存在一定的正相关关系但不显著,说明在一定程度上述2个科的真菌可提高黄瓜根系活力,促进根系生长代谢,促进根际产生生物活性物质,最终有利于黄瓜根系生长。
综上可知,设施生产中由于特殊的管理和环境,使土壤中养分积累和供应失衡现象严重,生物炭施入后可吸附养分离子,有利于土壤中有益微生物的繁殖,改变真菌等微生物的群落结构,有效提高土壤肥力,最终促进植株根系生长[2,7,20],通过上述调控
措施可提高黄瓜产量和品质。
4 结论
(1)日光温室中经20~60 t/hm2生物炭处理土壤后,在黄瓜结果期均可不同程度提高根系数、根系体积和根系活力,显著提高根际土壤中真菌子囊菌门和接合菌门真菌丰度,增加担子菌门、壶菌门和球囊菌门丰度而极大降低杂菌比例,明显提高子囊菌门未分类或未识别科、Incertaesedis27、毛壳菌科、小子囊菌科、毛球壳科、假散囊菌科、爪甲团囊菌科、裸囊菌科、丛赤壳科、Incertaesedis3、黄丝菌科、毛孢壳科以及接合菌门被孢霉科、球囊菌门球囊霉科、担子菌门粪锈伞科、壶菌门小壶菌科的丰度。
(2)生物炭处理土壤后,子囊菌门Incertaesedis27、毛球壳科、假散囊菌科、黄丝菌科和接合菌门被孢霉科的真菌在促进根系生长方面的作用最为明显,上述种类的真菌主要通过根被组织聚集,促进根系对营养元素吸收,提高土壤中有机质和养分含量,促进土壤中有机物质分解等而最终有利于黄瓜的根系生长。
(3)经综合比较,20 t/hm2的生物炭处理效果最为显著,与对照相比,黄瓜结果期根系数、根系体积和根系活力分别显著提高20.52%、50.73%和16.11%。
1 李明,胡云,黄修梅,等.生物炭对设施黄瓜根际土壤养分和菌群的影响[J/OL].农业机械学报,2016,47(11):275-281.http:∥www.j-csam.org/jcsam/ch/reader/view_abstract.aspx?file_no=20161123&flag=1.DOI:10.6041/j.issn.1000-1298.2016.11.023. LI Ming, HU Yun, HUANG Xiumei, et al. Effect of biological carbon on nutrient and bacterial communities of rhizosphere soil of facility cucumber[J/OL]. Transactions of the Chinese Society for Agricultural Machinery, 2016,47(11): 275-281.(in Chinese)
2 王欣,尹带霞,张凤,等.生物炭对土壤肥力与环境质量的影响机制与风险解析[J].农业工程学报,2015,31(4):248-257. WANG Xin, YIN Daixia, ZHANG Feng, et al. Analysis of effect mechanism and risk of biochar on soil fertility and environmental quality[J]. Transactions of the CSAE, 2015,31(4):248-257. (in Chinese)
3 姜海燕,闫伟,李晓彤,等.兴安落叶松林土壤真菌的群落结构及物种多样性[J].西北林学院学报,2010,25(2):100-103. JIANG Haiyan, YAN Wei, LI Xiaotong, et al. Diversity and community structure of soil fungi inLarixgmeliniiforest[J].Journal of Northwest Forestry University, 2010,25(2):100-103.(in Chinese)
4 PUGET P, ANGERS D A, CHEN U C. Nature of carbohy-drates associated with water-stable aggregates of two cultivate soils[J]. Soil Biology & Biochemistry, 1999, 31(1): 55-63.
5 邢来君,李明春.普通真菌学[M].北京:高等教育出版社,2001.
6 JIN H. Characterization of microbial life colonizing biochar and biochar-amended soils in Ithaca[D]. New York: Cornell University, 2010.
7 勾芒芒,屈忠义,杨晓,等.生物炭对砂壤土节水保肥及番茄产量的影响研究[J/OL].农业机械学报,2014,45(1):137-142. http:∥www.j-csam.org/jcsam/ch/reader/view_abstract.aspx?file_no=20140122&flag=1. DOI:10.6041/j.issn.1000-1298.2014.01.022. GOU Mangmang, QU Zhongyi, YANG Xiao, et al. Study on the effects of biochar on saving water, preserving fertility and tomato yield[J/OL]. Transactions of the Chinese Society for Agricultural Machinery, 2014,45(1):137-142.(in Chinese)
8 STEINER C, TEIXEIRA W G, LEHMANN J, et al. Long term effects of manure, charcoal and mineral fertilization on crop production and fertility on a highly weathered central Amazonian upland soil[J]. Plant and Soil, 2007, 291(1):275-290.
9 张伟明,孟军,王嘉宇,等.生物炭对水稻根系形态与生理特性及产量的影响[J].作物学报,2013,39(8):1445-1451. ZHANG Weiming, MENG Jun, WANG Jiayu, et al. Effect of biochar on root morphological and physiological characteristics and yield in rice[J]. Acta agronomica sinica, 2013, 39(8): 1445-1451. (in Chinese)10 RONDON M, LEHMANN J, RAMIREZ J, et al. Biological nitrogen fixation by common beans (PhaseolusvulgarisL.) increases with biochar additions[J]. Biology and Fertility of Soils, 2007, 43(6):699-708.
11 WARNOCK D D, LEHMANN J, KUYPER T W, et al. Mycorrhizal responses to biochar in soil—concepts and mechanisms[J]. Plant and Soil,2007,300(1):9-20.
12 LEHMANN J, JOSEPH S. Biochar for environmental management: science and technology[M]. London: Earth Scan, 2009.
13 MATSUBARA Y, HASEGAWA N, FUKUI H. Incidence of fusarium root rot in asparagus seedlings infected with arbuscular mycorrhizal fungus as affected by several soil amendments [J]. Journal of the Japanese Society for Horticultural Science, 2002, 71(3): 370-374.
14 SOLAIMAN Z M, BLACKWELL P, ABBOTT L K, et al. Direct and residual effect of biochar application on mycorrhizal root colonisation, growth and nutrition of wheat[J]. Australian Journal of Soil Research, 2010, 48(7): 546-554.
15 RILLIG M C, WAGNER M, SALEM M, et al. Material derived from hydrothermal carbonization: effects on plant growth and arbuscular mycorrhiza[J]. Applied Soil Ecology, 2010, 45(3): 238-242.
16 刘舒,陈春黎,刘敏,等.两种内生真菌对大花蕙兰的共生效应比较[J].华中农业大学学报, 2016,35(1):43-49. LIU Shu, CHEN Chunli, LIU Min, et al. Comparing the symbiotic effects of two endophytes on growth ofCymbidiumhybridum[J]. Journal of Huazhong Agricultural University, 2016,35(1):43-49. (in Chinese)
17 孟令男,许修宏,李洪涛,等.污泥堆肥对氯嘧磺隆残留及土壤中真菌群落结构的影响[J].农业环境科学学报,2014,33(3):495-501. MENG Lingnan, XU Xiuhong, LI Hongtao, et al. Effects of sewage sludge compost on chlorimuron-ethyl residue and fungal community structure in soil[J]. Journal of Agro-Environment Science, 2014,33(3):495-501. (in Chinese)
18 王丽娟,王威威,吕雪,等.鹿蹄草内生真菌的分离鉴定及其对鹿蹄草的生理效应[J].东北农业大学学报,2013,44(8): 87-92. WANG Lijuan, WANG Weiwei, LÜ Xue, et al. Isolation, identification and physiological effects of endophytic fungi fromPyrolacallianthaH.Andr[J]. Journal of Northeast Agricultural University, 2013,44(8): 87-92. (in Chinese)
19 郭云中.毛壳科Chaetomiaceae真菌多基因系统演化及分类鉴定研究[D].杨凌:西北农林科技大学,2012. GUO Yunzhong. The multi-gene phylogeny and classification of Chaetomiaceae[D].Yangling: Northwest A&F University,2012. (in Chinese)
20 杜衍红,蒋恩臣,王明峰,等.炭-肥互作对芥菜生长和肥料利用率的影响[J/OL].农业机械学报,2016,47(4):59-64.http:∥www.j-csam.org/jcsam/ch/reader/view_abstract.aspx?file_no=20160409&flag=1. DOI: 10.6041/j.issn.1000-1298.2016.04.009. DU Yanhong, JIANG Enchen, WANG Mingfeng, et al. Effect of interaction of biochar-fertilizer on the yield of the mustard and the fertilizer utilization ratio[J/OL]. Transactions of the Chinese Society for Agricultural Machinery, 2016,47(4): 59-64.(in Chinese)
Effect of Biochar on Fungal Abundance of Rhizosphere Soil and Cucumber Root Growth in Greenhouse
LI Fahu LI Ming LIU Jinquan HU Yun ZHANG Qingmei ZHAO Hengdong
(VocationalandTechnicalCollege,InnerMongoliaAgriculturalUniversity,Baotou014109,China)
The cucumber of solar greenhouse was selected to study the effect of biochar of corn straw on fungal abundance of rhizosphere soil and root growth of cucumber in fruiting period. The influence mechanism was found by the test. In the test, treatments were amounts of 20 t/hm2, 40 t/hm2and 60 t/hm2of biochar which were respectively applied to the soil of solar greenhouse. The results showed that root number, root volume and root activity were improved in various degrees, the fungal abundances of Ascomycota, Zygomycota were increased significantly, and the fungal abundances of Basidiomycota, Chytridiomycota and Glomeromycota were promoted but the proportion of hybrid bacterium was reduced greatly, when the amount of biochar was 20~60 t/hm2in fruiting period of cucumber. The results also showed that the fungal abundances ofIncertaesedis27, Chaetomiaceae, Microascaceae, Lasiosphaeriaceae, Pseudeurotiaceae, Onygenaceae, Gymnoascaceae, Nectriaceae,Incertaesedis3, Cephalothecaceae, Coniochaetaceae, Mortierellaceae, Glomeraceae, Bolbitiaceae and Spizellomycetaceae were improved by the application of biochar. Results showed that the effect of biochar on promoting root growth was more obvious for the fungi ofIncertaesedis27, Chaetomiaceae, Pseudeurotiaceae, Cephalothecaceae and Mortierellaceae, and these fungi promoted the root growth of cucumber by means of organizing in the root, promoting root to absorb nutrient, increasing organic matter and nutrient content, and promoting the decomposition of organic material. By comprehensive comparison, the effect of application rate of 20 t/hm2of biochar was better than those of other treatments, and the treatment of 20 t/hm2significantly improved the root number, root volume and root activity by 20.52%, 50.73% and 16.11%, respectively, compared with the test control in fruiting period of cucumber.
cucumber; biochar; fungal abundance; root growth; rhizosphere soil; greenhouse
10.6041/j.issn.1000-1298.2017.04.034
2016-10-27
2017-02-11
国家自然科学基金项目(31660602)
李发虎(1977—),男,讲师,主要从事园艺作物环境调控研究,E-mail: lifafahu@163.com
李明(1975—),男,副教授,博士,主要从事设施蔬菜根土互作调控研究,E-mail: liming19750811@163.com
S156.2; S154.3
A
1000-1298(2017)04-0265-06
