化疗栓塞治疗原发性肝癌合并肝动静脉瘘的临床研究
2017-06-01许飞周纯武
许飞,周纯武
·介入放射学·
化疗栓塞治疗原发性肝癌合并肝动静脉瘘的临床研究
许飞,周纯武
目的:探讨化疗栓塞治疗原发性肝癌合并肝动静脉瘘(HAVS)的临床疗效及影响预后的因素。方法: 67例不能手术切除的原发性肝癌合并HAVS患者行化疗栓塞治疗,观察HAVS栓塞效果及近期、远期疗效。应用Kaplan-Meier法、Log-rank检验进行患者的生存率分析,Cox回归模型进行多因素分析。结果:67例HAVS中肝动脉-门静脉瘘59例,肝动脉-肝静脉瘘8例;轻、中度动静脉瘘53例,重度动静脉瘘14例。HAVS完全栓塞44例(65.7%),轻、中度动静脉瘘的完全栓塞率(73.6%,39/53)高于重度动静脉瘘(35.7%,5/14),差异有统计学意义(χ2=7.04,P=0.008)。67例患者中,完全缓解(CR) 2例,部分缓解(PR) 29例,疾病稳定(SD) 30例,疾病进展(PD) 6例,总有效率为46.7% (31/67)。67例患者1年生存率为49.3%,中位生存期为11.0个月。单因素分析结果显示肿瘤大小(<8 cm/≥8 cm)、血管瘤栓(有/无)、术前AFP水平(<400/≥400 ng/mL)、碘油沉积类型(Ⅰ+Ⅱ/Ⅲ)、瘘口栓塞效果(瘘消失/未消失)的生存率差异有统计学意义(P<0.05),Cox模型多因素分析显示肿瘤大小、碘油沉积类型是生存率的独立预后因素。结论:化疗栓塞治疗原发性肝癌合并HAVS有效,肿瘤大小、碘油沉积类型是独立的预后因素。
肝肿瘤; 动静脉瘘; 肝动脉化疗栓塞术; 预后
原发性肝癌是临床常见的恶性肿瘤之一,肝动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)是不能行手术切除的肝癌的一线治疗手段。肝动静脉瘘(hepatic arteriovenous shunts,HAVS)是肝癌常见的合并症,分为肝动脉-门静脉瘘(APS)和肝动脉-肝静脉瘘(AHVS)。肝动静脉瘘会严重影响TACE疗效,并增加门静脉高压、肝功能损伤、异位栓塞等的发生风险[1],因此TACE术中对肝动静脉瘘的治疗尤为重要。本文回顾性分析67例肝癌合并肝动静脉瘘患者的临床及影像学资料,旨在探讨TACE对肝癌合并HAVS的治疗效果及预后影响因素。
材料与方法
1.病例资料
搜集2013年11月-2015年1月我院收治的肝癌合并肝动静脉瘘患者67例,所有患者均无法行手术切除,其中男64例,女3例,年龄29~77岁,中位年龄55岁。临床分期采用巴塞罗那(BCLC)分期,其中B期25例,C期42例。
2.治疗方法
67例患者均采用Seldinger法穿刺右股动脉,导丝引导导管至肝动脉造影,观察癌灶及HAVS情况后,超选至肿瘤供血动脉及瘘口进行栓塞治疗。所用化疗药物为表柔比星40~80 mg、吡柔比星20~40 mg、羟基喜树碱20~30 mg,选取两种药物联合应用。栓塞剂为明胶海绵(gelfoam,GF)颗粒、聚乙烯醇(polyvinyl alcohol,PVA)微粒、海藻酸钠(kelp micro gelation,KMG)和/或微球弹簧圈,以上1种栓塞剂与碘化油联合应用。
根据瘘口位置,将肝动静脉瘘分为中央型和周围型。中央型HAVS位于肝门部,门静脉主干和/或Ⅰ级分支、肝静脉提前显影;周围型HAVS位于肝脏边缘,门静脉Ⅱ级以下分支或肝静脉提前显影。根据瘘口大小、门静脉或肝静脉显影时间(>3.0 s、1.5~3.0 s、0.5~1.5 s),将HAVS分为轻度、中度及重度[2-3]。
TACE治疗先栓塞瘘口,再经肿瘤供血动脉注入化疗药物及栓塞剂。轻中度APS采用中小颗粒的PVA、GF颗粒或KMG微球栓塞,重度APS采用大颗粒的栓塞剂和/或弹簧圈进行栓塞;AHVS采用颗粒型栓塞剂和/或弹簧圈进行栓塞。HAVS消失或改善后,注入碘油乳剂,合并AHVS者栓塞应慎重,如碘油流向肝静脉,立即停止栓塞。多次TACE术后,部分患者联合消融治疗或放射治疗。
3.观察指标
观察指标包括瘘口栓塞效果、栓塞后再通率、TACE术近期疗效、远期疗效。
瘘口栓塞效果:栓塞瘘口1~2个月后,再次行数字减影血管造影(digital subtraction angiography,DSA)观察瘘口栓塞效果。近期疗效:根据mRECIST标准,评价肝癌TACE术后的近期疗效。远期疗效:自首次TACE术起,计算患者1年生存率及中位生存时间;生存时间为第1次TACE术至死亡或最后1次随访的时间。碘油沉积类型:根据上腹部CT的影像表现,将碘油沉积分为三种类型,第一种为致密栓塞型,第二种为基本栓塞型,碘油沉积较好但有缺损,第三种为稀少或无碘油沉积。
4.统计学分析
采用SPSS 18.0软件进行统计学分析,生存率计算采用kaplan-meier法。采用Logrank单因素检验分析相关因素与预后的关系,并对相关因素采用Cox回归模型进行多因素分析。
结 果
1.肝癌合并动静脉瘘分型
67例动静脉瘘中,肝动脉-门静脉瘘59例(88.1%,59/67),肝动脉-肝静脉瘘8例(11.9%,8/67);中央型动静脉瘘19例(28.4%,19/67),周围型动静脉瘘48例(71.6%,48/67);轻、中度动静脉瘘53例(79.1%,53/67),重度动静脉瘘14例(21.9%,14/67)。
2.肝动静脉瘘栓塞效果
44例(65.7%,44/67)肝动静脉瘘口经栓塞后消失,其中轻、中度动静脉瘘39例、重度动静脉瘘5例,轻中度、重度动静脉瘘的封堵成功率分别为73.6%(39/53)、35.7%(5/14),轻、中度动静脉瘘的封堵成功率高于重度动静脉瘘,差异有统计学意义(χ2=7.04,P=0.008,图1)。
3.肝动静脉瘘栓塞后再通率
肝动静脉瘘口经栓塞后即刻造影示完全栓塞53例(79.1%,53/67),而栓塞瘘口1~2个月后再次造影示再通9例,再通率为17.0%(9/53)。11例行联合治疗的患者,在射频消融(radiofrequencey Ablation,RFA)或放疗1~2个月后,再次复查了DSA,联合治疗前有6例瘘口完全栓塞,联合治疗后又有2例瘘口消失,完全栓塞者共8例,同时无瘘口再通发生。
4.TACE近期疗效
完全缓解(complete response,CR) 2例,部分缓解(partial response,PR) 29例,疾病稳定(stable disease,SD) 30例,疾病进展(progressive disease,PD) 6例,总有效率46.7%(31/67)。
5.TACE远期疗效
随访截止日期为2016年11月1日,67例患者中死亡59例,存活 8例,无失访患者,1年生存率为49.3%,中位生存期为11个月。单因素分析结果显示肿瘤大小(<8cm/≥8cm)、血管瘤栓(有/无)、术前AFP水平(<400 /≥400 ng/mL)、碘油沉积类型(Ⅰ+Ⅱ/Ⅲ)、瘘口栓塞效果(瘘消失/未消失)的生存率差异有统计学意义(P<0.05,表1)。Cox模型多因素分析显示肿瘤大小、碘油沉积类型是生存率的独立预后因素(表2)。
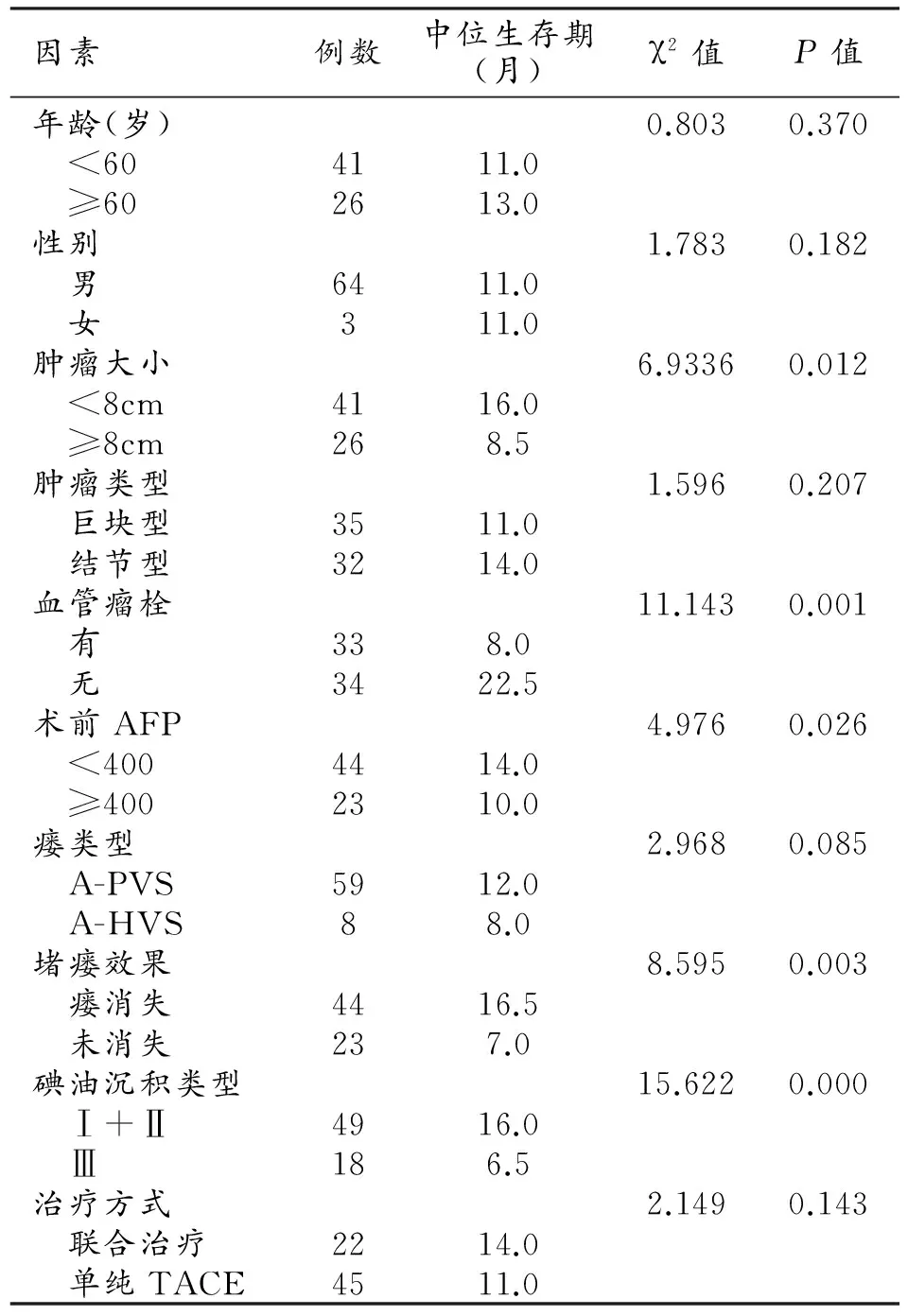
表1 患者预后单因素分析结果

表2 Cox模型多因素分析结果
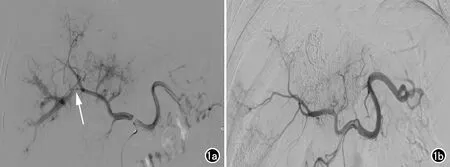
图1 肝癌合并APS患者行TACE治疗的DSA图像。a) 第1次TACE术前造影示肝癌(肝左叶、右叶多发肿物与结节)合并APS(箭),栓塞APS后再栓塞肿瘤供血动脉; b) 第2次TACE术前再次造影示瘘口完全栓塞,肿瘤染色明显减少。
肝动静脉瘘常见于中晚期肝癌患者,发生率为12.1%~31.2%[4-5],肿瘤沿门静脉、肝静脉浸润性生长或肿瘤直接侵犯静脉分支,可能引起HAVS的发生。临床工作中,巨块型肝癌、肿瘤多发、门静脉瘤栓及合并肝硬化者更易发生HAVS[5-6]。HAVS是肝癌TACE术预后不良的因素之一,本组病例单因素分析显示瘘口栓塞与否的生存时间差异有统计学意义,所以精细的堵瘘治疗,完全栓塞瘘口,对延长患者的生存时间非常重要。
肝癌合并HAVS的治疗策略:对于合并APS者,宜先栓塞瘘口,再经肿瘤供血动脉注入化疗药物及栓塞剂;对于合并AHVS者,必须先栓塞瘘口,再栓塞肿瘤。先栓塞瘘口,再栓塞肿瘤的供血动脉,碘油的沉积效果相对较好,且能减少肿瘤外异位栓塞风险;部分合并APS的患者,如先栓塞肿瘤,再栓塞瘘口,碘油会进入门静脉,增加了肝功能损伤、门脉高压的风险。当然,如能使用微导管超选过APS,亦可先栓塞肿瘤,再栓塞瘘口。
TACE术中堵瘘常用的栓塞剂为明胶海绵、微球、弹簧钢圈等,也有采用氰基丙烯酸酯(N-butyl-2-cyanoacrylate,NBCA)胶及无水酒精的报道[7-9]。明胶海绵多不能完全阻断血管,瘘口易再通,明胶海绵颗粒大小相对均匀,350~560μm可较好地封堵瘘口;微球类如KMG微球、PVA微粒等,为末梢栓塞剂,瘘口再通率低,并且同时能有效栓塞肿瘤供血血管;弹簧钢圈仅能栓塞瘘口血管近端,易形成侧枝循环,影响下次TACE;氰基丙烯酸酯(NBCA)胶是一种液体栓塞剂,可永久栓塞瘘口,但较易堵管;无水酒精刺激性强,不提倡单独应用,可与明胶海绵混合使用。
轻中度动静脉瘘应采用颗粒型栓塞剂,可取得较好的疗效。重度动静脉瘘因其分流量大,治疗难度较大,多需联合应用弹簧钢圈。轻中度动静脉瘘的栓塞效果好于重度动静脉瘘,本组病例显示轻中度动静脉瘘、重度动静脉瘘的封堵成功率分别为73.6%、35.7%,两者差异有统计学意义(P<0.05)。重度动静脉瘘可加重门静脉高压而导致上消化道出血、顽固性腹水或肝性脑病等一系列并发症,故在临床工作中应关注重度HAVS的治疗。
TACE术治疗肝动静脉瘘有效,而肝肿瘤消融术或放疗则是其有益补充。肝肿瘤消融术或放疗在治疗癌灶的同时,可闭塞部分HAVS,本组病例有18.2%的瘘口被闭塞,其机制可能包括:①瘘口部血管经消融治疗而直接闭塞;②肿瘤血管及组织被消融术或放疗所破坏,肿瘤逐渐坏死、缩小,瘘口进而逐渐缩小,直至闭塞;③门静脉瘤栓放疗后,门静脉血流改善,瘘口分流量减少所致。
既往文献报道,肝癌合并HAVS的患者经TACE治疗后,中位生存期为4.3~12.3个月,1年生存率为12.0%~50.0%[1,7,8,10]。本组病例的中位生存期为11.0个月,1年生存率为49.3%,患者经治疗后取得了较好的疗效。单因素分析结果显示肿瘤大小、血管瘤栓、术前AFP水平、碘油沉积类型、瘘口栓塞效果对预后有较明显的影响。Cox模型多因素分析显示肿瘤大小、碘油沉积类型是预后的独立因素。本组患者经治疗后取得了较好的疗效,可能与以下几点因素相关:①精细的TACE术,全面造影显示肿瘤供血及HAVS情况,分别超选至肿瘤供血动脉分支,缓慢注入化疗药物及栓塞剂,行末梢性栓塞;②HAVS的完全栓塞,根据HAVS的类型、位置、严重程度,选择合适的栓塞剂,完全栓塞瘘口,减少碘油等栓塞剂的流失,有助于获得致密的碘油沉积而延长患者生存时间;③瘘口封堵后,可降低门静脉高压,减少消化道出血风险,并改善肝功能、延缓肝硬化的发展;④ TACE联合RFA或放疗有一定优势[11],本组行联合治疗的患者生存时间有所延长,但与未行联合治疗的患者相比差异无统计学意义,可能与本组患者病程较晚、合并HAVS及血管瘤栓等因素有关。
综上所述,化疗栓塞治疗原发性肝癌合并HAVS有效,肿瘤大小、碘油沉积类型是独立的预后因素。由于本研究为回顾性研究,仍有待大样本研究的进一步证实。
[1] Huang MS,Lin Q,Jiang ZB,et al.Comparison of long-term effects between intra-arterially delivered ethanol and Gelfoam for the treatment of severe arterioportal shunt in patients with hepatocellular carcinoma[J].World J Gastroenterol,2004,10(6):825-829.
[2] Mei Q,Li Y.Transcatheter arterial embolization of hepatic arteriovenous shunts in patients with hepatocellular carcinoma[J].Semin Intervent Radiol,2012,29(3):237-240.
[3] 李彦豪,何晓峰,陈勇.实用临床介入诊疗学图解(第3版)[M].北京:科学出版社,2012:344-347.
[4] Ngan H,Peh WC.Arteriovenous shunting in hepatocellular carcinoma:its prevalence and clinical significance[J].Clin Radiol,1997,52(1):36-40.
[5] 孙磊,施海彬,刘圣,等.肝细胞癌肝动脉门静脉分流形成的相关因素分析[J].介入放射学杂志,2012,21(3):206-210.
[6] 张红志,郭凡.彩色多普勒诊断原发性肝癌并门静脉癌栓[J].放射学实践,2011,26(6):659-660.
[7] 刘秋松,梅雀林,李彦豪,等.聚乙烯醇微粒末梢性化疗栓塞肝细胞癌合并肝动静脉分流的疗效与安全性[J].中华放射学杂志,2015,49(10):763-768.
[8] Zhou WZ,Shi HB,Liu S,et al.Arterioportal shunts in patients with hepatocellular carcinoma treated using ethanol-soaked gelatin sponge: therapeutic effects and prognostic factors[J].J Vasc Interv Radiol,2015,26(2):223-230.
[9] Sonomura T,Kawai N,Kishi K,et al.N-butyl cyanoacrylate embolization with blood flow control of an arterioportal shunt that developed after radiofrequency ablation of hepatocellular carcinoma[J].Korean J Radiol,2014,15(2):250-253.
[10] Furuse J,Iwasaki M,Yoshino M,et al.Hepatocellular carcinoma with portal vein tumor thrombus:embolization of arterioportal shunts[J].Radiology,1997,204(3):787-790.
[11] Peng ZW,Zhang YJ,Chen MS,et al.Radiofrequency ablation with or without transcatheter arterial chemoembolization in the treatment of hepatocellular carcinoma:a prospective randomized trial[J].J Clin Oncol,2012,31(4):426- 432.
Clinical study of transcatheter arterial chemoembolization in treatment of primary hepatic carcinoma combined with hepatic arteriovenous shunt (HAVS)
XU Fei,ZHOU Chun-wu.
Department of Interventional Therapy, National Cancer Center/Cancer Hospital, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing, 100021,China
Objective:To investigate the effect of transcatheter arterial chemoembolization (TACE) in primary hepatic carcinoma combined with hepatic arteriovenous shunt (HAVF) and factors influencing the prognosis.Methods:From November 2013 to January 2015,67 patients with inoperable primary hepatic carcinoma combined with hepatic arteriovenous shunt were treated by TACE.The effect of chemo-embolization on arterioportal shunt,the short-term effect and long-term effect were observed.Kaplan-Meier method,the cumulative survival rates and multivariate Cox proportional hazard model were used to analyze the survival prognostic factors.Results:Of a total of 67 cases of HAVS,there were 59 cases of hepatic arterioportal shunt and 8 cases of hepatic arteriovenous shunt respectively.53 cases were mild-to-moderate shunt and 14 cases were severe shunt.44 cases of HAVF were completely occluded,and the embolization rate of mild-to-moderate shunt was significantly better than that of severe shunt (χ2=7.04,P=0.008).Complete remission,partial remission,stable disease and progressive disease were obtained in 2,29,30 and 6,respectively.The overall effective rate was 46.7%.The 1-year survival rate and median survival time were 49.3% and 11.0 months respectively.Log-rank analysis showed that tumor size,tumor thrombosis,preoperative AFP level,the type of lipiodol retention and the effect of embolization on HAVS were the factors affecting prognosis.Multivariable analysis showed that tumor size and the type of lipiodol retention were the independent prognostic factors of survival rate.Conclusion:Transcatheter arterial chemoembolization is an effective method of treatment in primary hepatic carcinoma combined with HAVS.Tumor size and the type of lipiodol retention are the independent prognostic factors.
Liver neoplasms; Arteriovenous fistula; Transcatheter arterial chemoembolization; Prognosis
100021 北京,国家癌症中心/中国医学科学院北京协和医学院肿瘤医院介入治疗科
许飞(1979-),男,河北保定人,博士,主治医师,主要从事肿瘤影像诊断与介入治疗工作。
,周纯武,E-mail:cjr.Zhouchunwu@vip.163.com
R735.7; R459.9
A
1000-0313(2017)05-0529-04
10.13609/j.cnki.1000-0313.2017.05.021
2017-02-04 修回如期:2017-04-10)
