内脏脂肪体积及常见肥胖指标与非酒精性脂肪肝的相关性研究
2017-06-01陈炽华杨文洁严福华
陈炽华, 杨文洁, 严福华
·肝脏脂肪定量诊断影像学专题·
内脏脂肪体积及常见肥胖指标与非酒精性脂肪肝的相关性研究
陈炽华, 杨文洁, 严福华
目的:探讨腹部内脏脂肪(VAT)体积、心外膜脂肪(EAT)体积、腹部皮下脂肪(SAT)体积、脐平面腹腔长短径、体质指数(BMI)、腰围(WC)、SAT脂肪密度、静脉血甘油三酯(TG)、血胆固醇(CH)值与非酒精性脂肪肝(NAFLD)的相关性。方法:44例受检者(11例脂肪肝和33例正常者)行胸腹部CT平扫,记录受检者的身高、体重、性别、年龄、近期的血TG及CH值、慢性病史、饮酒史及用药史。非酒精性脂肪肝定义为平扫CT上肝脏与脾脏的CT值比值CTL/S<1。后处理软件半自动测量EAT体积、VAT体积、腹部SAT体积、WC、腹腔的长短径及棘突后皮下脂肪厚度,自动计算出皮下脂肪的CT值;分析相关指标与CTL/S的相关性。比较相关指标在脂肪肝组与正常组中的差异,并对差异有统计学意义的指标采用受试者工作特征(ROC)曲线计算其对NAFLD的诊断效能。结果:相关性分析显示,VAT体积与CTL/S呈中度相关(r=0.551,P<0.001),皮下脂肪密度、腹腔短径、血TG值与CTL/S呈弱相关(r=0.375,P=0.012 ;r=0.390,P=0.0009;r=0.471,P=0.001)。EAT体积、SAT体积、皮下脂肪厚度、腹腔长径、BMI、WC均与CTL/S无显著相关(P>0.05)。ROC分析显示VAT体积的曲线下面积(AUC)最大为0.799 (95% CI:0.670~0.927),腹部短径的AUC为0.749 (95% CI:0.598~0.901),TG的AUC为0.700 (95% CI:0.496~0.904),三者之间的AUC差异无统计学意义(P>0.05)。结论:VAT体积与NAFLD的相关性最佳,相比临床常用的SAT体积、BMI,WC等指标,VAT体积更能预测NAFLD的发病风险。
非酒精性脂肪肝; 腹部内脏脂肪体积; 体层摄影术,X线计算机
非酒精性脂肪肝(non-alcoholic fatty liver disease,NAFLD)是指排除了酒精、药物等其他原因而出现的肝内脂肪沉积。西方国家的NAFLD非常常见,人群发病率可以达到20%以上[1]。尽管亚洲人群的发病率没有西方国家那么高,但发病率呈现出明显上升的趋势[2]。相关研究表明,NAFLD与心血管疾病、糖尿病,胰岛素抵抗和系统性炎症等密切相关[3]。在NAFLD的发生发展过程中,遗传和代谢紊乱发挥了非常重要的作用。相关研究结果显示,肥胖和NAFLD相关。在这些研究中,大多采用了体重、体重质量指数(body mass index,BMI)和腰围作为肥胖评估的指标[4-6]。近年来,中央型肥胖越来越受到人们的关注,一般认为以腹部内脏脂肪(visceral adipose tissue,VAT)大量增加为特征的中心性肥胖与胰岛素抵抗、2型糖尿病、动脉粥样硬化等密切相关;而以皮下内脏脂肪(subcutaneous adipose tissue,SAT)增加为特征的外周型肥胖则与血脂异常以及低的粥样硬化患病风险相关[7-9]。在探讨中央型肥胖与脂肪肝的关系时,国外的研究一般采用的评估指标为腰围、VAT面积或厚度[5,6,10,11];而国内的相关研究则很少。本研究通过测量CT平扫图像上的内脏脂肪体积、皮下脂肪体积、厚度、脐平面腰围及心外膜脂肪体积等参数,旨在探讨VAT体积及其他指标与非酒精性脂肪肝的相关性。
材料与方法
1.研究对象
选取2014年5月-8月于我院接受胸腹部CT平扫的体检者为研究对象。研究对象的排除标准:①有酒精性肝损伤及药物性肝损伤者;②6个月内体重明显下降或增长者;③确诊肿瘤及内分泌疾病者(甲状腺功能亢进、库欣综合征等)。最终入组研究对象(受检者)44例,其中男36例,女8例,年龄39~78岁,平均54岁。记录受检者的身高、体重、性别、年龄、近期血甘油三酯(triglyceride,TG)及血胆固醇(cholesterol,CH)值、慢性病史、饮酒史以及用药史。44例受检者均签署知情同意书。
2.检查方法
胸部扫描及心外膜脂肪(epicardial adipose tissue,EAT)的体积测量:采用Siemens双源CT机(Somatom Definition Flash,Medical Solutions)行CT扫描。正式扫描前,操作者对受检者进行呼吸训练。根据定位像,确定扫描范围为气管分叉下1 cm至心膈面。扫描参数:管电压120 kV,自动管电流,准直器宽度1.2 mm,采集螺距0.2,球管转速0.33 s/r。采用Flash一次屏气完成扫描。机器自动重建出一期扫描图像,重建层厚3 mm,层间距1.5 mm,重建函数为B26f。由一位经验丰富的放射科医师应用Siemens原型软件Cardiac Risk (Siemens Medical Solutions)进行分析。同一位患者的EAT体积测量两次取平均值。将图像导入Cardiac Risk后软件会自动追踪心包轨迹,计算出心肌表面到心包之间的脂肪体积,计算的范围包括从肺动脉分叉处以下1 cm至心底面。脂肪的CT阈值定义为-250~-30 HU。对于软件识别不准确的地方,操作者可以进行调整。
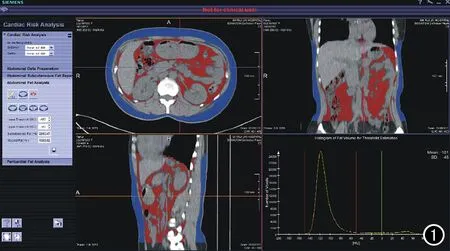
图1 Cardiac Risk软件测量腹部脂肪,红色区域为腹腔内脂肪组织,蓝色区域为皮下脂肪组织。
腹部扫描及腹部脂肪的测量:受检者平卧于平板检查床上,正常呼吸末扫描,扫描范围为膈以下至耻骨联合。扫描参数:管电压120 kV,自动管电流,层厚、层间距均为5 mm。将扫描图像导入cardiac risk软件(图1),在横轴面图像上每隔2~4层划出腹腔及皮下脂肪的界限,以肝膈顶为第一层,髂前上棘平面为最后一层,软件根据所画层面,自动生成其余层的界线,由一位经验丰富的放射科医生手动调整识别不准确的位置。软件根据皮下脂肪CT值(均数±3标准差)来估算腹腔内脏脂肪阈值范围, 从而计算出VAT体积 、SAT体积、VAT/SAT、VAT/腹部脂肪体积。于肚脐平面划出腹腔的周径即为腰围(waist circumference,WC),垂直于扫面床作一经过肚脐的线段,长度即为腹部矢状径,取与扫描床平行的最长径为腹部横径,腰L4/5后方棘突到皮下的距离为皮下脂肪厚度。
脂肪肝的诊断:采用肝/脾CT比值(CTL/S)评估脂肪肝[12-14]。为了避开胸部的干扰,选取以肝门为中心上下5层的层面,分别在肝脏的Ⅱ、Ⅲ、Ⅳ段及Ⅴ/Ⅵ段、Ⅶ/Ⅷ段共选取6个兴趣区(region of interest,ROI),脾脏选取3个ROI,所有ROI的面积均在220~280 mm2之间。ROI需避开血管、脏器周围的脂肪和骨组织。CTL/S通过计算肝脏与脾脏的平均CT值比值得来。CTL/S≤1为脂肪肝,CTL/S>1为正常肝脏 ,CTL/S越小代表脂肪肝程度越严重。
3.统计学分析
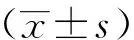
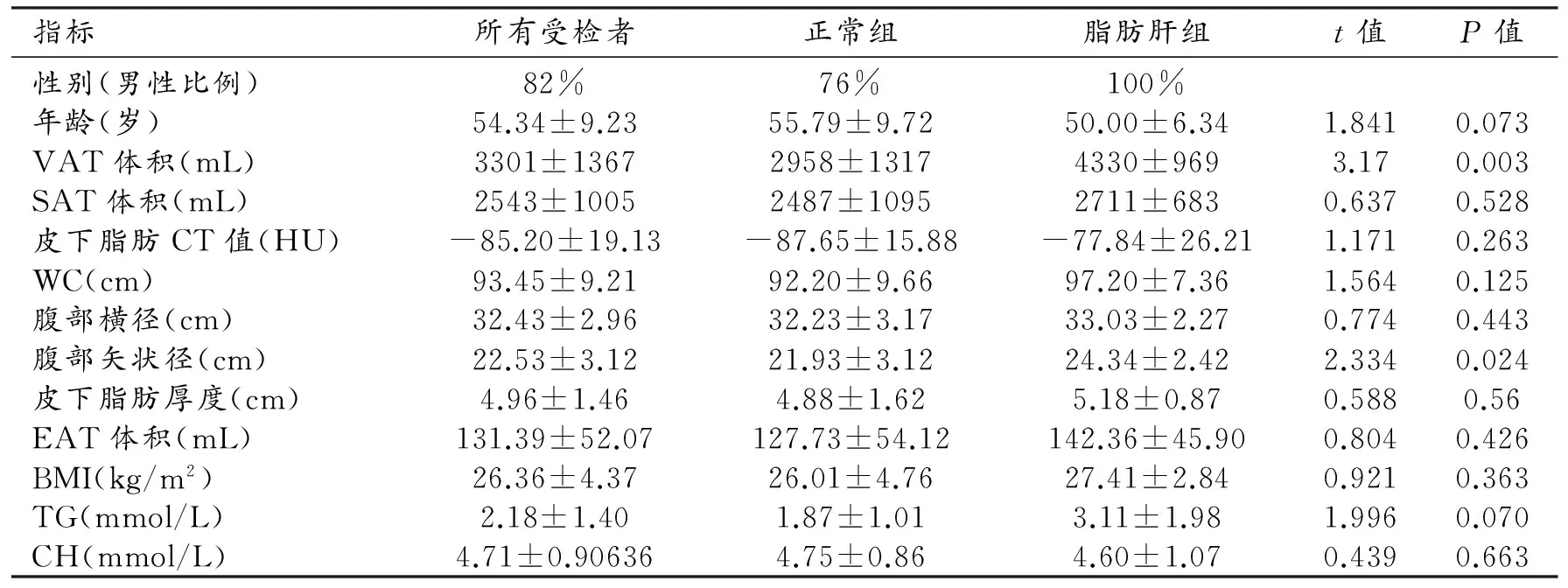
表1 受试者一般资料
注:VAT,内脏脂肪组织;SAT,皮下脂肪组织;WC,腰围; EAT,心外膜脂肪组织
采用Spearman检验分析VAT体积、EAT体积、SAT体积、SAT脂肪密度平均值、WC、BMI、皮下脂肪厚度、TG值、CH值与CTL/S的相关性。采用两样本t检验比较连续变量资料(VAT体积、EAT体积、SAT体积、SAT脂肪密度平均值、WC、BMI、皮下脂肪厚度、TG值、CH值)在脂肪肝组与正常组中的差异,绘制受试者工作特征 (receiver operating characteristic,ROC)曲线计算、比较相关指标的诊断效能。以P<0.05为差异有统计学意义。
结 果
1.受检者的一般资料
44例受检者中11例诊断为脂肪肝,33例为正常肝脏。 脂肪肝组中VAT体积为(4330±969) mL, 矢状径为(24.34±2.42) cm;正常组中VAT体积为(2958±1317) mL, 矢状径为(21.93±3.12) cm,两组间VAT体积、矢状径差异均有统计学意义(P值分别为0.003、 0.024)。两组间其余指标差异均无统计学意义(P值均>0.05,表1)。
2.相关指标与CTL/S的相关性分析结果
VAT体积与CTL/S值呈中度相关(r=0.551,P<0.001,图2),皮下脂肪密度、腹部矢状径、血TG值与CTL/S值呈低度相关(r=0.375,P=0.012;r=0.390,P=0.0009;r=0.471,P=0.001)。EAT体积、SAT体积、皮下脂肪厚度、腹腔长径、BMI、WC、 CH均与CTL/S值无明显相关(P值均>0.05)。
3.ROC曲线分析结果
将VAT体积、腹部矢状径对脂肪肝的诊断效能进行ROC曲线分析,显示两者的曲线下面积分别为0.799 (95%CI:0.670~0.927)、0.749 (95%CI:0.598~0.901)。VAT体积的曲线下面积大于腹部矢状径,但两者间差异无统计学意义(P>0.05)。VAT体积的截点为2986ml,此时诊断脂肪肝的敏感度、特异度分别为100%、63.64%;腹部矢状径的截点为21.22 cm,此时诊断脂肪肝的敏感度、特异度分别为100%,45.45%。
讨 论
近年来,NAFLD的发病率呈明显上升趋势,且患者年龄趋于低龄化,已经成为危害人们健康的常见病、多发病。NAFLD可导致单纯脂肪沉积、脂肪性肝炎及肝硬化等一系列改变。原发性的NAFLD多为肥胖、高脂血症、胰岛素抵抗、代谢综合征等累及到肝脏引起的病理学改变[15]。本研究发现,腹部内脏脂肪体积与肝脏脂肪沉积具有中等程度的相关性,而皮下脂肪体积及临床常用的腰围、BMI、皮下脂肪厚度等指标在脂肪肝组与正常组中差异无统计学意义,与CTL/S值也没有相关性,这说明并不是所有的肥胖都会导致非酒精性脂肪肝发生风险的提高,腹型肥胖是一种更加危险的分型。既往研究大多通过测量腰围或腹腔内脂肪的面积或厚度来量化腹腔内脂肪。腰围因为包含了皮下脂肪及腹腔内的脂肪,并且测量会受到立卧位姿势的影响,是一种不精确的评估方式。腹腔内脂肪厚度(visceral fat thickness,VFT)可以通过CT或超声进行测量,但各项研究测量的位置有所不同,且容易受到操作者技术及受检者呼吸幅度的影像,可重复性不高[11;16;17]。腹腔内脏脂肪的面积可以通过CT或MR获取,可信度较高,并且与内脏脂肪体积具有良好的相关性[18]。有研究显示CT测量的VAT面积与脂肪肝的严重程度相关[19];MRI测得的VAT面积偏大是肝脏炎症和纤维化的独立危险因素[20]。但是MRI检查耗时长、费用高,且各个研究所测量面积的层面有所差异,所得出的截点意义难以推广应用。随着CT的普及及相关技术的发展,批量测量VAT体积成为可能。本研究通过测量VAT体积,能够更为直观、精确地量化腹腔内脂肪,研究结论也更为可靠。
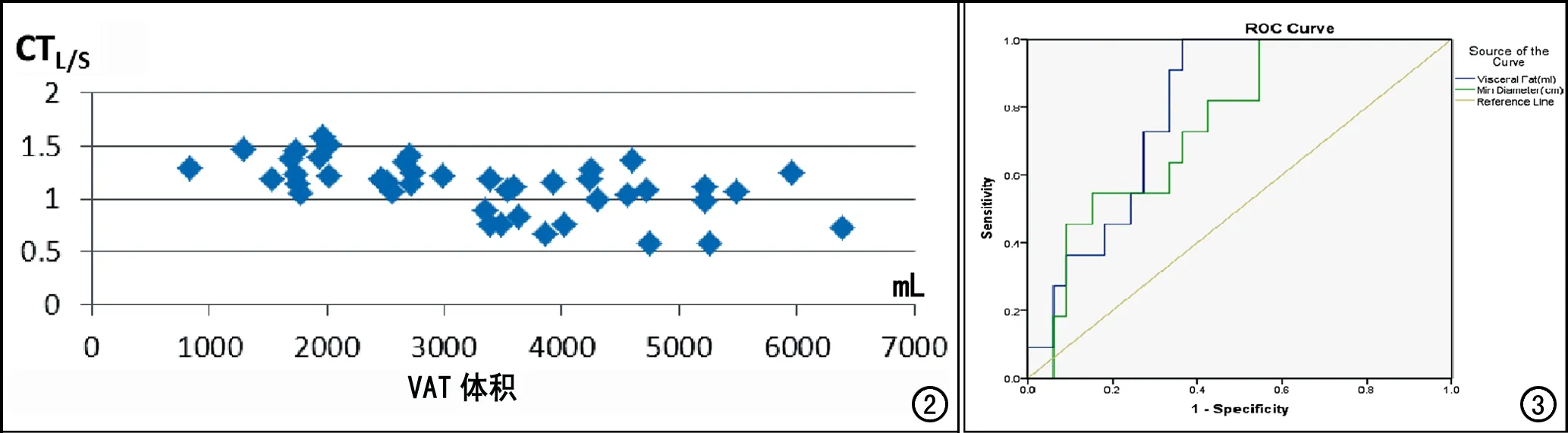
图2 VAT体积与CTL/S的相关性分析图。 图3 VAT体积、腹部矢状径对脂肪肝诊断效能的ROC曲线。
大量研究证实以VAT大量增加为特征的中央型肥胖与胰岛素抵抗、2型糖尿病、动脉粥样硬化等密切相关;以SAT增加为特征的外周型肥胖则与血脂异常以及低的粥样硬化患病风险相关,所以也有学者将内脏脂肪称为致病性的脂肪组织,将皮下脂肪称为保护性的脂肪组织[7-9;21]。脂肪细胞是脂肪组织的主要细胞组分,也是能量最主要的储存部位。VAT含有大量大脂肪细胞,大脂肪细胞有拮抗胰岛素的抗脂解作用,引起胰岛素抵抗及后续的高脂血症。SAT则含有更多小脂肪细胞,小脂肪细胞可在进食后高效地吸收游离脂肪酸(free fatty acid,FFA)和TG,能进行强有力的能量缓冲[21],那么,究竟VAT的积聚是如何与脂肪肝的发生、发展相关联的呢? Bays在2014年写过一篇关于内脏脂肪增加与全身脂肪代谢紊乱的综述,认为当SAT中的脂肪增殖与分化不足以储存额外的能量时,那么现有的脂肪细胞体积会继续增大,同时溢出的能量会引起血液中游离脂肪酸水平的升高,VAT、心旁脂肪、血管旁脂肪的积聚;血FFA及TG水平的升高又会引起肝脏、肌肉、心脏及肾脏的脂肪浸润和脂肪毒性反应,如在肝脏会引起胰岛素抵抗和非酒精性脂肪肝炎。此外,VAT分布于腹腔内,包绕着腹腔脏器,VAT的静脉直接回流进入门静脉,其代谢产物直接进入肝脏,过量FFA可为肝脏TG合成提供底物进而诱发高脂血症;脂肪因子可通过产生免疫介质如C反应蛋白(C-reactive protein,CRP)激活肝脏的炎症反应[9];此文献不仅解释了为什么VAT积聚会与肝脏的脂肪沉积相关,也解释了为什么血TG水平会与脂肪肝相关。
既往相关研究显示BMI、WC与脂肪肝是相关的,但本研究中脂肪肝组与正常组的BMI、WC差异无统计学意义,考虑主要与以下原因有关:①文献中提到肝脏的CT值及脂肪百分比在不同BMI分组中有差异,但是仅在严重肥胖与正常组比较时差异有统计学意义[22,23],本研究受检者的BMI 范围为21.05~42.25 kg/m2,平均(26.36±4.37) kg/m2,仅有5例受检者BMI>30 kg/m2,且总样本量较少,所以差异无统计学意义;②既往研究中WC与VAT的相关性会受到种族人群的影响变化较大[24],同时WC既包含了内脏脂肪的部分也包含了皮下脂肪的部分,所以是一种不够精确的评估指标,再加上本研究样本量较少,所以导致两组的WC差异无统计学意义。
本研究中EAT体积在两组中差异无统计学意义。EAT是内脏脂肪的一种,位于心脏表面,跟心肌血管之间没有筋膜分隔,大量文献显示EAT是心血管疾病的独立危险因素[25-28],也有少数文献认为EAT体积增加是非酒精性脂肪肝肝脏损害的危险因素[29]。EAT通过旁分泌作用,分泌的脂肪因子主要影响冠脉血管,虽然可以通过血液循环作用于全身脏器,但对于肝脏的影响可能不如腹腔内脏脂肪明显。再者EAT的体积纵向增加比横向比较EAT体积更有意义。
值得一提的是,腹部矢状径与NAFLD的相关性、脂肪肝组与正常组的腹部矢状径差异都有统计学意义,与VAT体积的相关性也很好(r=0.759,P<0.001);有关文献也认为腹高在预测腹型肥胖上要优于WC和BMI,预测的截点男性为20 cm,女性为20.3 cm[30],与本研究的截点(21.2 cm)相近。
本研究也存在一些不足,样本量较小可能导致一些偏倚,且没有进一步根据年龄、性别进行分组讨论;但本研究通过测量内脏脂肪体积,较之前测量内脏脂肪面积或腰围的方法更为精确,可更直观地显示内脏脂肪与肝脏脂肪沉积的关系,并且通过ROC曲线确定了VAT体积的截点,内脏脂肪体积>2985 mL时,诊断脂肪肝的敏感度为100%,特异度为63.64%。
综上所述,内脏脂肪体积可以作为非酒精性脂肪肝的一个预测指标,且优于传统的腰围和BMI,将来有望在临床筛查和随访中发挥更大的作用。
[1] Neuschwandertetri BA,Caldwell SH.Nonalcoholic steatohepatitis:summary of an AASLD single topic conference[J].Hepatology,2003,37(5):1202-1219.
[2] Ashtari S,Pourhoseingholi MA,Zali MR.Non-alcohol fatty liver disease in Asia:prevention and planning[J].World J Hepatol,2015,7(13):1788-1796.
[3] Kotronen A,Ykijärvinen H.Fatty liver a novel component of the metabolic syndrome[J].Arterioscler Thromb Vasc Biol,2008,28(1):27-38.
[4] Tison GH,Blaha MJ,Nasir K,et al.Relation of anthropometric obesity and computed tomography measured nonalcoholic fatty liver disease (from the multiethnic study of atherosclerosis)[J].Am J Cardiol,2015,116(4):541-546.
[5] Motamed N,Sohrabi M,Ajdarkosh H,et al.Fatty liver index vs waist circumference for predicting non-alcoholic fatty liver disease[J].World J Gastroenterol,2016,22(10):3023-3030.
[6] Birjandi M,Ayatollahi SM,Pourahmad S,et al.Prediction and diagnosis of non-alcoholic fatty liver disease (NAFLD) and identification of its associated factors using the classification tree method[J].Iran Red Crescent Med J,2016,18(11):e32858.
[7] Bays HE,Fox KM,Grandy S.Anthropometric measurements and diabetes mellitus:clues to the "pathogenic" and "protective" potential of adipose tissue[J].Metab Syndr Relat Disord,2010,8(4):307-315.
[8] Fox CS,Massaro JM,Hoffmann U,et al.Abdominal visceral and subcutaneous adipose tissue compartments association with metabolic risk factors in the framingham heart study[J].Circulation,2007,116(1):39-48.
[9] Bays H.Central obesity as a clinical marker of adiposopathy;increased visceral adiposity as a surrogate marker for global fat dysfunction[J].Curr Opin Endocrinol Diabetes Obes,2014,21(5):345-351.
[10] Chung GE,Kim D,Kwark MS,et al.Visceral adipose tissue area as an independent risk factor for elevated liver enzyme in nonalcoholic fatty liver disease[J].Medicine,2015,94(9):e573.
[11] Andrade LJ,Melo PR,Paraná R,et al.Grading scale of visceral adipose tissue thickness and their relation to the nonalcoholic fatty liver disease[J].Arq Gastroenterol,2014,51(2):118-122.
[12] Zeb I,Li D,Nasir K,et al.Computed tomography scans in the evaluation of fatty liver disease in a population based study:the multi-ethnic study of atherosclerosis[J].Acad Radiol,2012,19(7):811-818.
[13] Piekarski J,Goldberg HI,Royal SA,et al.Difference between liver and spleen CT numbers in the normal adult:its usefulness in predicting the presence of diffuse liver disease[J].Radiology,1980,137(3):727-729.
[14] Zeng MD,Fan JG,Lu LG,et al.Guidelines for the diagnosis and treatment of nonalcoholic fatty liver diseases[J].J Dig Dis,2008,9(2):108-112.
[15] García-Monzón C,Martín-Pérez E,Iacono OL,et al.Characterization of pathogenic and prognostic factors of nonalcoholic steatohepatitis associated with obesity[J].J Hepatol,2000,33(5):716-724.
[16] Osawa H,Mori Y.Sonographic diagnosis of fatty liver using a histogram technique that compares liver and renal cortical echo amplitudes[J].J Clin Ultrasound,1996,24(1):25-29.
[17] Strauss S,Gavish E,Gottlieb P,et al.Interobserver and intraobserver variability in the sonographic assessment of fatty liver[J].AJR,2007,189(6):320-323.
[18] Irlbeck T,Massaro JM,Bamberg F,et al.Association between single-slice measurements of visceral and abdominal subcutaneous adipose tissue with volumetric measurements:the framingham heart study[J].Int J Obes (Lond),2010,34(4):781-787.
[19] Eguchi Y,Eguchi T,Mizuta T,et al.Visceral fat accumulation and insulin resistance are important factors in nonalcoholic fatty liver disease[J].J Gastroenterol,2006,41(5):462-469.
[20] Van DPD,Milner KL,Hui J,et al.Visceral fat:a key mediator of steatohepatitis in metabolic liver disease[J].Hepatology,2008,48(2):449-457.
[21] 李顺昌.内脏和皮下脂肪组织的异质性探讨[J].中国糖尿病杂志,2015,23(9):862-864.
[22] Pang Q,Zhang JY,Song SD,et al.Central obesity and nonalcoholic fatty liver disease risk after adjusting for body mass index[J].World J Gastroenterol,2015,21(5):1650-1662.
[23] Jon AF,Cheema AR,Khan AN.Assessment of liver fat in an obese patient population using noncontrast CT fat percent index[J].Clin Imaging,2014,38(3):259-264.
[24] Alberti KG,Zimmet P,Shaw J,et al.The metabolic syndrome-a new worldwide definition[J].Lancet,2005,366(9491):1059-1062.
[25] Mihl C,Loeffen D,Versteylen MO,et al.Automated quantification of epicardial adipose tissue (EAT) in coronary CT angiography;comparison with manual assessment and correlation with coronary artery disease[J].J Cardiovasc Comput Tomogr,2014,8(3):215-221.
[26] Groves EM,Erande AS,Christine L,et al.Comparison of epicardial adipose tissue volume and coronary artery disease severity in asymptomatic adults with versus without diabetes mellitus[J].Am J Cardiol,2014,114(5):686-691.
[27] Mohar DS,Jonathan S,Hoang KC,et al.Epicardial adipose tissue volume as a marker of coronary artery disease severity in patients with diabetes independent of coronary artery calcium: findings from the CTRAD study[J].Diabetes Res Clin Pract,2014,106(2):228-235.
[28] 祁荣兴,黄胜,王天乐,等.DSCT测量心外膜脂肪体积与代谢综合征组分的相关性研究[J].放射学实践,2016,31(8):739-742.
[29] Fracanzani AL,Pisano G,Consonni D,et al.Epicardial adipose tissue (EAT) thickness is associated with cardiovascular and liver damage in nonalcoholic fatty liver disease[J].Plos One,2016,11(9):e0162473.
[30] 李红星,郭淑芹,马锐,等.腹高与内脏脂肪面积的相关性及探讨腹高预测腹型肥胖切点的研究[J].中华内分泌代谢杂志,2015,31(2):136-139.
The correlation of visceral adipose tissue volume and other routine obesity indexes with non-alcoholic fatty liver disease
CHEN Chi-hua,YANG Wen-jie,YAN Fu-hua.
Ruijin Hospital,Shanghai Jiaotong University School of Medicine,Shanghai 200025,China
Objective:To investigate the correlation of visceral adipose tissue (VAT) volume,epicardial adipose tissue (EAT) volume,abdominal subcutaneous adipose tissue (SAT) volume,the maximum and the minimum abdomen diameter at the navel level,body mass index (BMI),waist circumference (WC),SAT fat density,blood triglyceride (TG),and blood cholesterol (CH) with non-alcoholic fatty liver disease (NAFLD),respectively.Methods:Forty-four patients included in this study were divided into two groups:fatty liver group (n=11) and control group (n=33).All subjects underwent unenhanced CT scan of chest and abdomen.Patients' height,weight,gender,age,recent results of blood TG &CH,history of chronic diseases,alcohol drinks and medication were all collected and recorded.The non-alcoholic fatty liver (NAFLD) was defined as the ratio of mean CT value of liver to spleen (CTL/S) less than 1 (CTL/S<1) on unenhanced CT images.The EAT volume,VAT volume,SAT volume,WC,the maximum diameter &the minimum diameter of abdomen at the navel level and abdominal subcutaneous adipose tissue thickness were all semi-automatically measured on CT images using software cardiac risk.Statistics were done to analyze the correlation of the above indexes and CTL/S,and the difference of the indexes in fatty liver and control group was compared.Furthermore,the receiver operating characteristic curve (ROC) was used to measure the diagnostic efficiency of those indexes with statistical significance in predicting NAFLD.Results:The VAT volume had a fair correlation with CTL/S(r=0.551,P<0.001);the subcutaneous adipose tissue density,the minimum diameter at the navel level and the blood TG had a weak correlation with CTL/S(r=0.375,P=0.012;r=0.390,P=0.0009;r=0.471,P=0.001).None of the other indexes correlated with CTL/Ssignificantly (P>0.05).The VAT volume had the biggest area under the curve (AUC) of 0.799 with 95% confidence interval (CI) of 0.670~0.927.The AUC of minimum diameter at the navel level and blood TG was 0.749 (95%CI of 0.598~0.901) and 0.700 (95%CI of 0.496~0.904),respectively.The difference in AUC among these three indexes was not significant (P>0.05).Conclusion:The VAT volume correlates with NAFLD better than those clinical routine indexes (SAT,BMI,WC,etc).It can better predict the risk of NAFLD.
Nonalcoholic fatty liver; Visceral adipose tissue volume; Tomography,X-ray computed
200025 上海,交通大学医学院附属瑞金医院放射科
陈炽华(1990-),女,江苏南通人,博士,住院医师,主要从事心血管影像诊断工作。
R575.5; R814.42
A
1000-0313(2017)05-0436-05
10.13609/j.cnki.1000-0313.2017.05.002
2017-03-20
2017-04-22)
