HXKs基因在香蕉果实后熟过程中功能初探
2017-05-30李成梁冯仁军卢利方云天艳张恒张银东张锡炎
李成梁 冯仁军 卢利方 云天艳 张恒 张银东 张锡炎

摘 要 香蕉是世界主要水果之一,对乙烯非常敏感,属于呼吸跃变型果实。目前,香蕉果实后熟机理还未完全探明,后熟过程中己糖激酶(HXK)与乙烯的关系还不清楚。通过BLAST比对从香蕉基因组数据库中发现HXK基因家族的11个成员,经克隆获得这些基因的序列,并研究HXKs基因在香蕉果实自然后熟过程中的转录表达谱,重点研究乙烯利、甘露糖、NAG和1-MCP对HXKs基因表达、HXK酶活和内源乙烯生物合成的影响。结果表明:在香蕉果实后熟过程中HXKs基因呈现差异性表达,乙烯利上调大多数HXKs基因的表达和HXK酶活,1-MCP的作用正好相反,这表明外源乙烯正作用于HXK。另一方面,甘露糖加快内源乙烯生物合成,NAG却推迟内源乙烯生物合成,这说明HXK正作用于内源乙烯生物合成。所以,在香蕉果实后熟过程中乙烯和HXK之间存在相互促进的关系。这将为进一步阐明香蕉果实后熟机制提供理论依据,也将为香蕉果实保鲜新技术的挖掘提供新思路。
关键词 香蕉果实后熟;HXKs基因;表达分析;酶活;乙烯生物合成
中图分类号 S668.1 文献标识码 A
Abstract Banana is one of the staple fruit in the world that belongs to the respiratory climacteric fruit and is very sensitive to ethylene. The mechanism of banana fruit ripening is not fully proved at present, and the relationship between hexokinase(HXK)and ethylene during banana fruit ripening is not clear yet. In this study, the 11 members of the HXK gene family were retrieved from the banana genomic database by Basic Local Alignment Search Tool(BLAST), and the sequences of HXKs genes were obtained by cloning. Simultaneously, the expression profiles of the HXKs genes were researched on transcriptional level in naturally ripened banana fruit. Then, it was mainly studied how ethephon, mannose, N-acetylglucosamine(NAG)and 1-methylcyclopropene(1-MCP)affected the expression of HXKs genes, HXK activity, and ethylene content in the treated banana fruit with the four reagents. The results showed that the expression profiles of HXKs genes were differential during the ripening process of banana fruit. The expression of most HXKs genes and HXK activity increased by ethephon during ripening porcess, although 1-MCP having the contrary effect, which indicated that ethylene positively affected the functions of HXK. On the other hand, mannose induced ethylene biosynthesis, but NAG suppressed ethylene biosynthesis, which implied that HXK also promoted ethylene biosynthesis. Those results suggest that there was a positive interaction between ethylene and HXK during ripening process of banana fruit. It would provide a theoretical basis for further elucidating the mechanism of banana fruit ripening and also help us discover a novel strategies to dig new methods of fresh-keeping for banana fruit.
Key words banana fruit ripening; HXKs genes; expressional analysis; enzymic activity; ethylene biosynthesis
doi 10.3969/j.issn.1000-2561.2017.04.012
香蕉(Musa spp.)作為世界主要水果之一,鲜果销售量达到了全球第一[1]。但香蕉果实不耐贮藏的特性严重影响香蕉产业的发展[2]。其主要原因之一就是香蕉果实是一种呼吸跃变型果实,采摘后会出现内源乙烯大量产生,呼吸速率急剧升高,并快速完全后熟的现象[3]。香蕉果实对乙烯非常敏感[4],乙烯在香蕉果实后熟过程中起着重要作用,因为外源乙烯能诱导内源乙烯的提早释放[5]。刚采收的香蕉果实中淀粉约占鲜重的20%,约占干重的85%[6]。在香蕉果实后熟过程中,淀粉合成相关的酶活性降低,分解相关的酶活性增加,大部分淀粉被转变成可溶性糖[7],然后可溶性糖主要通过糖酵解途径被分解成为丙酮酸和乳酸[8]。因此,糖酵解在香蕉果实后熟糖分解代谢过程中起着重要作用。己糖激酶(hexokinase,HXK)是在动物、植物和微生物中普遍存在的一种酶[9]。HXK是生物体内葡萄糖进行糖酵解的启动酶,同时也是糖酵解途径的限速酶[10]。在糖酵解的活化阶段,HXK在Mg2+参与下催化葡萄糖磷酸化,生成6-磷酸葡萄糖[11],此外,他还对葡萄糖、甘露糖、果糖和半乳糖等己糖均具有磷酸化的作用,是生物体内的糖感受器[12]。植物体HXK亚细胞定位显示,其主要存在于线粒体和叶绿体等细胞器膜上和细胞质中,另外,细胞核和高尔基体中也有分布[13]。己糖激酶通常存在多个功能位点,在生物体内发挥的功能极为复杂,能够介导植物体内的多种糖信号转导作用[14-19]。研究结果发现,许多植物中内源乙烯生物合成与糖信号途径存在诸多联系[20-23],但香蕉果实中己糖激酶与乙烯信号途径之间的关系仍不明确。
为了探明香蕉果实中己糖激酶与乙烯信号途径之间的关系,本研究应用乙烯利(乙烯供体)、甘露糖(HXK底物)、N-乙酰葡糖胺(N-acetylglucosamine,NAG,HXK酶活抑制剂)、1-甲基环丙稀(1-methylcyclopropene,1-MCP,乙烯功能抑制剂)4种药剂分别处理香蕉果实,研究这些处理对HXKs基因转录表达、HXK酶活和内源乙烯含量的影响。通过上述研究,以期明确在香蕉果实采后成熟过程中己糖激酶与内源乙烯生物合成的关系,从而阐明香蕉HXK基因家族在果实后熟过程中的功能。
1 材料与方法
1.1 材料
1.1.1 植物材料 本试验所采用的植物材料为巴西蕉,采自中国热带农业科学院热带生物技术研究所试验基地,所采收的香蕉果实来自同一束香蕉花序,八成熟。挑选发育良好、无外伤、长势相近的香蕉果实作为试验材料。
1.1.2 试剂 乙烯利购于安阳全丰生物科技有限公司(LS20071780);1-MCP购于美国AgroFresh公司;NAG和甘露糖购于上海宝曼生物科技有限公司;RevertAidTM Premium Reverse Transcriptase购于Fermentas公司;荧光定量PCR(qRT-PCR)中使用的SYBRR Select Master Mix试剂盒购于Life公司;己糖激酶试剂盒购于苏州科铭生物技术公司。
1.2 方法
1.2.1 试验材料的处理 0.1 g/kg的乙烯利和0.12 mmol/L的甘露糖水溶液在不伤害香蕉果实的前提下对香蕉果实分别具有最佳的催熟和保鲜作用;0.08 mmol/L的NAG水溶液在不伤害香蕉果实的前提下对香蕉果实具有最佳的保鲜作用;AgroFresh公司的1-MCP预装包对香蕉果实具有良好的保鲜效果。首先,对挑选出来的香蕉果实进行快速的表面消毒和清洗,等表面水渍风干后将其分成5组:1个对照(CK)组,4个处理(乙烯利、甘露糖、NAG和1-MCP)组;然后将上述浓度的药品溶液均匀地涂抹在香蕉果实的表面,待其表面水渍风干后装入密闭的保鲜袋,置于培养箱中(温度25 ℃、湿度85%、光照12 h)保存;从处理时开始计算,每隔1 d(第0,2,4,6,8……天)取一次样品,直至香蕉果实腐烂;对取得的样品按果皮、果肉进行分开收集,贮于-80 ℃待用。
1.2.2 总RNA的提取和反转录 本试验采用改良CTAB法提取处理组和对照组香蕉果肉和果皮的总RNA。通过琼脂糖凝胶电泳检测总RNA的完整性,利用紫外分光光度計检测其纯度。参照试剂盒说明书,采用Fermentas公司RevertAidTM Premium Reverse Transcriptase反转录试剂盒对消化过DNA的总RNA进行cDNA第一链的合成,以香蕉Actin基因为参照(引物见表1),通过PCR方法检测反转录效果。
1.2.3 HXKs基因在香蕉果实自然后熟过程中和不同处理下的表达分析 通过在The Banana Genome Hub(http://banana-genome.cirad.fr/)上进行在线BLAST分析,获得了香蕉HXKs基因;利用Primer Premier 5.0软件设计这些基因的PCR引物,采用对PCR产物测序的方法验证引物是否有效;以反转录好的cDNA为模板,Actin基因为内参,参照试剂盒说明书,利用Life公司SYBRR Select Master Mix qRT-PCR试剂盒检测HXKs基因在自然后熟过程中和不同处理条件下香蕉果肉和果皮中的表达情况。采用2-△△Ct(Cycle threshold,Ct)法计算处理组与对照组的表达差异[24],计算公式为:目的基因相对表达量为2-△△Ct;△△Ct=△Ct(CK组)-△Ct(处理组);△Ct=Ct(目的基因)-Ct(内参基因)。
1.2.4 HXK酶活力测定 参照试剂盒说明书,采用苏州科铭生物技术公司生产的己糖激酶试剂盒对香蕉果实的己糖激酶进行提取和酶活力检测。每隔1 d(第0,2,4,6,8……天)检测一次酶活力,直至香蕉果实腐烂。
1.2.5 内源乙烯含量测定 本试验采用岛津GC2010气相色谱仪测量处理组及对照组香蕉果实的内源乙烯产量,每隔1 d(第0,2,4,6,8……天)检测一次内源乙烯含量,直至香蕉果实腐烂。
1.3 统计分析
本试验对各个样品设置3个生物学重复和3个技术重复。采用Excel 2010软件对试验数据进行统计分析,处理与对照数据的比较采用t检验,以p值<0.05为显著性差异。
2 结果与分析
2.1 总RNA的提取和反转录
提取各样品的总RNA后,并对其进行质量检测。总RNA的1%琼脂糖凝胶电泳结果表明,28S、18S条带清晰,且前者亮度大概是后者的2倍,说明提取的总RNA未出现降解。用紫外分光光度计对总RNA进行检测,OD260/OD280在1.8~2.0之间,说明多糖和蛋白等杂质含量较低,总RNA质量符合后续试验的要求。反转录后,利用Actin基因的引物对合成的cDNA进行PCR检测,结果表明,本试验获得了Actin基因的特异性条带,这说明合成的DNA质量较好,可用于后续的qRT-PCR试验。
2.2 香蕉HXKs基因的克隆
通过The Banana Genome Hub在线BLAST分析后,获得了11个香蕉HXKs基因。根据这11个HXKs基因的序列特征设计了相应的PCR引物(表1)。引物合成后,以反转录获得的cDNA为模板对HXKs基因进行了PCR反应,PCR产物回收后委托生工生物工程上海(股份)有限公司进行测序。测序结果经过BLAST对比后,方可确认为目的基因。HXB1和HXA1基因经过多对引物的PCR反应均未能扩增出目的片段,因此,这2个基因可能在香蕉果实中低表达或不表达。
2.3 香蕉HXKs基因的分组和染色体定位
根据HXKs基因的序列特征,将其分成A、B和C 3个组。A组包括HXA1、HXA2和HXA3,B组由HXB1、HXB2、HXB3和HXB4组成,C组包含HXC1、HXC2、HXC3和HXC4。11个香蕉HXKs基因在染色体上的位置见表2。
2.4 各种处理对香蕉果实表观形态的影响
乙烯利、甘露糖、NAG和1-MCP处理香蕉果实后,随着时间推移,香蕉果实的表观形态变化不同。由图1可知,乙烯利处理的香蕉果实已经完全变软,果皮已经变黑,果实开始腐烂(处理后第8天);甘露糖处理的香蕉果实才刚后熟,果皮变黄,果实变软;NAG和1-MCP处理及对照的香蕉果实仍然生硬,果皮为绿色。通过多天的表观观察后发现,乙烯利、甘露糖对香蕉果实有催熟作用,且乙烯利的催熟作用效果显著优于甘露糖;NAG和1-MCP对香蕉果实具有保鲜作用,且1-MCP的保鲜作用效果明显优于NAG。
2.5 香蕉果实自然后熟过程中HXKs基因的转录表达谱
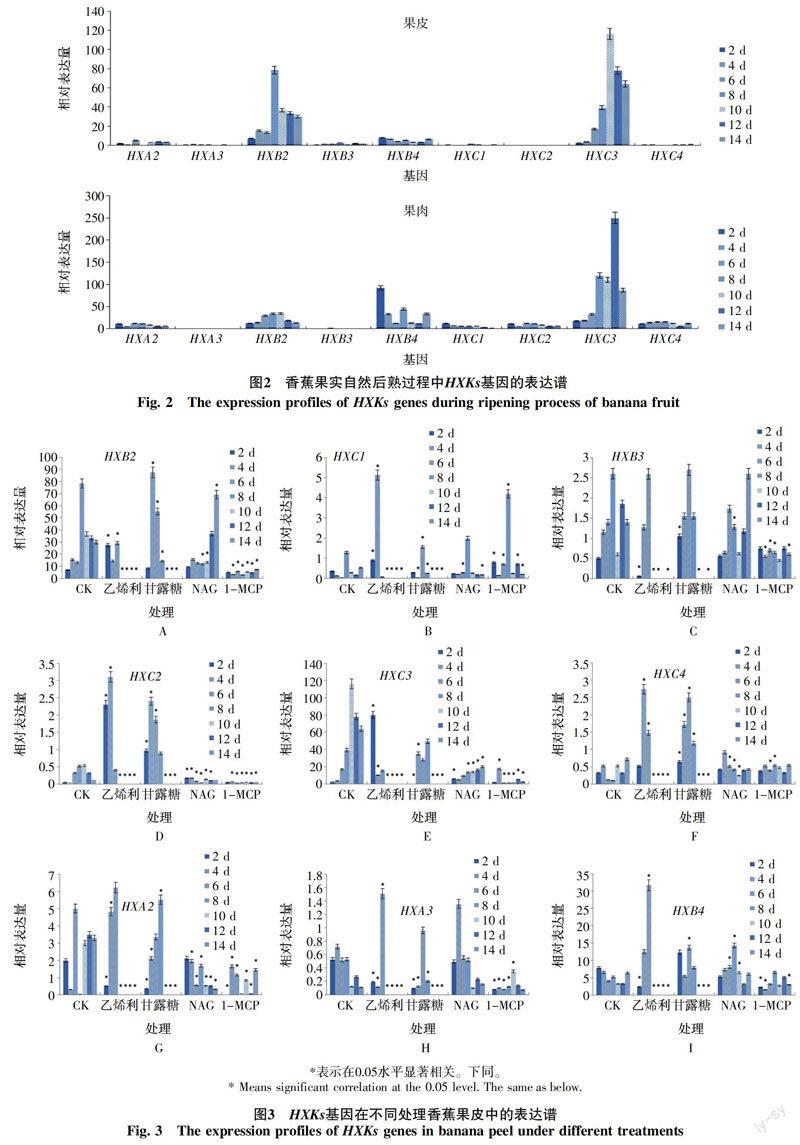
在香蕉果实自然后熟(未使用任何药剂)过程中HXKs基因的表达存在差异(图2)。总体来看,果皮中,HXC3的表达量最高,其次是HXB2,然后是HXB4和HXA2,而HXA3、HXB3、HXC1、HXC2和HXC4的表达处于很低的水平或未检测到;在果肉中,HXC3的表达量也是最高,其次是HXB4和HXB2,然后是HXC4、HXA2、HXC2、HXC1,其余基因的表达处于很低的水平或检测不到。
2.6 各种处理对香蕉果实HXKs基因转录表达的影响
各种处理对香蕉果实HXKs基因转录表达的影响不同。由图3可知,在果皮中,乙烯利诱导HXB2、HXC1、HXC2、HXC3、HXC4、HXA2和HXB4的表达,抑制HXA3的表达,基本不影响HXB3的表达;甘露糖上调HXB2、HXC2、HXC3、HXC4、HXA2和HXB4的表达,下调HXA3的表达,对HXC1和HXB3的表达影响不大;NAG抑制HXC2、HXC3和HXA2的表达,对HXB2、HXC1、HXB3、HXC3、HXC4、HXA3和HXB4的表达影响不大;1-MCP仅诱导HXC1的表达,抑制HXB2、HXB3、HXC2、HXC3、HXA2和HXA3的表达,基本不影响HXC4和HXB4的表达。由图4可知,在果肉中,乙烯利诱导HXB2、HXC4和HXA3的表达,抑制HXC1、HXB3、HXC3和HXB4的表达,基本不影响HXC2和HXA2的表达;甘露糖上调HXC1和HXB3的表达,下调HXC3的表达,对HXB2、HXC2、HXC4、HXA2、HXA3和HXB4的表达影响不大;NAG诱导HXB3和HXB4的表达,抑制HXB2、HXC3、HXC4和HXA3的表達,对HXC1、HXC2和HXA2的表达影响不大;1-MCP诱导HXC1和HXB4的表达,抑制HXB2、HXC2、HXC3、HXC4和HXA3的表达,基本不影响HXB3和HXA2的表达。这些结果表明,乙烯利和甘露糖在香蕉果皮中诱导了大部分HXKs基因的表达,而1-MCP和NAG在香蕉果皮中却抑制了大部分HXKs基因的表达;果肉中的情况恰好与果皮相反。乙烯利和1-MCP的作用较强,甘露糖和NAG的作用较弱。结合香蕉果实的表观特征,发现果皮中HXKs基因的高水平表达出现的先后与各个处理对香蕉果实后熟快慢的影响呈正相关。
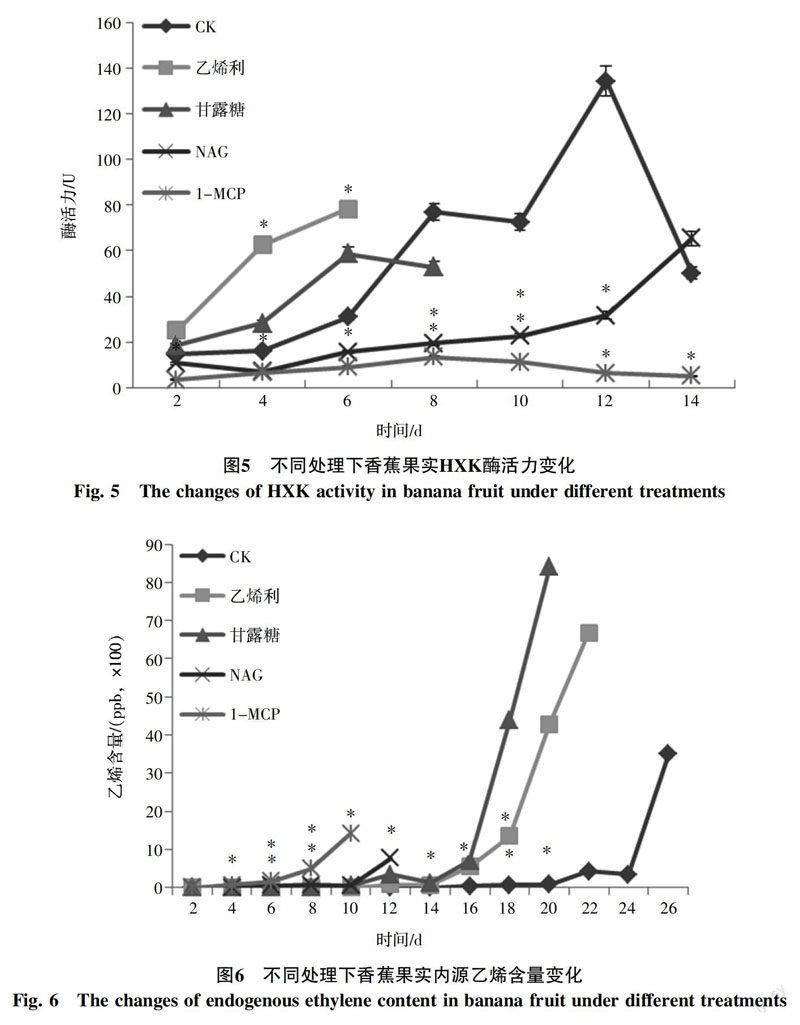
2.7 各种处理对香蕉果实中HXK酶活的影响
4种处理对香蕉果实中HXK酶活的影响见图5。在香蕉果实自然后熟(CK组)过程中,HXK酶活力逐渐升高,到第8天出现一个酶活平台期,从第10天开始酶活再次升高,到第12天时酶活达到峰值,为初始酶活的7倍,然后迅速下降。前8 d,乙烯利和甘露糖处理香蕉果实的HXK酶活显著上升,且乙烯利处理香蕉果实的HXK酶活高于甘露糖处理香蕉果实的HXK酶活;此时NAG和1-MCP处理香蕉果实的HXK酶活仅维持在初始水平。以上结果表明,乙烯利和甘露糖诱导HXK酶活的升高,1-MCP和NAG却抑制HXK酶活的升高。乙烯利和1-MCP的作用较强,甘露糖和NAG的作用较弱。结合香蕉果实的表观特征,结果发现HXK高水平酶活出现时间的早晚与各个处理对香蕉果实后熟快慢的影响呈正相关。
2.8 各种处理对香蕉果实中内源乙烯含量的影响
为了探明4种处理对香蕉果实中内源乙烯含量的影响,对不同处理的香蕉果实进行了内源乙烯含量跟踪监测(图6)。各处理检测到内源乙烯的时间存在先后差异,乙烯利处理的香蕉果实在第4天就检测到内源乙烯,甘露糖处理的香蕉果实第6天检测到内源乙烯,自然后熟香蕉果实(CK组)第10天检测到内源乙烯,NAG处理的香蕉果实第12天检测到内源乙烯,1-MCP处理的香蕉果实直到第16天才检测到微量内源乙烯。以上结果表明,乙烯利和甘露糖促进内源乙烯生物合成,1-MCP和NAG却抑制内源乙烯生物合成。乙烯利和1-MCP的作用较强,甘露糖和NAG的作用较弱。结合香蕉果实的表观特征,结果发现大量内源乙烯生物合成的先后与各个处理对香蕉果实后熟快慢的影响结果一致。
3 讨论
HXK是植物体内糖酵解的启动酶,同时也是糖酵解途径的限速酶[10],他不仅参与糖的代谢,同时也参与糖信号感受和转导过程[13],在香蕉果实后熟过程中发挥着重要作用。本试验研究了HXKs基因在香蕉果实后熟过程中的表达变化规律,重点研究了乙烯利、甘露糖、NAG和1-MCP对HXKs基因表达、HXK酶活和内源乙烯生物合成的影响,结果表明,HXKs基因在香蕉果实后熟过程中呈现差异性表达。乙烯利和甘露糖在香蕉果皮中诱导了大部分HXKs基因的表达,而1-MCP和NAG在香蕉果皮中却抑制了大部分HXKs基因的表达;果肉中的情况恰好与果皮相反。乙烯利和甘露糖促进HXK酶活的升高和内源乙烯生物合成,1-MCP和NAG却抑制HXK酶活的升高和内源乙烯生物合成。结合香蕉果实的表观特征,结果发现乙烯利和甘露糖促进香蕉果实后熟,1-MCP和NAG却抑制香蕉果实后熟。在各种处理对HXKs基因表达的影响试验中,发现部分HXKs基因在果皮和果肉中的表达模式相反,这与Inaba等[25]的研究结果一致。Inaba等[25]发现香蕉果皮中基因的表达特征与果实后熟进程呈正相关,然而,由于负反馈抑制作用的影响,果肉中基因的表达特征与果实后熟进程呈负相关。
本研究结果发现,在香蕉果实后熟过程中乙烯利上调大多数HXKs基因的表达和HXK酶活,1-MCP的作用正好相反,这表明外源乙烯正向作用于HXK。另一方面,甘露糖加快内源乙烯生物合成,NAG却推迟内源乙烯生物合成,这说明HXK正向作用于内源乙烯生物合成。因此,在香蕉果实后熟过程中乙烯和HXK之间存在相互促进的关系。但在拟南芥生长过程中却发现,葡萄糖通过其感应子己糖激酶加快EIN3(ethylene-insensitive 3)的降解,從而拮抗乙烯信号途径[26]。其原因可能为:首先,香蕉果实后熟过程与拟南芥生长过程是完全不同的两个过程,因此,乙烯信号途径和葡萄糖信号途径在这两个过程中的作用可能不同;其次,香蕉果实是光合作用“库”,而拟南芥的叶和根是光合作用“源”,所以,乙烯信号途径和葡萄糖信号途径在“源”和“库”中的作用也可能不同。当然,这些还需要进一步的试验证实。
参考文献
[1] 刘以道, 张慧坚. 世界香蕉产业发展概况及发展趋势[J]. 世界农业, 2013, 10(1): 76-79.
[2] 陈平生. 四个品种香蕉抗性淀粉的特性及其在后熟期间变化规律的研究[D]. 广州: 华南理工大学, 2012.
[3] Biale J B, Young R E. Respiration and ripening in fruits-retrospect and prospect[M]//Friend J, Rhodes M J C, eds. Recent advances in the biochemistry of fruits and vegetables. London: Academic Press, 1981: 1-39.
[4] Fox T C, Green B J, Kennedy R A, et al. Changes hexokinase activity in Echinochloa phyllopogon and Echinochloa cruspavoms in response to abiotic stress[J]. Plant Physiol, 1998, 118(7): 1 403-1 409.
[5] Turner J F, Copeland L. Hexokinase II of pea seeds[J]. Plant Physiol, 1981, 68(6): 1 123-1 127.
[6] Claeyssen E, Rivoal J. Isozymes of plant hexokinase: occurrence, properties and functions[J]. Cheminform, 2007, 68(6): 709-731.
[7] Jang J C, Sheen J. Sugar sensing in higher plants[J]. Plant Cell, 1994, 6(9): 1 665-1 679.
[8] Gupta A K, Kaur N. Sugar signalling and gene expression in relation to carbohydrate metabolism under abiotic stresses in plants[J]. J Biosci, 2005, 30(5): 761-776.
[9] Balasubramanian R, Karve A, Kandasamy M, et al. A role for F-action in hexokinase-mediated glucose signaling[J]. Plant Physiol, 2007, 145(7): 1 423-1 434.
[10] Perata P, Matsukura C, Vernieri P, et al. Sugar repression of a gibberellin-dependent signaling pathway in barley embryos[J]. Plant Cell, 1997, 9(11): 2 197-2 208.
[11] Prata R, Williamson J D, Conkling M A, et al. Sugar repression of mannitol dehydrogenase deactivity in celery cells[J]. Plant physiol, 1997, 114(2): 307-314.
[12] Jang J C, Leon P, Zhou L, et al. Hexokinase as a sugar sensor in higher plants[J]. Plant Cell, 1997, 9(1): 5-19.
[13] Halford N G, Purcell P C, Hardie D G. Is hexokinase really a sugar sensor in plants[J]. Trends Plant Sci, 1999, 4(1): 117-120.
[14] Loreti E, Bellis L D, Alpi A, et al. Why and how do plant cells sense sugars[J]. Ann Bot, 2001, 88(4): 803-812.
[15] Cho J I, Ryoo N, Eom J S, et al. Role of the rice hexokinases OsHXK5 and OsHXK6 as glucose sensors[J]. Plant Physiol, 2009, 149(4): 745-759.
[16] Rolland F, Moore B, Sheen J. Sugar sensing and signaling in plants[J]. Plant Cell, 2002, 14(S): 185-205.
[17] Rolland F, Baena-Gonzalez E, Sheen J. Sugar sensing and signaling in plants: conserved and novel mechanisms[J]. Annu Rev Plant Biol, 2006, 57(4): 675-709.
[18] Ramon M, Rolland F, Sheen J. Sugar sensing and signaling[A]. Arabidopsis Book, 2008, e6: 0117.
[19] Smeekens S, Ma J, Hanson J, et al. Sugar signals and molecular networks controlling plant growth[J]. Curr Opin Plant Biol, 2010, 13(2): 274-279.
[20] 柳 玲. 相對定量的2-△△CT法分析HLA-G基因在子宫内膜异位症中的表达[J]. 中国优生与遗传杂志, 2007, 15(1): 25-26.
[21] Abeles F B. Ethylene in plant biology[M]. New York: Academic Press, 1973: 1-302.
[22] Abeles F B, Morgan P W, Saltveit M E Jr. Ethylene in plant biology(2Ed.)[M]. San Diego: Academic Press, 1992: 414.
[23] Simmonds N W. Bananas[M]. Singapore: Print House, 1966: 252-275.
[24] Hill S A, ap Rees T. The effect of glucose on the control of carbohydrate metabolism in ripening bananas[J]. Planta, 1995, 196(2): 335-343.
[25] Inaba A, Liu X, Yokotani N, et al. Differential feedback regulation of ethylene biosynthesis in pulp and peel tissues of banana fruit[J]. J Exp Bot, 2007, 58(5): 1 047-1 057.
[26] Yanagisawa S, Yoo S D, Sheen J. Differential regulation of EIN3 stability by glucose and ethylene signalling in plants[J]. Nature, 2003, 425(3): 521-525.
