腭突间充质细胞中TGFβ1信号通路介导维甲酸致腭裂的实验研究
2017-05-27汤伟钳胡晓
汤伟钳 胡晓


【摘要】 目的 探讨转化生长因子β1(TGFβ1)信号通路在维甲酸(RA)致腭裂过程中的作用。方法 选取8~10周龄野生型小鼠, 构建RA诱导腭裂的小鼠模型, 分别取E13.5(E13.5组)、E15.5(E15.5组)和E17.5(E17.5组)的腭突, 荧光定量PCR(q-PCR)检测TGFβ1基因的表达, 信号通路检测法(Western blot)检测下游p-Smad2(S467)的表达;RA处理原代培养的腭突间充质细胞(MEPM), q-PCR检测TGFβ1基因的表达, Western blot检测下游p-Smad2(S467)的表达。RA和TGFβ1共同处理MEPM, CCK-8法检测细胞的增殖活性。结果 RA诱导的腭裂小鼠中, E13.5组和E15.5组腭突中TGFβ1的表达显著下降(P<0.01), 到E17.5时, 与对照组的表达水平相当(P>0.05)。p-Smad2(S467)的表达也呈现同样的趋势。RA显著抑制了MEPM中TGFβ1和p-Smad2(S467)的表達, 且呈浓度依赖性。RA和TGFβ1共处理组的细胞增殖活性较RA单纯处理组显著上升, 体外添加TGFβ1重组蛋白能有效逆转RA对MEPM增殖的抑制作用。结论 MEPM中TGFβ1信号通路在RA致腭裂过程中发挥着重要作用。
【关键词】 维甲酸;腭裂;转化生长因子β1;腭突间充质细胞
DOI:10.14163/j.cnki.11-5547/r.2016.32.090
【Abstract】 Objective To investigate effect by signal channel of transforming growth factor β1 (TGFβ1) in embryonic palate mesenchymal cells in retinoic acid (RA)-induced cleft palate. Methods RA-induced cleft palate rat model was established on 8~10-week-old wild mice. Palatine process of E13.5(E13.5 group), E15.5(E15.5 group) and E17.5(E17.5 group) were taken, along with quantitative PCR(q-PCR) for TGFβ1 gene expression detection and Western blot for downstream p-Smad2 (S467) expression detection. RA was used to process embryonic palate mesenchymal cells (MEPM) in primary culture, along with q-PCR for TGFβ1 gene expression detection and Western blot for downstream p-Smad2 (S467) expression detection. Combination of RA and TGFβ1 was used to process MEPM cells, along with CCK-8 for cellular proliferative activity detection. Results Among rats with RA-induced cleft palate, E13.5 group and E15.5 group had obviously reduced TGFβ1 expression (P<0.01), which was at similar level as the control group in E17.5 (P>0.05). Their p-Smad2 (S467) expression showed the same pattern. Expression of TGFβ1 and p-Smad2 (S467) expressions in MEPM cells were obviously inhibited by RA, along with concentration dependent manner. Cellular proliferative activity in combined process by RA and TGFβ1 was higher than single RA. External addition of TGFβ1 recombinant protein effectively reversed inhibiting effect by RA on MEPM cells proliferation. Conclusion Signal channel of TGFβ1 in MEPM shows significant effect in retinoic acid-induced cleft palate.
【Key words】 Retinoic acid; Cleft palate; Transforming growth factor β1; Embryonic palate mesenchymal cells
RA是哺乳动物胚胎各个器官正常发育必不可少的物质。过量RA可导致腭裂已早有报道, 但具体的分子机制尚不明确。转化生长因子-β(TGFβ)超家族是一类具有多种生物学活性的细胞因子, 在胚胎发育过程中发挥着重要作用。有研究显示RA诱导腭裂的过程中腭突上皮细胞的TGFβ1信号通路出现异常[1], 但MEPM的TGFβ1信号通路在RA致腭裂中的作用尚不清楚。本研究探讨了RA对小鼠体内腭突和体外培养的MEPM中TGFβ1信号通路的影响, 分析了TGFβ1信号通路介导RA致腭裂的分子机制。
1 材料与方法
1. 1 实验动物 8~10周龄的野生型C57BL/6J小鼠购自于广东省医学实验动物中心[许可证号SCXK(粤)2013-0002]。SPF级环境下饲养, 12 h光照, 12 h黑暗, 食物和水自由获取。交配当天晚上以雌雄2∶1的比例合笼, 次日早晨检测雌鼠阴道栓, 阳性者记为E0.5。
1. 2 RA诱导腭裂模型的构建 分别取E13.5(E13.5组)、E15.5
(E15.5组)和E17.5(E17.5组)的腭突, q-PCR检测TGFβ1基因的表达, Western blot检测下游p-Smad2(S467)的表达;RA购于上海sigma公司, 模型的构建参照先前的报道进行[2]。
1. 3 q-PCR检测 分别取各组的胚鼠, 于解剖镜下剪取腭突组织, 加入Trigene试剂提取总RNA, 用RE-TROscript逆转录试剂盒合成cDNA, 用q-PCR(SYBR green)检测的方法, 以β-actin为内参, 分析TGFβ1的基因表达水平。以上试剂均购自北京康润生物公司。
1. 4 Western blot检测 分别取各组的腭突组织, 于液氮中研磨成粉末, 加入RIPA裂解液[海门碧云天, 含50 mmol/L Tris-HCl(pH 7.4), 150 mmol/L NaCl, 1% NP-40, 0.1% SDS和1 mmol/L PMSF], 裂解充分后, 离心, 取上清, 用Western blot法检测下列TGFβ/Smad2信号通路蛋白的表达:p-Smad2(S647)、Smad2(武汉爱博泰克), β-actin(天津三箭)。
1. 5 MEPM原代培养 原代培养参照前面报道的方法进行。简要过程如下:取E13.5正常胚鼠的上腭, 用显微剪剪下双侧腭突组织, Hanks缓冲液漂洗后, 剪成约1 mm3大小的组织块, 用组织块贴瓶法进行培养。待间充质细胞爬出组织块并长至约80%覆盖度时, 进行第一次传代(P1), 取P3~P5代细胞进行正式实验。细胞经处理后, q-PCR和Western blot检测如前所述进行。细胞活力检测(CCK-8法, 南京东仁化学)实验中, MEPM经RA(2 μm)和TGFβ1(2 ng/ml, 北京义翘神州)处理24 h后, 操作按照说明书进行。
1. 6 统计学方法 采用SPSS20.0统计学软件进行数据统计分析。计量资料以均数±标准差( x-±s)表示, 采用t检验;用qPCR分析基因相对表达量时, 数据转换为相对于对照组的倍数;用CCK-8分析原代细胞增殖时, 数据转换为相对于对照组的相对百分数, 两组间差异比较用独立样本t检验, 三组的组间差异比较用单因素方差分析(One-Way ANOVA)。计数资料以率(%)表示, 采用χ2检验。P<0.05表示差异具有统计学意义。
2 结果
2. 1 RA对小鼠体内腭突TGFβ1信号通路的影响 q-PCR结果显示, E15.5组的小鼠腭突中TGFβ1的表达较E13.5组显著升高, 到E17.5时又显著下降。而在RA组, E13.5组和E15.5组中TGFβ1的表达均较对照组显著下降(P<0.01), 而到E17.5时, E15.5组和RA组TGFβ1的表达水平相当, 差异无统计学意义(P>0.05)。见图1。表明RA抑制了腭发育关键时期(E13.5和E15.5)TGFβ1的表达。为了验证这一结果, 本次采用Western blot的方法进一步分析了TGFβ1信号通路下游的重要因子Smad2的活性。结果显示, 在E13.5和E15.5, RA组p-Smad2(S467)的表達均较对照组显著下降, 到E17.5时则与对照组基本相当, 差异无统计学意义(P>0.05)。以上结果表明RA抑制了腭发育关键时期(E13.5和E15.5)TGFβ1信号通路的活性。
2. 2 RA对体外培养的MEPM中TGFβ1信号通路的影响 q-PCR结果显示, RA显著抑制了MEPM中TGFβ1的表达, 且呈浓度依赖性。同样Western blot结果显示, RA显著抑制了MEPM中p-Smad2(S467)的表达, 且呈浓度依赖性。见图2。结果表明RA抑制了MEPM中TGFβ1信号通路的活性。
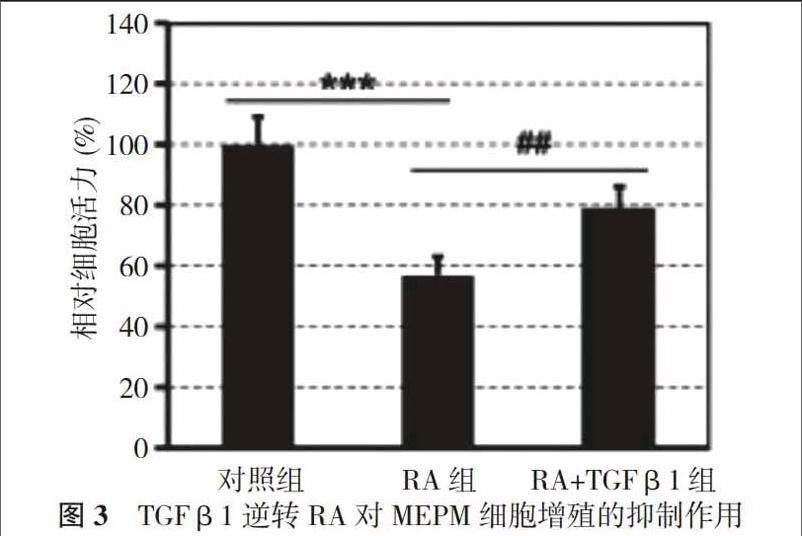
2. 3 体外添加TGFβ1逆转RA对MEPM增殖的抑制作用
CCK-8法结果显示, RA显著降低了MEPM的增殖活力(RA:2 μm, TGFβ1:2 ng/ml, 处理24 h)。为了探讨TGFβ1在RA抑制MEPM增殖中所扮演的角色, 在RA处理的MEPM中添加了TGFβ1重组蛋白。结果显示, RA和TGFβ1共处理组的细胞增殖活性较RA单纯处理组显著上升, 表明体外添加TGFβ1重组蛋白能有效逆转RA对MEPM细胞增殖的抑制作用。见图3。
3 讨论
小鼠腭的形成过程与人类非常相似, 是开展腭裂病因学研究的常用模型。正常小鼠腭的发育开始于E11.5, 在E12.5时腭突垂直向下生长, 一直持续至E13.5;在E14.5左右腭突上抬呈水平生长, 到E15.5时双侧腭突开始接触、粘附, 随后上皮细胞大量凋亡, 双侧腭突的间充质细胞相融合, 形成连续的上腭;到E17.5时腭完全融合形成一道屏障将口腔和鼻腔分开, 形成独立的口洞和鼻洞[3, 4]。可见, 腭的发育是由一系列复杂的过程组成, 并受多种信号通路的调控。在前期的研究中, 成功构建了RA诱导腭裂的小鼠模型, 并探讨了Wnt/β-catenin信号通路参与其中的分子机制[5, 6]。TGFβ信号通路也与腭的发育过程紧密关联。研究表明, 在腭的发育过程中, TGFβ1及其下游信号分子Smad2的表达具有时空特性, 在上皮细胞和间充质细胞的表达不同, 在不同腭发育时期的表达也不同。新近有研究显示, RA诱导腭裂的过程中腭突上皮细胞的TGFβ1信号通路出现异常[7-10]。但MEPM的TGFβ1信号通路在RA致腭裂中的作用尚不清楚。为此, 作者首先检测了RA诱导腭裂小鼠模型中MEPM TGFβ1的表达。在对照组, 从E13.5~E15.5, 间充质细胞的TGFβ1表达持续升高, 到E17.5时迅速降低, 这与腭发育过程中间充质细胞先扩增后分化的轨迹相吻合。同时, 从E13.5~E15.5RA组间充质细胞中TGFβ1的表达较对照组显著降低, 表明TGFβ1参与调控间充质细胞的增殖和分化。为了进一步分析间充质细胞中TGFβ1通路在RA致腭裂中的作用, 作者构建了间充质细胞体外培养模型, 发现RA能显著抑制MEPM中TGFβ1通路的活性, 同时呈浓度依赖性, 与体内结果一致, RA也显著降低了MEPM的增殖活性。体外添加TGFβ1有效逆转RA的抑制作用。这些结果一致表明, MEPM中TGFβ1信号通路在RA致腭裂过程中也发挥了重要的作用。对这一问题进行更加深入的研究, 将有助于进一步丰富对腭裂病因学的认识。
参考文献
[1] 黄洪章, 吕宝辉, 陈亦阳, 等. 维甲酸诱导小鼠腭裂发病机制的实验研究. 中华口腔医学杂志, 2003, 38(3):185-187.
[2] 胡晓, 李叶扬, 梁岷, 等. 维甲酸改变腭突发育关键时期细胞增殖和凋亡导致腭裂. 中华整形外科杂志, 2016, 32(3):224-228.
[3] Bush JO, Jiang R. Palatogenesis: morphogenetic and molecular mechanisms of secondary palate development. Development, 2012, 139(2):231-243.
[4] Hu X, Gao J, Liao Y, et al. Retinoic acid alters the proliferation and survival of the epithelium and mesenchyme and suppresses Wnt/尾-catenin signaling in developing cleft palate. Cell Death & Disease, 2013, 4(4):320-327.
[5] 王莎. 維甲酸致小鼠腭裂发生中TGF-β/Smad2/3信号分子的研究. 兰州大学, 2012.
[6] 姚兆友, 何倩婷, 刘中华, 等. 维甲酸诱导腭裂发生中转化生长因子-β信号通路相关分子表达的研. 广东牙病防治, 2013, 21(11):565-570.
[7] 吴慧. 维甲酸诱导腭裂小鼠出生前后Wnt通路相关信号分子的表达. 大连医科大学, 2011.
[8] 沈璐, 丛蔚, 王如, 等. 维甲酸诱导腭裂相关wnt和成纤维细胞生长因子配体表达的动态变化. 华西口腔医学杂志, 2011, 29(1):62-65.
[9] 刘典伟. 叶酸对维甲酸诱导的腭裂小鼠的腭突间充质细胞增殖影响的研究. 山西医科大学, 2014.
[10] 陈亦阳, 陈沐, 汪淼, 等. 胚鼠腭突细胞转化生长因子β3基因的RNA干扰及对TGFβ-Smad信号通路的影响. 中华口腔医学研究杂志电子版, 2011, 5(1):16-21.
[收稿日期:2016-10-03]
