草鱼肠道酸碱度的研究
2017-05-16班赛男吴山功张晶邹红王桂堂
班赛男吴山功张 晶邹 红王桂堂
(1. 中国科学院水生生物研究所中国科学院水生生物多样性与保护重点实验室, 武汉 430072; 2. 中国科学院大学, 北京 100049)
草鱼肠道酸碱度的研究
班赛男1,2吴山功1,2张 晶1,2邹 红1王桂堂1,2
(1. 中国科学院水生生物研究所中国科学院水生生物多样性与保护重点实验室, 武汉 430072; 2. 中国科学院大学, 北京 100049)
胃肠道是一个复杂的消化系统, 每一部分都具有独特的生理特征。酸碱度(pH)是消化道重要的生理指标之一, 其对营养物质的消化、吸收和肠道微生物的生长等具有重要影响。为了研究草鱼在食物消化过程中, 肠道的酸碱度变化, 测定了草鱼肠道食物糜、肠液和黏膜的pH。结果显示, 随着食物的消化, 它们的pH都有下降的趋势。肠道食物糜pH在6.86±0.24到8.43±0.10之间, 肠液pH在7.14±0.22到8.63±0.02之间, 相同时间点相同肠段两者之间的pH差异很小, 并且在实验期间两者的pH变化趋势相同。黏膜pH在6.23±0.04到6.7±0.13之间, 为弱酸性。除了时间点12h外, 相同时间点和相同肠道部位黏膜的pH与食物糜、肠液的pH相比均有显著性差异(P<0.05)。分析发现草鱼摄食食物的pH与上述三相的pH之间均有显著性差异(P<0.05), 研究结果为草鱼消化生理及营养学研究提供了基础资料。
草鱼; 肠道食物糜; 肠液; 肠道黏膜; pH
胃肠道是动物主要的消化器官, 每一部分都有独特的生理特征[1], 酸碱度(pH)是胃肠道重要的生理指标, 它可以改变食物的消化过程, 影响消化效率, 对肠道健康及营养物质吸收有重要的作用[2]。正因为其重要性, 胃肠道的酸碱度受到了广泛关注。鱼类是水生变温动物, 体内酸碱度很容易受外界环境的影响, 尤其是淡水鱼类, 它们维持胃肠道酸碱度平衡的机制有体液的缓冲机制、鳃部的气体交换机制和排泄机制等, 由于体液的缓冲机制和气体交换机制在酸碱度调节中的作用受到一定的限制, 因此排泄机制在鱼类酸碱度调节中的作用显得更加重要[3,4]。虽然人们已经研究了多种鱼类胃肠道酸碱度的变化, 但是由于研究方法、目的及结果不完全一致, 而且肠道的分段没有做相应的划分,肠道食物糜及其液相部分也没有很好的区分[5—10],因此研究结果有一定的局限性。肠道黏膜含有起吸收作用的柱状上皮细胞和能分泌消化酶和黏液的杯状细胞, 在营养物质的消化、吸收及健康免疫上有着重要的作用[11—13]。动物肠道黏膜酸碱度的研究已有很多报道[14—17], 但有关鱼类肠道黏膜酸碱度的研究却很少。
草鱼是我国重要的淡水养殖经济鱼类, 为我国“四大家鱼”之一, 经济价值和食用价值较高[18]。草鱼是典型草食性鱼类, 没有胃, 所以营养物质的消化和吸收主要在肠道中进行[19—21]。但是草鱼肠道酸碱度的研究基本还处于空白状态, 只有Hlckling[10]研究了摄食水生植物后, 草鱼肠道食物糜的酸碱度及消化酶在不同肠段的分布。Day等[20]通过对草鱼短期禁食再喂食, 研究了肠道酸碱度的变化及氨肽水解酶的活性。他们的研究对草鱼肠段没有较细的区分, 草鱼肠道食物糜、肠液和黏膜三相在食物消化的不同时间点、肠道的不同部位之间的关系也没有较深入地探讨。本研究以草鱼为对象, 摄食后, 在不同时间点对肠道不同部位的三相进行取样,并分别测定其pH。旨在弄清草鱼在消化食物时, 肠道酸碱度的变化, 同时分析对草鱼肠道酸碱度产生影响的生物及环境因子。
1 材料与方法
1.1 饲养条件
实验用2龄草鱼养殖于湖北省黄冈市水产科学研究所养殖基地, 一组草鱼一直饲喂苏丹草, 另一组草鱼一直饲喂商品颗粒饲料, 饲料购于湖北裕泰科技饲料有限公司。在池塘养殖5个月后采样,取饲喂苏丹草的草鱼21尾, 取饲喂商品颗粒饲料的草鱼4尾, 草鱼体长(31.9±0.9) cm, 体重(453.4± 38.5) g。
1.2 样品采集
2015年9月23日上午8:00最后一次饲喂草鱼, 10:00开始对饲喂苏丹草的草鱼连续取样, 以第一次采样时间为0时间点, 接下来分别在第一次采样时间点之后的2h、4h、8h、12h、24h和144h取样,每个时间点取3尾鱼做重复[1,22], 同时在0时间点取摄食商品颗粒饲料的草鱼4尾, 与摄食苏丹草的草鱼做对照。在每个时间点取养殖草鱼的池塘水, 用于水环境pH的测定。测量体长体重后, 解剖草鱼,取出肠道部分。先按结构把肠道分为前肠(AI)、中肠(MI)和后肠(PI)三段[19], 并用细线结扎, 再将肠道伸展开, 使其处于自然伸直状态。因为按照结构来分, MI与AI、PI相比较长, 不利于从整个肠道空间上研究pH的变化趋势, 因此再将MI按长度平均分为三段, 靠近AI的部分为MI-1, 靠近PI的部分为MI-3, 中间的部分为MI-2, 并用细线将MI按上述方法分三段结扎[23—25]。纵向剖开肠道, 取出各段肠道食物糜和黏膜, –80℃保存等待样品进一步处理。
1.3 样品的处理
样品室温解冻, 将食物糜分为两份, 一份直接测pH, 作为食物糜酸碱度, 另一份10000×g离心5min, 吸取上清液测pH作为肠液酸碱度[1], 黏膜和池塘水解冻后直接测pH。另外, 还测定草鱼摄入的苏丹草和商品颗粒饲料的pH。由于草鱼在采样时间点24h时肠道食物糜已经完全排空, 所以关于食物糜与肠液部分的pH结果只记录到采样时间点12h, 黏膜不受食物的影响, 所以一直记录到144h。
1.4 pH测定
实验采用梅特勒-托利多微量pH计(Metter-ToledoFE20 上海, 中国和Inlab solids pro IP67, Metter-Toledo Inc, Columbus, USA)进行酸碱度的测量。
1.5 数据处理
用IBM SPSS Statistics 22软件对数据进行统计学分析, SigmaPlot 12.5软件作图。用单因素方差分析不同时间点相同肠段pH的变化, 数据分析前进行同质性检验。用重复测量方差分析相同时间点不同肠道部位pH的变化, 分析过程中数据要求符合球形假设, 对于不符合球形检验的数据采用主体内效应检验中的Huynd-Feldt法, 并且采用多变量检验结果进行校正。而不同时间点、不同肠段食物糜、肠液和黏膜三相之间pH比较先用一般线性模型的单变量检验, 对于结果有显著性差异的数据, 用多重比较显示具有差异的结果。食物、水与肠道食物糜、肠液和黏膜的pH比较用独立样本t检验。检验过程中显著水平的P值设为0.05, 两两比较采用Tukey HSD结果, 并用Bonferroni’s对结果作适当的
校正[1, 2, 25]。
2 结果
2.1 肠道食物糜在各时间点的状态
在采样时间点0时, 此时草鱼处于饱食状态, 整个肠道充满食物。在时间点2h, AI食物糜较时间点0减少, 其他肠段仍然充满食物糜。时间点4h时, AI食物糜中液体明显增多, MI食物糜减少, PI仍充满食物糜。到8h时, AI有大量肠液, 食物糜较少, MI和PI食物糜均减少, 肠液增多。在时间点12h时,食物糜和肠液仅余少量。到24h时, 整个肠道已经完全排空。
2.2 肠道食物糜、肠液和黏膜在各时间点的pH变化
肠道食物糜在各时间点的pH 单因素方差分析结果表明除了MI-3食物糜pH在各个时间点没有显著性差异外, 其余肠段食物糜pH在不同时间点差异显著(P<0.05)。
从图 1可以看出, 草鱼AI食物糜的pH随着摄食时间的延长呈下降趋势。采样时间点0, pH为7.78±0.11, 在2h达到最大, 为8.25±0.32。摄食后的时间越长, AI食物糜越少, 在12h, pH降到最低, 为7.05±0.23。单因素方差分析显示不同时间点AI食物糜的pH差异显著(P<0.05), 进一步分析发现时间点2h、8h与12h的pH之间有显著性差异(P<0.05)。
MI三段食物糜pH随时间变化的总趋势与AI相同, pH都是先上升后下降。MI-1、MI-2和MI-3的最大值相似分别是8.43±0.10、8.40±0.10和8.36± 0.18, 最小值分别是7.10±0.24、7.49±0.10和7.59± 0.22。
草鱼PI食物糜pH与其他肠段的变化趋势相同,在对应的时间点上pH均有所降低, 尤其是在时间点12h, 肠道食物糜pH降到最低, 为6.86±0.24。
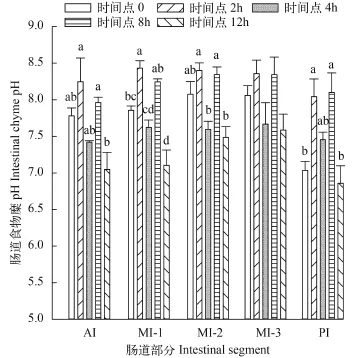
图 1 肠道食物糜pH在各时间点的变化Fig. 1 pH measurements of intestinal chyme at different time points小写字母表示在时间点之间的差异; 下同Different lowercase letters indicate significant differences at different time points (P<0.05); the same applies below
肠液部分在各时间点的pH 单因素方差结果显示不同时间点相同肠段肠液pH之间有显著性差异(P<0.05)。不同肠段肠液pH在各时间点的变化与肠道食物糜变化趋势相同, 都是先上升后降低。
如图 2所示AI肠液pH在采样时间点2h达到最大, 为8.37±0.27, 在12h降到最小值, 为7.14±0.22。MI三段肠液pH在各时间点相对应的值相似, 其中MI-1和MI-2都是在8h和12h分别达到最大值和最小值, 最大值分别为8.44±0.16和8.62±0.24, 最小pH分别为7.63±0.02和7.81±0.13。而MI-3肠液的pH在2h和4h达到最大值和最小值, 分别为8.63±0.02和7.74±0.23。
摄食后PI肠液的pH一直升高, 时间点8h达到最大值8.51±0.32, 但在12h时突然降低到最小值7.17±0.24。
肠道黏膜部分在各时间点的pH 单因素方差分析显示不同时间点相同肠段黏膜pH之间均没有显著性差异。与肠道食物糜和肠液的pH相比, 各肠段黏膜pH相对稳定, 均呈弱酸性, 在6.23±0.03到6.7±0.11之间。
如图 3所示, AI黏膜pH在时间点8h达到最大值6.58±0.12, 12h时降到最低, 为6.37±0.03。MI-1黏膜pH与AI的变化趋势一样, 并且在同样的时间点处达到最大值和最小值, 分别为6.70±0.11和6.36±0.03。与其他肠段不同的是, MI-1黏膜pH经过多重比较,结果显示在时间点8h与12h之间有显著性差异(P<0.05)。
MI-2黏膜pH在各时间点的变化不同于以上两段, 在时间点0的pH最低, 为6.32±0.03, 其后逐渐上升, 8h达到最大值6.49±0.10, 之后在12h和144h之间变化很缓慢。MI-3和PI黏膜pH在各时间点上比前三段低, 变化趋势也与前三段不尽相同, 但是两者pH在各时间点上相差很小。在草鱼摄食后的整个时间段里, PI黏膜pH最稳定。
2.3 肠道食物糜、肠液和黏膜的pH在肠道不同部位的变化
图 4、图 5是草鱼在摄食后不同时间点, 肠道食物糜、肠液和黏膜三相pH的变化趋势图。在草鱼摄食后, 对不同肠段食物糜的pH数据进行重复测量方差分析, 结果显示数据符合球形假设, 各肠段间食物糜的pH有显著性差异(P<0.05)。从图上可以看出, 在各个时间点, 整个肠道食物糜pH变化趋势一致, 都是先升高再降低, 最大值均出现在MI部分, 最小值在AI或者PI部分, 其中时间点0、2h和12h的最小值出现在PI, 分别为7.03±0.12、8.04± 0.24和6.86±0.24。虽然4h和8h的最小值是在AI, 但是此时AI和PI的pH相差很小, 分别相差0.3和0.4个pH单位。多重比较显示在时间点0, 只有PI食物糜的pH与其他肠段具有显著性差异(P<0.05), 其他时间点食物糜的pH在肠段之间均无显著性差异。
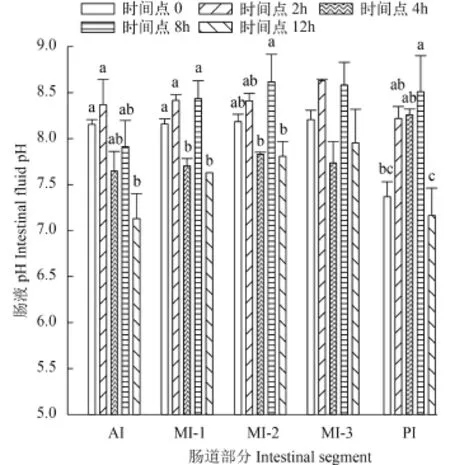
图 2 肠液pH在各时间点的变化Fig. 2 pH measurements of intestinal fluid at different time points
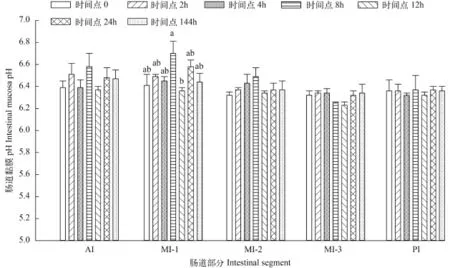
图 3 肠道黏膜pH在各时间点的变化Fig. 3 pH measurements of intestinal mucosa at different time points
对不同肠段肠液的pH数据进行重复测量方差分析, 结果显示数据符合球形假设, 各肠段间肠液pH有显著性差异(P<0.05)。在实验期间, 肠液pH在7.14±0.22到8.63±0.02之间。除了时间点4h外, 肠液pH在各肠段的变化趋势一样, 都是先升高再降低。在4h, AI到MI的酸碱度变化很平缓, 呈下降趋势,但是到PI时, pH没有像其他时间点一样下降, 而是上升, 并且达到了最大值8.26±0.06。同食物糜相同, 多重比较显示在时间点0, 只有PI肠液的pH与其他肠段具有显著性差异(P<0.05), 其他时间点肠液的pH在肠段之间均无显著性差异。
因为草鱼肠道各部位肠道黏膜的pH经检验不符合球形假设, 所以把多变量中Pillai’s轨迹的结果和球形检验中校正模型Huynh-Feldt的结果相结合,最后发现不同肠段间黏膜pH具有显著性差异(P<0.05)。在草鱼摄食后, 各肠道黏膜pH均为弱酸性, 不同时间点的变化趋势不尽相同。如图 4, 时间点0, 肠道黏膜pH先升高, 在MI-1处达到最大值6.41±0.10, MI-3降到最低值6.32±0.03, 同样的变化趋势也出现在8h和24h样品中。时间点2h、12h和144h肠道黏膜的pH变化趋势相同, 最大值都是在AI处, 之后降低并在MI-3处达到最低, 分别为6.34±0.02、6.23±0.03和6.34±0.08。而4h时的pH变化趋势与其他时间点不同, 其黏膜pH先升高后下降, 在MI-1处达到最大, 在PI处达到最小值。多重比较显示在时间点12h, 只有MI-3黏膜的pH与AI、MI-1具有显著性差异(P<0.05), 其他时间点黏膜的pH在肠段之间均无显著性差异。
2.4 相同时间点、相同肠段的肠道食物糜、肠液和黏膜三相间的差异
用SPSS软件对数据做一般线性模型的单变量检验, 结果显示, 在草鱼摄食后, 肠道食物糜、肠液和黏膜三相之间的pH差异性显著(P<0.05)。如图 4、图 5, 在采样时间点0, 肠液和肠道食物糜pH的变化趋势相同, 与黏膜明显的区分开。进一步多重比较结果显示除了AI外, 其余各肠段肠液和肠道食物糜的pH没有明显差异, 而黏膜pH与肠液、肠道食物糜的pH在各肠段差异性显著(P<0.05)。在时间点2h和8h肠液和肠道食物糜的pH在各肠段均没有显著性差异, 黏膜与肠道食物糜和肠液之间均有显著性差异(P<0.05)。
在时间点4h时, 肠道食物糜和肠液pH之间只有PI存在显著性差异(P<0.05), 黏膜pH与其他两相之间均有显著性差异。在12h, 各肠段食物糜和肠液大量减少, 此时只有MI的食物糜、肠液与黏膜有显著性差异(P<0.05), AI和PI三相之间均没有显著性差异。
2.5 食物和养殖池塘水对草鱼肠道pH的影响
草鱼摄入的苏丹草和商品颗粒饲料的pH分别为5.31±0.03和5.44±0.03, 养殖草鱼池塘水在取样期间各时间点的pH依次为8.10±0.02、8.24±0.02、8.32±0.04、8.14±0.03、8.19±0.03、8.33±0.04和8.54±0.06。
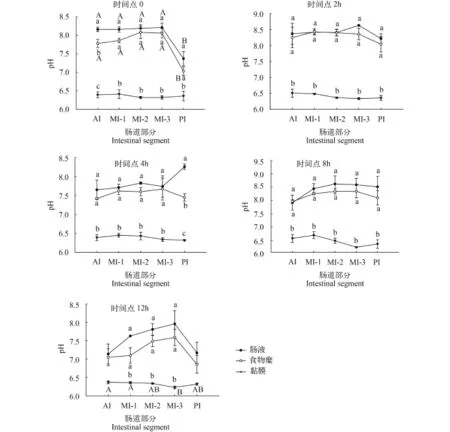
图 4 各肠段食物糜、肠液和黏膜pH在时间点0—12h的变化Fig. 4 pH measurements of intestinal chyme, fluid and mucosa between 0 and 12h post-feeding (0—12h)小写字母表示三相之间的显著性差异, 大写字母表示肠段之间的显著性差异Different lowercase letters indicate significant differences among the three phase (P<0.05). Differences capital letters indicate significant differences among the intestinal segments (P<0.05)
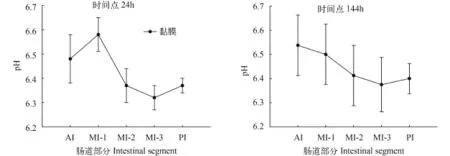
图 5 各肠段黏膜pH在时间点24、144h的变化Fig. 5 pH measurements of intestinal mucosa at time points 24h and 144h
苏丹草和商品颗粒饲料的pH与不同时间点不同肠段相应肠道食物糜、肠液和黏膜的pH进行独立样本t检验, 结果显示, 不同时间点不同肠段三相的pH与相应食物的pH均有显著性差异(P<0.05)。
采样时间点养殖草鱼池塘水的pH与对应时间点草鱼不同肠段三相pH之间用独立样本t检验, 结果显示, 各时间点黏膜pH与水的pH之间均存在显著差异(P<0.05)。随着食物的消化, 食物糜和肠液的pH与相应时间点池塘水pH之间的差异性逐渐增大。时间点0时只有PI食物糜和肠液的pH与水的pH之间有显著性差异(P<0.05)。2h时MI-1和MI-3肠液的pH与水的pH之间有显著性差异(P<0.05)。4h时MI-1、MI-2肠液和AI、MI-1、MI-2、PI食物糜的pH与水的pH之间均有显著性差异(P<0.05)。到12h时只有MI-3肠液和食物糜的pH与水的pH之间没有显著性差异, 其余均存在显著性差异。但是时间点8h时各肠段食物糜和肠液的pH与水的pH之间均没有显著性差异。采样期间我们也发现, 随着食物的减少, 草鱼肠道中的水分先增多后减少, 在时间点8h时, 肠道水分含量最多。
3 讨论
摄食苏丹草的草鱼食物糜和肠液的pH变化趋势一致, 在食物消化的初期即采样时间点0, 前肠和中肠食物糜和肠液的pH比较高, 食物继续消化过程中的2h、4h和8h, 中肠和后肠的pH升高, 而前肠的pH有所降低。pH的这种变化趋势可能是以下三种因素造成的: (1)养殖池塘水的影响。测的养殖期间池塘中水的pH是8.28±0.08, 草鱼在摄食和吞咽的过程中同时摄入池塘水, 并且水会随着食物的消化逐渐从前肠进入后肠, 进而可能会影响到整个肠道pH的变化[22,26]。(2)胆汁的影响。胆囊分泌胆汁进入前肠, 并随食物的蠕动进入后肠。胆汁在帮助食物消化的同时, 也会增加肠道食物糜的pH[27]。(3) Cl–/交换器的影响。胰腺和肠道自身利用Cl–/交换器分泌, 该交换器已被证实在调节Opsanus beta和Platichthysflesus肠道食物糜酸碱度上发挥主要的作用[28,29]。在时间点12h, 肠道pH普遍降低, 特别是后肠pH只有6.86±0.24, 此时草鱼肠道中食物仅余少量, 其中一尾鱼前肠和中肠已经没有食物。随着食物减少, 分泌到肠道中的胆汁和因摄食带入的水也减少[22,25,30],的分泌是一个需能过程, 在肠道食物很少时分泌量也会减少[2,31]。此外, 随着食物消化时间延长, 后肠微生物的发酵却更充分了[32], 短链脂肪酸作为草鱼后肠微生物发酵的主要产物, 种类有乙酸、丙酸、丁酸和异丁酸等, 浓度分别为(2.10±0.28)、(0.45±0.10)、(0.33±0.11)和(0.03±0.01) mmol/kg(本实验室未发表的数据)。一方面肠道中短链脂肪酸的产生会对的分泌起抑制作用[33], 另一方面, 短链脂肪酸本身具有的酸性对肠道的碱性也有一定的中和作用。因此, 这些综合因素导致了时间点12h肠道pH, 特别是后肠食物糜和肠液pH降低。
食物在消化过程中, 肠道食物糜与肠液的pH变化趋势一致, 相差很小。此外, 相同时间点食物糜和肠液pH都是在中肠处达到最大值, 与Page和Solovyev的研究结果一致。Page等[24]研究斑点叉尾时也发现肠道食物糜的pH在中肠处达到最大, Solovyev等[34]研究石斑鱼在摄食后, 肠道食物糜的pH同样是在中肠达到最大。本实验中结果不同的是在时间点4h, 肠液的pH在后肠达到最大, 这种个别时间点pH的特别变化, 在Nikolopoulou等[22]研究中也有发现。
实验中同时也测定了摄食商品颗粒饲料后草鱼肠道的pH, 结果显示食物糜pH在7.41±0.01和7.60±0.15之间, 肠液pH在7.55±0.22和8.01±0.15之间, 与相应时间点摄食苏丹草的pH相比各肠段都有所降低, 结果与Kohl和Åshild的研究一致。Kohl等[2]在研究摄食不同纤维含量的小鼠肠道pH时发现高纤维食物会增加小肠的pH, Åshild等[35]研究了摄食不同蛋白含量食物的大西洋蛙鱼肠道pH, 结果发现肠道pH与食物蛋白含量呈负相关。
为进一步研究食物对消化道pH的影响, 我们分析了苏丹草和草鱼商品颗粒饲料的pH, 统计结果显示苏丹草和食物的pH与肠道食物糜、肠液和黏膜之间的pH有显著性差异(P<0.05), 说明草鱼肠道的pH不是由摄入食物的pH决定的。
肠道黏膜酸碱度与一些营养物质吸收直接相关[16,17], 在动物肠道表面的黏膜层存在一个区域,此处的酸碱度不受肠道食物糜和肠液的影响, 呈弱酸性[14,15]。我们的研究结果显示草鱼肠道黏膜pH为弱酸性, 在6.32±0.03和6.70±0.11之间, 而且不同时间点各肠段黏膜pH变化较小, 较肠道食物糜和肠液pH稳定。
肠道食物糜、肠液和肠道黏膜的pH均有下降趋势。相同时间点、相同部位食物糜和肠液的pH差异性很小, 但是两者与黏膜之间的pH有显著性差异。相同时间点、不同部位肠道食物糜、肠液和黏膜的pH之间均分别存在显著性差异, 说明草鱼不同肠段生理特征具有差异性。食物的pH与食物糜、肠液和黏膜的pH之间均有显著性差异(P<0.05), 说明消化过程中肠道的pH并不是由食物的pH决定的。本研究的结果为草鱼消化生理和营养学的研究提供了基础资料。
致谢:
感谢中国科学院水生生物研究所解绶启研究员和胡慧花博士在pH测定方面给予的帮助。
[1]Bucking C, Wood C M. The effect of postprandial changes in pH along the gastrointestinal tract on the distribution of ions between the solid and fluid phases of chyme in rainbow trout [J]. Aquaculture Nutrition, 2009, 15(3): 282—296
[2]Kohl K D, Stengel A, Samuni-Blank M, et al. Effects of anatomy and diet on gastrointestinal pH in Rodents [J]. Journal of Experimental Zoology Part A Ecological Genetics & Physiology, 2013, 319(4): 225—229
[3]LIN H R. Fish Physiology [M]. Guangdong Higher Education Press. 2007, 116—150 [林浩然. 鱼类生理学. 广东高等教育出版社. 2007, 116—150]
[4]Evans D H, Piermarini P M, Choe K P. The multifunctional fish gill: dominant site of gas exchange, osmoregulation, acid-base regulation, and excretion of nitrogenous waste [J]. Physiological Reviews, 2005, 85(1): 97—177
[5]Maier K J, Tullis R E. The effects of diet and digestive cycle on the gastrointestinal tract pH values in the goldfish, Carassius auratus L., Mozambique tilapia, Oreochromis mossambicus (Peters), and channel catfish, Ictalurus punctatus (Rafinesque) [J]. Journal of Fish Biology, 2006, 25(2): 151—165
[6]Hoehne-Reitan K, KjØrsvik E, Reitan K. Development of the pH in the intestinal tract of larval turbot [J]. Marine Biology, 2001, 139(6): 1159—1164
[7]Saghari Fard M R, Weisheit C, Poynton S L. Intestinal pH profile in rainbow trout Oncorhynchus mykiss and microhabitat preference of the flagellate Spironucleus salmonis (Diplomonadida) [J]. Diseases of Aquatic Organisms, 2007, 76(3): 241—249
[8]German D P, Bittong R A. Digestive enzyme activities and gastrointestinal fermentation in wood-eating catfishes [J]. Journal of Comparative Physiology B, 2009, 179(8): 1025—1042
[9]Solovyev M M, Kashinskaya E N, Rusinek O T, et al. Physiological pH values in the digestive tract of perch Perca fluviatilis, from different habitats [J]. Journal of Ichthyology, 2016, 56(2): 312—318
[10]Hlckling C F. On the feeding process in the White Amur, Ctenopharyngodon idella [J]. Journal of Zoology, 1966, 148(4): 408—419
[11]Martin E, Trichet V V, Legrand-Frossi C, et al. Comparison between intestinal and non-mucosal immune functions of rainbow trout, Oncorhynchus mykiss [J]. Fish & Shellfish Immunology, 2012, 33(6): 1258—1268
[12]Rombout JHWM, Kiron V. Mucosal Vaccination of Fish [M]. Fish Vaccination. 2014, 56—67
[13]Irene S. The Mucosal Immune System of Teleost Fish [J]. Biology, 2015, 4(3): 525—539
[14]Mcewan G T A, Schousboe B, Skadhauge E. Direct measurement of mucosal surface pH of pig jejunum in vivo [J]. Journal of Veterinary Medicine Series A, 1990, 37(6): 439—444
[15]Laverty G, Holtug K, ElbrØnd V S, et al. Mucosal acidification and an acid microclimate in the hen colon in vitro [J]. Journal of Comparative Physiology B, 1994, 163(8): 633—641
[16]Akiba Y, Nakamura M, Nagata H, et al. Acid-sensing pathways in rat gastrointestinal mucosa [J]. Journal of Gastroenterology, 2002, 37(14): 133—138
[17]Kristl A. Membrane Permeability in the Gastrointestinal Tract: The Interplay between Microclimate pH and Transporters [J]. Chemistry & Biodiversity, 2009, 6(11): 1923—1932
[18]Wu S, Ren Y, Peng C, et al. Metatranscriptomic discovery of plant biomass-degrading capacity from grass carp intestinal microbiomes [J]. FEMS Microbiology Ecology, 2015, 91(10): fiv107
[19]Nie D S, Wang J G. Biology and Diseases of Grass Carp [M]. Beijing: Science Press. 1999, 27— 33 [倪达书, 汪建国. 草鱼生物学与疾病. 北京: 科学出版社. 1999, 27—33]
[20]Day R D, Tibbetts I R, Secor S M. Physiological responses to short-term fasting among herbivorous, omnivorous, and carnivorous fishes [J]. Journal of Comparative Physiology B Biochemical Systemic & Environmental Physiology, 2014, 184(4): 497—512
[21]Wang W W, Wu S G, Zou H, et al. Characterization of cellulose-decomposing bacteria in the intestinal of grass carp, Ctenopharyngodon idella (Val.) [J]. Acta Hydrobiologica Sinica, 2014, 38(2): 291—297 [王微微, 吴山功,邹红, 等. 草鱼肠道纤维素降解细菌的分离与鉴定. 水生生物学报, 2014, 38(2): 291—297]
[22]Nikolopoulou D, Moutou K A, Fountoulaki E, et al. Patterns of gastric evacuation, digesta characteristics and pH changes along the gastrointestinal tract of gilthead sea bream (Sparus aurata, L) and European sea bass (Dicentrarchus labrax, L) [J]. Comparative Biochemistry & Physiology Part A Molecular &Integrative Physiology, 2010, 158(4): 406—414
[23]Bignell D E, Eggleton P. On the elevated intestinal pH of higher termites (Isoptera: Termitidae) [J]. Insectes Sociaux, 1995, 42(1): 57—69
[24]Page J W, Andrews J W, Murai T, et al. Hydrogen ion concentration in the gastrointestinal tract of channel catfish [J]. Journal of Fish Biology, 2006, 8(3): 225—228
[25]Mcconnell E L, Basit A W, Murdan S. Measurements of rat and mouse gastrointestinal pH, fluid and lymphoid tissue, and implications for in-vivo experiments [J]. Journal of Pharmacy & Pharmacology, 2008, 60(1): 63—70
[26]Kristiansen H R, Rankin J C. Discrimination between endogenous and exogenous water sources in juvenile rainbow trout fed extruded dry feed [J]. Aquatic Living Resources, 2001, 14(6): 359—366
[27]Eastwood M A. The physiological effect of dietary fiber: an update [J]. Annual Review of Nutrition, 1992, 12: 19—35
[28]Taylor J R, Grosell M. Feeding and osmoregulation: dual function of the marine teleost intestine [J]. Journal of Experimental Biology, 2006, 209(15): 2939—2951
[29]Taylor J R, Whittamore J M, Wilson R W, et al. Postprandial acid-base balance and ion regulation in freshwater and seawater-acclimated European flounder, Platichthys flesus [J]. Journal of Comparative Physiology B, 2007, 177(6): 597—608
[30]Lefebvre P, Cariou B, Lien F, et al. Role of bile acids and bile acid receptors in metabolic regulation [J]. Physiological Reviews, 2009, 89(1): 147—191
[31]Pörtner H O, Bock C. A Contribution of Acid-base Regulation to Metabolic Depression in Marine Ectotherms [M]. Life in the Cold. Springer Berlin Heidelberg. 2000, 443—458
[32]Mountfort D O, Campbell J, Clements K D. Hindgut fermentation in three species of marine herbivorous fish [J]. Applied and Environmental Microbiology, 2002, 68(3): 1374—1380
[33]Rabbani G H, Albert M J, Rahman H, et al. Short-chain fatty acids inhibit fluid and electrolyte loss induced by cholera toxin in proximal colon of rabbit in vivo [J]. Digestive Diseases and Sciences, 1999, 44(8): 1547—1553
[34]Solovyev M M, Kashinskaya E N, Izvekova G I, et al. pH values and activity of digestive enzymes in the gastrointestinal tract of fish in Lake Chany (West Siberia) [J]. Journal of Ichthyology, 2015, 55(2): 251—258
[35]Åshild K, Sundby A, Holm H. Characteristics of digestive processes in Atlantic salmon (Salmo salar), enzyme pH optima, chyme pH, and enzyme activities [J]. Aquaculture, 2015, 449: 27—36
HYDROGEN ION CONCENTRATION IN THE DIGESTIVE TRACT OF GRASS CARP (CTENOPHARYNGODON IDELLUS)
BAN Sai-Nan1,2, WU Shan-Gong1,2, ZHANG Jing1,2, ZOU Hong1and WANG Gui-Tang1,2
(1. The Key Laboratory of Aquatic Biodiversity and Conservation of Chinese Academy of Sciences, Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, China; 2. University of Chinese Academy of Sciences, Beijing 100049, China)
The gastrointestinal tract is a complex digestive system, and each section has its unique physiological characteristics. Hydrogen ion concentration (pH) is an important physiological indicator of the digestive tract. It involves the process of digestion and absorption of nutrients and the growth of intestinal microbes. This study investigated the change of pH level of the intestinal tract in grass carp (Ctenopharyngodon idellus) during food digestion period. The pH levels of intestinal chyme, fluid and mucosa of the fish were measured at different time points after food ingestion. The results indicated food digestion resulted in significant decreases in pH of the intestinal tract. The pH levels of the intestinal chyme and fluid ranged from 6.86±0.24 to 8.43±0.10 and from 7.14±0.22 to 8.63±0.02, respectively. Within each intestinal segment, there was no significant difference in pH between the intestinal chyme and fluid at each time point. By contrast, the pH levels of intestinal mucosa were between 6.23±0.04 and 6.7±0.13, significantly lower than measurements made in the intestinal chyme and fluid (P<0.05), with the exception of the 12h post-ingestion. Further analyses found that the pH level of the fish diet was significantly different with the pH levels of intestinal chyme, fluid and mucosa (P<0.05). The present study advances the understanding of the digestive physiology in grass carp.
Grass carp; Intestinal chyme; Intestinal fluid; Intestinal mucosa; pH
Q174
A
1000-3207(2017)03-0530-08
10.7541/2017.68
2016-05-25;
2016-08-24
国家自然科学基金(31372571和31272706); 现在农业产业技术体系建设专项资金(CARS-46-08)资助 [Supported by the National Natural Science Foundation of China (31372571, 31272706); the Earmarked Fund for China Agriculture Research System (CARS-46-08)]
班赛男(1990—), 女, 河南商丘人; 硕士研究生; 主要从事鱼类消化生理及消化道微生物研究。E-mail: bansainan@163.com
王桂堂, 研究员; E-mail: gtwang@ihb.ac.cn
