饲料脂肪水平对大菱鲆幼鱼TOR 信号通路的影响
2017-05-16唐卓懿麦康森艾庆辉
唐卓懿 崔 坤 陈 强 谭 朋 廖 凯 麦康森 艾庆辉
(中国海洋大学教育部海水养殖重点实验室, 青岛 266003)
饲料脂肪水平对大菱鲆幼鱼TOR 信号通路的影响
唐卓懿 崔 坤 陈 强 谭 朋 廖 凯 麦康森 艾庆辉
(中国海洋大学教育部海水养殖重点实验室, 青岛 266003)
研究旨在探究饲料脂肪水平对大菱鲆(Scophthalmus maximus)幼鱼雷帕霉素受体(TOR)信号通路的影响。以大菱鲆幼鱼[初始体重(8.6±0.01) g]为实验对象, 配制脂肪水平分别为11.69% (适宜脂肪组)和16.58% (高脂组)的2种等氮饲料在室内循环水系统中进行投喂实验, 养殖周期为97d。结果显示: (1)饲料脂肪水平升高对大菱鲆幼鱼存活和特定生长率(SGR)无显著影响(P>0.05)。(2)与适宜脂肪组相比, 肝脏中TOR和4EBP1 mRNA水平在高脂组上调(P<0.05)而4EBP2 mRNA水平在高脂组下调(P<0.05)。此外, 与适宜脂肪组相比, 肌肉中TOR和4EBP1 mRNA水平在高脂组下调(P<0.05)而4EBP2 mRNA水平在高脂组无显著变化。(3)饲料脂肪水平显著影响AKT、TOR和4EBPs磷酸化水平。肝脏中p-AKT (T308和S473)/AKT、p-mTOR(S2448)/ mTOR和p-4EBP1 (T37/46)/4EBP1在高脂组显著高于适宜脂肪组,而p-p70S6K (T389)/p70S6K在高脂组显著低于适宜脂肪组。肌肉中p-AKT (S473)/AKT、p-mTOR (S2448)/mTOR和p-4EBP1 (T37/46)/4EBP1在高脂组显著低于适宜脂肪组,而p-p70S6K (T389)/p70S6K在高脂组显著高于适宜脂肪组。结果表明: 大菱鲆幼鱼肝脏和肌肉TOR、4EBP1和4EBP2的mRNA表达量与AKT、TOR、4EBP1和p70 S6K磷酸化受到饲料脂肪水平调控, 饲料脂肪水平升高, 激活了肝脏TOR信号通路, 同时肌肉TOR信号通路受到部分抑制。
大菱鲆; 脂肪水平; 基因表达; 磷酸化; TOR信号通路
雷帕霉素受体(TOR)信号通路是细胞感知营养物质并调控生长的主要通路, 在进化上极其保守。TOR是一种丝氨酸/苏氨酸激酶, 它包含了两个结构功能不同的复合物——mTORC1和mTORC2。在mTORC1激活后, 其下游主要作用因子4EBPs和S6K发生磷酸化。S6K的磷酸化促进了多种蛋白的转录激活和翻译起始延伸。磷酸化的4EBPs与真核生物翻译起始因子eIF-4E脱离, 激活后者, 使40S核糖体亚基与mRNA的5′端结合[1—3], 启动蛋白质的翻译。
在哺乳动物中, TOR信号通路的研究已经非常广泛和深入[4]。在鱼类上, 以斑马鱼(Danio rerio)为模式生物, 研究发现TOR信号通路调控肠道上皮细胞形成、细胞自噬[5,6]、心肌炎发生[7,8]和非酒精脂肪肝的发生[9]等。此外, 在大菱鲆(Scophthalmus maximus)[10]、建鲤(Cyprinus carpio var. Jian)[11—13]、军曹鱼(Rachycentron canadum)[14]、虹鳟(Oncorhynchus mykiss)[15—19]和草鱼(Ctenopharyngodon idella)[20,21]中分别进行了饲料中精氨酸、色氨酸、蛋氨酸、亮氨酸、油酸、胆碱水平以及豆粕替代鱼粉和不同蛋能比对TOR信号通路的调控作用的研究。
然而, 目前关于饲料中脂肪水平对养殖鱼类TOR信号通路的相关研究较少。大菱鲆肉质鲜美, 营养价值高, 经济价值高, 是我国重要养殖品种。在大菱鲆中, TOR信号通路受到饲料脂肪水平调控的研究目前尚未见报道。通过研究饲料脂肪水平对大菱鲆幼鱼TOR信号通路的影响, 有助于深入了解饲料脂肪对大菱鲆蛋白质合成调控的机理。
1 材料与方法
1.1 实验过程与样品采集
配制粗蛋白含量为50%, 粗脂肪含量分别为11.69%和16.58%的两种饲料(表 1)。大菱鲆幼鱼购自山东青岛七好生物科技有限公司, 在青岛鳌山卫国家海洋科研中心实验基地暂养15d后, 饥饿24h。然后随机选取体质健壮、规格整齐、平均体重为(8.75±0.01) g的大菱鲆幼鱼随机分为2组, 每组6个重复, 每个重复30尾。将2组饲料分别与6个养殖桶随机匹配, 每日8:00和18:00各饱食投喂一次, 光照时间为12L:12D (7:30至19:30), 养殖周期97d。在实验结束后, 将实验鱼禁食24h, 每桶随机选6尾鱼, 取肝脏、肌肉保存于–80℃, 用作分析实验。
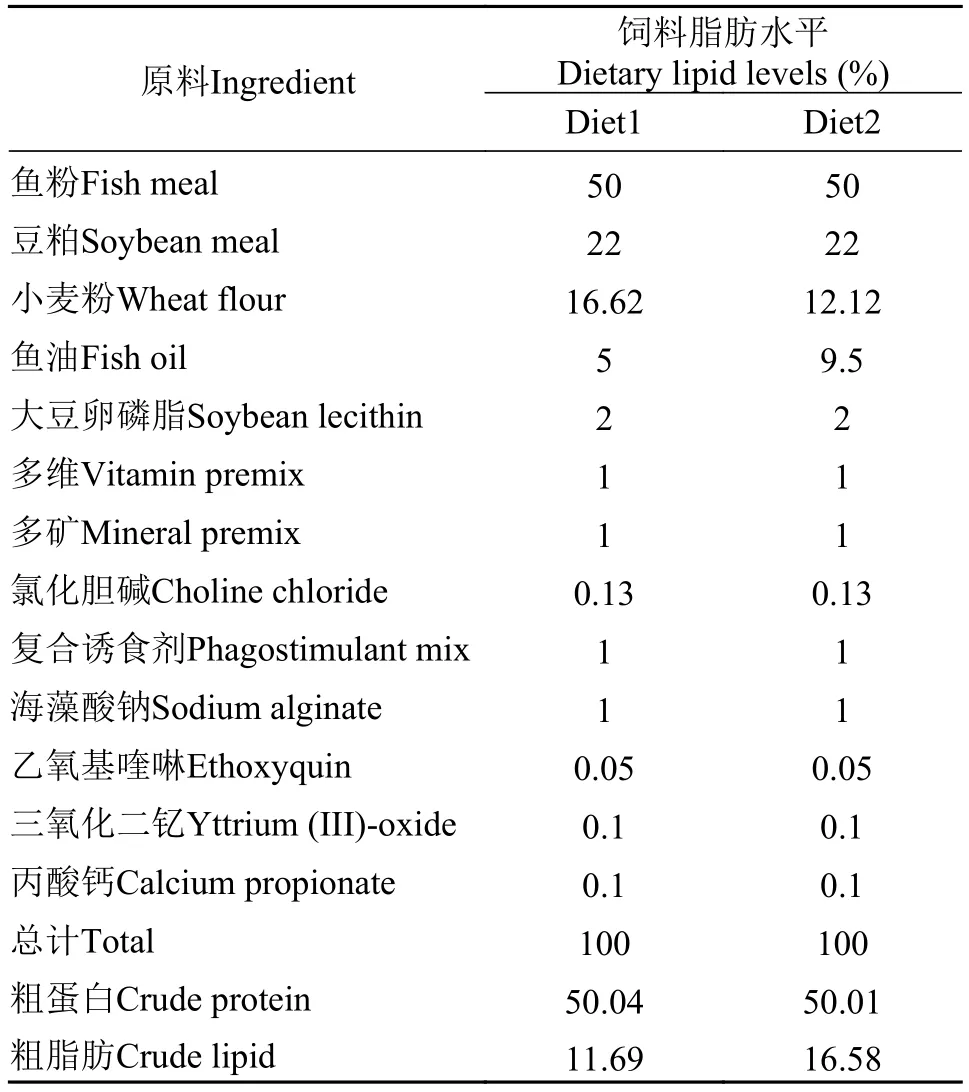
表 1 实验饲料的配方以及常规营养成分(%饲料干重)Tab. 1 Formulation and proximate composition of the experimental diet (% dry matter)
1.2 计算及统计方法
存活率(Survival rate, SR, %)=(初始实验鱼数量–死亡实验鱼数量)/初始实验鱼数量×100
特定生长率(Specific growth rate, SGR, %)=[Ln (实验鱼终末体重)–Ln (实验鱼初始体重)]/实验天数×100
1.3 总RNA提取及反转录
在液氮中研磨组织样本, 使用TaKaRa RNAiso Reagent提取组织样本总RNA, 用异丙醇法沉淀RNA, 凝胶电泳检测RNA质量。使用PrimeScript®RT reagent Kit With gDNA Eraser (Perfect Real Time)(TaKaRa, Japan)进行反转录, 反转录结束后检测cDNA浓度, 并稀释到300 ng/μL, 置于–80℃冰箱中保存。
1.4 验证引物扩增效率
荧光定量PCR引物参考张凯凯[22](表 2)。通过验证, 选用RPSD (DQ848899.1)为内参基因。通过制作浓度标准曲线验证目标序列与内参序列的扩增效率一致性[23]。
1.5 实时定量PCR
使用TransStart Top Green qPCR SuperMix (TRANSGEN, China)试剂盒进行荧光定量反应。定量程序设定为: 94摄氏度预热30s; 设置循环为: 94摄氏度5s, 引物Tm值15s, 72摄氏度10s, 共45个循环。相对表达量采用2–ΔΔCt的方法计算。
1.6 Western Blot
称取适量肝脏和肌肉样品, 冰上匀浆。使用试剂盒(Beyotime Institute of Biotechnology, Jiangsu, China)测定蛋白浓度。使用裂解液稀释所得蛋白,加入5×蛋白上样缓冲液, 煮沸, 离心。配置聚丙烯酰胺凝胶(TOR使用6%, 其余蛋白使用12%), 150 V室温电泳70min。室温下100 V转膜60min, 于5%脱脂奶粉TBST溶液中封闭, 洗膜。一抗4℃孵育过夜,洗膜。二抗37℃孵育60min, 洗膜。使用碧云天化学发光试剂(BeyoECL Plus kit)处理PVDF膜后于暗盒中压片, 在暗室用X光片自动洗片机(SGSB GROUP CO. LTD, Shanghai, China)中显影, 得到相应条带。使用image J软件进行灰度分析。
2 结果
2.1 存活、生长
大菱鲆幼鱼存活率(均为100%)和特定生长率(分别为2.34%/d和2.28%/d)在处理组间无显著差异(P>0.05, 表 3)。
2.2 肝脏和肌肉TOR信号通路相关基因mRNA表达量
在肝脏中, 高脂组TOR和4EBP1的mRNA水平显著高于适宜脂肪组(P<0.05), 而4EBP2表达量低于适宜脂肪组(P<0.05); 在肌肉中, TOR和4EBP1表达量在高脂组显著低于适宜脂肪组(P<0.05), 而4EBP2表达量在两组间无显著差异(P>0.05, 图 1)。
2.3 肝脏和肌肉TOR信号通路相关蛋白磷酸化水平变化
在肝脏中, 与适宜脂肪组相比, p-AKT (Thr308)/ AKT、p-AKT (Ser473)/AKT、p-TOR (Ser2448)/TOR和p-4EBP1 (Thr37/46)/4EBP1蛋白水平在高脂组显著上调(P<0.05), 而p-p70 S6K (Thr389)/p70 S6K蛋白水平在高脂组显著下调(P<0.05)。在肌肉中, 与适宜脂肪组相比, p-AKT (Thr308)/AKT和p-p70 S6K (Thr389)/p70 S6K蛋白水平在高脂组显著上调,而p-AKT (Ser473)/AKT、p-TOR (Ser2448)/TOR和p-4EBP1 (Thr37/46)/4EBP1蛋白水平在高脂组显著下调(P<0.05)(图 2)。

表 3 饲料脂肪水平对大菱鲆成活率(%)和特定生长率(%/d)的影响(平均值±标准误, n=6)Tab. 3 Effects of dietary lipid levels on the survival rate (%) and specific growth rate (SGR) (%/d) of juvenile Turbot(Scophthalmus maximus L.) (means±SEM, n=6)
3 讨论
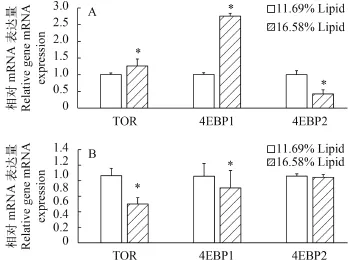
图 1 大菱鲆幼鱼不同组织TOR和4EBP1/2的mRNA表达量Fig. 1 Relative mRNA level of TOR and 4EBP1/2 in different tissuesA. 肝脏中相关基因表达; B. 肌肉中相关基因表达; 柱状图上标星号表示有显著差异(P<0.05; 独立样本t检验)(n=3); TOR. 雷帕霉素受体; 4EBP1. 4E结合蛋白1; 4EBP2. 4E结合蛋白2A. Related genes expression in liver. B. Related genes expression in muscle. Asterisk indicates significant differences (P<0.05; independent-samples t test) among treatments (n=3). TOR. Target of Rapamycin; 4EBP1. 4E binding protein 1; 4EBP2. 4E binding protein 2
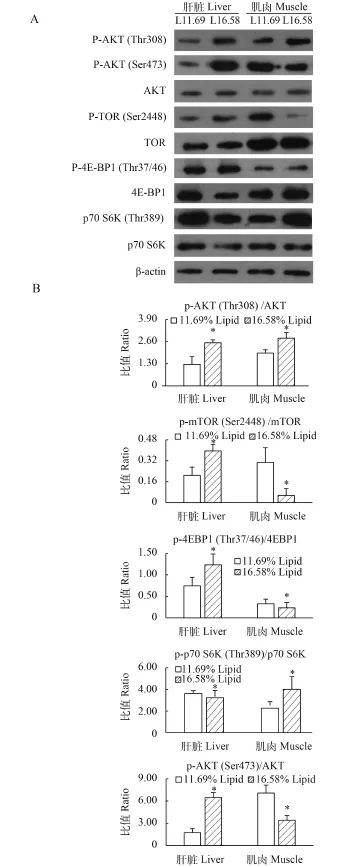
图 2 大菱鲆TOR信号通路相关蛋白的蛋白印迹Fig. 2 Western Blotting from tissues of turbotA. 肝脏和肌肉中相关蛋白的蛋白印迹的代表图; B. 图A数据的定量分析; 柱状图上标星号表示有显著差异(P<0.05), 独立样本t检验)A. Representative images of western blot from liver, muscle; B. Quantitive analysis of data from A. Asterisk indicates significant differences (P<0.05; independent-samples t test) among treatments (n=3)
目前, 鱼类TOR和4EBPs的mRNA表达量受饲料脂肪水平调控的研究目前尚未见报道。本研究发现大菱鲆幼鱼肝脏和肌肉TOR、4EBP1和4EBP2的mRNA表达量受到饲料脂肪水平调控。研究结果显示: 在肝脏中, 高脂组TOR和4EBP1的mRNA水平显著高于适宜脂肪组, 而4EBP2表达量低于适宜脂肪组; 在肌肉中, TOR和4EBP1的mRNA水平在高脂组低于适宜脂肪水平组, 4EBP2 mRNA水平在高脂组无显著变化。与本研究类似, 在建鲤中的研究发现, 饲料胆碱水平调控肝脏、肌肉、脾脏和头肾的TOR和4EBP2 mRNA表达量[11,13], 许丹丹[24]的研究发现豆粕替代鱼粉影响大菱鲆幼鱼肠道4EBP1的mRNA表达而且4EBP1 mRNA表达量受摄食后取样时间点的影响。以上研究表明建鲤和大菱鲆幼鱼TOR和4EBPs的mRNA表达受到饲料营养素的调控。而在张凯凯[22]的研究中, 支链氨基酸水平并未影响大菱鲆幼鱼肌肉TOR、4EBP1和4EBP2的mRNA表达; 与张凯凯的研究类似, Luo等[14]的研究表明军曹鱼幼鱼TOR mRNA表达量不受饲料玉米蛋白粉水平调控, 这可能是由于饲料营养素对TOR和4EBPs的调控存在种间差异。另外, 不同饲料营养素对相同种类的鱼体中TOR和4EBPs的作用机制可能也存在差异。饲料营养素对鱼类TOR和4EBPs的mRNA表达的作用机制还有待于进一步研究。在人类的研究[25]表明, 4EBP1和4EBP2具有非常相似的基因序列和晶体结构, 4EBP2的氨基酸序列仅仅在60至63号位与4EBP1存在差异。4EBP1和4EBP2生理作用相同, 二者均能够与真核翻译启动子——eIFs结合并抑制后者活性。在鱼类中, 有关4EBP1和4EBP2的比较研究相对较少, 二者受饲料营养素调控的差异还有待于进一步研究。
TOR是进化上非常保守的丝氨酸/苏氨酸激酶, TOR信号通路是细胞感知营养素水平并调控生长的重要通路。mTORC1是TOR信号通路中整合营养素信息并调控下游作用因子——S6K和4EBPs的关键蛋白。胰岛素和生长因子通过PI3K-AKT和mTORC2-AKT途径使AKT激活并且在Thr308和Ser473位点磷酸化, AKT激活mTORC1使后者在Ser2448位点磷酸化, mTORC1激活使TOR信号通路下游两个重要作用因子——S6K和4EBPs磷酸化并启动蛋白质的翻译。在鱼类中, AKT、TOR、4EBP1和p70 S6K磷酸化受到饲料脂肪水平调控的研究相对较少。本研究发现大菱鲆幼鱼肝脏和肌肉中AKT、TOR、4EBP1和p70 S6K磷酸化受到饲料脂肪水平调控。研究结果显示: 在肝脏中, 与适宜脂肪组相比, AKT (Thr308)、AKT (Ser473)、TOR (Ser2448)和p-4EBP1 (Thr37/46)磷酸化水平在高脂组显著上调; 而p70 S6K (Thr389)磷酸化水平在高脂组显著下调。在肌肉中, 与适宜脂肪组相比, AKT (Thr308)和p70 S6K (Thr389)磷酸化水平在高脂组显著上调; 而AKT (Ser473)、TOR (Ser2448)和4EBP1 (Thr37/46)磷酸化水平在高脂组显著下调。在塞内加尔鳎(Solea senegalensis)的研究中[26], 肌肉AKT磷酸化在高脂组受到抑制, 此结果与本研究类似, 但肌肉S6K磷酸化水平在高脂组降低, 此结果与本研究结果相反。在人类的研究中, 2型糖尿病人肌肉普遍存在胰岛素抵抗现象。Treins等[27]研究表明S6K敲除小鼠不会发生胰岛素抵抗, 并且S6K的激活对PI3K-AKT通路存在抑制, 加剧胰岛素抵抗。在本研究中, 肌肉AKT (Ser473)在高脂组降低, S6K磷酸化在高脂组升高, 与在哺乳动物中对胰岛素抵抗的研究结果一致。此外, 有研究表明4EBPs和S6K存在类似互补的作用, 当4EBPs被敲除后, S6K磷酸化水平上升, 同时发生胰岛素抵抗且p-AKT (Ser473)/ AKT下调[28], 在本研究中也发现了类似结果。
总之, 饲料脂肪水平升高, 肝脏TOR信号通路被激活, 肌肉TOR信号通路受到部分抑制。肝脏和肌肉TOR信号通路的变化规律不同, 可能与肌肉对胰岛素的敏感性发生变化有关。
[1]Gingras A C, Gygi S P, Raught B, et al. Regulation of 4E-BP1 phosphorylation: a novel two-step mechanism [J]. Genes & Development, 1999, 13(11): 1422—1437
[2]Banko J L, Francis P, Lingfei H, et al. The translation repressor 4E-BP2 is critical for eIF4F complex formation, synaptic plasticity, and memory in the hippocampus [J]. Journal of Neuroscience the Official Journal of the Society for Neuroscience, 2005, 25(42): 9581—9590
[3]Zid B, Rogers A, Katewa S, et al. 4E-BP extends lifespan upon dietary restriction by enhancing mitochondrial activity in Drosophila [J]. Cell, 2009, 139(1): 149—160
[4]Wullschleger S, Loewith R, Hall M N. TOR signaling in growth and metabolism [J]. Cell, 2006, 124(3): 471—484
[5]Makky K, Tekiela J, Mayer A N. Target of rapamycin (TOR) signaling controls epithelial morphogenesis in the vertebrate intestine [J]. Developmental Biology, 2007, 303(2): 501—513
[6]Ding Y H, Sun X J, Xu X L. TOR-autophagy signaling in adult zebrafish models of cardiomyopathy [J]. Autophagy, 2012, 8(1): 142—143
[7]Sudhir K, Xu X L. Target of rapamycin (TOR)-based therapy for cardiomyopathy: evidence from zebrafish and human studies [J]. Trends in Cardiovascular Medicine, 2012, 22(2): 39—43
[8]Ding Y, Sun X, Redfield M, et al. Target of rapamcyin (TOR)-based therapeutics for cardiomyopathy [J]. Cell Cycle, 2012, 11(3): 428—429
[9]Sapp V, Matthews R P, Gaffney L, et al. Fructose leads to hepatic steatosis in zebrafish that is reversed by mTOR inhibition [J]. Hepatology, 2014, 60(5): 1581—1592
[10]Xu D D, He G, Mai K S, et al. Postprandial nutrient-sensing and metabolic responses after partial dietary fishmeal replacement by soyabean meal in turbot (Scophthalmus maximus L.) [J]. British Journal of Nutrition, 2015, 115(3): 1—10
[11]Wu P, Feng L, Kuang S Y, et al. Effect of dietary choline on growth, intestinal enzyme activities and relative expressions of target of rapamycin and eIF4E-binding protein2 gene in muscle, hepatopancreas and intestine of juvenile Jian carp (Cyprinus carpio var. Jian) [J]. Aquaculture, 2011, 317(1-4): 107—116
[12]Chen G F, Feng L, Kuang S Y, et al. Effect of dietary arginine on growth, intestinal enzyme activities and gene expression in muscle, hepatopancreas and intestine of juvenile Jian carp (Cyprinus carpio var. Jian) [J]. British Journal of Nutrition, 2012, 108(2): 195—207
[13]Wu P, Jiang J, Liu Y, et al. Dietary choline modulates immune responses, and gene expressions of TOR and eIF4E-binding protein2 in immune organs of juvenile Jian carp (Cyprinus carpio var. Jian) [J]. Fish & Shellfish Immunology, 2013, 35(3): 697—706
[14]Luo Y W, Ai Q H, Mai K S, et al. Effects of Dietary Corn Gluten Meal on Growth Performance and Protein Metabolism in Relation to IGF-I and TOR Gene Expression of Juvenile Cobia (Rachycentron canadum) [J]. Journal of Ocean University of China, 2012, 12(3): 418—426
[15]Dai W W, Stéphane P, Mennigen J A, et al. Post-prandial regulation of hepatic glucokinase and lipogenesis requires the activation of TORC1 signaling in rainbow trout (Oncorhynchus mykiss) [J]. Journal of Experimental Biology, 2013, 216(Pt 23): 4483—4492
[16]Sánchezgurmaches J, Cruzgarcia L, Gutiérrez J, et al. Endocrine control of oleic acid and glucose metabolism in rainbow trout (Oncorhynchus mykiss) muscle cells in culture [J]. American Journal of Physiology Regulatory Integrative & Comparative Physiology, 2010, 299(2): R562-R572
[17]Marine L, Stéphane P, Elisabeth P J, et al. Integration of insulin and amino acid signals that regulate hepatic metabolism-related gene expression in rainbow trout: role of TOR [J]. Amino Acids, 2010, 39(3): 801—810
[18]Marine L, Stéphane P, Elisabeth P J, et al. L-leucine, L-methionine, and L-lysine are involved in the regulation of intermediary metabolism-related gene expression in rainbow trout hepatocytes [J]. Journal of Nutrition, 2011, 141(1): 75—80
[19]Seiliez I, Panserat S, Lansard M, et al. Dietary carbohydrate-to-protein ratio affects TOR signaling and metabolism-related gene expression in the liver and muscle of rainbow trout after a single meal [J]. American Journal of Physiology - Regulatory Integrative and Comparative Physiology, 2011, 300(3): R733-R743
[20]Jiang J, Wang B, Liu Y, et al. Effects of dietary arginine supplementation on growth performance, flesh quality, muscle antioxidant capacity and antioxidant-related signalling molecule expression in young grass carp (Ctenopharyngodon idella) [J]. Food Chemistry, 2015, 167C: 91—99
[21]Wen H L, Feng L, Jiang W D, et al. Dietary tryptophanmodulates intestinal immune response, barrier function, antioxidant status and gene expression of TOR and Nrf2 in young grass carp (Ctenopharyngodon idella) [J]. Fish & Shellfish Immunology, 2014, 40(1): 275—287
[22]Zhang K K. Studies on nutritional metabolism of several functional amino acids for juvenile turbot (Scophthalmus maximus L.) [D]. Thesis for Doctor of Science. Ocean University of China, Qingdao. 2014 [张凯凯. 大菱鲆幼鱼几种功能性氨基酸营养代谢的研究. 博士学位论文,中国海洋大学, 青岛. 2014]
[23]Livak J, Schmittgen D. Analysis of Relative Gene Expression Data Using Real Time Quantitative PCR and the 2-ΔΔCTmethod [J]. Methods, 2001, 25(4): 402—408
[24]Xu D D. Preliminary study on the mechanisms of nutrient sensing and responses of different protein sources in juvenile turbot (Scophthalmus maximus L.) [D]. Thesis for Doctor of Science. Ocean University of China, Qingdao. 2014 [许丹丹. 大菱鲆幼鱼对不同蛋白源营养感知与应答机制的初步研究. 博士学位论文, 中国海洋大学, 2014]
[25]Fukuyo A, Yasuko I, Ishida T, et al. Structural scaffold for eIF4E binding selectivity of 4E-BP isoforms: crystal structure of eIF4E binding region of 4E-BP2 and its comparison with that of 4E-BP1 [J]. Journal of Peptide Science, 2011, 17(9): 650—657
[26]Borges P, Valente L M, Véron V, et al. High dietary lipid level is associated with persistent hyperglycaemia and downregulation of muscle Akt-mTOR pathway in Senegalese sole (Solea senegalensis) [J]. PloS One, 2014, 9(7): e102196
[27]Treins C, Alliouachene S, Hassouna R, et al. The combined deletion of S6K1 and Akt2 deteriorates glycemic control in a high-fat diet. [J]. Molecular & Cellular Biology, 2012, 32(19): 4001—4011
[28]Le B O, Petroulakis E, Paglialunga S, et al. Elevated sensitivity to diet-induced obesity and insulin resistance in mice lacking 4E-BP1 and 4E-BP2 [J]. Journal of Clinical Investigation, 2007, 117(2): 387—396
EFFECTS OF DIETARY LIPID LEVELS ON TOR PATHWAY IN JUVENILE TURBOT (SCOPHTHALMUS MAXIMUS L.)
TANG Zhuo-Yi, CUI Kun, CHEN Qiang, TAN Peng, LIAO Kai, MAI Kang-Sen and AI Qing-Hui
(The Key Laboratory of Mariculture (Ministry Education of China), Ocean University of China, Qingdao 266003, China)
This study investigated the effects of dietary lipid levels on the TOR pathway in juvenile turbot using diets containing graded levels of lipid 11.69% (L11.69) and 16.58% (L16.58) (dry weight) to feed triple groups of juvenile turbot (8.6±0.01 g) for a 97d trial. The lipids level in diet did not impact survival rate and SGR. Compared those in L11.69 group, L16.58 group increased the gene expression of TOR, 4EBP1 but decreased 4EBP2 in liver, and it increased the phosphorylation of pAKT-S473, pAKT-T308, pmTOR-S2448, and p4EBP1-T37/46. In the muscle, L16.58 group had decreased TOR and 4EBP1 associated with pAKT-S473, pmTOR-S2448 and p4EBP1-T37/46 compared with those in L11.69 group. In conclusion, L16.58 diet can activate TOR pathway in liver while partially suppress TOR pathway in muscle of junvenile turbot compare with L11.69 diet.
Turbot; Dietary lipid level; Gene expression; Phosphorylation; TOR pathway
S963.1
A
1000-3207(2017)03-0491-06
10.7541/2017.63
2016-05-16;
2016-11-04
国家重点基础研究发展计划(973计划)养殖鱼类蛋白质高效利用的调节机制(2014CB138600)资助 [Supported by Mechanisms of Protein Efficient Utilization in Farmed Fish, National Program on Key Basic Research Projects (973 Program) (2014CB138602)]
唐卓懿(1990—), 男, 广东韶关人; 硕士研究生; 研究方向为水产动物营养与饲料。E-mail: tzypublic@163.com
艾庆辉, 教授; 研究方向为水产动物营养与饲料。E-mail: qhai@ouc.edu.cn
