肌小节组装研究进展
2017-05-10侯彩平韩利文侯海荣王希敏张姗姗张轩铭王雪李晓彬田青平何秋霞刘可春
侯彩平 ,韩利文 ,侯海荣 ,王希敏 ,张姗姗 ,张轩铭 ,王雪 ,李晓彬,田青平 ,何秋霞* ,刘可春*
(1.山东省科学院生物研究所,山东省生物检测技术工程实验室,山东省生物传感器重点实验室,山东 济南250014;2.山西医科大学药学院,山西 太原 030001)
【药理与毒理】
肌小节组装研究进展
侯彩平1,2,韩利文1,侯海荣1,王希敏1,张姗姗1,张轩铭1,王雪1,李晓彬1,田青平2,何秋霞1*,刘可春1*
(1.山东省科学院生物研究所,山东省生物检测技术工程实验室,山东省生物传感器重点实验室,山东 济南250014;2.山西医科大学药学院,山西 太原 030001)
肌小节是横纹肌的基本功能单位,是由肌动蛋白、肌球蛋白和各种相关蛋白质组装而成的高度有序的结构。在肌小节组装过程中,Z带、M带以及一系列相关蛋白的正确组装是维持肌肉运动的关键,研究肌小节组成蛋白的折叠和组装机制对于了解肌肉疾病的病因和进行有针对性地治疗非常重要。本文综述了肌小节中的主要组分以及组装过程的研究进展,认为目前仍对肌小节骨架的装配、收缩复合体的功能及肌小节组装相关分子伴侣与疾病的关系等的相关研究不够深入。因此,未来还需从肌球蛋白结合蛋白、肌联蛋白、分子伴侣等与疾病的关系方面开展进一步的研究,为肌肉相关疾病的治疗寻找新的思路和解决办法。
肌小节;组装;肌肉蛋白;分子伴侣
身体肌肉组织和皮下脂肪组织的总称是肌肉,肌肉在机体运动过程中扮演着不可或缺的角色,各种形式的运动离不开肌细胞的参与。躯体的运动和呼吸需要骨骼肌的收缩,心脏的射血活动需要心肌的收缩,胃肠、子宫、血管等器官的运动,则离不开平滑肌的收缩。肌肉组织由肌细胞(肌纤维)和结缔组织组成[1],肌肉细胞的两个本质特征是细胞核精确定位以及肌小节线性排列。肌纤维由肌球蛋白和肌动蛋白组成,肌球蛋白和肌动蛋白有序地排列起来,组成了高度重复的肌小节结构。Auld等[2]发现细胞核定位先于肌小节形成,细胞核通过核骨架-细胞骨架的连接复合体对肌小节的组装和稳定起关键作用。肌小节装配是一个复杂而又高度有序的过程,其各组分的正确折叠和组装对肌肉发育和收缩非常重要。目前,已知有20多种肌肉疾病因肌小节组成蛋白突变或组装异常引起[3]。因此,研究肌小节组成蛋白的折叠和组装机制对于了解肌肉疾病的病因和进行有针对性地治疗非常重要。肌小节各组分蛋白的正确折叠和组装以及维持肌小节的稳定,都离不开分子伴侣的帮助[4],研究分子伴侣在肌小节组装中的作用机理具有重要的理论和实践意义。本文对肌小节各个重要组成部分的相关蛋白质及其组装进行综述,以期对肌肉相关疾病的治疗寻找新的思路和解决办法。
1 肌小节的组成
肌小节是肌纤维最基本的结构和功能单位,是肌肉收缩舒张的基本单位,其简化模型见图1[5],主要是由细丝、粗丝、Z线和肌连蛋白(Titin)组成的。肌动蛋白和伴肌动蛋白连接则形成细丝,上面附着肌钙蛋白和原肌球蛋白。细丝具有极性,正极与Z盘相连,负极指向肌小节中心。粗丝由肌球蛋白分子聚合而成,目前发现肌球蛋白分子有35种,组成骨骼肌的肌球蛋白是肌球蛋白-Ⅱ(以下简称为肌球蛋白)[6]。
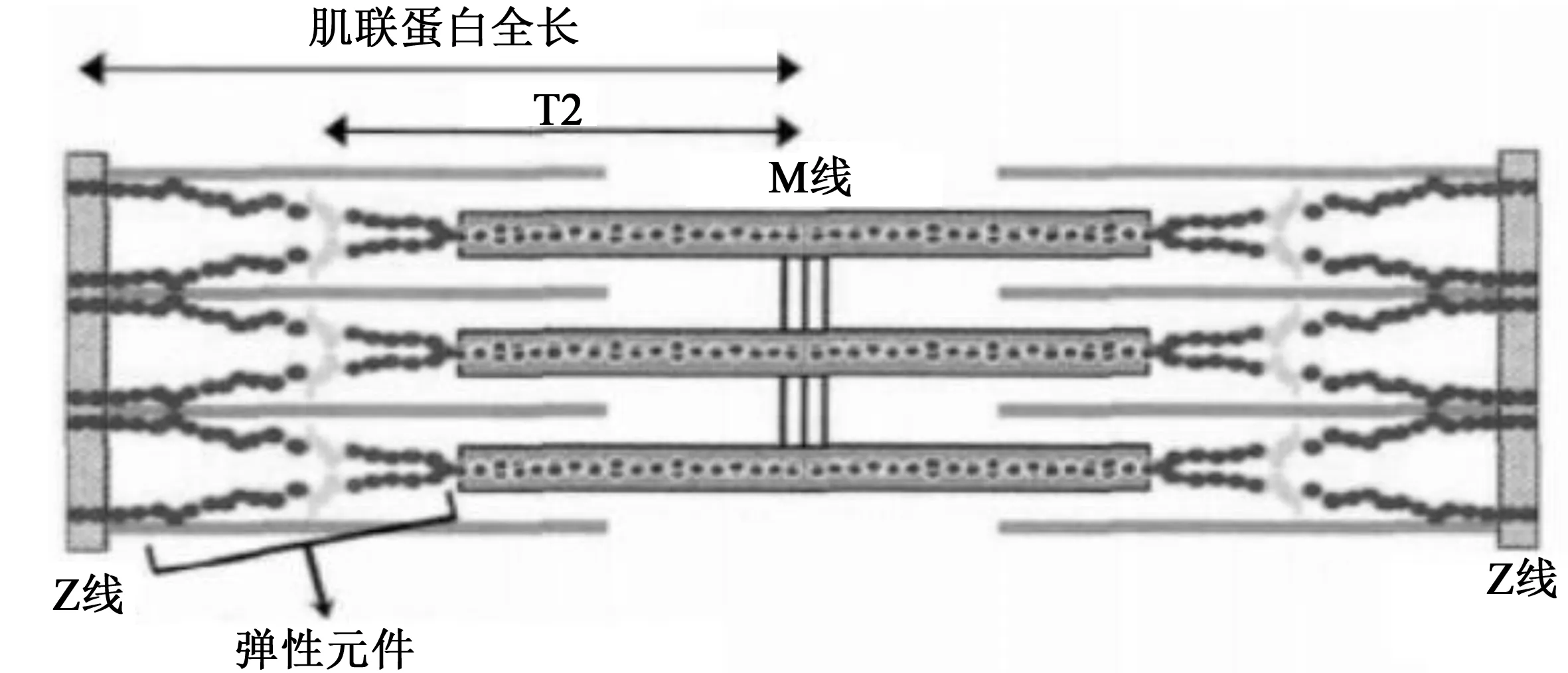
图1 肌小节组成简化模型图[5]Fig.1 Simplified model of sarcomere composition
许多人类遗传性疾病是由肌小节组成蛋白编码基因突变引起的,比如肥厚性心肌病。最近,生物化学和基因组的研究已经证实许多新的基因在肌小节表达,但是其在肌小节组装以及肌原性疾病中的作用还不清楚。
1.1 粗肌丝
肌小节是位于两条Z线之间的一个区域,Z线是每段肌小节的边界线。通过X-线衍射发现,肌小节的明暗带还存在更加微小且平行排列的丝状结构肌丝。粗肌丝是暗带中含有的较粗的肌丝,即暗带[7],成束的粗肌丝能被M线固定在一定位置,其主要成分是肌球蛋白。
1.2 细肌丝
与粗肌丝呈梳齿状排列的是细肌丝,细肌丝是明带中较细的肌丝。与粗丝相比,细丝的蛋白成分更为复杂[8],肌动蛋白丝通过倒钩状的尾部固定在Z线,并向肌小节中央延伸,而且与调节蛋白肌钙蛋白复合体(Troponin complex)和原肌球蛋白(Tropomyosin)共同组成细肌丝。细肌丝由Z线结构向两侧明带伸出,游离端必然有一段要伸入暗带,所以肌小节中会有一段细肌丝和粗肌丝处于交叉状态。
1.3 Z线
Z线是细肌丝的锚定结构。Yamaguchi等[9]利用电子显微镜技术确定了脊椎动物肌小节的Z线结构,发现老鼠、比目鱼、猫和犬心肌的Z线较宽,古比鱼、蝾螈和青蛙的骨骼肌Z线较窄,还在纤维性肌病和年老狗的心肌中发现了杆状Z带。Z线结构模型由两条Z线组成,两条Z线中心处呈90度相互连接,并连接着相邻的两个细肌丝(肌动蛋白丝),如图2[9]所示。Ca2+激活的两性蛋白酶证实与相邻肌小节重叠的细肌丝数量(α-辅肌动蛋白层)决定了Z线结构的宽度,数量越多,Z线越宽[9-11]。Z线结构模型显示并描述了Z线宽窄类型的关系,为检测这一模型,Yamaguchi等还用电脑模拟了Z线结构动力学。

图2 Z线结构合适的几何模型[9]Fig.2 A proposed model of Z-filament geometry
1.4 肌小节主要组成蛋白
1.4.1 肌球蛋白(Myosin)
粗肌丝的主要成分是肌球蛋白,是分子量为480 kDa的高度不对称性分子[12],约占总肌肉蛋白的1/3,具有ATP驱动的机械酶活性,能够沿着肌动蛋白滑动。目前发现肌球蛋白家族有35个成员,具有两个结构域,分别是高度保守的马达结构域和可变的结合结构域。马达结构域对于肌肉收缩非常重要,平滑肌收缩是由肌球蛋白重链ATP酶(Myh11)活性控制的,Myh11突变会对人类或动物的心血管、消化道、生殖泌尿系统产生各种影响。斑马鱼Myh11催化ATP水解结构域隐性突变体(mlt),即高度保守的色氨酸突变为精氨酸(W512R),Mlt突变体使肌球蛋白功能紊乱并且引起肠道上皮细胞侵略性扩增。Mlt突变体引起的细胞扩增表型与肌球蛋白紊乱的程度正相关,这说明脊椎动物的周围基质能使肠道上皮调整到正常生理状态,反过来肠道上皮细胞会调节周围基质对生理和病理刺激产生应答。基因突变改变了平滑肌肌球蛋白的调节规则,这一现象可能成为疾病影响肠道、脉管系统以及其他含有平滑肌的组织或表达平滑肌蛋白的收缩性细胞的风险因素[13]。此外,肌球蛋白调节蛋白对肌小节的结构与功能也非常重要。Prill等[14]发现斑马鱼smy1b纯合突变体的快肌纤维中不能形成成熟的肌小节,原因是当斑马鱼发育至19 h,即肌小节开始组装的时候,肌球蛋白不能整合到肌小节上,说明smyd1b对肌球蛋白和肌小节正确组装是必需的。
肌纤维含有不同亚型的肌球蛋白II二聚体,都能进行收缩与舒张。大多数哺乳动物能表达12种亚型肌球蛋白II,每个亚型都来源于不同的基因[15]。肌小节中的肌球蛋白结合蛋白C(MYBPC)能与几种收缩蛋白和结构蛋白相互作用[16]。人体有11种肌球蛋白亚型,心肌肌球蛋白II(MYBPC-3)发生突变或敲除会导致心肌病的发生。目前对快肌同源基因(mybpc-2) 在体内的功能还不了解,为解决这一问题,Li等[17]利用斑马鱼模型对肌小节的肌丝结构进行了收缩功能分析以及X-射线衍射测量。利用吗啉代反义核苷酸技术敲除快肌的肌球蛋白II编码基因mybpc-2B(含量大于50%),斑马鱼出现骨骼肌疾病,肌肉细胞凋亡增加且与肌肉蛋白降解相关的因子上调。突变体表型也产生变化,比如肌小节缩短但分布范围变宽、肌动蛋白丝缩短、肌丝间间隔变宽等,表明快肌的mybpc与肌小节组装有关。总之,缺乏Mybpc-2会导致严重的肌小节结构改变甚至引起肌无力等疾病[17],所以肌球蛋白在肌小节组装中具有重要的作用。
肌球蛋白结构中,值得关注的是不同的肌球蛋白亚型在不同的肌纤维类型中是如何适应不同的机械力学强度的。成人骨骼肌和心肌中肌球蛋白亚型已经研究的比较完善,不同亚型间机械运动收缩参数相差多达十倍。胚胎期和围产期的眼外肌纤维中肌球蛋白亚型的研究较少,因为这些时期仅表达一种肌球蛋白亚型的肌纤维[18]。不同的人类肌肉肌球蛋白亚型的研究受到肌球蛋白纯化技术的限制,大多数肌肉中含有多种亚型但不易分离。肌小节肌球蛋白表达量很难统计,是因为目前仍不明确肌球蛋白折叠需要的分子伴侣或者分子伴侣组合。Deacon等[19]已经成功表达出8种人类肌小节肌球蛋白马达结构域亚型,表达出的质量仅1~2 mg,但非常有用。
目前,人为设计肌小节肌球蛋白定点突变体已成为可能,但非常昂贵且耗时。在科罗拉多大学和斯坦福大学两实验室的合作下,Bloemink[20]和Sommese[21]已经设计出人β-心肌肌球蛋白突变体,例如R453C肥厚型心肌病模型,这为今后该疾病的发病机理研究和防治提供了至关重要的模型。
1.4.2 肌动蛋白(Actin)
肌动蛋白是真核生物细胞中最丰富并且高度保守的一种蛋白,大概占总肌肉蛋白的15%。肌动蛋白丝参与许多关键的细胞进程,包括细胞分布、运动、胞内运输以及细胞黏附[22]。肌动蛋白丝这些多种多样的功能由超过150种肌动蛋白结合蛋白调控,肌动蛋白相关蛋白 2/3 (Arp2/3)复合体调节肌动蛋白丝分枝的形成,Arp2/3复合体结构透明可见,但其交叉连接架构的基础还不清楚。Rouiller等[23]重建了分枝结点以揭示Arp2/3复合体与母肌丝的相互作用,该研究还说明了母肌丝和分枝肌丝上形成的Arp2/3复合体的结构变化。Arp2和Arp3亚基重新组装成一个二聚体,形成一个短距离的子肌丝模板,母肌丝的两个亚基构象改变后分枝肌丝的稳定性增加。这些数据解释了为什么分枝肌丝的形成需要Arp2/3复合体、成核促进因子、肌动蛋白单体以及母肌丝的相互作用[23]。
1.4.3 原肌球蛋白(Tropomyosin,Tpm)
原肌球蛋白是一个α双螺旋卷曲二聚体,沿着肌动蛋白丝形成一个连续的首尾共聚体。原肌球蛋白最初是1946年由Bailey[24]首次在肌肉中发现的,其参与调节肌动蛋白与其结合蛋白的相互作用并且能稳定肌动蛋白以及调节肌肉收缩。最近的研究表明,多种原肌球蛋白异构体具有能决定一个细胞内特有肌动蛋白丝数量的功能,其结构变化是研究原肌球蛋白特异性功能的关键。Janco等[25]利用肌动蛋白共沉淀和荧光聚合检测法对8个原肌球蛋白异构体进行了纯化,观测到所有原肌球蛋白长度在0.1~5 μm之间, 此异构体与肌动蛋白的亲和力是不同的。数据表明亲和力与原肌球蛋白分子量无关,但是高分子量原肌球蛋白异构体的协同性是低分子量的3倍,肌动蛋白的伸长率几乎全部降低 27%~85%。研究显示,原肌球蛋白异构体的生化特征发生了细微的调整,并且依赖于原肌球蛋白分子非选择性重叠区域的顺序变化。原肌球蛋白的基因突变与多种肌肉病变有关,如家族性肥厚性心肌病、重症肌无力等[26]。
1.4.4 肌钙蛋白(Troponin, Tn)
肌钙蛋白的分子量80 kDa,含3个亚基,分别为肌钙蛋白T(TnT)、肌钙蛋白I(TnI)、肌钙蛋白C(TnC)[27]。肌钙蛋白不仅具有调节肌肉收缩的作用,还参与肌小节的装配[28-29]。
调节钙离子依赖性的收缩离不开肌钙蛋白,肌钙蛋白突变体的形成与肌肉疾病相关。Ferrante等[28]破坏了斑马鱼的肌钙蛋白基因,肌肉发生了萎缩。肌钙蛋白T活力的完全缺失导致了肌小节结构的缺失,当肌钙蛋白和肌球蛋白的活动同时被破坏,肌小节也难以成熟。电子显微镜显示原肌球蛋白未能集中在肌小节而且插入的细肌丝丢失,表明肌钙蛋白T的损失影响细肌丝的合成。如果肌钙蛋白的中间结构域缺失,肌原纤维会形成但最终会瓦解,这是因为失去了对肌动蛋白-肌球蛋白活性的控制力。肌钙蛋白复合物不仅能够调控肌动蛋白-肌球蛋白相互作用,而且是细肌丝进行正确组装必不可少的物质。
1.4.5 肌联蛋白(Titin)
肌联蛋白是脊椎动物条纹肌的巨大肌小节细胞骨架蛋白[30-31],完整的肌联蛋白1(T1)亚型的分子量为3 000~3 800 kDa[31]。长度超过1 μm的肌联蛋白分子与肌小节M线到Z带的一半重叠,形成肌原纤维中的第三肌丝体系。在肌小节的A带,肌联蛋白与粗(肌球蛋白)丝相连。肌小节的M线附近有一些称为T2(MW~2 000 kDa)的分子,由类免疫球蛋白(Igc2)和类纤连蛋白(FnIII)结构域组成,FnIII具有β折叠并且包含激酶(TK)结构域[31]。在肌小节区域的部分肌联蛋白分子能与细(肌动蛋白)丝相互作用,然而,大部分的肌联蛋白分子能自由通过并在肌球蛋白丝的末端和Z带之间形成灵活的连接,作为一个“分子弹簧”调节肌小节的长度[32](图3)。在一半肌小节中每个肌球蛋白丝包含6个肌联蛋白分子[33],其N末端与Z带中重叠,而C末端则与肌小节的M线重叠。
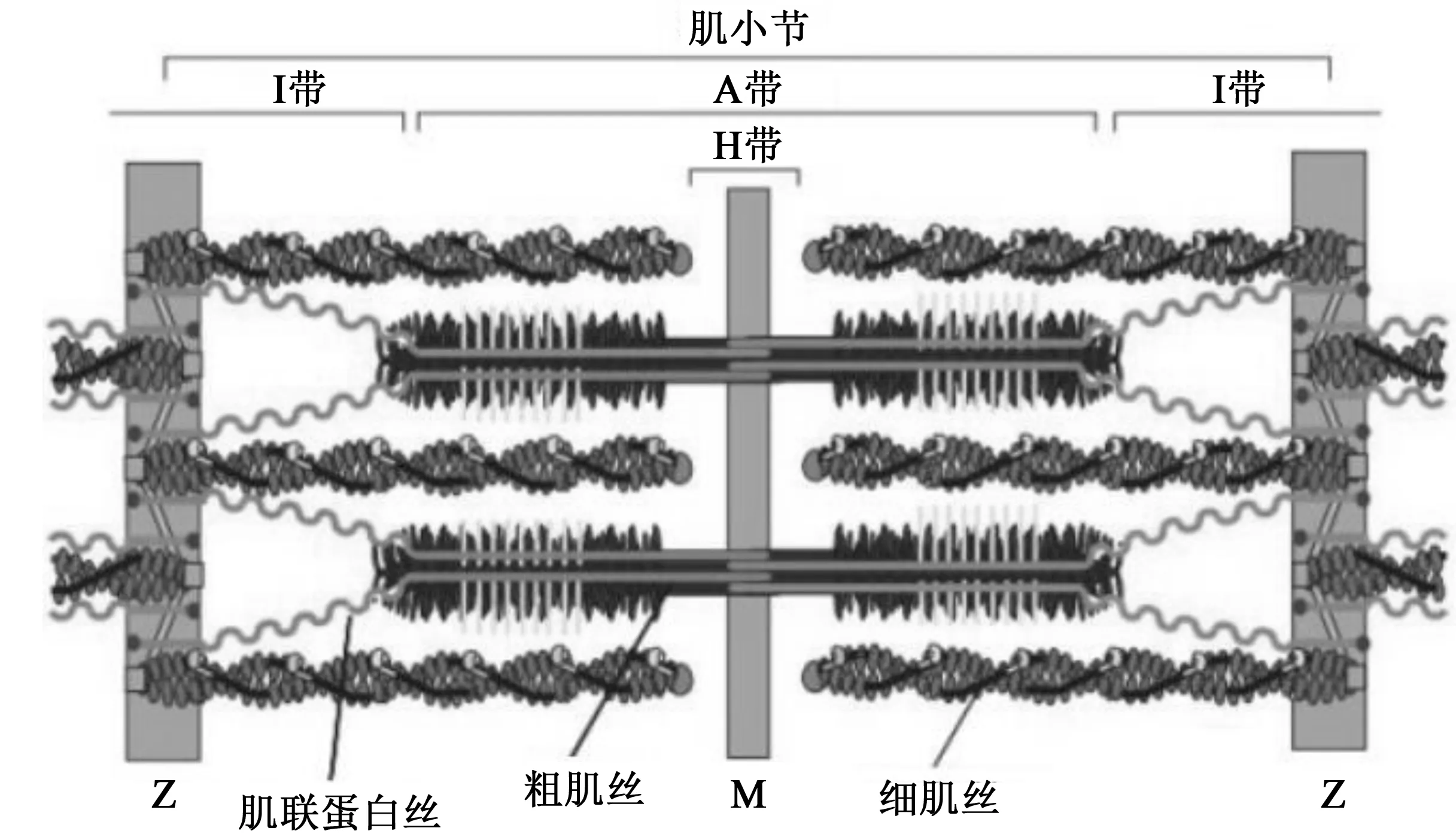
图3 肌联蛋白简图[32]Fig.3 Titin diagram
肌联蛋白是一种多功能蛋白,参与维持高度有序的肌小节结构并能启动和调节肌动蛋白-肌球蛋白的相互作用。作为压力传感器(mechanosensor),肌联蛋白能结合肌小节中的许多蛋白并将其聚集在单个肌小节中,因此在细胞内信号转导过程中起重要作用[31]。肌联蛋白可以在体内磷酸化[34],已经在肌小节的M线和Z带中发现了磷酸化位点[31],并且已经发现肌联蛋白分子的许多潜在磷酸化位点与心肌和骨骼肌的收缩活动有关。
Salmova[35]等发现在骨骼肌肉萎缩过程中,肌联蛋白降解活性增加是其T2区域的分子磷酸化的结果。肌联蛋白含量的减少导致肌肉进一步萎缩,并伴随有一系列负面后果,例如肌小节结构和肌肉收缩发生紊乱。
2 肌小节组装过程
肌小节组装可以认为是生物学中最为复杂的大分子组装之一,是各种蛋白和新陈代谢酶的动态网络。肌小节组成蛋白能够产生动力并向细胞内各组分发出信号,而酶可以控制许多线状的肌丝层[36]。肌丝滑行是肌小节组装以及运动过程的重要一环[37],我们当前对肌肉收缩分子机制的了解都是基于Huxley等[38-39]的肌丝滑行学说。根据这一学说,我们了解到肌肉收缩期间肌球蛋白丝和肌动蛋白丝长度保持恒定,肌球蛋白构象的改变可作为动力拉着肌动蛋白丝朝着肌小节中心滑动,当两者朝着彼此相互滑动时,肌肉缩短,这一过程所需的能量来源于ATP的水解作用。Huxley等[38]之后还创立了一个数学模型来描述肌丝滑行和动力产生的分子进程。
在肌细胞分化的最早阶段,除了肌联蛋白之外的所有肌小节蛋白在细胞质中广泛累积,而在可能代表几个肌联蛋白分子聚合物的点状图案中发现了肌联蛋白[40]。在几个小时内,在α-肌动蛋白处沿着质膜出现肌动蛋白点,形成Z线前体,这些积聚物是先前通过电子显微镜观察到的“致密Z线前体”的组分。尽管目前不清楚Z带与细胞膜的结合方式,但其早期表型表明这可能是肌原纤维形成过程中的基本组织结构, 并提供了新生肌小节中肌丝极化组织的初始线索。伴肌动蛋白不仅具有分子尺功能,可以使细丝长度具体化、稳定肌动蛋白丝,而且参与生物体内的大量细胞进程,比如Z带的形成和肌原纤维的组装。
丝状肌动蛋白在细胞膜附近积聚并与Z带结合[41],形成I-Z-I复合物(图3)。像其他肌纤维成分一样,肌球蛋白首先在细胞质中广泛出现;稍后,在细胞质中观察到肌球蛋白丝没有与I-Z-I复合物结合;随后出现了肌联蛋白的M线抗原决定簇,肌球蛋白粗丝与I-Z-I结构一起排列在肌小节中。肌球蛋白结合蛋白的组装与以上过程相关,表明这种分子可能将粗肌丝固定在肌联蛋白丝上,类似于Z线中α-辅肌动蛋白的交联作用[42]。
然而,在肌动蛋白细丝成熟之前,肌球蛋白粗丝就已经以其成熟的肌小节模式排列。超微结构分析显示,在新生肌原纤维中观察到的最短肌小节长度(Z带间距)为1.5 μm,没有可见的I条带,这表明粗丝的长度决定新生肌纤维的肌小节长度。大约在这个阶段,发育中的肌原纤维与细胞膜分离并扩散到细胞质中。
脊椎动物的肌小节肌球蛋白组装成粗肌丝的精确机制还不清楚,肌球蛋白形成有序结构的能力非常关键。肌球蛋白通过M带交叉连接形成分子马达,并在活跃收缩中提供稳定且有弹性的连接。纯化后的肌肉肌球蛋白可以自发地在体外组装成肌丝,越来越多的证据表明,在心肌和骨骼肌中肌联蛋白是肌球蛋白分子精确组装成粗肌丝所需的一个模板。
许多因素可能导致肌动蛋白丝成熟类型较晚出现,比如细肌丝排列延迟、肌丝长度统一达到1 μm延迟、肌动蛋白丝末端突出的蛋白原肌球蛋白组装延迟以及组装过程中肌动蛋白亚型进行转换。在秀丽隐杆线虫12~13体节期,肌动蛋白亚型受到抑制,α-肌动蛋白成为主要表达的蛋白,原肌球蛋白也在此期出现。这些过程和细丝成熟同时发生,原肌球蛋白延迟组装和其在维持肌动蛋白丝长度中所起的关键作用有关。
粗肌丝和细肌丝最终的排列、H带随后的发育和成熟肌小节的形成,由细胞黏附和动力机制所调节[39]。肌纤维形成分支而且单个的肌纤维通过肌间蛋白整齐排列,形成一个连接细胞和空隙区域的三维网络。肌原纤维稳定化以及成直线排列是肌纤维形成的最后一步,也是具备运动功能最重要的一步[43]。
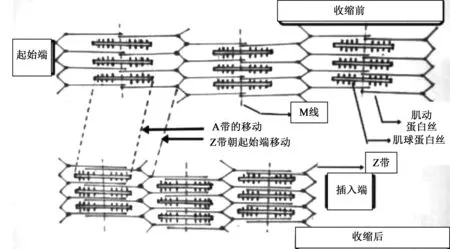
图4 肌丝滑行原理[45]Fig.4 Sliding principle of myofilament
细肌丝的位置分布相当于一个正六边形,粗肌丝则相当于正三边形[44];而粗、细肌丝在H带两侧的暗带中交叉存在,每一条粗肌丝都处在细肌丝所分布的正六边形的中央,为收缩时粗细肌丝之间的相互滑动提供足够空间[45](图4)。肌球蛋白与肌动蛋白结合后,大大增加了ATP酶的活性,转换率提高了200倍。肌动蛋白的激活作用主要是通过加速产物ADP和Pi缓慢释放过程来增加反应速度的,肌球蛋白和肌动蛋白的复合物结合ATP后,重新分解为肌动蛋白和肌球蛋白ATP复合物[46]。肌球蛋白需要20%的ATP结合肌动蛋白,但需要80%的ATP与之分离。肌动蛋白与肌球蛋白或肌球蛋白-ADP-Pi复合物很容易结合,而与肌球蛋白-ATP复合物的结合可能性很低。这样,肌动蛋白就交替地与两者结合,又从肌球蛋白-ATP复合物解离下来,如此便产生了运动[43]。
3 肌小节组装相关分子伴侣
1987年,Lasky[47]首先提出了分子伴侣(molecular chaperones)的概念,将细胞核内能与组蛋白结合并能介导核小体有序组装的核(nucleoplasmin)称为分子伴侣。分子伴侣能够识别并结合不完整折叠或装配的蛋白质,为其进行正确的折叠组装提供助力,而分子伴侣本身仅参与中间过程,对顾客蛋白的功能无影响,热休克蛋白就是其中一类分子伴侣。目前发现有100多种分子伴侣参与蛋白的折叠与装配过程[46],只有极少数几个分子伴侣的功能研究得比较清楚,例如参与肌小节组成蛋白折叠的分子伴侣有Chaperonin、热激蛋白(Hsp90,Hsp70)和Unc45。Chaperonin蛋白参与肌球蛋白重链二聚化过程[48],Hsp90,Hsp70和肌球蛋白特异性的分子伴侣Unc45,协助肌球蛋白de novo折叠和马达结构域发挥功能[49]。肌小节中各类蛋白的折叠、装配与降解是一个十分复杂的过程,分子伴侣的协助对蛋白进行正确的折叠组装以及维持肌小节的稳定非常关键, Hsp90和Unc45是脊椎动物肌小节组装过程中最重要的两个分子伴侣[50]。
3.1 Hsp90
Hsp90是一个调控肌小节组装的关键分子伴侣,分为Hsp90α和Hsp90β两种,所有真核细胞中均能发现两者的存在。Hsp90α是一种二聚体蛋白分子,由能够结合ATP的N端结构域和参与二聚体形成的C端结构域MEEVD组成,C端结构域还能结合辅助分子伴侣[51-52]。Hsp90α是一种依赖温度表达的蛋白,斑马鱼中有两种Hsp90α基因:hsp90α1和hsp90α2,这两种基因具有很高的同源性[45]。其中,hsp90α1在肌小节组装过程中必不可少,而hsp90α2对其影响较小[53]。敲除斑马鱼的hsp90α2和hsp90β两个基因后,肌肉发育正常,提示hsp90α1在肌小节组装中具有特别的作用;在斑马鱼中突变或降低hsp90α1的表达使其ATP酶活性降低后,出现肌原纤维组装异常和骨骼肌不能收缩的现象[53-54]。ATP酶有缺陷的hsp90α1突变体slothu45斑马鱼表现出与敲除hsp90α1相似的表型,证明有ATP活性的Hsp90对于肌肉发育是必不可少的[54]。秀丽隐杆线虫中Hsp90突变后,其ATP酶活性降低,肌球蛋白聚集,不能形成规则排列的肌小节[55]。而进一步研究发现,降低肌球蛋白的表达或抑制肌球蛋白酶的活性后没有发生干扰肌小节组装的现象[56],表明Hsp90可能参与肌小节其他组成蛋白的折叠和合成。Hsp90除了参与肌球蛋白折叠,还参与肌细胞分化过程。Yun等[57]发现Hsp90能促进ccd37和myod基因之间的相互作用,ccd37和myod是肌肉分化的关键转录因子。
3.2 Unc45
Unc45是肌球蛋白马达结构域进行正确的折叠所必需的分子伴侣,与Hsp90结合共同参与肌球蛋白的折叠。Unc45是一类十分保守的蛋白,鱼类中有两种,分别是广泛表达的Unc45a和横纹肌特异性表达的Unc45b[58-60]。在斑马鱼中,Unc45b是作为Hsp90α的辅助伴侣分子参与肌小节装配过程的[52]。
与广谱分子伴侣Hsp90不同,Unc45的顾客蛋白只有肌球蛋白。在多细胞动物中,Unc45对于细胞增殖、胞质分裂和肌小节粗丝组装都非常重要。敲除秀丽隐杆线虫的unc45导致体壁肌肉发育停滞,温度敏感型突变体在特定温度下出现肌纤维排列混乱和瘫痪的现象[61]。Unc45通过秀丽隐杆线虫肌球蛋白的降解调节肌小节组装[61],其中多个Unc45形成极性蛋白链,为Hsp90和肌球蛋白组装提供结合位点,协助Hsp90和肌球蛋白(Myosin)之间的相互作用[62](图5)。

图5 Unc45,Hsp90和肌球蛋白(Myosin)相互关系示意图[62]Fig.5 The schematic of relationship between Unc45, Hsp90 andMyosin
斑马鱼和果蝇的研究中显示,敲除unc45后肌小节组装受到了严重的干扰[63-64]。Melkani 等[65]发现果蝇unc45能帮助变性的柠檬酸盐合酶再折叠,并且阻止热诱导的肌球蛋白进行体外聚合。线虫和斑马鱼实验表明,Unc45与肌球蛋白的马达结构域结合,并作为辅助分子伴侣与Hsp90特异性结合[66]。Unc45 N端TPR结构域结合Hsp90,C端UCS结构域特异性结合肌球蛋白的马达结构域[67]。这些研究表明Unc45已成为一个独立的分子伴侣蛋白,而不仅仅只是Hsp90的辅助分子伴侣。
Unc45在心肌发育中与骨骼肌同样重要,敲除果蝇心肌中的Unc45导致肌纤维数量减少并发生紊乱、肌球蛋白水平减少、寿命缩短[65];降低斑马鱼心肌中Unc45的表达后也造成心脏功能的紊乱[63]。生物化学和分子生物学实验证实,老鼠的unc45b以复合体的形式存在(α-心脏肌球蛋白、β-心脏肌球蛋白和GATA4),是心脏发育中重要的转录因子,这一研究同样强调了Unc45在心脏发育中是必不可少的[68]。Li等[69]的研究发现降低斑马鱼smyd1b的基因表达会导致hsp90和unc45b表达量增加,且肌球蛋白表达量减少。肌纤维的缺陷可能是由unc45b表达量或活力信号的错误调节引起的,因此导致肌球蛋白降解增加。这些研究同样指出unc45b和其相互作用因子在肌小节组装和肌肉发育中的复杂作用。
4 存在问题与研究展望
目前对肌小节组装的研究主要集中在肌小节骨架、肌动蛋白-肌球蛋白复合体功能以及分子伴侣等方面,而对于肌球蛋白分子伴侣复合体的了解非常有限,在突变导致的肌动球蛋白复合体输出功率异常以及分子伴侣介导的自噬方面的研究仍然不够。
4.1 存在问题
4.1.1 肌小节骨架
肌小节骨架是指特化的细胞骨架,是整合空间结构、机械收缩和信号功能的一组蛋白质,对于肌动蛋白和肌球蛋白有序组装到肌小节,以及肌小节在肌纤维的排列都非常重要,但是肌小节骨架的装配过程还不明确。研究发现肌小节组装的起始位点位于细胞膜附近,但是其与细胞膜骨架之间的联系还不清楚。
肌联蛋白是细胞内最大的蛋白质,长度与肌小节的1/2相同。肌联蛋白对维持肌丝结构稳定和组成蛋白更新非常重要,但是其调节肌肉蛋白降解的机制还不清楚。
伴肌动蛋白(Nebulin)具有稳定细丝和调节细丝长度的作用,敲除伴肌动蛋白的小鼠在两周内因肌肉萎缩而死亡。伴肌动蛋白突变直接导致杆状体疾病发生,然而,其与肌联蛋白之间的相互作用还不清楚。
肌球蛋白家族有35个成员,不同亚型的肌球蛋白如何在不同的肌纤维中发挥各自的功能,这是肌球蛋白结构研究的热点之一。目前对于胚胎期、围产期的眼周肌纤维中肌球蛋白亚型的研究较少,因为其中的单一亚型肌球蛋白很难分离。肌球蛋白的折叠需要分子伴侣复合体,目前对于肌球蛋白分子伴侣复合体的了解非常有限,这导致肌球蛋白的基因工程表达与修饰非常困难,这也是限制肌球蛋白结构及功能研究的因素之一。
4.1.2 肌动蛋白-肌球蛋白复合体
不断地进行收缩与舒张是肌小节复合体的主要生物学特性,肥厚型和扩张型心肌病都是因为心肌收缩异常引起的。肥厚型心肌病是最常见的遗传性心血管疾病,全球患病率超过1/500。扩张型心肌病也是遗传性心血管疾病,发病率相对肥厚型心肌病较低。这两种心肌病都是由人β-心肌肌球蛋白基因突变引起的,肥厚型心肌病患者的心脏收缩力度增强,而扩张性心肌病患者的心脏收缩力度减弱。为发现该现象产生的原因,目前大部分的研究集中在肌动球蛋白复合体功能方面,尤其是ATP酶活性和收缩强度研究,在突变导致的肌动球蛋白复合体输出功率异常方面的研究较少。
4.1.3 分子伴侣
分子伴侣是蛋白质正确折叠和维持稳定性的关键,最近很多研究集中在肌肉生物学相关过程中分子伴侣的特性与功能方面。发育过程中,分子伴侣帮助肌小节组成蛋白正确折叠并整合到新生肌小节上。除了协助肌肉分化,分子伴侣在肌肉组织稳态中发挥重要作用。破坏分子伴侣网络将导致神经肌肉疾病的发生,自噬是细胞清除受损蛋白质和细胞器的方式之一。自噬分为三类,分别是分子伴侣介导的自噬、大自噬和微自噬。最近有研究发现,分子伴侣介导的自噬小体组分LAMPA和热休克蛋白70在散发性包涵体肌炎患者中表达水平升高,说明分子伴侣介导的自噬参与了肌原性疾病的发生与发展。但是,目前关于分子伴侣介导的自噬在骨骼肌中的研究非常少。
4.2 未来研究方向
目前有很多疾病与肌肉相关,如重症肌无力、渐冻人症、进行性肌营养不良、肌肉萎缩等,了解肌小节组装的过程对防治这些疾病是至关重要的。只有肌小节相关蛋白进行正确的折叠和组装,肌小节才能发挥正常的生理功能。越来越多的研究证明,肌小节骨架是遗传性肌病的靶点,其中的上百种蛋白质在时间和空间上相互作用,未来需要大量的工作去研究肌肉收缩异常的机理及其治疗原则。肌小节骨架蛋白不仅是肌病的致病靶点,也是肌病诊断和治疗的靶点,比如基因突变和衰老诱发的肌病。研究发现,肌小节组成蛋白在搭建蛋白复合体过程中具有新的作用,包括肌肉基因表达中的蛋白翻译规律和转录控制,这一发现为今后在肌小节组成蛋白和其作用通路中发现新的药物作用靶点提供了重要的依据,也为基因编辑的发展进步做了潜在的铺垫。
目前体外研究肌小节收缩的体系有两种,即二组分体系(肌动蛋白和肌球蛋白)和六组分体系(肌动蛋白、肌球蛋白原、肌球蛋白、肌钙蛋白T、肌钙蛋白I和肌钙蛋白C)。随着对肌小节研究的深入,发现肌球蛋白结合蛋白C(Mybp-c)和肌联蛋白对于肌小节收缩也非常重要,因此,构建八组分体系对于理解肥厚型和扩张性心肌病的发病机理非常重要。利用皮肤纤维、心肌细胞、离体器官和动物模型研究小分子对心肌收缩的影响,对于心肌病的防治也非常必要。
蛋白质的活性与物理构象和分子伴侣介导的折叠密切相关。破坏肌小节的精密结构与组装过程导致肌肉发育、维持与修复异常,这充分说明分子伴侣在其中的重要作用。不同分子伴侣参与肌小节组装与成分更新被揭示的过程,也是人类寻找肌原性疾病防治靶点的过程。在收缩蛋白异常折叠的肌细胞中,调节分子伴侣活性,表型正常的肌纤维数量会增多,说明增强分子伴侣活性有助于渐进性肌病的治疗。开发靶向分子伴侣的小分子药物,也是肌原性疾病防治的一个热点领域。
[1]EHLER E, GAUTEL M. The sarcomere andsarcomerogenesis[M]// The Sarcomere and Skeletal Muscle Disease. New York :Springer, 2008.
[2] AULD A L, FORKER E S. Nucleus-dependent sarcomere assembly is mediated by the LINC complex[J]. Molecular biology of the cell, 2016, 27(15): 2351-2359.
[3] LAING N G, NOWAK K J. When contractile proteins go bad: the sarcomere and skeletal muscle disease[J].Bioessays, 2005, 27(8): 809-822.
[4] HELLERSCHMIED D, CLAUSEN T. Myosin chaperones[J]. Current Opinion Structural Biology, 2014, 25:9-15.
[5] FUKUDA N, TERUI T, ISHIWATA S,et al. Titin-based regulations of diastolic and systolic functions of mammalian cardiac muscle[J]. Journal of Molecular and Cellular Cardiology, 2010, 48(5): 876-881.
[6]柳睿殊,刘荣,刘书霞,等. 肌肉力量的微观起源[J]. 生命科学研究, 2014, 18(5):453-457.
[7] MYHRE J L, HILLS J A,PRILL K, et al. The titin A-band rod domain is dispensable for initial thick filament assembly in zebrafish[J]. Developmental Biology, 2014, 387(1): 93-108.
[8] DAVULURI G, SEILER C, ABRAMS J, et al. Differential effects of thin and thick filament disruption on zebrafish smooth muscle regulatory proteins[J]. Neurogastroenterology and Motility, 2010, 22(10): 1100-e285.
[9] YAMAGUCHI M, IZUMIMOTO M, ROBSON R M, et al. Fine structure of wide and narrow vertebrate muscle Z-lines: A proposed model and computer simulation of Z-line architecture[J]. Journal of Molecular Biology, 1985, 184(4): 621-643.
[10] LUTHER P K, BARRY J S, SQUIRE J M. The three-dimensional structure of a vertebrate wide (slow muscle) Z-band: Lessons on Z-band assembly[J]. Journal of Molecular Biology, 2002, 315(1): 9-20.
[11] LUTHER P K. Three-dimensional structure of a vertebrate muscle Z-band: Implications for titin and alpha-actinin binding[J]. Journal of Structure Biology, 2000, 129(1): 1-16.
[12] SEILER C, DAVULURI G, ABRAMS J, et al. Smooth muscle tension induces invasive remodeling of the zebrafish intestine[J]. Plos Biology, 2012, 10(9):e1001386.
[13]ABRAMS J, EINHORN Z, SEILER C, et al. Graded effects of unregulated smooth muscle myosin on intestinal architecture, intestinal motility and vascular function in zebrafish[J]. Disease Models & Mechanisms, 2016, 9(5): 529-540.
[14] PRILL K, REID P W, WOHLGEMUTH S L, et al. Still heart encodes a structural HMT, SMYD1b, with chaperone-like function during fast muscle sarcomere assembly[J].PloS One, 2015, 10(11): e0142528.
[15] SCHIAFFINO S, REGGIANI C, et al. Fiber types in mammalian skeletal muscles[J]. Physiol Rev, 2011, 91(4): 1447-1531.
[16] OFFER G,MOOS C, STARR R. A new protein of the thick filaments of vertebrate skeletal myofibrils: Extractions, purification and characterization[J]. Journal of Molecular Biology, 1973, 74(4):653-676.
[17] LI M, ANDERSSON- LENDAHL M, SEJERSEN T, et al. Knockdown of fast skeletal myosin-binding protein C in zebrafish results in a severe skeletal myopathy[J]. Journal of General Physiology, 2016, 147(4): 309-322.
[18] RACCA A W, BECK A E, RAO V S,et al. Contractility and kinetics of human fetal and human adult skeletal muscle[J]. J Physiol. 2013, 591(12): 3049-3061.
[19] DEACON J C, BLOEMINK M J, REZAVANDI H, et al. Identification of functional differences between recombinant human α and β cardiac myosin motors[J]. Cell Mol Life Sci, 2012, 69(13): 2261-2277.
[20] BLOEMINK M, DEACON J, LANGER S, et al. The hypertrophic cardiomyopathy myosin mutation R453C alters ATP-binding and hydrolysis of human cardiac β-myosin[J]. J Biol Chem, 2014, 289: 5158-5167.
[21] SOMMESE R F, SUNG J, NAG S, et al. Molecular consequences of the R453C hypertrophic cardiomyopathy mutation on human ß-cardiac myosin motor function[J]. Proc Natl Acad Sci USA, 2013, 110(31): 12607-12612.
[22] 马兰芳,杨书红,王世宣. 肌动蛋白相关蛋白2/3复合体的研究进展[J]. 中国妇幼保健, 2014, 29(34):5724-5726.
[23] ROUILLER I, XU X P , AMANN K J , et al. The structural basis of actin filament branching by the Arp2/3 complex[J]. The Journal of Cell Biology, 2008, 180(5): 887-895.
[24] BAILEY K. Tropomyosin :a new asymmetric protein component of muscle[J]. Nature, 1946, 157: 368-369.
[25] JANCO M, BONELLO T T, BYUN A, et al. The impact of tropomyosins on actin filament assembly is isoform specific[J]. Bioarchitecture, 2016, 6(4):61-75.
[26] KHAITLINA S Y. Chaper seven-Tropomyosin as a regulator of actin dynamics[J]. International Review of Cell and Molecular Biology, 2015, 318: 255-291.
[27] MUKHOPADHYAY S, LANGSETMO K, STAFFORD W F III, et al. Identification of a region of fast skeletal troponin T required for stabilization of the coiled-coil formation with troponin I[J]. Journal of Biological Chemistry, 2005, 280(1): 538-547.
[28] FERRANTE M I, KIFF R M, GOULDING D A, et al. Troponin T is essential for sarcomere assembly in zebrafish skeletal muscle[J]. Journal of Cell Science, 2011, 124(Pt 4): 565-577.
[30] VIKHLYANTSEV I M, PODLUBNAYA Z A. New titin (connectin) isoforms and their functional role in striated muscles of mammals: Facts and suppositions[J]. Biochemistry, 2012, 77(13): 1515-1535.
[31] LINKE W A , HAMDANI N. Gigantic business: Titin properties and function through thick and thin[J]. Circ Res, 2014, 114(6): 1052-1068.
[32] BOATENG S Y, GOLDSPINK P H. Assembly and maintenance of the sarcomere night and day[J]. Cardiovasc Res, 2008, 77(4): 667-675.
[33] LIVERSAGE A D, HOLMES D, KNIGHT P J, et al. Titin and the sarcomere symmetry paradox[J]. Journal of Molecular Biology, 2001, 305(3):401-409.
[34] SOMERVILLE L L, WANG K. Sarcomere matrix of striated muscle: In vivo phosphorylation of titin and nebulin in mouse diaphragm muscle[J]. Archives of Biochemistry and Biophysics, 1988, 262(1):118-129.
[35] SALMOVA N N, GRITSYNA Y V, ULANOVA A D, et al. On the role of titin phosphorylation in the development of muscular atrophy[J]. Biophysics, 2015, 60(4): 684-686.
[36] PINNIGER G J. Muscles as motors and muscles as brakes[J]. Leonardo, 2015, 48(2): 174-175.
[37] MUNGAL S U, DUBE S P, DHOLE A, et al. New hypothesis for mechanism of sliding filament theory of skeletal muscle contraction[J]. National Journal of Physiology, Pharmacy & Pharmacology, 2015, 5(1): 72-75.
[38] HUXLEY H E, HANSON J. Changes in the cross-striations of muscle during contraction and stretch and their structural interpretation[J]. Nature, 1954, 173(4412): 973-976.
[39] HUXLEY A F, NIEDERGERKE R. Structural changes in muscle during contraction: Interference microscopy of living muscle fibres[J]. Nature, 1954, 173(4412): 971-973.
[40] 邱华玲,于建兴,陈宏权. MyoG 基因结构与功能研究进展[J]. 生物信息学, 2007, 5(4): 190-192.
[41] SANGER J W, WANG J S, FAN Y L, et al. Assembly and dynamics of myofibrils[J].J Biomed Biotechnol, 2010, 2010: 858606.
[42] EHLER E,ROTHEN B M, HAMMERLE S P, et al. Myofibrillogenesis in the developing chicken heart: Assembly of Z-disk, M-line and the thick filaments[J]. Journal of Cell Science, 1999, 112(10):1529-1539.
[43] GREGORIO C C, ANTIN P B. To the heart of myofibril assembly[J]. Trends in Cell Biol, 2000, 10(9): 355-362.
[44] ROTTY J D,WU C,BEAR J E. New insights into the regulation and cellular functions of the Arp2 /3 complex[J]. Nat Rev Mol Cell Biol, 2013,14 (1): 7-12.
[45] 张震华,薛良义. 鱼类肌节的组成及装配[J]. 中国细胞生物学学报, 2012, 34(12): 1276-1281.
[46] SCHNORRER F, SCHÖNBAUER C, LANGER C C, et al. Systematic genetic analysis of muscle morphogenesis and function in Drosophila[J]. Nature, 2010, 464(7286): 287-291.
[47] LASKY L A, NAKAMURA G, SMITH D H, et al. Delineation of a region of the human immunodeficiency virus type 1 gp120 glycoprotein critical for interaction with the CD4 receptor[J]. Cell, 1987, 50(6): 975-985.
[48] SRIKAKULAM R, WINKELMANN D A. Myosin II folding is mediated by a molecular chaperonin[J]. J Biol Chem, 1999, 274: 27265-27273.
[49] SRIKAKULAM R, WINKELMANN D A. Chaperone-mediated folding and assembly of myosin in striated muscle[J]. J Cell Sci, 2004, 117(Pt 4): 641-652.
[50] ETARD C, ROOSTALU U, STRAHLE U. Shuttling of the chaperones Unc45b and Hsp90a between the A band and the Z line of the myofibril[J]. J Cell Biol, 2008,180(6): 1163-1175.
[51] PRODROMOU C, PANARETOU B, CHOHAN S, et al. The ATPase cycle of Hsp90 drives a molecular ‘clamp’ via transient dimerization of the N-terminal domains[J]. EMBO J, 2000, 19(16): 4383-4392. [52] ZHAO R, HOURY W A. Molecular interaction network of the Hsp90 chaperone system[J]. Adv Exp Med Biol, 2007, 594: 27-36.
[53] DU S J, LI H Q, BIAN Y H, et al. Heat-shock protein 90α1 is required for organized myofibril assembly in skeletal muscles of zebrafish embryos[J]. Proc Natl Acad Sci USA, 2008, 105(2): 554-559.
[54] HAWKINS T A, HARAMIS A P, ETARD C, et al. The ATPase-dependent chaperoning activity of Hsp90a regulates thick filament formation and integration during skeletal muscle myofibrillogenesis[J]. Development, 2008, 135(6): 1147-1156.
[55] NI W, HUTAGALUNG A H, LI S, et al. The myosin-binding UCS domain but not the Hsp90-binding TPR domain of the UNC-45 chaperone is essential for function in Caenorhabditis elegans[J]. J Cell Sci, 2011, 124(Pt 18): 3164-3173.
[56] CODINA M, LI J L, GUTIÉRREZ J, et al. Loss of Smyhc1 or Hsp90α1 function results in different effects on myofibril organization in skeletal muscles of zebrafish embryos[J]. PloS One, 2010, 5: e8416.
[57] YUN B G, MATTS R L. Differential effects of Hsp90 inhibition on protein kinases regulating signal transduction pathways required for myoblast differentiation[J]. Exp Cell Res, 2005, 307(1): 212-223.
[58] ETARD C, BEHRA M, FISCHER N, et al. The UCS factor Steif/Unc-45b interacts with the heat shock protein Hsp90a during myofibrillogenesis[J]. Dev Biol, 2007, 308(1): 133-143.
[59] PRICE M G, LANDSVERK M L, BARRAL J M, et al. Two mammalian UNC-45 isoforms are related to distinct cytoskeletal and muscle-specific functions[J]. J Cell Sci, 2002, 115(Pt 21): 4013-4023.
[60] WOHLGEMUTH S L, CRAWFORD B D, PILGRIM D B. The myosin co-chaperone Unc-45 is required for skeletal and cardiac muscle function in zebrafish[J]. Dev Biol, 2007, 303(2): 483-492.
[61] LANDSVERK M L, LI S, HUTAGALUNG A H, et al. The UNC-45 chaperone mediates sarcomere assembly through myosin degradation in caenorhabditis elegans[J]. J Cell Biol, 2007, 177(2): 205-210.
[62] GAZDA L, POKRZYWA W, HELLERSCHMIED D, et al. The myosin chaperone Unc-45 is organized in tandem modules to support myofilament formation in C. elegans[J]. Cell, 2013, 152(1/2): 183-195.
[63] WOHLGEMUTH S L, CRAWFORD B D, PILGRIM D B. The myosin co-chaperone Unc-45 is required for skeletal and cardiac muscle function in zebrafish[J]. Dev Biol. 2007, 303(2): 483-492.
[64] LEE CF, MELKANI G C, YU Q, et al. Drosophila UNC-45 accumulates in embryonic blastoderm and in muscles, and is essential for muscle myosin stability[J]. J Cell Sci, 2011, 124(5): 699-705.
[65] MELKANI G C, LEE C F, CAMMARATO A, et al. Drosophila Unc-45 prevents heat-induced aggregation of skeletal muscle myosin and facilitates refolding of citrate synthase[J]. Biochem Biophys Res Commun, 2010, 396(2): 317-322.
[66] BARRAL J M, BAUER C C, ORTIZ I, et al. Unc-45 mutations in Caenorhabditis elegans implicate a CRO1/She4p-like domain in myosin assembly[J]. J Cell Biol, 1998, 143(5): 1215-1225.
[67] SRIKAKULAM R, LIU L, WINKELMANN D A. Unc45b forms a cytosolic complex with Hsp90 and targets the unfolded myosin motor domain[J]. PloS One, 2008, 3(5): e2137.
[68] CHEN DS, LI SM, SINGH R, et al. Dual function of the Unc-45b chaperone with myosin and GATA4 in cardiac development[J]. J Cell Sci, 2012, 125(16): 3893-3903.
[69] LI H Q, ZHONG Y W, WANG Z F, et al. Smyd1b is required for skeletal and cardiac muscle function in zebrafish[J]. Mol Biol Cell, 2013, 24(22): 3511-3521.
The research progress of sarcomere assembly
HOU Cai-ping1,2, HAN Li-wen1, HOU Hai-rong1, WANG Xi-min1, ZHANG Shan-shan1,ZHANG Xuan-ming1, WANG Xue1, LI Xiao-bin1, TIAN Qing-ping2, HE Qiu-xia1,2*, LIU Ke-chun1,2*
(1.Shandong Provincial Engineering Laboratory for Biological Testing Technology, Shandong Provincial Key Laboratory of Biosensors, Institute of Biology,Shandong Academy of Sciences, Jinan 250014,China; 2. School of Pharmacology, Shanxi Medical University, Taiyuan 030001, China)
∶As the basic contractile unit of striated muscles, sarcomere has a highly ordered structure, which was assembled by Actin, Myosin, and a variety of related proteins. During the assembling process, the correcting assembly of Z belt, M belt, and a series of associated proteins is essential for maintaining movement of muscles, so the study on the mechanism of folding and assembling of sarcomere composition protein is very important for understanding the causes of muscle disease and carrying out targeted therapy. In this paper, the research progress of sarcomere primary components and sarcomere assembling process was reviewed. It was considered that the present studies on sarcomere skeleton assembly, the function of the sarcomere contractile complex, and the relationship between the chaperones and muscle diseases were not deep enough. Therefore, in the future, more studies should be developed on the relationship between Myosin binding protein, Titin, molecular chaperones, and diseases, to find new ideas and solutions to the treatment of muscle related diseases.
∶sarcomere;assembling;muscle protein;molecular chaperones
10.3976/j.issn.1002-4026.2017.02.005
2016-12-12
国家自然科学基金(3140070050);山东省重点研发计划(2016GSF121039)
侯彩平(1991—), 女,硕士研究生,研究方向为药剂学。E-mail:hcp071003@163.com
*通信作者,何秋霞(1980—),女,副研究员,研究方向为药物筛选。E-mail:heqx@sdas.org 刘可春(1964—),男,研究员,研究方向为药物筛选。E-mail:hliukch@sdas.org
Q445
A
1002-4026(2017)02-0025-12
