多巴胺转运体基因敲除小鼠认知功能的变化
2017-05-10黄国明钞雪林陈建云
黄国明 钞雪林 陈建云
(南昌大学第一附属医院精神科,江西 南昌 330006)
多巴胺转运体基因敲除小鼠认知功能的变化
黄国明 钞雪林 陈建云
(南昌大学第一附属医院精神科,江西 南昌 330006)
目的 观察多巴胺转运体(DAT)基因敲除小鼠认知功能的变化。方法 采用Western印迹及PCR方法检测DAT基因敲除C57BL/6 J小鼠模型,通过对DAT基因敲除小鼠进行Morris 水迷宫试验及旷场试验研究小鼠认知能力的变化。结果 在Morris 水迷宫试验中,与WT组小鼠相比,DAT基因敲除小鼠平均逃避潜伏期明显延长,显示其学习能力下降;在撤掉平台后,其在原平台象限停留时间缩短,表明其记忆能力亦下降。在旷场试验中,与WT组小鼠相比,DAT基因敲除小鼠总的探索路程降低,虽然其自主兴奋性运动增加,但多为无目的性运动,其在中央格停留时间及次数也下降,表明其探索好奇能力明显下降。结论 敲除小鼠DAT基因可导致小鼠多动,同时损伤小鼠的认知功能,表明DAT基因可能和学习、记忆、探索能力有关。
多巴胺转运体;认知功能;Morris 水迷宫试验;旷场试验
多巴胺(DA)在行为、认知、情感、奖赏等多种中枢神经系统功能活动中具有重要作用。DA能系统异常参与导致精神分裂症、药物成瘾、帕金森疾病、迟发性运动障碍、路易体痴呆、阿尔茨海默病、注意力缺陷多动症等多种神经精神疾病。DA能神经递质信号的传递受突触间隙DA浓度的影响,即同时受DA能神经元合成释放DA到突触间隙的能力及DA转运体(DAT)重摄取突触间隙内DA到神经末梢的能力调控〔1,2〕。本研究采用DAT基因敲除小鼠模型(DAT-KO),探讨DAT基因敲除后小鼠认知功能的变化。
1 材料和方法
1.1 材料 纯合子DAT基因敲除C57BL/6 J小鼠(基因型DAT-/-)为HO组,DAT基因敲除C57BL/6 J小鼠(基因型DAT+/-)为HET组,野生型C57BL/6 J小鼠(基因型DAT+/+)为WT组,每组13只,20月龄,来源于上海软隆科技发展有限公司。WT组小鼠均重40~43 g,皮毛光滑,饮食、 活动、体质量增长正常;HET组小鼠均重35~40 g,皮毛光滑,饮食、 活动、体质量增长正常;HO组小鼠均重32~36 g,皮毛不整,饮食正常,多动。
1.2 方法 各组取3只小鼠断头处死,取大脑组织。(1)PCR验证基因型:以100 mg组织加入1 ml Trizol匀浆提取总RNA。按照TAKA逆转录试剂盒的要求进行逆转录反应得到cDNA,-80℃冷冻保存。引物设计及合成:根据GenBank所给出的基因序列,采用Primer 5.0软件设计各基因的引物,GAPDH上游引物5'-GAGACCTTCAACACCCCAGCG-3',下游引物5'-TCGGGGCATCGGAACCGCTCA-3';DAT上游引物5'-GGCGGGAGTGGTATTATGAA-3',下游引物5'-GTGATCCGGAAGGACTGATT-3'。引物由上海生工生物工程技术服务有限公司合成。real-time PCR反应:以cDNA为模板,在7500 real-time PCR反应体系中进行定量PCR反应扩增,采用2-ΔΔCT法计算各组的RNA表达差别。
(2)Western印迹验证基因型:以1 g组织加入RIPA裂解液,冰上裂解30 min。4℃,10 000 r/min离心15 min,取上清液,用BCA法测定蛋白浓度为1 μg/μl,分装后-80℃冷冻保存。取相同质量的裂解缓冲液上样进行SDS-PAGE胶电泳,分离后转移至PVDF膜,5%牛奶封闭1 h,分别用抗GAPDH抗体(1∶1 000;Abcam公司)及抗DAT抗体(1∶1 000;Abcam公司)孵育4℃过夜,用TBST溶液洗膜后,加入1∶5 000稀释二抗室温孵育1 h,洗膜后ECL显色扫描。应用Image J分析软件进行灰度扫描分析,实验重复3次。
1.2.1 Morris水迷宫试验 水迷宫装置为一圆形水池,直径150 cm,高50 cm,水深28 cm,水温(25±1)℃,可升降平台直径8 cm,高25 cm。水迷宫分为 4个象限,水池上方由摄像头与计算机相连,记录小鼠游泳轨迹,水迷宫测试时环境应保证黑暗和安静,避免小鼠的行为受外界干扰。
(1)定位航行试验(反映空间记忆的获得能力):在水池内某一位置固定平台,将小鼠面向池壁放入水中,记录其在 2 min 内寻找到并爬上平台的时间(逃避潜伏期)和路程,小鼠找到并爬上平台后,让其停留5 s,若小鼠入水后2 min内未能找到平台,则将其引导置于平台上,并停留10 s,此时记录逃避潜伏期为 120 s。每日于固定的时间训练2次(上午9:00,下午2:00),连续5 d。每次训练完成后迅速将小鼠擦干。每日各小鼠逃避潜伏期用2次训练的均值表示。
(2)空间探索实验(检测空间记忆的保持能力):在第6天(即为期5 d的定位航行实验结束后)去除平台,将小鼠从固定象限中点面朝池壁放入水中,记录小鼠2 min池内活动情况,通过分析获得2 min内小鼠经过原平台所在靶象限的时间。
1.2.2 旷场试验 旷场实验是评价实验动物在新环境中自主行为、探究行为与恐惧焦虑感的一种常用方法。小鼠由于对新开阔环境恐惧而主要在周边区域活动,但其探究特性又促使其产生在中央区域活动的动机,小鼠在中央格停留时间及次数代表其探索好奇的程度。实验采用长宽高均为50 cm的无顶塑料箱,内壁为黑色,底部分为25个等份小方格。将小鼠从中央格放入箱内,由摄像系统记录小鼠5 min内的探索活动,追踪其探索路程及在中央格停留时间及次数。每只老鼠适应结束后用酒精擦拭箱子,避免前只老鼠气味干扰。
1.3 统计学分析 采用SPSS17.0软件进行单因素方差分析和Tukey法。
2 结 果
2.1 Western印迹及PCR验证小鼠基因型 DAT mRNA在HO组基本不表达(0.09±0.02),HET组(0.65±0.14)较WT组(1.19±0.78)下降50%,差异有统计学意义(P<0.01)。进一步采用Western印迹对小鼠脑组织蛋白进行检测发现,DAT蛋白在HO组也基本不表达(0.07±0.01),HET组DAT蛋白水平(0.34±0.11)则较WT组(0.79±0.24)下降70%,差异有统计学意义(P<0.01),见图1。表明建立DAT基因敲除小鼠模型成功。
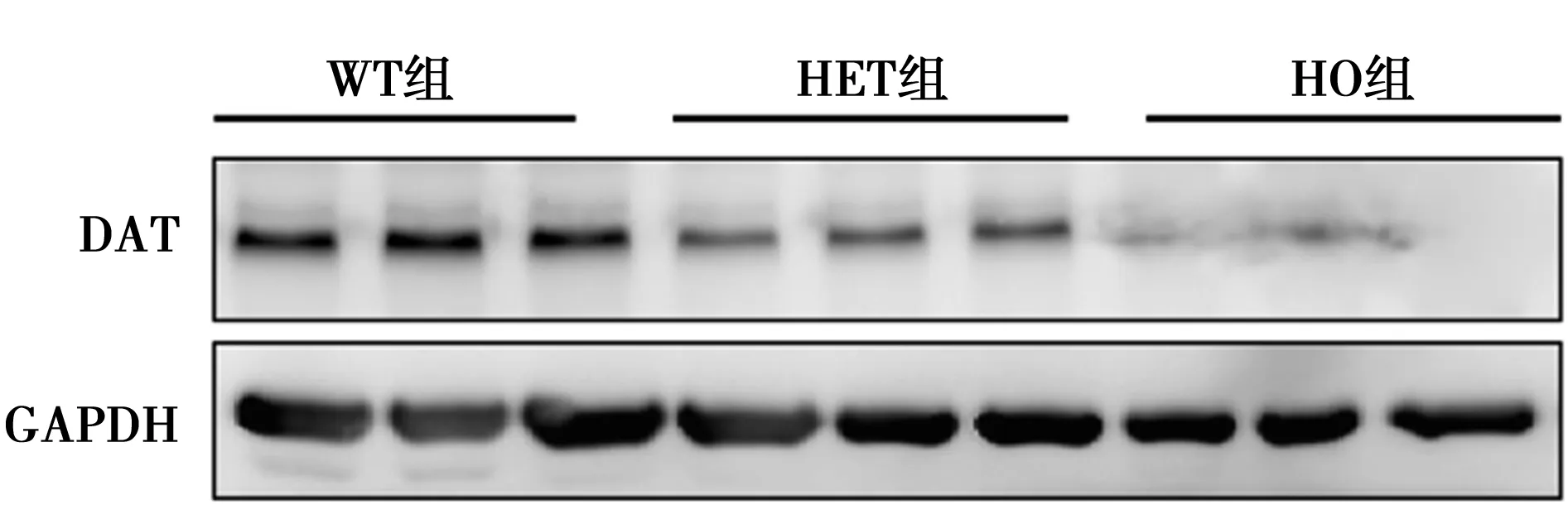
图1 各组大鼠DAT蛋白相对表达水平
2.2 Morris水迷宫试验结果
2.2.1 DAT基因敲除对小鼠学习能力的影响 各组小鼠的平均逃避潜伏期均逐渐缩短(图2)。经过5 d的Morris水迷宫定位航行实验训练,WT组、HET组、HO组第5天逃避潜伏期均值分别为(36.32±8.76)s,(68.12 ± 8.15)s,(90.03 ±11.81)s,均短于第1天的(53.39 ±10.45)s,(85.97 ± 8.10)s,(110.20 ±2.32) s(P<0.01)。表明随着定位航行训练次数的增加,各组小鼠都具有了一定的空间学习能力。同时HET组及HO组平均逃避潜伏期均明显高于WT组,表明其空间学习能力较WT组下降。
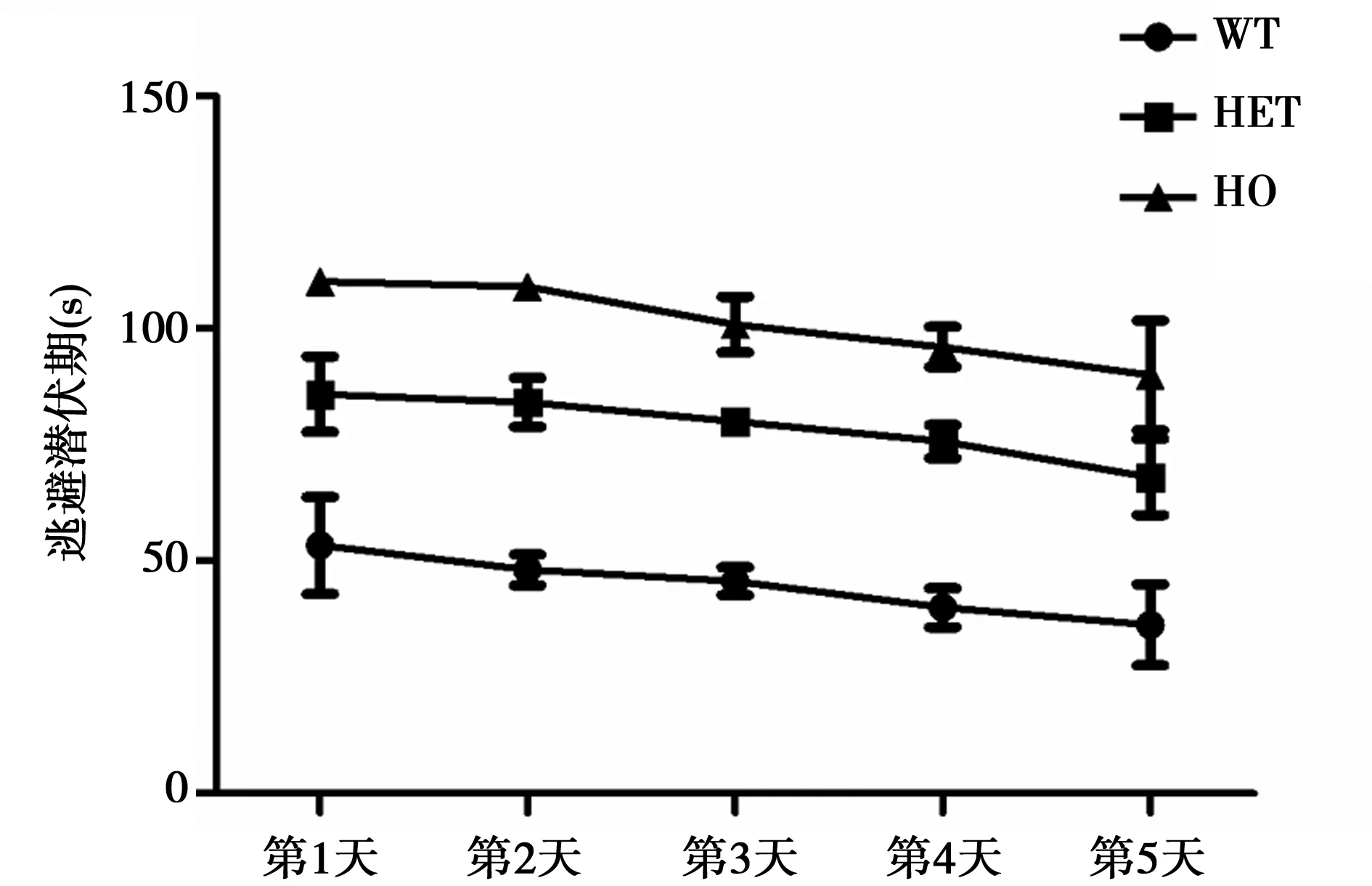
图2 各组大鼠定位航行试验平均逃避潜伏期变化
2.2.2 DAT基因敲除对小鼠记忆能力的影响 在训练小鼠完成5 d的 Morris水迷宫定位航行实验后,于第6天进行空间探索试验,与WT组〔43.14±7.23)s〕比较,HET组〔(23.31±4.28)s〕在原平台所在象限的活动时间稍有延长,HO组〔14.21±5.31)s〕明显短于WT组(P<0.05,P<0.01),表明基因敲除可损伤小鼠的记忆能力。
2.3 旷场试验结果
2.3.1 各组小鼠探索路程 WT组探索路程(1 708.30±58.95)cm,HET组(1 671.40±59.96)cm,HO组(909.70±38.15)cm,HET组与WT组比较差异无统计学意义(P>0.05),而HO组小鼠明显低于WT组(P<0.01)。
2.3.2 各组小鼠中央格停留时间及次数 与WT组〔(43.15±9.78)s、(10.12±2.33)次〕比较,HET组〔(21.15±7.08)s、(5.42±1.33)次〕中央格停留时间及次数均低于WT组(P<0.05);HO组〔(10.04±3.28)s、(2.12±1.01)次〕明显低于WT组(P<0.01),表明基因敲除可降低小鼠探索好奇能力。
3 讨 论
DA是重要的神经递质,在脑内发挥极其重要的功能〔3〕,DA参与的神经通路有黑质-纹状体通路(调节躯体自主运动),该通路受损可导致帕金森病及其他运动障碍性疾病〔4〕;以及中脑-皮层传导束和中脑-边缘传导束(参与情绪、行为动机和学习记忆等心理和认知功能的调节)障碍〔5〕,该通路异常则与精神分裂、药物成瘾相关〔6〕。DAT位于DA能神经元突触周围的细胞膜上,是一种Na+/Cl-依赖转运体〔7〕,它的主要功能是重摄取突触间隙内的DA,从而调控突触间隙内DA的有效浓度,维持DA循环,减少对新合成DA的需求,保持DA在神经元中的稳态〔8〕。敲除 DAT基因破坏突触间隙内DA的重摄取及清除过程,Isingrini等〔9,10〕研究结果显示敲除DAT基因导致突触间隙内DA存在时长增加100倍;Gainetdinov等〔11,12〕研究也表明敲除DAT基因导致突触间隙内DA水平至少升高 5 倍,存在时间延长 300 倍。因此,敲除DAT基因可能会对小鼠的运动、认知、情绪等各方面产生重要影响。
本研究通过对DAT基因敲除小鼠进行Morris 水迷宫试验及旷场试验研究小鼠认知能力的变化,结果显示,敲除DAT基因可能导致小鼠学习、记忆、探索能力均下降,导致小鼠认知减退。
研究发现DAT基因敲除小鼠的行为学表型研究发现,完全敲除DAT的 DAT-KO小鼠表现为自发性兴奋性运动明显增加,同时其旷场试验及水迷宫试验能力下降〔13〕,但Spielewoy等〔14〕认为旷场试验及水迷宫试验能力下降的原因为小鼠的自发性运动导致其无法进行学习、探索试验,未明确提出其认知能力下降。Del′Guidice等〔15〕采用H型迷宫试验检测DAT基因敲除小鼠的行为学表现,认为小鼠多动不干扰其认知能力,敲除小鼠DAT基因导致小鼠认知能力下降,与本研究结果一致。利用PET检测人大脑发现DAT的表达量下降与大脑老化相关,DAT的下降与路易体痴呆相关,同时DAT SPECT技术正被探索用于区分帕金森病、路易体痴呆及阿尔茨海默病〔16〕,这可能与DAT缺失导致突触间隙DA量升高有关,Morice等〔17〕发现给予DAT-KO小鼠DA竞争性抑制药物可以改善认知能力下降,认为DAT基因敲除导致的突触间隙高DA水平参与导致认知能力下降。目前认为DA、五羟色胺、烟碱等均与认知功能相关,有研究表明给予DAT-KO小鼠尼古丁可以改善其认知能力下降〔18,19〕。运动和认知能力的维持可能有赖于脑内多种递质间的平衡〔20〕,包括DA在内的大脑递质系统与认知功能之前的关系尚需更多机制研究。
本研究结果表明敲除小鼠DAT基因不仅导致小鼠自主性兴奋性运动增加,而且导致小鼠认知能力降低,DAT基因参与学习、记忆、探索能力的调控,为进一步研究相关的神经疾病提供了理论基础。
1 Weinstein JJ,Chohan MO,Slifstein M,etal.Pathway-specific dopamine abnormalities in schizophrenia 〔J〕.Biol Psychiatry,2017;81(1):31-42.
2 Ayers-Ringler JR,Jia YF,Qiu YY,etal.Role of astrocytic glutamate transporter in alcohol use disorder 〔J〕.World J Psychiatry,2016;6(1):31-42.
3 Arnsten AF,Wang M,Paspalas CD.Dopamine's actions in primate prefrontal cortex:challenges for treating cognitive disorders 〔J〕.Pharmacol Rev,2015;67(3):681-96.
4 Yulug B,Hanoglu L,Kilic E.The neuroprotective role of vesicular monoamine transporter 2 in neurodegenerative diseases 〔J〕.Med Chem,2015;11(2):104-8.
5 Arnsten AF,Girgis RR,Gray DL,etal.Novel dopamine therapeutics for cognitive deficits in schizophrenia 〔J〕.Biol Psychiatry,2017;81(1):67-77.
6 dela Pena I,Gevorkiana R,Shi WX.Psychostimulants affect dopamine transmission through both dopamine transporter-dependent and independent mechanisms 〔J〕.Eur J Pharmacol,2015;764:562-70.
7 Brooks DJ.Molecular imaging of dopamine transporters 〔J〕.Ageing Res Rev,2016;34:114-21.
8 Raiteri L,Raiteri M.Multiple functions of neuronal plasma membrane neurotransmitter transporters 〔J〕.Prog Neurobiol,2015;134:1-16.
9 Isingrini E,Perret L,Rainer Q,etal.Resilience to chronic stress is mediated by noradrenergic regulation of dopamine neurons 〔J〕.Nat Neurosci,2016;19(4):560-3.
10 Isingrini E,Perret L,Rainer Q,etal.Selective genetic disruption of dopaminergic,serotonergic and noradrenergic neurotransmission:insights into motor,emotional and addictive behaviour 〔J〕.J Psychiatry Neurosci,2016;41(3):169-81.
11 Gainetdinov RR.Dopamine transporter mutant mice in experimental neuropharmacology 〔J〕.Naunyn Schmiedebergs Arch Pharmacol,2008;377(4-6):301-13.
12 Homberg JR,Kyzar EJ,Nguyen M,etal.Understanding autism and other neurodevelopmental disorders through experimental translational neurobehavioral models 〔J〕.Neurosci Biobehav Rev,2016;65:292-312.
13 Reith ME,Blough BE,Hong WC,etal.Behavioral,biological,and chemical perspectives on atypical agents targeting the dopamine transporter 〔J〕.Drug Alcohol Depend,2015;147:1-19.
14 Spielewoy C,Gonon F,Roubert C,etal.Increased rewarding properties of morphine in dopamine-transporter knockout mice 〔J〕.Eur J Neurosci,2000;12(5):1827-37.
15 Del'Guidice T,Lemasson M,Etievant A,etal.Dissociations between cognitive and motor effects of psychostimulants and atomoxetine in hyperactive DAT-KO mice 〔J〕.Psychopharmacology (Berl),2014;231(1):109-22.
16 Shingai Y,Tateno A,Arakawa R,etal.Age-related decline in dopamine transporter in human brain using PET with a new radioligand 〔(1)(8)F〕FE-PE2I 〔J〕.Ann Nucl Med,2014;28(3):220-6.
17 Morice E,Billard JM,Denis C,etal.Parallel loss of hippocampal LTD and cognitive flexibility in a genetic model of hyperdopaminergia 〔J〕.Neuropsychopharmacology,2007;32(10):2108-16.
18 McCleery J,Morgan S,Bradley KM,etal.Dopamine transporter imaging for the diagnosis of dementia with Lewy bodies 〔J〕.Cochrane Database Syst Rev,2015;1:CD010633.
19 Weiss S,Nosten-Bertrand M,McIntosh JM,etal.Nicotine improves cognitive deficits of dopamine transporter knockout mice without long-term tolerance 〔J〕.Neuropsychopharmacology,2007;32(12):2465-78.
20 Salamone JD,Correa M,Yohn S,etal.The pharmacology of effort-related choice behavior:dopamine,depression,and individual differences 〔J〕.Behav Process,2016;127:3-17.
〔2016-12-26修回〕
(编辑 滕欣航)
黄国明(1979-),男,硕士,副主任医师,主要从事老年精神障碍研究。
R395.4
A
1005-9202(2017)08-1866-04;
10.3969/j.issn.1005-9202.2017.08.019
