严重脑白质疏松症相关因素的病例对照研究
2017-05-10封红亮张帅美罗征进张仁伟刘煜敏
封红亮, 张帅美, 罗征进, 徐 艳, 张仁伟, 刘煜敏
严重脑白质疏松症相关因素的病例对照研究
封红亮, 张帅美, 罗征进, 徐 艳, 张仁伟, 刘煜敏
目的 探讨严重脑白质疏松症的相关因素。方法 按照筛选标准连续收集2015年4月-2016年2月武汉大学中南医院神经内科住院患者,通过头部核磁共振评估脑白质疏松症Fazekas评分并收集相关临床资料,并应用非条件Logistic回归来分析严重脑白质疏松症的相关因素。结果 共纳入608例患者,包括Fazekas评分为0的对照组415例和Fazekas评分为3~6的病例组193例。多因素Logistic回归结果提示:高龄(G3 vs G1:OR10.81,95%CI2.76~42.38,P=0.001;G4 vs G1:OR28.40,95%CI7.02~114.95,P<0.05;G5 vs G1:OR68.79,95%CI14.22~332.92,P< 0.05)、脑动脉粥样硬化(OR1.98,95%CI1.07~3.65,P=0.029)和高血压病(OR=4.84,95%CI=2.65~8.85,P<0.05)与严重脑白质疏松症之间呈显著正相关。结论 高龄、脑动脉粥样硬化和高血压病可能是严重脑白质疏松症的独立危险因素。
白质疏松; 危险因素; 相关因素; 回归分析; 病例对照研究
脑白质疏松症(leukoaraiosis,LA)也称脑白质高信号和脑白质变性,属于脑小血管病的一种,是由多种不同原因造成的双侧脑室周围或半卵圆中心区域白质异常的一个影像学概念[1,2]。自1987年,加拿大神经病学专家Hachinski[3]等首次对LA进行描述以来,国内外学者对其病因、机制及临床症候学进行了大量的研究,目前认为潜在的致病机制可能主要是弥散的脑小血管病变和慢性脑缺血损伤。目前,很多研究报道年龄、高血压病、2型糖尿病、脑动脉粥样硬化、吸烟等是LA的独立危险因素,但是,很多学者提出了争议性的结论[4~6]。而且,既往研究侧重于LA发病与否,但轻度的LA往往临床意义较局限,严重的LA与急性缺血性卒中、痴呆或者轻度认知功能障碍死亡风险关系密切[7]。鉴于此,本研究旨在通过一项大样本病例对照研究对比无或轻度LA人群和严重LA患者的暴露因素分布情况来阐明严重LA的相关因素。
1 材料与方法
1.1 研究对象 连续收集2015年4月-2016年2月武汉大学中南医院神经内科住院患者,满足以下所有条件的病例才能被纳入:(1)年龄在40~89岁之间;(2)通过Siemens Magnetom Trio Tim 3.0T超导磁共振扫描获得T2WI-FLAIR扫描图像且图像质量不影响 Fazekas评分。纳入患者出现下列任何一种情况将被排除:(1)患有多发性硬化、同心圆硬化、弥漫性硬化、视神经脊髓炎和脑白质营养不良等特异性的中枢神经系统脱髓鞘疾病;(2)患有中枢神经系统感染性疾病;(3)患有颅内肿瘤;(4)有颅内血肿或脑多发微出血病灶;(5)患有急性或者陈旧性大面积脑梗死(>1/3大脑中动脉供血区);(6)存在直径大于2 cm的侧脑室旁新发或陈旧梗死灶;(7)存在其他可能影响 Fazekas评分的疾病如严重脑外伤、脑结构变异和各种原因导致的脑积水等。
1.2 数据收集 由两名神经病学研究生单独对同一研究对象资料进行收集整理,数据不一致时查找原始病历资料来纠正。收集数据包括:住院号、姓名、性别、年龄、脑动脉粥样硬化(基于CT或MR脑血管成像判断,大脑前动脉或大脑中动脉或大脑后动脉或椎基底动脉或颈内动脉狭窄率≥50%)、吸烟史、高血压病、2型糖尿病、冠心病、血常规指标(白细胞计数、红细胞计数、血红蛋白浓度、血小板计数、红细胞压积、平均红细胞体积、红细胞分布宽度、平均红细胞血红蛋白浓度和平均红细胞血红蛋白含量)和生化指标(尿素氮、肌酐、尿酸、空腹血糖、甘油三脂、总胆固醇、高密度脂蛋白和低密度脂蛋白)。
1.3 Fazekas评分 由两位经验丰富的神经内科医师独立完成对同一研究对象的LA的Fazekas评分[8],不一致的通过协商或者第三方讨论决定最终评分。所有评估均基于T2WI-FLAIR图像,其中对于侧脑室旁高信号:0分:无病灶;1分:病灶呈帽状或铅笔样薄层;2分:呈光滑的晕圈病灶;3分:不规则的脑室旁高信号,延伸到深部白质。对于深部白质高信号:0分:无病灶;1分:点状病灶;2分:病灶开始融合;3分:病灶大片融合。为了进一步削弱定性评估的偏倚和保证研究结果更为可靠和稳定,对侧脑室旁和深部白质Fazekas评分进行加和获得最终Fazekas评分(0~6分),其中Fazekas评分3~6分为严重LA,而Fazekas评分为0者作为对照组人群。
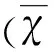
2 结 果
2.1 研究对象一般情况和单因素Logistic回归分析结果 共纳入608例研究对象,其中包括对照组(Fazekas评分=0)415例和严重LA患者(Fazekas评分3~6)193例,两组人群一般情况(见表1)。单因素Logistic回归分析结果提示:年龄、脑动脉粥样硬化、吸烟史、高血压病、2型糖尿病、红细胞计数、血红蛋白浓度、血小板计数、红细胞压积、平均红细胞血红蛋白浓度、红细胞分布宽度、尿素氮、肌酐、尿酸、总胆固醇和低密度脂蛋白与严重LA相关性有统计学意义;而性别、冠心病、白细胞计数等其他因素与严重LA的相关性无统计学意义(见表1)。
2.2 多因素Logistic回归分析结果 在Enter模型下,校正性别、2型糖尿病和白细胞计数等因素后,结果提示:高龄(G3 vs G1:OR10.81,95%CI2.76~42.38,P=0.001;G4 vs G1:OR28.40,95%CI7.02~114.95,P<0.05;G5 vs G1:OR68.79,95%CI14.22~332.92,P<0.05)、脑动脉粥样硬化(OR1.98,95%CI1.07~3.65,P=0.029)和高血压病(OR=4.84,95%CI2.65~8.85,P<0.05)与严重LA的发病风险呈显著正相关(见表2)。
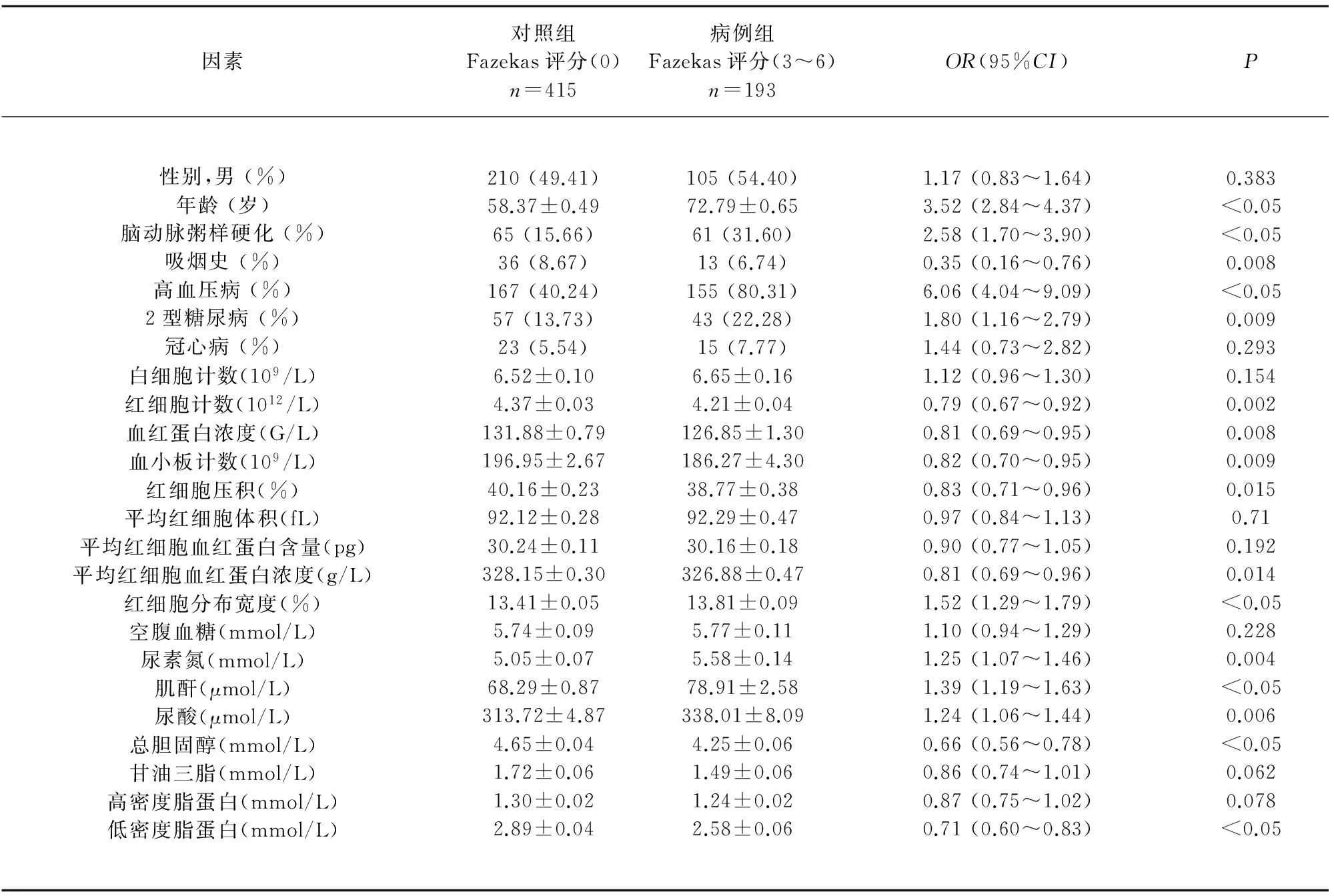
表1 患者一般情况和单因素Logistic回归分析结果
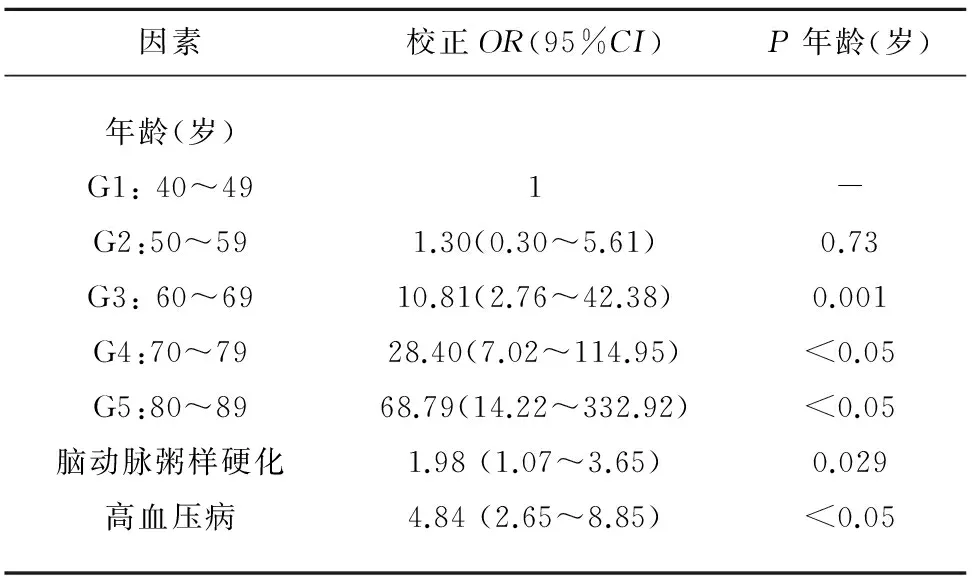
表2 多因素Logistic回归分析结果
G=分组(group);校正因素:性别、2型糖尿病、白细胞计数、红细胞计数、血红蛋白浓度、血小板计数、红细胞压积、平均红细胞体积、平均红细胞血红蛋白含量、平均红细胞血红蛋白浓度、红细胞分布宽度、空腹血糖、尿素氮、肌酐、尿酸、总胆固醇、甘油三酯、高密度脂蛋白和低密度脂蛋白
3 讨 论
随着影像学技术的不断发展和普及应用,LA的检出率不断升高,有研究报道,在老年人群中其检出率高达15%[9]。典型的LA在头部CT上呈现白质区(尤其是双侧侧脑室周围和深部白质)斑片或大片的弥漫性的低密度病灶,在头部MRI常规平扫图像上呈现等T1、长T2或者长T1、长T2信号病灶[10]。近年来,LA的临床意义和病因学研究越来越受到神经病学和神经影像学专家的关注,LA临床表现多样,轻度的LA患者一般无任何症状和体征,而严重的LA患者通常表现为认知功能障碍、情感障碍、步态异常和尿失禁等[11]。既往有关的病因学研究大多存在以下两大问题:第一,未进行样本量的估算,有限的样本量很容易造成多因素统计分析结果的较大偏倚;第二,在logistic回归分析中将因变量(LA)编码时将是否患病(Fazekas评分=0或者Fazekas评分≥1)进行二分类编码,侧重于LA患病与否,而忽视了严重LA这一更具临床意义的临床阶段,掩盖或高估了某些相关因素。我们认为,可能正是这两大关键因素导致了目前对于LA病因学研究的巨大分歧。本研究在制定严格的删选标准的基础之上,对样本量进行了合理评估,以期获得更为可靠的统计分析结论,探究严重LA发病的相关因素。
本研究单因素Logistic回归分析结果提示对于50~89岁的人群,年龄每增加10岁,罹患严重LA的风险会升高约3.5倍;而多因素Logistic回归分析结果进一步证实这一相关关系,并且同40~49岁人群组相比,60~89岁的人群,发生严重LA的风险升高了约10~68倍。由此看来,高龄(尤其大于60岁)是严重LA发病较强的独立危险因素。这种严重LA发生风险随着年龄增加而显著增加的趋势提示严重LA可能同机体老年化本身有着密切关系。这与以往有关年龄和LA发病风险的相关研究的结论相一致[6,12]。目前对于高龄导致LA发生的机制尚不十分明确。有研究认为,随着年龄的增长,颅内卵磷脂和髓鞘碱性蛋白等逐渐减少,从而促进了神经纤维脱髓鞘改变,与此同时,小动脉会随年龄增长而出现硬化改变,出现血管管径减小和扩张性能减低改变,进而降低了脑组织的血供代偿功能[13]。
高血压病是一种可以引起多脏器各级动脉硬化的全身性疾病,其中以心、脑、肾脏和眼的损害为著,它是目前较为公认的心脑血管疾病的危险因素之一。然而对于高血压病是否是LA发病的危险因素,过去的相关研究报道结论不一致[13,14]。根据我们大样本多因素校正后的分析结果,高血压病能够增加近5倍的严重LA的发病风险,可能是其独立的危险因素。纹状体动脉和脉络膜动脉(发自室膜下动脉)是侧脑室周围的脑白质区域血流供应的主要动脉,他们之间的吻合支稀少或者缺如,与其他区域脑组织相比其侧枝循环代偿能力较低,更易受到血流动力学变化的影响[15]。高血压病导致的颅内小动脉管壁增厚和玻璃样变达到一定程度后可能导致脑白质慢性缺血缺氧状态,另外,长期的高血压病状态还可能降低血脑屏障的通透性,干扰脑脊液循环,引起脑间质水肿和神经纤维脱髓鞘病变[13]。有研究发现同未良好控制血压的高血压病患者相比,血压控制良好的患者发生LA的风险显著降低[16],进一步提示了血压的良好管理是预防LA的重要举措。
一直以来,动脉粥样硬化被认为是多种血管危险因素(如高血压病、高胆固醇血症和糖尿病等)的共同病理生理途径。由于目前缺乏对于颅内细小动脉和微动脉狭窄的评价方式,因此我们参照北美症状性颈动脉内膜切除实验 NASCET标准[17]:狭窄率=(1- A/B)×100%(A:最狭窄处血管直径;B:狭窄远端正常颈内动脉直径),定义脑动脉粥样硬化:基于CT或MR脑血管成像判断,头颈部大动脉(大脑前动脉、大脑中动脉、大脑后动脉、椎基底动脉和颈内动脉)狭窄率≥50%。本次研究发现脑动脉粥样硬化可能是严重LA的独立危险因素(OR1.98,P= 0.029)。作为脑小血管病的一种,目前国内外学者普遍认为LA的病理机制是脑小动脉及微动脉的血管病变。不容忽视的是,上游颅内大动脉的狭窄病变可以引起远端血流动力学受损,减少脑组织的灌注,进而引起各种急慢性的脑缺血改变。因此,脑动脉粥样硬化和脑组织低灌注很可能是严重LA发生发展的两个重要机制。未来研究可以进一步直接评估脑细小动脉硬化和脑灌注指标(如局部脑血流量、局部脑血容量、平均通过时间和达峰时间等)对于不同程度LA发生发展的作用。
本研究还发现,性别对于罹患严重LA的风险无显著影响。但在Cardiovascular Health Study[18]和Atherosclerosis Risk in Communities[19]两大研究中,研究者发现了LA在女性中更为多发,与女性侧脑室周围的N-乙酰天冬氨酸和胆碱等浓度较高的情况相一致。然而,值得注意的是,有研究发现作为女性体内一种天然的血管保护因子,较高血清雌激素浓度可以对脑组织起到改善血流灌注、抗氧化损伤和降低神经凋亡等作用[20]。相应地,在绝经期后,女性雌激素水平会不同程度地下降,脑白质对于缺血缺氧的耐受性可能也会降低。限于条件,我们在本次研究中未能记录到患者血清雌激素浓度和绝经状态。因此,今后需要进一步深入研究性别、雌激素水平和绝经状态等重要因素在LA发生发展过程中起到的联合作用。
综上所述,高龄、脑动脉粥样硬化和高血压病可能是严重LA的独立危险因素;有待进一步深入研究性别、性激素水平、绝经状态等因素与LA发生发展之间的相关关系。
[1]Pantoni L.Cerebral small vessel disease:from pathogenesis and clinical characteristics to therapeuticchallenges[J].Lancet Neurol,2010,9 (7):689-701.
[2]Sam K,Crawley AP,Poublanc J,et al.Vascular dysfunction in leukoaraiosis[J].AJNR Am J Neuroradiol,2016,37(12):2258-2264.
[3]Hachinski VC,Potter P,Merskey H.Leuko-araiosis[J].Arch Neurol,1987,44(1):21-23.
[4]Grueter BE,Schulz UG.Age-related cerebral white matter disease (leukoaraiosis):a review[J].Postgrad Med J,2012,88:79-87.
[5]王晏雯,刘小利,王俊俊,等.长时血压变异性与脑白质疏松的相关性研究[J] .解放军医学杂志,2015,40(3):142-146.
[6]丽 璇,徐 恩.缺血性脑白质病变的研究进展[J] .中华脑血管病杂志,2008,3:174-177.
[7]Henninger N,Khan MA,Zhang J,et al.Leukoaraiosis predicts cortical infarct volume after distal middle cerebral artery occlusion[J].Stroke,2014,45(3):689-695.
[8]Fazekas F,Chawluk JB,Alavi A,et al.MR signal abnormalities at 1.5 T in Alzheimer's dementia and normal aging[J].AJR Am J Roentgenol,1987,149(2):351-356.
[9]Ferro JM,Madureira S.Age-related white matter changes and cognitive impairment[J].J Neurol Sci,2002,203-204:221-225.
[10]Wallin A,Sjegren M,Edman A,et al.Symptoms,vascular risk factors and blood-brain barrier function in relation to CT white-matter changes in dementia[J].Eur Neurol,2000,44(4):229-235.
[11]Senda J,Ito K,Kotake T,et al.Association of leukoaraiosis with convalescent rehabilitation outcome in patients with ischemic stroke[J].Stroke,2016,47(1):160-166.
[12]黄 焕,殷聪国,罗本燕.缺血性脑白质病变与动态血压相关性研究[J].中国实用内科杂志,2015,35(3):250-253.
[13]Longstreth W,Manolio TA,Arnold A,et al.Clinical correlates of white matter findings on cranial magnetic resonance imaging of 3301 elderly people.The Cardiovascular Health Study[J].Stroke,1996,27(8):1274-1282.
[14]Henon H,Godefroy O,Lucas C,et al.Risk factors and leukoaraiosis in stroke patients[J].Acta Neurol Scand,1996,94(2):137-144.
[15]Taourio C,Levy C,Dufouil C,et al.Low cerebral blood flow velocity and risk of white matter hyperintensities[J].Ann Neurol,2001,49(3):411-414.
[16]van Dijk EJ,Breteler MM,Schmidt R,et al.The association between blood pressure,hypertension,and cerebral white matter lesions cardiovascular determinants of dementia study[J].Hypertension,2004,44(5):625-630.
[17]North American Symptomatic Carotid Endarterectomy Trial Collaborators.Beneficial effect of carotid endarterectomy in symptomatic patients with high-gradecarotid stenosis[J].N Engl J Med,1991,325(7):445-453.
[18]Wong TY,Klein R,Sharrett AR,et al.Cerebral white matter lesions,retinopathy,and incident clinical stroke[J].JAMA,2002,288(1):67-74.
[19]Meyer JS,Kawamura J,Terayama Y.White matter lesions in the elderly[J].J Neurol Sci,1992,110(1-2):1-7.
[20]冯 敏,张友好,寿广丽,等.脑白质疏松症相关因素的Logistic回归分析[J].中华全科医学,2011,9(11):1677-1739
A case-control study of related factors for severe leukoaraiosis
FENGHongliang,ZHANGShuaimei,LUOZhengjin,etal.
(DepartmentofNeurology,ZhongnanHospitalofWuhanUniversity,Wuhan430071,China)
Objective To investigate the factors of the incidence of severe leukoaraiosis (LA).Methods According to the selection criteria,We enrolled the patients at Department of Neurology,Zhongnan Hospital of Wuhan University from April 2015 to February 2016.Fazekas scores were performed based on the brain magnetic resonance imaging (MRI) and relevant clinical data were collected.Logistic regression was used to analyze the relationships between relevant clinical factors and severe LA.Results 608 patients were finally enrolled including 415 controls with 0 Fazekas score and 193 cases with 3-6 Fazekas scores.The results of multivariate logistic regression indicated that advanced age (G3 vs G1:OR10.81,95%CI2.76~42.38,P=0.001;G4 vs G1:OR28.40,95%CI7.02~114.95,P<0.05;G5 vs G1:OR68.79,95%CI14.22~332.92,P<0.05),cerebral artery stenosis(OR1.98,95%CI1.07~3.65,P=0.029) and hypertension(OR4.84,95%CI2.65~8.85,P<0.05) were significantly associated with the increased risk of severe LA.Conclusion Advanced age,cerebral artery stenosis and hypertension may be independent risk factors of severe LA incidence.
Leukoaraiosis; Risk factors; Relevant factors; Regression analysis; Case-control study
1003-2754(2017)04-0324-04
2016-10-17;
2017-01-29
国家自然科学基金面上项目(81371273)
(武汉大学中南医院神经内科,湖北 武汉 430071)
刘煜敏,E-mail:wb001792@whu.edu.cn
R742
A
