1,25(OH)2D3减轻小鼠局灶性脑缺血再灌注后炎性反应
2017-05-10石艳超陈秀菊
石艳超, 陈秀菊, 郭 英
1,25(OH)2D3减轻小鼠局灶性脑缺血再灌注后炎性反应
石艳超1, 陈秀菊2, 郭 英3
目的 探讨1,25(OH)2D3对小鼠局灶性脑缺血再灌注后炎性反应的作用及其机制。方法 造模前,通过一个月低维生素D饮食喂养,小鼠随机分为假手术组、局部缺血再灌注组(模型组)和1,25(OH)2D3组(治疗组)。造模前3 d始,假手术组和模型组每天腹腔注射2.4%乙醇,治疗组腹腔注射1,25(OH)2D3,共持续6 d。再灌注72 h后,Zea Longa法对鼠进行神经功能评分,干湿重法测量缺血侧脑组织含水量,RT-PCR法检测缺血侧半球IL-1β mRNA和TNF-α mRNA表达,采用Western blot法检测缺血侧半球NF-κB p65和Claudin-5的表达。结果 与模型组比较,缺血再灌注后72 h,治疗组小鼠神经功能评分较低,缺血侧半球脑含水量、IL-1β mRNA、TNF-α mRNA和NF-κB p65表达显著减少,Claudin-5表达显著增加,差异均有统计学意义(P<0.05)。结论 1,25(OH)2D3减轻小鼠局灶性脑缺血再灌注损伤后炎性反应,其机制通过抑制NF-κB的活化有关。
1,25(OH)2D3; 脑缺血再灌注; NF-κB; 炎性反应
炎性反应是脑缺血再灌注 (cerebral ischemia reperfusion injury,CIR) 损伤中复杂的级联反应之一,涉及多种炎性介质、炎性细胞及炎症反应通路,阻断CIR中炎性反应可显著减轻脑损伤。1,25(OH)2D3是维生素D在体内的活性形式,其对哺乳类动物T细胞的表达有影响。有研究表明[1],在周围和中枢神经系统中,1,25(OH)2D3抑制了炎性反应,对疾病有治疗作用,但其在CIR中的作用尚未明确。本实验通过构造动物模型,观察1,25(OH)2D3对小鼠脑缺血后,神经功能缺损和脑水肿的程度,Claudin-5表达的情况,IL-1β、TNF-α及NF-κB p65等炎性标志物的变化,旨在探讨1,25(OH)2D3对CIR中炎性反应的影响,以期为临床治疗脑梗死提供依据。
1 材料与方法
1.1 实验动物分组及处理 健康6周龄雄性C57BL/6J小鼠,体重14~18 g,清洁级。低维生素D饮食喂养一个月后,随机分为假手术组、模型组和治疗组。造模前3 d始,假手术组和模型组腹腔注射同体积的溶于生理盐水的 2.4% (v/v) 乙醇,治疗组腹腔注射1,25(OH)2D3(50 ng/d,Sigma-Aldrich),共持续6 d。
1.2 小鼠CIR模型制作 参照文献[2]报道的Zea Longa法制备改良线栓法大脑中动脉栓塞模型。术前禁食12 h,不禁饮。腹腔注射10%水合氯醛300 mg/kg麻醉,仰卧位固定于37 ℃恒温电热板上。取颈部正中切口,游离右侧颈总动脉、颈外动脉和颈内动脉,结扎颈总动脉近心端,以无创血管夹夹闭颈总动脉远心端及颈外动脉,于颈总动脉分叉下方剪开一切口,放置预先头端钝化处理的尼龙线(北京沙东生物),缓慢推进8~10 mm,感觉有阻力时停止,固定于颈总动脉。栓塞1 h后,拔出线栓恢复血流。单笼饲养,自由饮食。再灌注后2 h采用神经功能评分验证造模是否成功,即造模小鼠出现右侧Horner征和左侧以上肢为重的偏瘫,作为动物模型成功的判定标准,剔除不符合标准或死亡的动物,并随机补充。假手术组除不插入线栓外其余相同。
1.3 小鼠神经功能评定 于再灌注后72 h时,进行神经功能评分,参照Zea Longa评分标准:0分,无神经损伤症状;1分,轻微神经功能缺损,不能完全伸展对侧前爪;2分,重度局灶性神经功能缺损,向对侧转圈;3分,重度局灶性神经功能缺损,向对侧倾倒;4分,不能自发行走,意识丧失。
1.4 脑梗死体积的测定 取再灌注后72 h的小鼠,断头取脑置入-20 ℃冰箱内,30 min后取出,自视交叉水平行5个脑冠状切片,片厚约2 mm,将其置于2%的TTC溶液中,37 ℃避光孵育30 min,染色后置于10%甲醛溶液中于4 ℃避光固定24 h,肉眼观察并拍照。应用Image J 1.46 软件计算脑梗死体积,公式为:脑梗死体积(%)=[总的梗死体积-(右侧半球体积-左侧半球体积)]/左侧半球体积×100%。
1.5 脑组织含水量的测定 再灌注后72 h,经神经功能评分后,立即将小鼠断头处死。取缺血侧脑组织迅速称其湿重,然后置于100 ℃高温烤箱内,烘干48 h后称其干重。按照Elliott公式,计算出脑含水量,公式为:脑组织含水量(%)=(湿重-干重)/湿重×100%。
1.6 Western blot法检测缺血侧脑组织NF-κB p65和Claudin-5的表达 取再灌注后72 h的小鼠,腹腔注射10%水合氯醛300 mg/kg麻醉后,冰PBS心脏灌流,断头取脑。取缺血侧大脑半球,提取脑组织蛋白。采用BCA蛋白定量试剂盒(上海碧云天生物技术研究所)检测蛋白浓度。每孔加入等量蛋白,10%SDS-PAGE凝胶进行电泳,然后转移至甲醇浸泡过的PVDF膜上,1.5%胎牛血清室温封闭1 h后,分别加入NF-κB p65一抗(1∶1000,CST)、Claudin-5一抗(1∶1000,Introgen)和β-actin一抗(1∶2000,Santa Cruz),室温孵育12 h后,置入4 ℃冰箱过夜。加入二抗(1∶5000,Transgen Biotech),室温孵育2 h。每个条带加入显影液发光,采用Image J软件测定灰度值,以目的蛋白条带灰度值与内参β-actin条带灰度值的比值反映目的蛋白的表达水平。
1.7 实时定量PCR 取每只小鼠缺血侧大脑半球,获得总 RNA后取10 μl按照反转录酶Ⅱ试剂盒行逆转录操作,引物序列分别为:IL-1β:上游:5’-GTGGAACTTGAGGCCACATT-3’,下游:5’-TGTGACAAAAATGCCTGGAA-3’;TNF-α:上游:5’-CCAAGCCTTATCGGAAATGA-3’,下游:5’-TCTCACCCAGGGAATTACAAA-3’;内参β-actin 上游 5’-TGGAATCCTGTGGCATCCATGAAAC-3’,下游5’-TAAAACGCAGCTCAGTAACAGTCCG- 3’。扩增条件为:95 ℃预变性30 s,进入循环,95 ℃变性5 s,60 ℃退火30 s,共循环40次,随后95 ℃延伸15 s,60 ℃延伸1 min,95 ℃再延伸15 s,最后降至4 ℃。分别得到IL-1β、TNF-α和内参β-actin的Ct值后,采用相对定量的方法计算,△Ct=目的基因Ct值-内参基因Ct值。以2-△Ct为指标,分别计算出IL-1β、TNF-α和内参β-actin mRNA的相对表达水平。实验重复3次,求得平均值作为分析结果。
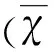
2 结 果
2.1 神经功能评分 小鼠取材前进行神经功能评分。假手术组因未闭塞大脑中动脉,未出现神经功能缺损症状,评分均为0分。与假手术组比较,模型组和治疗组的神经功能评分升高(P<0.05);与模型组比较,治疗组神经功能评分降低(P<0.05)(见表1)。
2.2 脑梗死体积和含水量的测定 假手术组小鼠脑组织未见脑梗死区域,模型组可见明显脑梗死灶(P<0.01),与模型组相比,治疗组中梗死灶体积明显减小(P<0.05);3组间脑含水量有明显差异(P<0.05),治疗组脑含水量较模型组低(P<0.05)(见表2)。
2.3 NF-κB p65和Claudin-5蛋白的表达量 与假手术组比较,模型组和治疗组的NK-κB p65表达明显上调(P<0.05);与模型组比较,治疗组的NF-κB p65的表达减少(P<0.05)。与假手术组比较,模型组和治疗组的Claudin-5表达明显减少(P<0.05);与模型组比较,治疗组Claudin-5的表达增加(P<0.05)(见图1、表3)。
2.4 IL-1β和TNF-α表达量 与假手术组比较,模型组和治疗组的IL-1β和TNF-αmRNA相对表达量明显升高(P<0.05);与模型组比较,治疗组的IL-1β和TNF-αmRNA相对表达量明显降低(P<0.05)(见表4)。
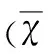
表1 脑再灌注后72 h各组小鼠神经功能评分±s)
与假手术组相比较*P<0.05;与模型组相比较#P<0.05
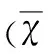
表2 脑再灌注后72 h各组小鼠脑梗死体积及 脑含水量比较±s)
与假手术组相比较*P<0.05;与模型组相比较#P<0.05
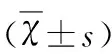
表3 脑再灌注后72 h各组小鼠脑组织NF-κB p65和 Claudin-5的表达量
与假手术组相比较*P<0.05;与模型组相比较#P<0.05

表4 脑再灌注后72 h各组小鼠脑组织IL-1β mRNA和 TNF-α mRNA 相对表达量
与假手术组相比较*P<0.05;与模型组相比较#P<0.05
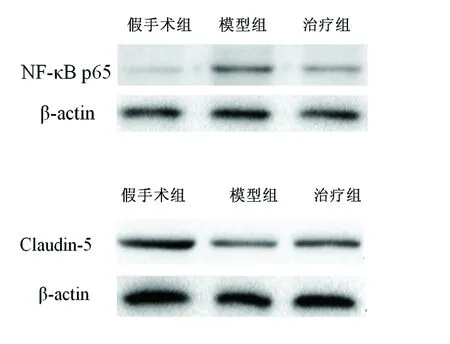
图1 再灌注后72 h,各组小鼠梗死侧脑组织NF-κB p65 和Claudin-5印迹条带
3 讨 论
CIR损伤的机制主要包括兴奋性氨基酸毒性、细胞内钙超载、一氧化碳失调控、炎性反应等。炎性反应在CIR损伤中起着关键作用,加重了脑损害[3~5],其病理基础以IL-1β和TNF-α等为代表的多种炎性介质失控、释放而形成“瀑布效应”,引起继发性神经细胞变性、坏死、凋亡等[6,7]。IL-1β是触发炎性反应的重要介质之一,脑缺血后其表达增多,对神经元有毒性作用,目前认为其是急性缺血期脑损伤程度的一个标志[8,9]。TNF-α是中枢神经系统参与炎性反应和免疫应答的重要介质,其可激活小胶质细胞、破坏BBB、促进炎性细胞的迁移,最终对神经元造成损伤[4,10~12]。
1,25(OH)2D3是维生素D在体内的活性形式,其除有维持体内钙磷平衡的作用,还有免疫调节作用,在很多疾病中参与免疫反应,下调炎性细胞及致炎性细胞因子的生成,对疾病起到了治疗作用[13]。基于以上研究,我们推测,1,25(OH)2D3通过影响免疫系统对脑梗死可能起到治疗作用。
CIR模型是研究脑梗死较好的动物模型,脑梗死的体积直接反映了脑损伤的严重程度,神经功能评分间接反映了病情的严重程度。本实验连续6 d对实验动物注射1,25(OH)2D3,为了避免食物因素对体内1,25(OH)2D3的影响,参照Joshi S等人研究[14],在造模前一个月,对实验动物实施了低维生素D饲料喂养。本实验发现,治疗组的神经功能评分及脑含水量低于模型组,提示1,25(OH)2D3能够在一定程度上改善脑梗死小鼠的神经功能减轻脑水肿程度。我们的实验还发现,脑缺血再灌注后,IL-1β和TNF-α炎性因子于梗死侧半球异常过度表达,加重了脑水肿的程度。在多种细胞中,缺血、缺氧诱发了NF-κB的活化[15,16],活化的NF-κB诱导了细胞凋亡,加重了病情。治疗组中,NF-κB p65的表达明显减少,神经功能评分减低,我们推测1,25(OH)2D3在一定程度上抑制了NF-κB的活化。
Claudin-5与BBB通透性的调节密切相关,其表达变化可作为衡量BBB损伤程度的标志,脑损伤后其表达明显下降,提示BBB透性增加[15,17,18]。为了解1,25(OH)2D3在脑缺血再灌注后对血脑屏障的影响,我们观察了代表BBB功能的Claudin-5的表达水平。实验中发现,与模型组相比较,治疗组中Claudin-5的表达水平降低及脑水肿程度降低,由此,我们推测1,25(OH)2D3具有保护BBB功能,或许能够为脑梗死治疗提供一种方法。
总之,我们的研究发现,1,25(OH)2D3保护了BBB,在一定程度上,抑制了致炎性细胞因子的产生,减少了Claudin-5蛋白的降解,发挥了对BBB的保护作用,减轻了脑水肿和脑梗死体积,促进神经功能的恢复,其机制可能是通过抑制NF-κB的激活,对CIR损伤脑组织起到了一定的保护作用。另外,患者脑梗死后,部分由于进食障碍,造成维生素D摄入减少,可能会加重脑梗死病情。提示我们在临床工作中,重视维生素D在脑梗死患者中的作用。
[1]Becklund BR,Severson KS,Vang SV,et al.UV radiation suppresses experimental autoimmune encephalomyelitis independent of Vitamin D production[J].Proc Natl Acad Sci USA,2010,107(14):6418-6423.
[2]Sasaki M,Honmou O,Kocsis JD.A rat middle cerebral artery occlusion model and intravenous cellular delivery[J].Methods Mol Biol,2009,549:187-195.
[3]Kleinig TJ,Vink R.Suppression of inflammation in ischemic and hemorrhagic stroke:therapeutic options[J].Curr Opin Neurol,2009,22(3):294-301.
[4]Denes A,Thornton P,Rothwell NJ,et al.Inflammation and brain injury:acute cerebral ischaemia,peripheral and central inflammation[J].Brain Behav Immun,2010,24(5):708-723.
[5]Yaidikar L,Thakur S.Punicalagin attenuated cerebral ischemia-reperfusion insult via inhibition of proinflammatory cytokines,up-regulation of Bcl-2,down-regulation of Bax,and caspase-3[J].Mol Cell Biochem,2015,402(1-2):141-148.
[6]Williams AJ,Dave JR,Tortella FC.Neuroprotection with the proteasome inhibitor MLN519 in focal ischemic brain injury:relation to nuclear factor kappaB (NF-kappaB),inflammatory gene expression,and leukocyte infiltration[J].Neurochem Int,2006,49(2):106-112.
[7]Janelidze S,Hu BR,Siesj P,et al,Alterations of Akt1 (PKBalpha) and p70(S6K) in transient focal ischemia[J].Neurobiol Dis,2001,8(1):147-154.
[8]Savard A,Lavoie K,Brochu ME,et al.Involvement of neuronal IL-1 beta in acquired brain lesions in a rat model of neonatal encephalopathy[J].J Neuroinflammation,2013,5,10:110.
[9]Clark WM,Rinker LG,Lessov NS,et al.Lack of interleukin-6 expression is not protective against focal central nervous system ischemia[J].Stroke,2000,31(7):1715-1720.
[10]Yoon JS,Lee JH,Tweedie D,et al.3,6’-dithiothalidomide improves experimental stroke outcome by suppressing neuroinflammation[J].J Neurosci Res,2013,91(5):671-680.
[11]Sairanen T,Carpen O,Karjalainen-Lindsberg ML,et al.Evolution of cerebral tumor necrosis factor-alpha production during human ischemic stroke[J].Stroke,2001,32(8):1750-1758.
[12]Huck V,Niemeyer A,Goerge T,et al.Delay of acute intracellular pH recovery after acidosis decreases endothelial cell activation[J].J Cell Physiol,2007,211(2):399-409.
[13]Harishankar M,Afsal K,Banurekha W,et al.1,25-Dihydroxy vitamin D3 downregulates pro-inflammatory cytokine response in pulmonary tuberculosis[J].Int Immunopharmacol,2014,23(1):148-152.
[14]Joshi S,Pantalena LC,Liu XK,et al.1,25-dihydroxyvitamin D3 ameliorates TH17 autoimmunity via transcriptional modulation of interleukon-17A[J].Mol Cell Biol,2011,31(17):3653-3669.
[15]Won S, Sayeed I,Peterson BL,et al.Vitamin D prevents hypoxia/reoxygenation-induced blood-brain barrier disruption via vitamin D receptor-mediated NF-kB signaling pathways[J].PLoS One,2015,10(3):e0122821.
[16]Koong AC,Chen EY,Giaccia AJ.Hypoxia causes the activation of nuclear factor kappa B through the phosphorylation of I kappa B alpha on tyrosine residues[J].Cancer Res,1994,54(6):1425-1430.
[17]Li G,Simon MJ,Cancel LM,et al.Permeability of endothelial and astrocyte cocultures:in vitro blood-brain barrier models for drug delivery studies[J].Ann Biomed Eng,2010,38(8):2499-2511.
[18]Won S,Lee JH,Wali B,et al.Progesterone attenuates hemorrhagic transformation after delayed tPA treatment in an experimental model of stroke in rats:involvement of the VEGF-MMP pathway[J].J Cereb Blood Flow Metab,2014,34(1):72-80.
1,25(OH)2D3ameliorates inflammatory response after focal cerebral ischemia reperfusion in mice
SHIYanchao,CHENXiuju,GUOYing.
(DepartmentofNeurology,PorthospitalofTianjin,Tianjin300456,China)
Objective To investigate the effect and mechanism of 1,25(OH)2D3on inflammatory response after focal cerebral ischemia reperfusion in mice.Methods After one month of low vitamin D diet,mice were randomly divided into sham-operated group,vehicle group and 1,25(OH)2D3treatment group.3 days before and after the induction of focal cerebral ischemia reperfusion,through intraperitoneal injection,sham-operated group and vehicle group mice were given 2.4% ethanol every day,and 1,25(OH)2D3treatment group mice were given 1,25(OH)2D3.72 h after ischemia reperfusion,neurological function deficits were assessed by Zea Longa method,brain water content was examined by wet and dry weight method,the expression of IL-1β mRNA and TNF-α mRNA in ischemic hemisphere was assessed by RT-PCR method,and Western blot method was used to detect the expression of NF-κB p65 and Claudin-5.Results 72 h after ischemia reperfusion,in 1,25(OH)2D3group,neurological function deficits score,brain water content,the expression of IL-1β mRNA,TNF-α mRNA and NF-κB p65 in ischemic hemisphere were significantly lower or smaller than those in the vehicle group (P<0.05),and the expression of Claudin-5 was significantly higher (P<0.05).Conclusion 1,25(OH)2D3ameliorates inflammatory response of focal cerebral ischemia reperfusion in mice and the mechanism may through inhibits the activation of NF-κB.
1,25(OH)2D3; Cerebral ischemic reperfusion; NK-κB; Inflammatory response
1003-2754(2017)04-0304-04
2016-12-20;
2017-03-30
(1.天津港口医院神经内科,天津 300456;2.天津南开医院神经内科,天津 300381;3.天津医科大学总医院耳鼻喉科,天津 300052)
陈秀菊,E-mail:91sqs@sina.com
R743.3
A
