香水百合试管鳞茎形成与增殖条件优化研究
2017-05-09杨鹭生陈晓敏戚卉李娟李国平
杨鹭生,陈晓敏,戚卉,李娟,李国平
(武夷学院生态与资源工程学院,福建武夷山354300)
香水百合试管鳞茎形成与增殖条件优化研究
杨鹭生,陈晓敏,戚卉,李娟,李国平
(武夷学院生态与资源工程学院,福建武夷山354300)
为探索香水百合试管鳞茎诱导与增殖的适宜培养条件,以其鳞片为外植体,采用正交试验设计,研究了蔗糖、噻苯隆(TDZ)、烯效唑(S3307)、二氯苯氧乙酸(2,4-D)等因素对试管小鳞茎形成的影响,结果表明:诱导香水百合试管小鳞茎形成的最优培养基是MS+1.5 mg/L TDZ+2mg/L S3307+0.2mg/L 2,4-D+60 g/L蔗糖;添加一定浓度的PP333可以促进小鳞茎的增殖生长,适宜试管鳞茎增殖的培养基为MS+10mg/L PP333。
香水百合;鳞茎;组织培养;正交试验设计
香水百合(Lilium casablanca)为百合科百合属东方百合(Lilium oriental)杂交种系,其花朵头较大,花色秀丽,气味芬芳宜人,一直深受消费者的青睐。百合传统的繁殖方法是靠鳞茎分株方式进行繁殖,种球易受病毒侵染而致品质下降。应用植物组织培养快速繁殖技术为百合脱毒种苗的大规模工厂化生产提供了一条有效途径[1]。百合鳞片离体培养中有试管内结小鳞茎现象,已有一些研究探讨了试管鳞茎形成机理和影响因素[2-5],但其结果因品种和培养条件不同而有所差异[6-7]。关于香水百合的组织培养再生体系已有些研究报道[8-10],影响百合试管鳞茎形成的主要因素有外植体种类、基本培养基、蔗糖浓度和植物生长调节剂种类及配比等。正交试验设计法是一种多因素的试验设计法,可研究多个因素对指标的效应,分析出各因素对指标的影响程度,以实现工艺的优化。在前人工作基础上,应用正交试验设计法研究蔗糖、噻苯隆(TDZ)、烯效唑(S3307)、二氯苯氧乙酸(2,4-D)等因素对试管小鳞茎形成的影响,初步筛选和优化适宜香水百合试管鳞茎形成的培养基,为实现香水百合试管种球快速繁殖提供参考。
1 材料与方法
1.1 供试材料
市售健壮饱满的香水百合(Lilium casablanca)鳞茎,取其鳞片中层部位为外植体。
1.2 试剂
6-苄氨基嘌呤(6-BA)、α-萘乙酸(NAA)、二氯苯氧乙酸(2,4-D)、噻苯隆(TDZ)、烯效唑(S3307)、多效唑(PP333)、70%酒精,0.1%升汞、无菌水等。以上植物生长调节剂均为分析纯级试剂。
1.3 方法
外植体预处理:将香水百合种球的鳞片掰开,先用流水冲洗1 h,然后用0.1%KMnO4溶液浸泡10min,再用流水冲洗,直到KMnO4的颜色完全被冲洗掉。
外植体灭菌与接种:在超净台无菌条件下,外植体用70%的酒精浸泡30 s,用无菌水冲洗2次,然后用0.1%升汞浸泡10min,再用无菌水冲洗4~5次,取中部鳞片切成1 cm×1 cm大小后,接种于不同培养基中。
试管小鳞茎的诱导培养:以MS+0.1mg/L NAA+ 0.8%琼脂(pH=5.8)为基本培养基,选取蔗糖、TDZ、S3307、2,4-D 4种因素处理,每种因素取4个水平(表1),采用L16(45)正交设计表(表2),共16组处理,考察蔗糖浓度和3种植物生长调节剂对香水百合愈伤组织诱导的影响。每种处理接种20瓶,每瓶接种外植体3~4块。接种后先进行暗培养10 d,后置培养室光下培养,光照强度为1 500~2 000 lx,14 h/d,培养温度(25+2)°C。每隔10 d观察外植体变化并记录,60 d后统计各处理每块外植体形成的小鳞茎数,其中平均小鳞茎数=目测形态正常的小鳞茎数/接种外植体数。
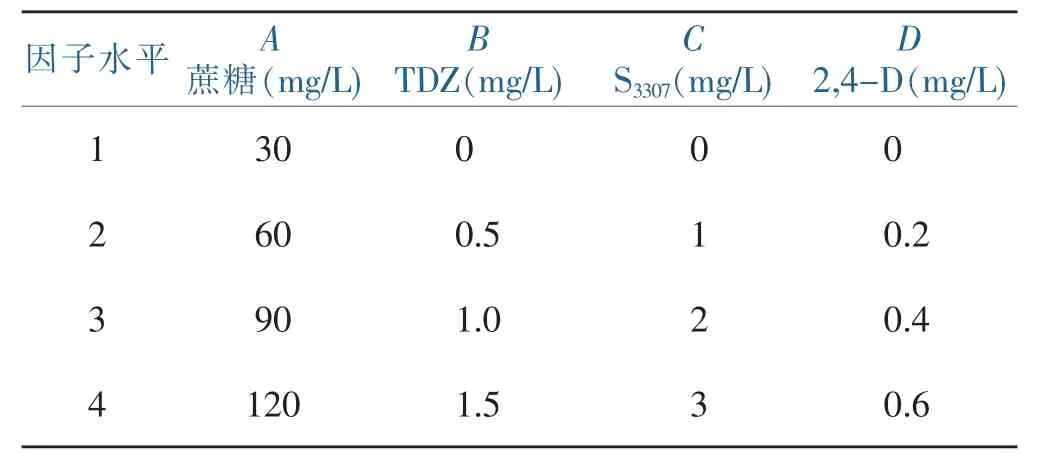
表1 因素水平表Table 1 Factors and levels

表2 正交试验设计表Table 2 Orthogonal experimental design
试管小鳞茎增殖培养:将诱导形成的试管小鳞茎分割为小块,接种于添加不同浓度PP333的培养基上(表3),以考察PP333对香水百合试管鳞茎增殖的影响。每种培养基均添加蔗糖60 g/L,琼脂浓度为8 g/L(pH=5.8)。每种培养基接种10瓶,每瓶接3~4块外植体,光照培养,培养条件同上述试管鳞茎的诱导培养。30天后统计增殖系数,其中增殖系数=(增殖形成的小鳞茎数/接种数)×100%。

表3 小鳞茎增殖培养基配方Table 3 Media for lily bulblet propagation
2 结果与分析
2.1 香水百合试管小鳞茎诱导的优化
通过正交试验设计,考察了不同浓度TDZ、S3307、2,4-D和蔗糖配比处理对香水百合试管小鳞茎形成的影响,正交试验结果如表4。4个因素对试管小鳞茎的形成有不同程度的影响,各因素不同水平之间的影响大小也存在差异。由表5中极差分析结果可知,蔗糖浓度对诱导香水百合试管小鳞茎形成的影响最大,4个因素对试管小鳞茎形成的影响大小顺序为:蔗糖〉2,4-D〉S3307〉TDZ。根据k值大小,初步筛选到适宜香水百合试管小鳞茎诱导形成的最佳培养基配方,即MS+0.1 mg/L NAA+0.2 mg/L 2,4-D+2 mg/L SS3307+ 1.5mg/L TDZ+60 g/L蔗糖+0.8%琼脂(pH=5.8)。在此培养基中(8号处理),平均每个外植体可产生6.25个小鳞茎(见图1、图2)。
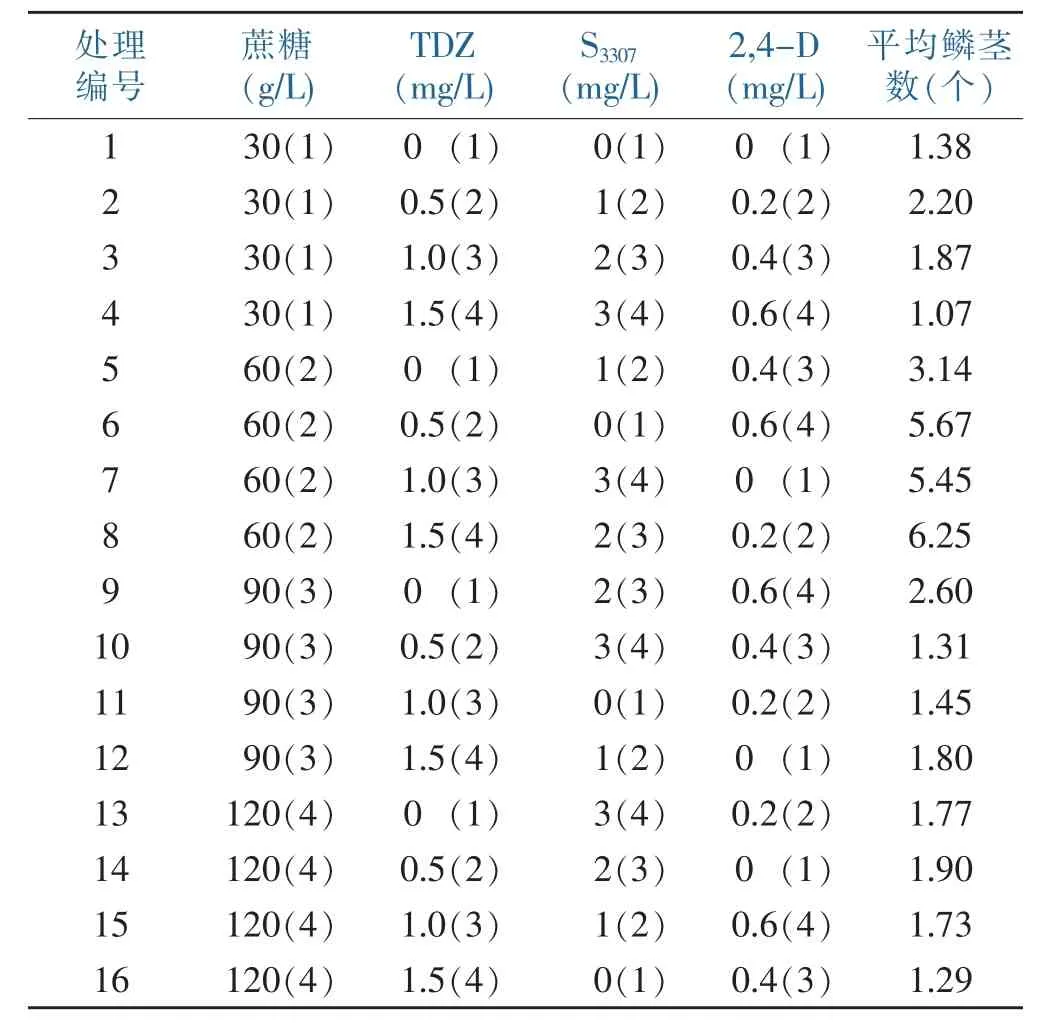
表4 正交试验结果Table 4 The results of the orthogonal experiment
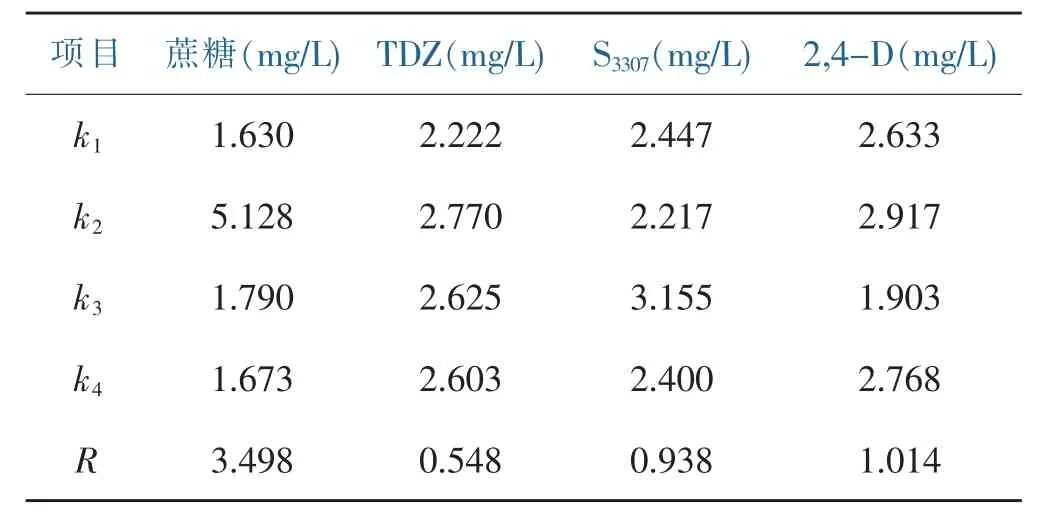
表5 极差分析结果Table 5 The results of range analysis

图1 示香水百合鳞片上形成的小鳞茎Figure 1 The bulblet forming on lily scales

图2 最优培养基中形成密集的试管小鳞茎Figure 2 Intensive test-tube bulbs forming in the optimal culturemedium
2.2 香水百合试管小鳞茎增殖培养
分析不同浓度PP333对香水百合试管小鳞茎增殖影响(表6),试验结果表明,培养基中添加一定浓度PP333可以促进试管小鳞茎的增殖,PP333的溶度为10 mg/L时增殖率最高,增殖系数达5.65,但溶度为15 mg/L时,增殖系数较对照处理(培养基编号1)的小,说明PP333溶度过高会抑制小鳞茎的分化。
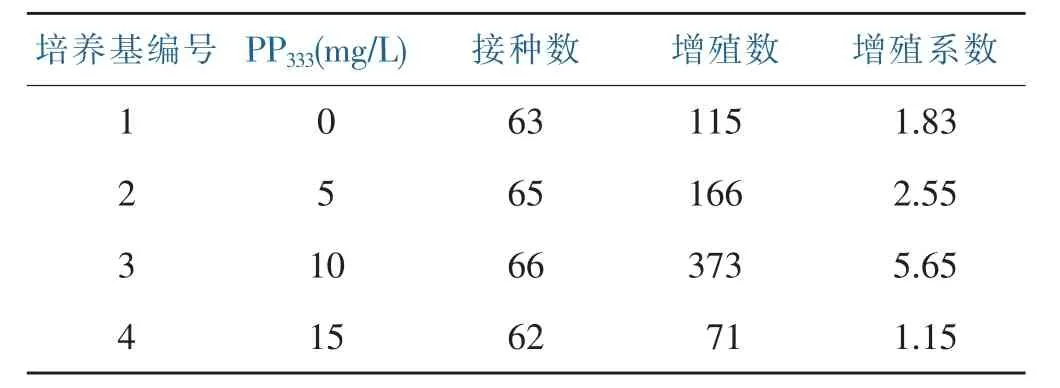
表6 不同浓度PP333对香水百合小鳞茎增殖影响Table 6 Effects of different concentration of PP333on lily bulblet propagation

图3 小鳞茎切块刚接入增殖培养基情况Figure3 Showing thesinglebulbletinoculated on culturemedium
图1至图6示在诱导培养基中形成的丛生小鳞茎被切割单离后可在增殖培养基中继代增殖,继续培养可分化出形态正常的叶和根,进而形成完整的试管苗。

图4 示增殖培养基3中小鳞茎增殖情况Figure 4 The propagation of bulbleton themedium No.3

图5 示小鳞茎上分化出叶Figure 5 Showing the leaf differentiation on bulblets

图6 示由小鳞茎发育形成的试管苗Figure 6 Plantlets formation via bulblets
3 讨论与结论
在百合的组织培养中,其花器官、叶片、茎段、芽尖、珠芽、鳞片和种子等器官均可作为外植体建立植株再生体系,但是以鳞片为外植体,通过诱导形成试管小鳞茎的研究最为广泛[11]。影响试管鳞茎形成的因素很多,一些研究表明鳞片的部位、低温处理、培养条件、基本培养基种类、蔗糖浓度和植物生长调节剂种类、浓度配比等因子都对试管鳞茎的诱导和增殖有显著影响[12-13]。培养基中添加的植物生长调节剂成分、浓度和不同配比对百合小鳞茎增殖起关键作用,应用的植物生长调节剂主要有6-BA、KT、NAA、ZT、2,4-D、IAA、IBA等[14]。
蔗糖是培养基中的重要组成部分,主要起提供能源物质和调节渗透压的作用。陈彦云等[15]研究表明,2%的蔗糖浓度时玻璃化苗多,不利于分化,浓度为3.5%蔗糖适宜麝香百合鳞片芽的诱导,浓度为6.5%蔗糖适宜于继代培养,促进试管鳞茎的生长。TDZ具有细胞生长素和细胞分类素这双重活性,TDZ在亚洲百合试管苗叶片分化、东方百合生长点的愈伤组织诱导、宜昌百合体胚诱导体系中,均有统计学意义[16-17]。付文奇等[7]研究表明,MS培养基中添加一定浓度2,4-D对诱导东方百合叶片形成愈伤组织有高度统计学意义。张彦妮等[18]在研究毛百合试管鳞茎形成和膨大的培养中,发现低浓度多效唑(PP333)显著促进小鳞茎膨大生长,并有利于诱导生根及试管苗生长。多效唑和烯效唑均是三唑类植物生长延缓剂,作用机制相似,但烯效唑的活性比多效唑高[19]。
基于上述分析,本研究选择蔗糖、TDZ、S3307、2,4-D这4种因素,通过正交试验设计,筛选出对香水百合试管鳞茎形成培养的最优浓度组合,即MS+0.1mg/L NAA+0.2 mg/L 2,4-D+2 mg/L S3307+1.5 mg/L TDZ+ 60 g/L蔗糖+0.8%琼脂(pH 5.8),4个因素中蔗糖浓度对试管小鳞茎形成的影响最大,与前人的研究结果相似。试管小鳞茎增殖培养结果表明,在一定的范围中,PP333可以显著促进小鳞茎增殖,PP333的溶度为10 mg/L时增殖率最高。
[1]徐品三,刘华夏.无病毒百合组培种球快速繁殖体系的建立[J].中国农学通报,2009,25(9):174-178.
[2]张洁,蔡宣梅,林真,等.百合试管鳞茎诱导及膨大技术的研究[J].福建农业学报,2010,25(3):328-331.
[3]傅玉兰,何风群.影响百合试管鳞茎增殖因素的研究[J].安徽农业大学学报,2001,28(2):179-181.
[4]朱志国.影响百合试管鳞茎增殖因素的研究[J].热带作物学报,2013,34(10):1961-1965.
[5]王爱勤,周歧伟,何龙飞,等.百合试管结鳞茎的研究[J].广西农业大学学报,1998,17(1):71-75.
[6]郑一强,孙红梅.东方百合试管鳞茎形成条件优化[J].中国农学通报,2011,27(6):90-94.
[7]付文奇,杜双田,陈建科,等.NAA和2,4-D对东方百合组织培养的影响[J].西北林学院学报,2008,23(2):83-86.
[8]阮少宁,杨华,梁一池,等.香水百合组织培养的试验研究[J].福建林学院学报,2001,21(2):142-145.
[9]李冰华,金晓玲,刘雪梅.香水百合鳞片组织培养再生体系的建立[J].江苏农业科学,2008(4):83-85.
[10]苏琛.香水百合再生体系的建立[J].安徽农业科学,2012, 40(7):3906-3907.
[11]蒋细旺,司怀军.百合的组织培养技术综述[J].湖北农业科学,2004(1):78-82.
[12]潘佑找,柯尊涛,赵宇瑛.不同外植体对兰州百合组织培养的影响[J].安徽农学通报,2007,13(19):242-245.
[13]周玲云,高素萍,陈锋.蔗糖和光周期在泸定百合试管鳞茎膨大中的作用机制[J].2016,42(4):435-441.
[14]李筱帆,张启翔.百合组织培养和植株再生的研究进展[J].安徽农业科学,2009,37(4):1479-1482.
[15]陈彦云.麝香百合组培快速繁殖技术研究[J].宁夏大学学报(自然科学版),2001,22(1):67-69.
[16]张艺萍,吴丽芳,吴学尉,等.东方百合胚性愈伤组织诱导和植株再生研究[J].江西农业学报,2008(12):33-36.
[17]孙安妮,张延龙,牛立新,等.宜昌百合体细胞胚诱导及植株再生[J].西北农业学报,2011(8):142-146.
[18]张彦妮,李兆婷,张艳波,等.毛百合试管鳞茎形成和膨大的培养优化[J].江苏农业科学,2016,44(4):74-78.
[19]李宁毅,刘冰.植物生长延缓剂S-3307对百合生长发育和内源激素的影响及相关性分析[J].西北农业学报,2010,19 (5):153-156.
(责任编辑:叶丽娜)
Culture Condition Optim ization of Test Tube-bulb Formation and Propagation of Lilium casablanca
YANG Lusheng,CHEN Xiaoming,QIHui,LIJuan,LIGuoping
(School of Ecology and Resource Engineering,Wuyi University,Wuyishan,Fujian 354300)
To find out optimizing culture conditions for test-bulb formation and propagation of Lilium casablanca,the effects of TDZ, S3307,2,4-D and sucrose in different concentration on the test-tube bulb induction and formation were studied with orthogonal test design, taking lily scales as explants.The results showed that the optimal culturemedium for bulblet induction was MS+1.5 mg/L TDZ+2 mg/L S3307+0.2 mg/L 2,4-D+60 g/L sugar.A certain concentration of PP333added in MSmedium promoted the growth and proliferation of lily bulblets,and the optimalmedium for bulblet propagation was MS+10mg/L PP333.
Lilium casablanca;bulb;tissue culture;orthogonal design
S 723.132
A
1674-2109(2017)03-0001-05
2016-09-27
福建省科技创新平台建设计划项目(2013N2009);福建省科技厅战略性新兴产业重点项目(2014N0030);国家级大学生创新创业训练计划(201410397006、201610397006)。
杨鹭生(1964-),女,汉族,高级实验师,主要从事生物资源开发与利用研究。
通迅作者:李国平(1966-),男,汉族,教授,主要从事植物种质资源与开发利用研究。
