自发性糖尿病长爪沙鼠环氧化酶(COX)-2在三种组织中的表达
2017-05-05王菲菲龚菁菁霍学云李长龙杜小燕陈振文吕建祎
王菲菲, 龚菁菁, 霍学云, 路 静, 郭 萌, 刘 欣, 李长龙, 杜小燕, 陈振文, 吕建祎
(首都医科大学基础医学院, 北京, 100069)
自发性糖尿病长爪沙鼠环氧化酶(COX)-2在三种组织中的表达
王菲菲, 龚菁菁, 霍学云, 路 静, 郭 萌, 刘 欣, 李长龙, 杜小燕, 陈振文, 吕建祎
(首都医科大学基础医学院, 北京, 100069)
目的 研究环氧化酶(COX)-2基因在糖尿病长爪沙鼠3种组织中的表达水平,进一步探索其与长爪沙鼠糖尿病发生和发展的关系。方法 选取糖尿病长爪沙鼠和正常沙鼠各6只,分别采集动物的骨骼肌、肝脏和肾脏组织,用实时PCR和Western blotting检测COX-2基因在各组织中mRNA和蛋白表达水平。 结果 实时PCR的结果表明,COX-2基因的mRNA水平在糖尿病组动物的骨骼肌组织中表达与对照组无明显差异,而肝脏和肾脏组织中有表达升高趋势。Western blotting结果显示,糖尿病组COX-2的蛋白水平在肝脏和肾脏组织中存在表达升高趋势,且肾脏具有统计学意义。结论 COX-2在糖尿病长爪沙鼠肝脏和肾脏组织中表达升高,在肾脏组织尤其明显,说明COX-2对长爪沙鼠糖尿病的影响可能发生在肝脏和肾脏组织中。
长爪沙鼠; II型糖尿病; COX-2; 实时PCR; Western blotting
糖尿病(Diabetes mellitus,DM)是因胰岛素分泌和/或作用缺陷引起的以高血糖为主要特征的全身代谢性疾病,同时也是一种慢性、低度的炎症性疾病,容易引发和参与一系列的代谢紊乱,导致各种并发症的发生,成为继心血管疾病和肿瘤之后的第三大严重危害人类健康的慢性终身疾病[1]。随着人们饮食结构和生活方式的改变,糖尿病的发病率呈逐渐上升的趋势。我国成人糖尿病患病率平均为11.6 %, 患病人数已达到1.14亿[2]。糖尿病主要分为1型和2型糖尿病,其中2型糖尿病(T2DM)患者占90 %以上[3]。2型糖尿病是多种因素共同作用的复杂遗传病,以胰岛素抵抗和/或胰岛素分泌不足为主要特征[4]。
环氧化酶(Cyclooxygenase ,COX)又称前列腺素G/H 合成酶, 是花生四烯酸转化为前列腺素(GP)的催化酶。哺乳动物的COX有两种形式: COX-1和COX-2。COX-1结构性表达于大多数细胞内, 参与维持正常的生理功能[5]。COX-2是一个重要的诱导酶,在细胞受到各种刺激时迅速合成,参与多种病理生理过程。COX-2的主要产物前列腺素具有诱导炎性反应、促进细胞增殖、抑制免疫反应、促进血管生成等多种生物学活性。在人体内COX-2局部表达增加与很多疾病状态有关。COX-2过度表达能增加血管通透性,促进单核细胞黏附,产生炎性细胞因子,诱导巨噬细胞趋化,激活基质金属蛋白酶,活化白细胞和血小板[6]。在胰岛β细胞中,COX-2的表达高于COX-1,能降低人体对胰岛素的敏感性[7]。近年来,许多研究表明[8]COX-2基因的高水平表达不仅与炎症密切相关,而且还与恶性肿瘤和糖尿病的发生关系密切。COX-2的主要代谢产物前列腺素E2具有抑制胰岛β细胞分泌胰岛素的功能,因此认为COX-2是影响1、2型糖尿病胰岛β细胞功能紊乱的关键性因子[9,10]。
本文通过研究COX-2在糖尿病沙鼠和正常沙鼠的骨骼肌、肝脏和肾脏组织中mRNA和蛋白水平的表达情况,为长爪沙鼠糖尿病模型的发生机制研究提供依据。
1 材料与方法
1.1 实验动物
清洁级近交系糖尿病模型长爪沙鼠和正常长爪沙鼠,选自首都医科大学实验动物部自行培育的近交系糖尿病模型长爪沙鼠培育16代群体和普通长爪沙鼠群体各6只, 12~15周龄, 体质量69.56~96.42 g,雌雄各半,饲养于控制温湿度的普通环境中[SYXK (京)2013-0005]。
1.2 样品采集
采用戊巴比妥(100 mg/kg)腹腔注射麻醉动物,脱颈椎方法施行安死术后, 解剖采集新鲜组织骨骼肌、肝脏和肾脏组织后立即置于液氮中。
1.3 仪器和试剂
研磨珠均质器(BioSpec,美国); 低温高速离心机(Eppendorf Centrifuge 5430R, Eppendorf, 德国); Nanodrop 2000c(Thermo scientific, 美国); Bio-Rad CFX96 manager System (Bio-Rad, 美国); PCR仪(Applied Biosystems, 美国); 电泳仪(Bio-Rad, 美国);电转仪(Bio-Rad, 美国); TRIzol®试剂Invitrogen,美国); 氯仿、无水乙醇、异丙醇(北京畅力通科技有限公司, 北京); 快速反转录试剂盒(Fast Quant RT Kit,天根生化科技有限公司, 北京); 实时定量PCR试剂盒(SuperReal PreMix Plus,SYBR Green,天根生化科技有限公司, 北京); 组织蛋白提取试剂盒(康为世纪生物科技有限公司,北京); 二喹啉甲酸(Bicinchoninic Acid,BCA)蛋白定量试剂盒(康为世纪生物科技有限公司,北京); 凝胶图像分析系统(Bio-Rad,美国); COX-2抗体(Abcam,英国)。
1.4 RNA提取及cDNA的制备
从液氮中取出冻存的长爪沙鼠3种组织约30 mg,剪碎后用均质器将组织彻底打碎,分别加入1 mL TRIzol®试剂,混匀于室温放置1 min,然后加入200 μL氯仿,震荡混匀后,在冰上放置15 min,4 ℃ 20 817 × g 离心15 min, 取上层清液于1.5 mL离心管中, 加入500 μL异丙醇, 振摇混匀后在冰上静置10 min, 4 ℃ 20 817×g 离心15 min, 弃上清。加入体积分数75%乙醇, 将离心管底部沉淀吹起, 4 ℃ 15 294 ×g离心10 min, 弃上清。重复以上步骤1次。室温晾干, 根据组织大小加入适量不含RNA酶的水溶解得到总RNA。采用Nanodrop 2000 c检测RNA浓度。cDNA的制备按照快速反转录试剂盒对上述总RNA样品进行逆转录, 得到相应的cDNA。
1.5 实时PCR
利用 Primer Premier 5.0 设计PCR扩增引物。除肌肉选取GAPDH基因作为内参外,其他组织选取β-actin基因作为内参基因并设计引物。GAPDH基因引物序列F: 5'-GCCATCAATGACCCC-3'; R: 5'-TCCCGTTCTCAGCCT-3',β-actin基因引物序列F: 5'-AGAGGGAAATCGTGCGTGAC-3'; R: 5'-CAATAGTGATGACCTGGCCGT-3',COX-2基因引物序列F: 5' GACGACTAAACCAAGCC-3'; R: 5'-GGAATTATTTCTAGGACGAT-3'引物均由北京天一辉远生物科技有限公司合成。
采用实时PCR法在Bio-Rad CFX96 manager System上对COX-2和内参基因的mRNA水平进行检测。所用试剂为实时定量PCR试剂盒,反应体系为20 μL体系。反应条件如下: Q-PCR Master Mix 10 μL, 上游引物0.6 μL,下游引物0.6 μL,模板DNA 1 μL,ddH2O 7.8 μL。反应程序均为: 95 ℃预变性5 min,之后94 ℃ 30 s,58 ℃ 35 s,共扩增30个循环,每个循环结束时检测荧光; 熔解曲线分析从48℃到63℃,每0.5℃检测一次。
1.6 Western blotting
将新鲜的长爪沙鼠骨骼肌、肝脏、肾脏组织,充分剪碎后用组织蛋白提取试剂盒提取总蛋白,用二喹啉甲酸(BCA)蛋白定量试剂盒对蛋白进行定量。取30 μg总蛋白进行SDS-PAGE凝胶电泳分离,通过半干转方式15 V 22 min将蛋白转至NC膜。以Tris-HCl 缓冲液(25 mmol/L Tris,0.15 mol/L NaCL, pH 7.2)室温封闭1~2 h。将膜与COX-2抗体(1∶1 000稀释)4 ℃孵育过夜, TBST洗3次, 与二抗(辣根过氧化酶联的抗兔血清用含0.5%脱脂牛奶TBST按照1∶5 000稀释)室温孵育1~2 h, TBST洗膜后用化学发光法显色。骨骼肌、肝脏和肾脏做免疫印迹时内参基因选用GAPDH作为内参。最后用凝胶图像分析系统扫描蛋白质印迹条带灰度。
1.7 统计学处理
所有数据均采用SPSS 16.0软件进行统计分析,以P<0.05差异有统计学意义。
2 结果
2.1 不同组织的COX-2 mRNA表达水平
COX-2是糖尿病长爪沙鼠骨骼肌抑制消减杂交筛选出的一个重要基因,它在不同组织中mRNA的表达水平各不相同(图1)。实验表明在骨骼肌组织中两组间mRNA表达水平基本相同。在肝脏组织和肾脏组织中,COX-2在糖尿病组mRNA表达水平略高于对照组,但没有统计学意义。
2.2 不同组织的COX-2蛋白表达水平
在糖尿病动物肾脏组织中COX-2蛋白表达显著高于对照组(P<0.05), 与实时PCR的结果一致。在糖尿病动物肝脏组织中COX-2蛋白表达略高于对照组, 但无统计学意义。在骨骼肌组织中, COX-2蛋白总体表达没有明显差异(图2)。
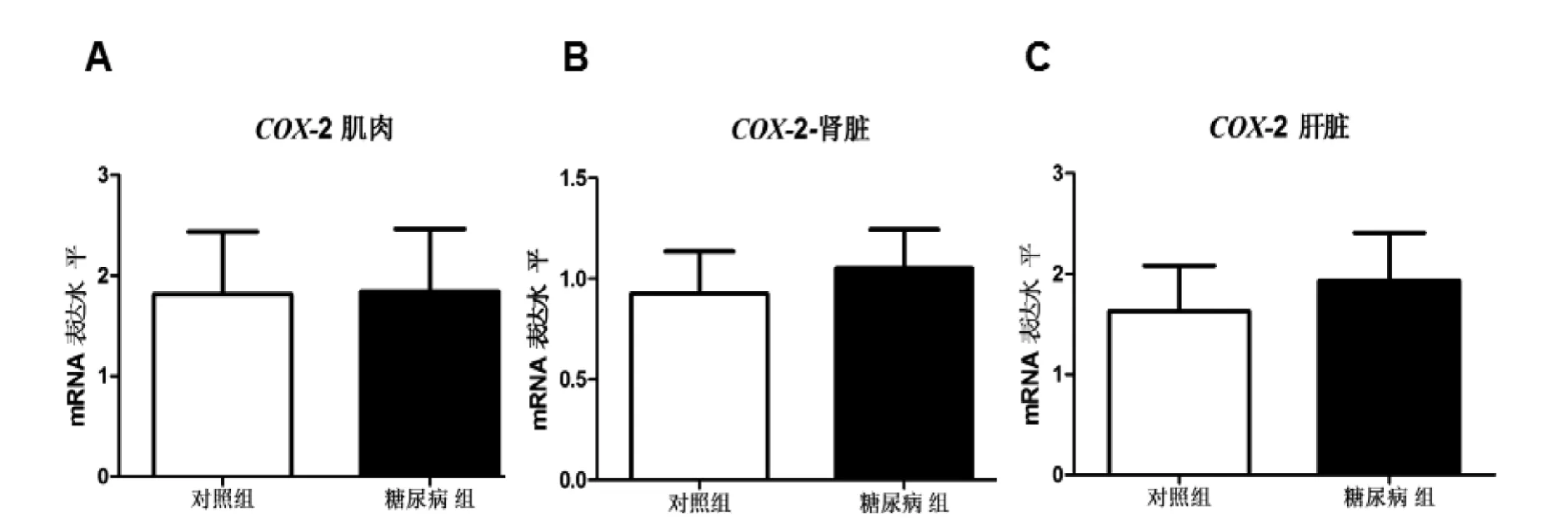
图 1 COX-2在长爪沙鼠不同组织中mRNA的表达情况Figure 1 The mRNA expression level of COX-2 in different tissues from diabetic and control gerbils
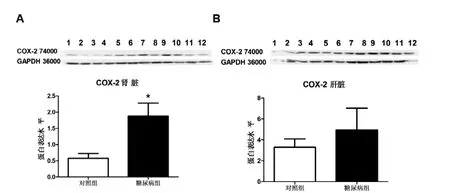
图 2 长爪沙鼠不同组织中COX-2 蛋白的表达情况Figure 2 Protein expression level of COX-2 in different tissues from diabetic and control gerbils
3 讨论
糖尿病是当前威胁全球人类健康最重要的非传染性疾病之一[11],可以由多种病因引起的。其中II型糖尿病是由遗传因素和环境因素共同作用导致的复杂遗传病[12-14],以葡萄糖耐量降低、胰岛素抵抗和胰岛素分泌不足为主要特征[15]。深入研究胰岛素抵抗,对于治疗和防治II型糖尿病具有重要意义。最近几年, 已有多种自发性糖尿病模型被开发使用[16],越来越多自发性糖尿病动物模型能够模拟各种人类糖尿病的症状,成为研究糖尿病遗传相关分子机制的关键载体[17]。本研究前期经过定向近交逐步培育成了一些生化指标和病理组织形态均符合糖尿病标准的长爪沙鼠自发性糖尿病模型群体。通过抑制消减杂交(suppression subtractive hybridization, SSH)的方法从同窝的高血糖和正常血糖长爪沙鼠骨骼肌中发现环氧化酶(COX)-2差异表达,但是糖尿病动物其他组织的表达情况还不清楚。本文研究COX-2在糖尿病沙鼠和正常沙鼠不同组织中mRNA和蛋白水平的表达情况。
胰岛素抵抗(或)胰岛素分泌不足会引起一些外周组织和器官代谢功能的紊乱,易引起并发症的发生。骨骼肌是最大的葡萄糖吸收和脂肪酸氧化的器官,在胰岛素的作用下吸收人体大部分的血糖以进行肌肉的有氧和无氧呼吸。血糖浓度过高(或低), 肝脏通过合成肝糖原(或肝糖原分解、糖异生)途径参与糖代谢并对机体血糖的储存和分布进行调节[18]。持续的高血糖状态会引起慢性并发症的发生,其中微血管病变是糖尿病特异性的并发症,表现为循环障碍和微血管基底膜的增厚,微血管病变可累及全身各组织器官,其中以糖尿病肾病最重要。肾脏中糖尿病相关的血糖紊乱、微血管病变可致慢性肾功能不全、蛋白尿以及肾小球病变[19-21]。因此,作者选取骨骼肌、肝脏和肾脏组织作为糖尿病疾病作用的靶组织,研究COX-2在各组织的表达情况。
本实验中,检测了COX-2在不同组织中的表达水平。实时PCR和Western blotting结果均显示,在肝脏和肾脏组织中,该基因在糖尿病组的mRNA表达量和蛋白水平较对照组有升高趋势,且肾脏组织蛋白表达存在明显差异。但在骨骼肌组织中糖尿病组mRNA和蛋白表达量与对照组无明显差异。COX-2是在糖尿病动物骨骼肌组织中经SSH筛选出来的基因,本研究中肝脏和肾脏结果与SSH结果一致,证明了SSH结果的可靠性,也首次阐释COX-2基因在糖尿病动物肌肉组织表达不明显。这些结果说明肝脏和肾脏可能是COX-2基因作用的靶器官,与长爪沙鼠糖尿病的发生和发展相关。
总之,本文结果表明在长爪沙鼠糖尿病模型中, COX-2可能与糖尿病的发生发展有关, 特别是在肝脏和肾脏组织中。这为研究糖尿病及其相关的分子调控机制以及模型动物的推广应用奠定了基础, 为进一步深入研究Ⅱ型糖尿病的防治提供新的思路。参考文献:
[1] 姜振伟, 唐红梅. 糖化血红蛋白和血清胱抑素C联合检测在糖尿病早期肾损伤中的应用价值[J]. 国际检验医学杂志, 2012, 33(3):759-760.
[2] American Diabetes Association. Diagnosis and classification of diabetes mellitus[J]. Diabetes Care, 2012, 27(Suppl 1):S5-S10.
[3] 赵永梅, 李敬华, 李贺. 外源性胰岛素对2型糖尿病内皮功能影响的研究进展[J]. 现代中西医结合杂志, 2016, (4): 448-450.
[4] Ashcroft FM, Rorsman P. Diabetes mellitus and the β-cell: the last ten years[J]. Cell, 2012, 148(6):1160-1171.
[5] 赵家俭. 环氧化酶-2与1型糖尿病[J]. 国外医学: 内分泌学分册, 2003, 23(5):297-299.
[6] Sjholm A, Nystrm T. Endothelial in flammation in insulin resistance[J].Lancet, 2005, 365(9459):610-612.
[7] BeloquiO, Paramo JA, Orbe J, etal. Monocyte cyclooxygenase-2 overactivity: a new marker of subclinical atheroscleros is in asymptomatic subjects with cardiovascular risk factors[J]. Eur Heart J, 2005, 26 (2):153-158.
[8] 李玲, 吴开春, 樊代明.环氧化酶-2与肿瘤[J]. 陕西肿瘤医学, 2000, 8(2):116-118.
[9] Robertson RP. Dominance of cyclooxygenase-2 in the regulation of pancreatic islet prostaglandin synthesis[J]. Diabetes, 1998, 47(9):1379-1383.
[10] LuoC, KallajokiM, Gross R, et al. Cellular distribution and contribution of cyclooxygense-2 to diabetogenesis in NOD mouse[J].Cell Tissuse Res, 2002, 310(2):169-175.
[11] 中华医学会糖尿病学分会. 中国2型糖尿病防治指南(2013年版)[J]中华糖尿病杂志, 2014, 22(7):447-498.
[12] 王敏. 糖尿病发病机制的研究进展[J]. 铜陵职业技术学院学报, 2016, 15(1):44-47.
[13] 徐春. 器官移植术后糖尿病的发病机制与防治措施[J].武警医学, 2014, 25(8):757-760.
[14] 肖遥, 武英, 赵丹丹, 等. 高血压合并糖尿病发病机制研究进展[J].医学信息, 2013, 5(14):617.
[15] 谢平, 黄坚. 2型糖尿病危险因素的研究进展[J]. 应用预防医学, 2016, 22(1):88-91.
[16] 李聪然, 游雪甫, 蒋建东. 糖尿病动物模型及研究进展[J].中国比较医学杂志, 2005, 15(1):59-63.
[17] 赵玉琼. 糖尿病动物模型[J]. 实验动物科学, 2012, 29(2): 53-57.
[18] Jin W, Patti ME. Genetic determinants and molecular pathways in the pathogenesis of Type 2 diabetes[J]. Clin Sci (Lond), 2009, 116(2):99-111.
[19] 廖群, 陈芳华. 尿蛋白、微量白蛋白及尿蛋白电泳联合检测诊断糖尿病早期肾损害[J]. 中国实验诊断学, 2011, 15(11):1944-1945.
[20] 谢席胜, 艾娜, 王宝福, 等. 糖尿病肾病流行病学研究进展[J]. 中国中西医结合肾病杂志, 2013, 14(10):937-940.
[21] 李丽晶, 刘国平, 于磊. SGLT2抑制剂治疗2型糖尿病的研究进展[J]. 中国中西医结合肾病杂志, 2016, 17(1):82-85.
Analysis on Cyclooxygenase 2 Expression in Different Tissues from Spontaneous Diabetic Mongolian Gerbils
WANG Fei-fei, GONG Jing-jing, HUO Xue-yun, LU-jing, GUO-Meng, LIU-Xin, LI Chang-long, DU Xiao-yan, CHEN Zhen-wen, LV Jian-yi
(School of Basic Medical Science, Capital Medical University, Beijing 100069, China)
ObjectiveTo analyze Cyclooxygenase 2(COX-2) expression level in different tissues of diabetic gerbils and to explore the relationship of diabetes occurrence and development in Mongolian gerbils.MethodsDifferent tissues including skeletal muscle, liver and kidney were collected from 6 diabetic gerbils and 6 control animals respectively. COX-2 mRNA and protein expression level in different tissues were separately detected by Real-time PCR and Western blotting.ResultsThe Real-time PCR showed that compared with control animal, the mRNA expression of COX-2 in skeletal muscle had no obvious difference whereas it exhibited uptrend in liver and kidney. As the results of Western blotting, the difference of COX-2 in skeletal muscle was almost undetectable in diabetes group. The relative expression level in diabetic group exhibited uptrend compared with control in liver and kidney. And there was statistical significance in the kidney.Conclusions COX-2 was high expressed in liver and more remarkably in kidney of diabetic gerbils. It may illustrate that the effect of COX-2 mainly occurred in liver and kidney of diabetic gerbils.
Mongolian gerbils; Type 2 diabetes; Cyclooxygenase 2 (cox-2); Real-time PCR; Western blotting
Q95-33
A
1674-5817(2017)02-0118-05
10.3969/j.issn.1674-5817.2017.02.007
2016-09-30
国家科技支撑计划(No. 2015BAI09B01); 国家自然科学基金 (Nos. 31272393 and 31402027); 北京市自然科学基金(No. 7141002)
王菲菲(1992-), 女, 硕士研究生, 专业: 遗传学。E-mail: wff23967321@163.com
吕建祎(1976-), 女, 博士, 讲师。研究方向:遗传学。E-mail: susanvalid@aliyun.com
