妊娠晚期甲状腺功能减退对母体血糖、血脂水平影响及母婴预后分析
2017-05-03黄贤恩陈良苗
黄贤恩,陈良苗,陈 翔
(1.温州医科大学附属第三医院内分泌科;2.产科,浙江 温州 325200)
妊娠晚期甲状腺功能减退对母体血糖、血脂水平影响及母婴预后分析
黄贤恩1,陈良苗1,陈 翔2
(1.温州医科大学附属第三医院内分泌科;2.产科,浙江 温州 325200)
目的 探讨妊娠晚期甲状腺功能减退对妊娠期孕妇血糖、血脂水平及对母婴不良结局的影响。方法 筛选2014年4月至2015年10月在温州医科大学附属第三医院产科就诊符合要求的妊娠晚期孕妇160例,其中甲状腺功能减退孕妇80例,包括临床甲状腺功能减退孕妇35例(临床甲减组)和亚临床甲状腺功能减退孕妇45例(亚临床甲减组),甲状腺功能正常孕妇80例(对照组)。对所有研究对象行血液生化检查,检测甲状腺功能指标(TSH、FT4、FT3)、血糖(空腹血糖、餐后1h、2h血糖)、血脂(TC、TG、HDL-C及LDL-C)及妊娠结局(妊娠期高血压、糖尿病、羊水量异常、产后出血、胎儿生长受限、胎儿窘迫及新生儿窒息等)。结果 80例妊娠晚期孕妇中,亚临床甲减组和临床甲减组孕妇所占比例分别为56.25%和43.75%,且妊娠晚期甲减(亚临床甲减组及临床甲减组)孕妇的TSH水平高于对照组,FT4、FT3水平低于对照组;血糖水平比较,临床甲减组的空腹血糖、餐后1h、2h血糖水平均显著高于亚临床甲减组,显著高于对照组,差异有统计学意义(t=2.289~5.776 ,均P<0.05),亚临床甲减组显著高于对照组,差异有统计学意义(t值分别为3.071、7.049、3.115,均P<0.05);血脂水平比较,亚临床甲减组与临床甲减组的TC、TG及LDL-C水平均显著高于对照组,差异有统计学意义(t=4.015~7.962, 均P<0.05),且临床甲减组显著高于亚临床甲减组,差异有统计学意义(t值分别为2.015、2.006、2.509,均P<0.05),三组的HDL-C水平比较,差异有统计学意义(t值分别为0.568、0.712、0.279,均P>0.05)。不良妊娠结局比较,亚临床甲减组的妊娠高血压及妊娠糖尿病的发生率显著高于对照组,差异具统计学意义(χ2值分别为6.438、5.207,均P<0.05),临床甲减组妊娠高血压、妊娠糖尿病、胎儿生长受限及新生儿窒息的发生率均显著高于对照组,差异有统计学意义(χ2值分别为13.455、12.121、6.737、6.186,均P<0.05),三组的羊水量异常、产后出血和胎儿窘迫等的发生率比较,差异均无统计学意义(χ2=0.000~3.046,均P>0.05)。结论 妊娠晚期甲状腺功能减退可引发孕妇血糖及血脂代谢紊乱,增加不良母婴妊娠结局的发生率。
妊娠晚期甲状腺功能减退;血糖代谢;血脂代谢;妊娠结局
甲状腺功能减退是临床上较为常见的一种内分泌疾病,依据下降程度可分为临床甲状腺功能减退(简称临床甲减,clinical hypothyroidism,CH)和亚临床甲状腺功能减退(简称亚临床甲减,subclinical hypothyroidism,SCH)[1]。妊娠期妇女因体内雌、孕激素水平变化,致使机体甲状腺激素(thyroid hormone,TH)水平骤变,进而在妊娠期表现出甲状腺功能异常的病症,其中最为典型的是妊娠期甲状腺功能减退。妊娠期甲状腺功能减退对妊娠妇女的血脂、胆固醇代谢等有重要影响,极易引起妊娠高血压、妊娠糖代谢紊乱,以及胎儿畸形生长、新生儿智力障碍等不良母婴妊娠结局[2]。近年来相关妊娠早期及中期的孕妇的甲状腺功能的报道较多,而甲状腺功能减退对妊娠晚期的孕妇的影响研究多侧重于妊娠合并症如糖尿病及高血压等对妊娠结局的影响上[3-4],关于单纯妊娠晚期甲减的研究较为少见。因此,本研究从妊娠晚期甲状腺功能的现状,孕妇血糖、血脂及母婴妊娠结局等方面进行研究,旨在明确妊娠晚期甲状腺功能减退患者的血糖血脂水平变化及其对不良妊娠结局的影响。
1资料与方法
1.1一般资料
收集2014年4月至2015年10月在温州医科大学附属第三医院产科就诊的晚期妊娠孕妇160例。对所有孕妇采用化学免疫发光法检测孕妇血液促甲状腺激素(thyroid stimulating hormone,TSH)、游离甲状腺素(free thyroxine,FT4)、游离三碘甲状腺原氨酸(free triiodothyronine,FT3)等指标。筛查出甲状腺功能减退孕妇80例(甲减组)及甲状腺功能正常孕妇80例(对照组)。甲减组孕妇年龄22~34岁,平均29.2±3.5岁,体重56.5~79.5kg,平均体重64.8±6.4kg,孕周31~41周,平均38.4±3.7周。对照组孕妇年龄25~38岁,平均年龄28.5±2.9岁,体重54.5~80.6kg,平均体重68.5±6.7kg,孕周30~42周,平均36.9±4.3周。甲减组与对照组孕妇的年龄、体重及孕周等一般资料比较,差异无统计学意义(均P>0.05),具有可比性。
1.2方法
1.2.1诊断标准
妊娠期甲状腺功能的诊断标准,参照《妊娠和产后甲状腺疾病诊治指南》推荐的妊娠期特异TSH参考范围,即孕早期0.1~2.5mU/L,孕中期0.2~3.0mIU/L,孕晚期0.3~3.0mIU/L。妊娠期TSH、FT4参考值范围为95%可信区间,即2.5th为下限和97.5th为上限。临床甲减诊断指标为:血清TSH>妊娠期参考值上限(97.5th)且FT4<妊娠期参考值下限(2.5th),此外2011年ata指南[5]还指出,妊娠期妇女若TSH>10 mIU/L,无论FT4是否下降,均可诊断为临床甲减。亚临床甲减诊断标准为:血清TSH>妊娠期参考值上限(97.5th)且FT4在参考范围之内(2.5th~97.5th)。依据检测结果将80例甲减孕妇分为亚临床甲减组(n=45)和临床甲减组(n=35)。
妊娠期分期标准参照《妊娠和产后甲状腺异常处理指南》[6]。妊娠期≤12周为妊娠早期;13周≤妊娠期≤27周为妊娠中期;28周≤妊娠期≤40周为妊娠晚期。
1.2.2纳入及排除标准
纳入标准:①单胎妊娠,属于妊娠晚期;②诊断符合妊娠合并甲状腺功能减退;③所有研究对象均知情,并自愿加入该研究;
排除标准:①双胎妊娠;②合并心、肺及肾重大脏器功能不全者;③既往患有糖尿病、高血压及脂质代谢异常者;④血液系统、自身免疫系统疾病及凝血功能异常患者;⑤个人或家族甲状腺疾病史及具有甲状腺药物治疗史患者;⑥既往垂体或下丘脑疾病;⑦不接受调查的孕妇。
1.2.3甲状腺功能检测
抽取160例妊娠晚期孕妇空腹肘静脉血5mL,室温静置1h后,3 000r/min离心5min,取离心后血清,采用化学免疫发光法检测孕妇血液TSH、FT4、FT3水平,仪器采用美国贝克曼库尔特全自动化学发光免疫分析仪DXI 800 ,所用试剂为DXI 800配套试剂,操作严格按照说明进行。
1.2.4血糖、血脂水平检测
所有孕妇行口服葡萄糖耐量试验(oral glucose tolerance test,OGTT)检查,采用己糖激酶法检测当日空腹及口服75g葡萄糖后1h及2h后血糖水平,采取肘静脉血3mL。采用酶法检测两组患者的甘油三酯(glycerin trilaurate,TG)、总胆固醇( total cholesterol,TC)、高密度脂蛋白胆固醇( high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)水平。血糖、血脂水平检测仪器均采用美国贝克曼库尔特全自动生化分析仪(型号为CX9型),试剂为仪器配套试剂,操作严格按照说明进行。
1.2.5妊娠结局采集
妊娠结局包括:妊娠期高血压与妊娠糖尿病并发生的发生情况、羊水量异常、孕妇产后出血、胎儿生长受限情况、胎儿窘迫及新生儿窒息等。
1.3统计学方法
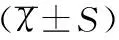
2结果
2.1妊娠晚期孕妇甲状腺功能情况
在80例妊娠晚期甲减孕妇中,依据《妊娠和产后甲状腺疾病诊治指南》中相关标准,又可将其分为亚临床甲减组和临床甲减组,其中亚临床甲减组患者45例,所占比例为56.25%,经检测,其TSH、FT3和FT4水平分别为(4.49±1.52)mIU/L、(3.68±0.67)pmol/L和(13.98±1.77)pmol/L;临床甲减组患者35例,占总数的43.75%,三者水平分别为(5.89±0.34)mIU/L、(3.35±0.34)pmol/L和(9.26±1.07)pmol/L,与对照组(2.15±0.32) mIU/L、(3.76±0.13)pmol/L和(14.32±1.47)pmol/L相比,TSH水平均升高,FT3和FT4水平均不同程度地降低。
2.2三组妊娠晚期孕妇血糖水平比较
亚临床甲减组及临床甲减组的空腹血糖、餐后1h血糖及餐后2h血糖水平与对照组相比,其水平均显著升高,差异具有统计学意义(均P<0.05),且临床甲减组的空腹血糖、餐后1h血糖及餐后2h血糖水平均显著高于亚临床甲减组,差异具有统计学意义(均P<0.05),见表1。
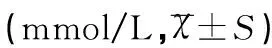
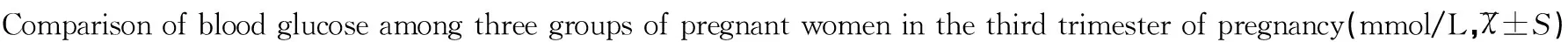

组别例数(n)空腹血糖餐后1h血糖餐后2h血糖对照组804.50±1.247.43±1.646.35±1.12亚临床甲减组455.22±1.298.83±1.766.99±1.03临床甲减组355.89±1.319.66±1.367.69±1.20t13.0717.0493.155t25.4374.1195.776t32.2892.3052.805P10.003<0.0010.002P2<0.001<0.001<0.001P30.0250.0240.006
注:t1(P1)、t2(P2)和t3(P3)分别表示亚临床甲减组与对照组相比、临床甲减组与对照组相比和临床甲减组与亚临床甲减组相比。
2.3三组妊娠晚期孕妇血脂水平比较
亚临床甲减组与临床甲减组的TC、TG、LDL-C水平较对照组均显著升高,差异有统计学意义(均P<0.05),且临床甲减组显著高于亚临床甲减组,差异有统计学意义(均P<0.05);亚临床甲减组与临床甲减组的 HDL-C均不同程度地高于对照组,且临床甲减组高于亚临床甲减组,但组间差异比较,差异无统计学意义(均P>0.05),见表2。
2.4三组不良母婴妊娠结局比较
与对照组相比,亚临床甲减组的妊娠高血压和妊娠糖尿病的发生率显著升高,差异具有统计学意义(均P<0.05),临床甲减组的妊娠高血压、妊娠糖尿病、胎儿生长受限及新生儿窒息发生率均显著升高,差异显著具统计学意义(均P<0.05);亚临床甲减组与临床甲减组相比,不良母婴结局均无统计学意义(P>0.05),三组的羊水量异常、产后出血和胎儿窘迫等的发生率比较,差异均无统计学意义(P>0.05),见表3。
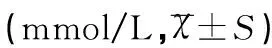
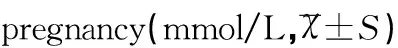
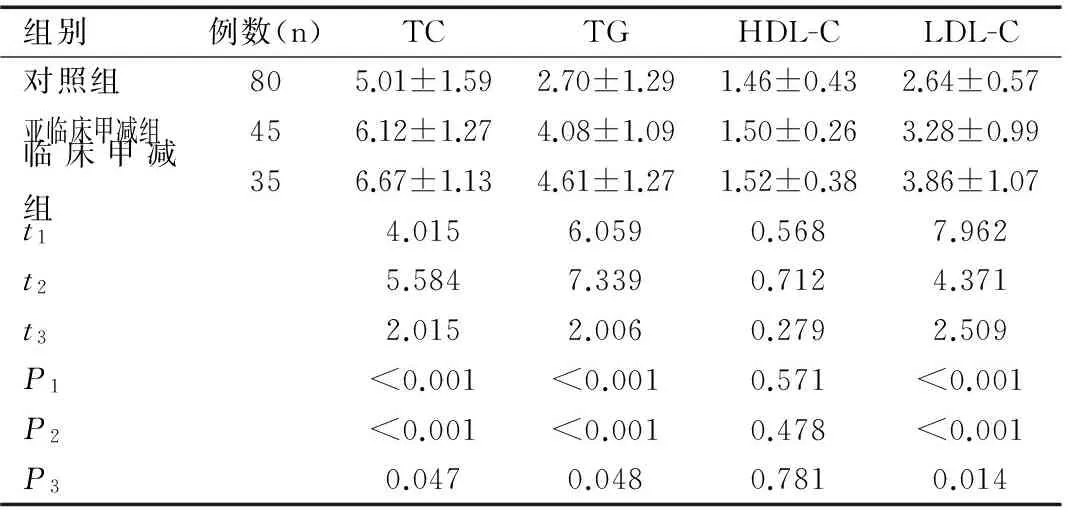
组别例数(n)TCTGHDL-CLDL-C对照组805.01±1.592.70±1.291.46±0.432.64±0.57亚临床甲减组456.12±1.274.08±1.091.50±0.263.28±0.99临床甲减组356.67±1.134.61±1.271.52±0.383.86±1.07t14.0156.0590.5687.962t25.5847.3390.7124.371t32.0152.0060.2792.509P1<0.001<0.0010.571<0.001P2<0.001<0.0010.478<0.001P30.0470.0480.7810.014
注:t1(P1)表示亚临床甲减组与对照组相比,t2(P2)表示临床甲减组与对照组相比,t3(P3)表示临床甲减组与亚临床甲减组相比。
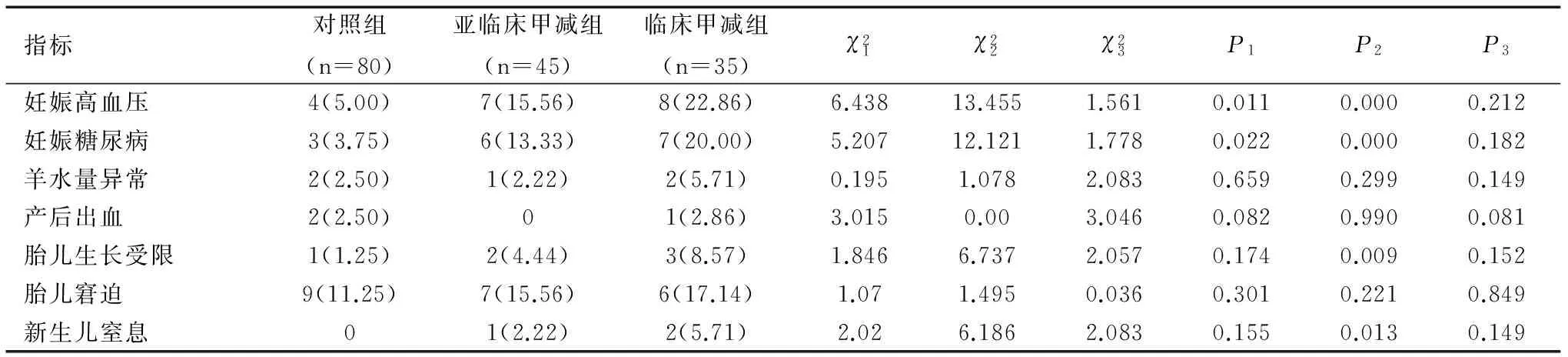
表3 三组不良母婴妊娠结局比较[n(%)]
3讨论
3.1妊娠晚期甲状腺功能减退孕妇甲状腺功能指标变化情况
甲状腺功能减退是妊娠期最为常见的甲状腺疾病,研究发现,临床甲减的发生率较亚临床甲减低[7]。妊娠期孕妇自身免疫性甲状腺疾病是妊娠期甲减发生的主要原因,此外,甲状腺切除手术、碘缺乏及放射碘治疗等因素也可引发甲减。甲减是一种机体甲状腺激素缺乏的临床综合征,甲状腺激素的分泌与机体的物质代谢等密切相关,因此,甲减患者的机体代谢发生紊乱。TSH是甲状腺功能检测的敏感指标。正常妊娠孕妇,血清TSH及FT4水平自早孕期至晚孕期,水平逐渐升高,这可能与孕妇早期HCG及雌激素的分泌量及胎儿发育等有关[8]。甲减患者血清各激素水平骤变,如FT3、FT4水平明显降低,TSH水平明显升高[9]。本研究对妊娠晚期甲减孕妇的甲状腺功能进行检测分析发现,80例妊娠晚期甲状腺功能减退孕妇,亚临床甲减患者居多,所占比例为56.25%,余下的43.75%为临床甲减孕妇,与正常的妊娠晚期孕妇相比,临床甲减组与亚临床甲减组孕妇的TSH水平均升高,FT3和FT4水平有不同程度的降低,研究结果与前人报道基本相符[10]。
3.2妊娠晚期甲状腺功能减退对患者血糖水平的影响
妊娠期甲状腺功能减退及妊娠期糖尿病是妊娠期最为常见的两大内分泌疾病。有糖尿病史或家族史是甲状腺功能筛查的重要因素。此外,由于甲状腺疾病与糖尿病的免疫学基础相同,所以研究推断,两者可能存在免疫重叠现象。正常妊娠早中期孕妇的血糖水平会随着妊娠的发展而逐渐下降,中晚期孕妇对胰岛素抵抗的敏感性下降,糖代谢异常是妊娠期加减的重要危险因素之一,反之,妊娠期甲状腺功能减退又可引发糖尿病并发症的发生。近年来大量研究已证实,妊娠早期甲减患者的血糖水平要显著高于妊娠甲亢及正常妊娠孕妇,其原因可能与甲状腺对糖代谢的双向调控有关[11]。此外研究还发现,妊娠糖尿病合并甲减患者的TSH与血糖水平存在一定的相关性[12]。因此,本研究将妊娠晚期血糖水平变化作为衡量甲状腺功能的一项指标,结果发现,妊娠晚期临床甲减组及亚临床甲减组孕妇的空腹血糖及餐后1h、2h血糖水平均显著高于正常的妊娠孕妇(P<0.05)。妊娠期孕妇患有糖尿病合并甲状腺功能异常的症状在临床医学上较为常见,孕妇血糖水平过高可加重甲减病情,反之亦然,因此,为避免两者并发症引发的不良妊娠结局,对妊娠期甲减患者实施血糖水平监测具有重要意义。
3.3妊娠晚期甲状腺功能减退对患者血脂水平的影响
妊娠期间孕妇自身需要消耗的脂肪较多,此外还要满足胎儿生长发育的需要,因此要求孕妇储备大量的脂肪。脂肪增多的同时,脂肪组织中激素敏感性的脂肪酶活性也随之升高,来加速脂肪动员,进而引发血脂升高。血脂升高如果表现为生理性,即有利于满足妊娠期孕妇及胎儿生长发育的需要,如果表现为病理性血脂升高,将导致血液黏滞度增加,引发血管内皮细胞功能受损,进而损害凝血、免疫等多个系统功能[13]。甲状腺激素可增加肝细胞等细胞表面LDL-C受体的表达、促进脂类分解、加速胆固醇的合成、分解及胆囊的排泄过程,与高胆固醇血症关系密切。甲减患者机体甲状腺激素水平降低,肝脏等组织细胞表面的LDL受体表达量下降,机体LDL-C清除率也随之降低,引起LDL-C蓄积,患者机体血液中TC、TG及LDL-C水平升高,HDL-C水平正常或轻度升高,极易引发高胆固醇血症。有研究表明,妊娠期甲减孕妇血清中,TC、LDL水平显著高于正常妊娠孕妇,TG及HDL水平与正常妊娠孕妇比较无差异[14]。本研究中临床甲减组及亚临床甲减组TC、TG及LDL-C水平均显著高于对照组(P<0.05),HDL-C水平三组比较差异无统计学意义(P>0.05)。进一步证实了,甲状腺功能异常对机体血脂水平的影响。研究发现,妊娠期孕妇的甲状腺功能与TC、LDL-C和胰岛素抵抗等均存在一定的相关性[15],因此妊娠晚期甲减孕妇的血脂变化可能与晚期甲状腺功能变化及胰岛素抵抗敏感性下降等有关,其具体机制仍有待于进一步研究。
3.4妊娠晚期甲状腺功能减对母婴妊娠结局的影响
妊娠期甲减的发生对妊娠孕妇及胎儿的影响均较大。研究发现,甲减患者的心指数较甲亢及甲状腺功能正常者下降,外周血管阻力增加,患者患高血压的风险也随之升高,妊娠期甲状腺功能减退孕妇患高血压的风险显著高于甲状腺功能正常的妊娠孕妇。甲状腺激素除对血管功能影响外,还可引起机体血糖代谢、凝血因子、限制孕酮分泌异常、进而引发妊娠期贫血、产后出血、妊娠期糖尿病及流产等并发症[16]。相关研究还发现,妊娠期甲减患者患有胎盘早脱的风险是正常妊娠孕妇的3倍[17]。妊娠期伴有甲状腺功能减退除对孕妇的影响外,还可以引发胎儿早产、先天性畸形、胎儿生长受限、胎儿窘迫以及新生儿窒息等不良结局。本研究对妊娠晚期甲减(临床甲减及亚临床甲减)患者的母婴结局与正常妊娠孕妇比较发现,临床甲减及亚临床甲减妊娠期孕妇患有妊娠高血压及糖尿病、胎儿生长受限及新生儿窒息等不良后果的风险均不同程度的高于对照组(P<0.05),羊水量异常、产后出血及胎儿窘迫在三组间无明显差异(P>0.05),研究结果与前人报道的内容略有不同[18],其原因可能与样本的选取以及样本量较少有关,因此如进一步证实,则需扩大样本数量做进一步研究。
综上所述,妊娠晚期甲状腺功能减退可引发患者血糖及血脂水平异常,引起妊娠期高血压、妊娠期糖尿病等并发症及胎儿窘迫、胎儿生长受限等不良母婴结局,因此监测妊娠期甲减患者血糖及血脂水平,对妊娠期甲状腺功能减退的诊断及治疗以及减少不良母婴结局等具有一定的临床意义。
[1]范进绵,郑东波,张州平. 亚临床甲状腺功能减退症患者血脂及超敏C反应蛋白变化分析[J]. 海南医学院学报,2016,22(9):869-871,875.
[2]康苏娅,汪云,伍理.妊娠合并亚临床甲状腺功能减退症1053例临床分析[J].中国妇幼健康研究,2014,25(2):252-253,262.
[3]佘广彤,王慧艳.妊娠期高血压疾病与甲状腺功能异常的临床研究[J].中国妇产科临床杂志, 2014,15(4):310-313.
[4]徐玉红,孙丽洲,晋柏.妊娠期糖尿病孕妇甲状腺功能减退的临床分析[J].现代妇产科进展, 2014,23(4):291-294.
[5]Stagnaro-Green A, Abalovich M, Alexander E,etal. Guidelines of the American Thyroid Association for the diagnosis and management of thyroid disease during pregnancy and postpartum[J].Thyroid, 2011, 21(10): 1081-1125.
[6]张淼,时立新.2012年中国《妊娠和产后甲状腺疾病诊治指南》解读[J].中国实用内科杂志,2012,32(10):761-763.
[7]Jaiswal N, Melse-Boonstra A, Thomas T,etal. High prevalence of maternal hypothyroidism despite adequate iodine status in Indian pregnant women in the first trimester[J]. Thyroid, 2014,24(9):1419-1429.
[8]Medeiros M F,Cerqueira T L,Silva Junior J C,etal.An international survey of screening and management of hypothyroidism during pregnancy in Latin America[J]. Arq Bras Endocrinol Metabol,2014,58(9):906-911.
[9]Harari F, Bottai M, Casimiro E,etal. Exposure to lithium and cesium through drinking water and thyroid function during pregnancy: a prospective cohort study[J]. Thyroid, 2015, 25(11): 1199-1208.
[10]Sachdeva A,Singh V,Malik I,etal.Association between serum ferritin and thyroid hormone profile in hypothyroidism[J].Int J Med Sci Public Health,2015,4(6):863-865.
[11]董玥,王秀民.甲状腺功能减退症对妊娠期糖尿病影响的研究[J].中国妇幼健康研究,2016, 27(7):834-837.
[12]Ferrannini E,Muscelli E,Frascerra S,etal.Metabolic response to sodium-glucose cotransporter 2 inhibition in type 2 diabetic patients[J].J Clin Invest,2014,124(2): 499-508.
[13]丁俊蓉,周益伟,高玲,等.妊娠期糖尿病孕妇孕晚期血脂水平的变化及其与新生儿出生体重的相关性研究[J].中国优生与遗传杂志,2014,22(6):64-65.
[14]Mullur R,Liu Y Y,Brent G A.Thyroid hormone regulation of metabolism[J]. Physiol Rev,2014,94(2):355-382.
[15]Sharifi F,Nezamdiba M,Kamali K.Thyroid function and its relation to insulin resistance in women with gestational diabetes mellitus (GDM) compared with healthy pregnant women[J]. J Zanjan Univ Med Sci Health Serv,22(94):61-71.
[16]Ajmani S N,Aggarwal D,Bhatia P,etal.Prevalence of overt and subclinical thyroid dysfunction among pregnant women and its effect on maternal and fetal outcome[J].J Obstet Gynaecol India,2014,64(2):105-110.
[17]Hou J,Yu P,Zhu H,etal.The impact of maternal hypothyroidism during pregnancy on neonatal outcomes: a systematic review and meta-analysis[J].Gynecol Endocrinol, 2016,32(1):9-13.
[18]王亦丹,徐友娣.妊娠期亚临床甲减者TPOAb与妊娠结局相关性分析[J].中国妇幼健康研究,2016,27(3):308-311.
[专业责任编辑: 杨文方]
Influence of hypothyroidism on maternal blood glucose and serum lipid level and maternal and neonatal prognosis in third trimester of pregnancy
HUANG Xian-en1, CHEN Liang-miao1, CHEN Xiang2
(1.DepartmentofEndocrinology; 2.DepartmentofObstetrics,ThirdAffiliatedHospitalofWenzhouMedicalUniversity,ZhejiangWenzhou325200,China)
Objective To investigate the influence of hypothyroidism on maternal blood glucose and blood lipid level and adverse maternal-neonatal outcomes in patients of third trimester of pregnancy. Methods Altogether 160 pregnant women meeting requirements and visiting Department of Obstetrics of Third Affiliated Hospital of Wenzhou Medical University during the period of April 2014 to October 2015 were selected. Among them 80 cases had hypothyroidism, including 35 cases of clinical hypothyroidism (CH) (CH group) and 45 cases of subclinical hypothyroidism (SCH) (SCH group), and 80 cases had normal thyroid function (control group). All cases underwent blood biochemical examination, including thyroid function indexes (TSH, FT4, FT3), blood glucose (fasting blood glucose, postprandial 1h, 2h blood glucose), blood lipid (TC, TG, HDL-C and LDL-C), and pregnancy results (gestational hypertension, diabetes, abnormal amniotic fluid volume, postpartum hemorrhage, fetal growth restriction, fetal distress and neonatal asphyxia). Results Among 80 cases of pregnant women with hypothyroidism in late pregnancy, proportion of pregnant women in SCH group and in CH group was 56.25% and 43.75%, respectively. TSH level of patients with hypothyroidism in late pregnancy (SCH group and CH group) was higher than that in the control group, but FT4 and FT3 levels were lower. For comparison of blood glucose levels, the fasting blood glucose, postprandial 1h and 2h blood glucose levels in CH group were significantly higher than those in SCH group and control group (tvalue ranged 2.289 to 5.776, allP<0.05), and the above parameters in SCH group were significantly higher than those in the control group with statistical significance (tvalue was 3.071, 7.049 and 3.115, respectively, allP<0.05). For comparison of blood lipid levels, TC, TG and LDL-C levels in SCH group and CH group were significantly higher than those in the control group, and the differences were statistically significant (tvalue ranged 4.015 to 7.962, allP<0.05), and the above parameters in CH group were significantly higher than those in SCH group with statistical significance (tvalue was 2.015, 2.006 and 2.509, respectively, allP<0.05). There was no significant difference in HDL-C level among three groups (tvalue was 0.568, 0.712 and 0.279, respectively, allP>0.05). For comparison of adverse pregnancy outcomes, the incidences of gestational hypertension and gestational diabetes mellitus in SCH group were significantly higher than those in the control group, and the differences were statistically significant (χ2value was 6.438 and 5.207, respectively, bothP<0.05). The incidences of gestational hypertension, gestational diabetes mellitus, fetal growth restriction and neonatal asphyxia in CH group were significantly higher than those in the control group, and the differences were statistically significant (χ2value was 13.455, 12.121, 6.737 and 6.186, respectively, allP<0.05). There were no significant differences among three groups in incidence of abnormal amniotic fluid volume, postpartum hemorrhage and fetal distress (χ2value ranged 0.000 to 3.046, allP>0.05). Conclusion Hypothyroidism in the third trimester of pregnancy can cause blood glucose and lipid metabolism disorders, and the incidence of adverse maternal and infant pregnancy outcomes will increase.
hypothyroidism in the third trimester of pregnancy; blood glucose metabolism; blood lipid metabolism; pregnancy outcomes
2017-01-17
黄贤恩(1980-),男,主治医师,主要从事妊娠合并甲状腺功能异常等方面疾病的诊治工作。
陈良苗,主任医师。
10.3969/j.issn.1673-5293.2017.03.026
R714.2
A
1673-5293(2017)03-0299-04
