植入前遗传学筛查用于几种适应症的效率初探
2017-04-21孙贻娟曹英张硕伏静滕彬谷瑞环王宁怡孙晓溪
孙贻娟,曹英,张硕,伏静,滕彬,谷瑞环,王宁怡,孙晓溪
(复旦大学妇产科医院集爱遗传与不育诊疗中心,上海 200011)
·专题讨论·
植入前遗传学筛查用于几种适应症的效率初探
孙贻娟,曹英,张硕,伏静,滕彬,谷瑞环,王宁怡,孙晓溪*
(复旦大学妇产科医院集爱遗传与不育诊疗中心,上海 200011)
目的 探讨植入前遗传学筛查(PGS)用于染色体异常、反复种植失败和反复自然流产患者的效率。 方法 回顾性研究2015年1月到2016年3月在我中心行PGS治疗,共328个取卵周期和随后进行的263个冻胚移植周期,根据其适应症分为男方染色体异常(A组)、女方染色体异常(B组)、反复种植失败(C组)和反复自然流产(D组),分析4组患者的体外受精-胚胎发育情况、胚胎单核苷酸多态性(SNP)检测分析结果和临床结局。 结果 4组患者成熟卵母细胞(MII)率、受精率、卵裂率、D3有效胚胎率均无统计学差异(P>0.05);获卵数在A组(12.93±5.73)、B组(13.17±6.65)显著高于C组(10.48±6.07)、D组(10.76±5.47),D组可进行PGS活检的胚胎数与D3有效胚胎数的比率(57.2%)显著高于A组(51.3%)、B组(48.4%)和C组(50.0%)(P均<0.05);正常核型胚胎比率C组(71.6%)、D组(58.7%)显著高于A组(39.0%)、B组(33.5%),而无可移植正常核型胚胎的周期率D组(13.5%)显著低于A组(31.3%)、B组(33.3%)、C组(29.1%)(P均<0.05);4组患者的妊娠率和流产率均无统计学差异(P>0.05)。 结论 三种适应症的患者实施PGS均能达到满意的临床妊娠率;夫妇染色体异常的患者最终获得正常核型胚胎的几率较低,但是有效避免了高流产率的风险;反复自然流产的患者经PGS筛选后胚胎移植可将流产率控制在较低水平(3.4%)。
植入前遗传学筛查; 反复种植失败; 复发性流产; 单核苷酸多态性; 冻融胚胎移植
(JReprodMed2017,26(4):308-312)
胚胎植入前遗传学筛查(PGS)是指对体外受精获得的具有遗传风险或染色体非整倍风险的胚胎,在移植入子宫腔前行染色体结构和数目的检测,分析是否有遗传物质的异常,从而选择正常胚胎进行移植。与针对携带已知遗传性疾病患者的胚胎植入前遗传学诊断(PGD)不同,PGS用于存在高度胚胎非整倍体风险的夫妇,以提高体外受精-胚胎移植(IVF-ET)的妊娠率,降低流产率。目前PGS的适应证在国内外尚无统一标准。本文通过对染色体异常、反复种植失败和反复自然流产几类患者应用PGS助孕的临床结果分析,探讨PGS用于这几种适应症的效率。
材料与方法
一、研究对象
回顾性研究2015年1月到2016年3月在复旦大学妇产科医院集爱遗传与不育诊疗中心行PGS治疗共328个取卵周期和随后进行的263个冻融胚胎移植(FET)周期。
PGS指证包括:(1)男女双方的染色体异常,有或无自然流产史,经遗传咨询确定可行PGS;(2)反复种植失败3次及以上,并且排除其他因素导致的反复种植失败;(3)反复自然流产2次及以上,并排除夫妇染色体异常和其他导致流产的因素,或者流产史中明确胚胎异常,或有不良孕产史者。
所有PGS的患者都经遗传咨询并给予充分知情告知。根据PGS指证将其分为男方染色体异常组(A组)、女方染色体异常组(B组)、反复种植失败组(C组)和反复自然流产组(D组)。
二、方法
1.控制性超促排卵:根据患者年龄和卵巢储备功能,采用我中心常规的GnRH-a/FSH/HMG长方案或GnRH-ant/FSH/HMG拮抗剂方案或克罗米芬/HMG微刺激方案。根据B超监测和血清E2水平适当调整药物剂量,当2个以上主导卵泡直径达18 mm时给予HCG(珠海丽珠)5 000~10 000 U,34~36 h后经阴道B超引导下穿刺取卵。
2.体外受精胚胎培养与胚胎评价:所有拟行PGS检测的周期常规行卵胞浆内单精子注射(ICSI)授精,授精后16~18 h观察受精情况,选出正常受精(2PN)的合子,继续培养并记录D3胚胎发育情况,包括胚胎卵裂球数目、大小均一性和碎片程度,根据我中心常规分级方法将胚胎分为I~IV级[1]。胚胎数目在6细胞以上、分级在III级以上者判定为D3日可用胚胎,可用胚胎行激光透明带打孔后继续培养至D5。D5根据囊胚发育分期、内细胞团和滋养层分级对囊胚进行评分[2]:囊胚发育分期评分为I~V期,内细胞团评分A~C级,滋养层评分A~C级。D5未发育到IV期的囊胚再继续培养一天至D6再次评估,标准同D5。
3.囊胚活检与玻璃化冷冻:选择分期在V期以上且分级在BC、CB以上的囊胚行活检,将活检胚胎置于显微操作皿中,显微固定针固定囊胚,使孵出的细胞与囊胚“赤道面”在一个平面上,活检针轻轻吸住孵出的滋养层细胞回拉,同时激光切割4~5个滋养层细胞,将活检取得的细胞放入细胞裂解液待检测。囊胚立即采用Cryotop进行玻璃化冷冻,使用欧文公司的冷冻试剂盒(Irvine Scientific,美国):首先将囊胚室温下转移至ES液中平衡7 min,然后转移至VS液中多点冲洗平衡,迅速将囊胚放到Cryotop前端浸入液氮,囊胚从进入VS液至进入液氮的时间控制在45~60 s。
4.单核苷酸多态性(SNP)检测:获取的胚胎滋养层细胞应用QIAGEN REPLI-g Single Cell Kit试剂盒(Qiagen,德国),按照试剂盒标准实验步骤进行全基因组扩增(whole-genome amplification,WGA),简述如下:4 μl样品,3 μl buffer D2混匀后,65℃孵育10 min后,加入3 μl终止液;随后每个反应加入40 μl Master mix,使总反应体系达到50 μl,30℃孵育8 h,65℃ 3 min后4℃保存。随后按照Illumina Cyto-12芯片(Illumina,美国)实验步骤进行第二轮扩增、DNA片段化、沉淀、重悬、芯片杂交、洗涤、SNP单碱基延伸、着色等,应用Illumina iScan进行芯片扫描,应用Karyotype和Bluefuse Multi软件对芯片扫描数据进行胚胎染色体的拷贝数变异分析。通过LogR比率分析判断胚胎染色体的拷贝数变异:当LogR为0时,说明检测位点为正常拷贝数2;若升高,则说明拷贝数大于2;反之则小于2[3]。
5.囊胚复苏与胚胎移植:PGS检测结果正常的胚胎择期进行囊胚复苏与胚胎移植。囊胚于移植当天上午复苏:使用欧文公司的解冻试剂盒(Irvine Scientific,美国),将载有胚胎的Cryotop从液氮中取出,迅速将前端浸入预热好的37℃ TS液中,胚胎自载体上自动脱落,平衡1 min后,依次移入常温下的DS、WS1、WS2各3 min,最后放入囊胚培养液中,培养2 h后移植。
内膜准备:患者自然周期排卵后或人工周期血
清E2达到734 pmol/L、内膜达7 mm后开始注射黄体酮,注射黄体酮第6天行冻胚复苏移植。
6.妊娠结局确定:移植后14 d测血β-HCG,阳性者2周后B超检查探及宫内孕囊及胎心搏动为临床妊娠。
三、统计学分析
采用SPSS 16.0软件进行统计学分析。计量资料用(均数±标准差)(±s)表示,组间均数比较采用t检验、方差分析,率之间比较采用χ2检验;P<0.05为差异有统计学意义。
结 果
一、患者一般情况
由于4组患者PGS指证不同,C组和D组的年龄显著大于A、B组,C组移植失败次数显著高于其他3组,D组流产次数显著高于其他3组(P均<0.05)(表1)。

表1 四组患者一般情况(x-±s)
注:与A、B组比较,*P<0.05;与其他3组比较,#P<0.05
二、体外受精-胚胎发育相关数据
4组患者成熟卵母细胞(MII)率、正常受精率、卵裂率、D3有效胚胎率均无统计学差异(P>0.05);A、B组获卵数显著高于其他两组(P<0.05),D组可进行PGS活检的胚胎数与D3有效胚胎的比率显著高于其他3组(P<0.05)(表2)。

表2 四组患者体外受精胚胎发育情况[(x-±s),%]
注:与C、D组比较,*P<0.05;与其他3组比较,#P<0.05
三、SNP检测结果与FET结局
C、D组正常胚胎比率显著高于其他两组(P<0.05);D组无正常胚胎移植的周期率显著低于其他3组(P<0.05);四组的妊娠率均在50%以上,流产率均在10%以下,组间无统计学差异(P>0.05)(表3)。
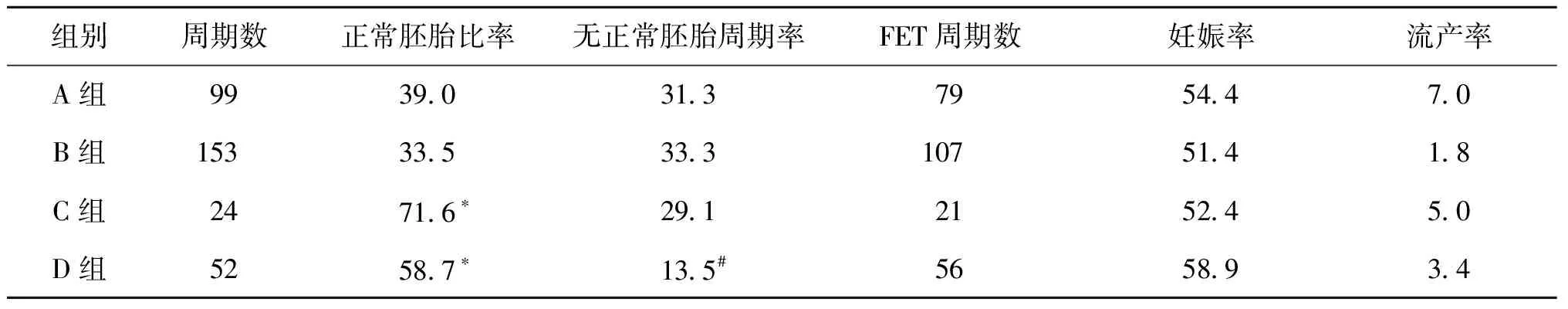
表3 四组患者SNP检测结果与FET结局(n,%)
注:与A、B组对比,*P<0.05;与其他组对比,#P<0.05
讨 论
近十余年,PGS在欧美发达国家的辅助生育领域中已大量应用,被用于高龄女性、反复种植失败、反复流产患者和严重男性因素的不育患者,其中高龄占总PGS数的50%左右[4],应用PGS选择染色体数目正常的胚胎移植可以提高种植率和妊娠率,降低流产率,提高活产率[5],高龄女性卵母细胞非整倍体率增加,曾被认为是PGS的最大受益者。另外对于预后良好的女性,有研究者认为通过PGS选择优质胚胎进行单胚胎移植可以降低医源性多胎妊娠带来的风险[6]。由此PGS曾一度得到越来越广泛的应用,根据欧洲人类生殖与胚胎协会(ESHRE)收集的多中心数据,2006年全球57个生殖中心共进行了3 900个PGS周期[7]。
但是关于PGS应用指征的争论从未停止。荷兰学者Mastenbroek等[8]通过一个大样本、多中心、随机 双盲研究,发现408名年龄35~41岁的IVF妇女中,取单卵裂球活检进行PGS反而明显降低了活产率而流产率相似,说明PGS对于高龄妇女只是干扰了胚胎的自然选择,对妊娠结局并无益处。另外一项对PGS研究的Meta分析也表明行PGS会显著降低高龄妇女的活产率[9]。ESHRE的PGD组织对2010年PGS的统计数据表明,参与调查的全球62个生殖中心进行了2 979个PGS周期,PGS的常规应用呈下降趋势[10]。目前认为PGS的应用仍然应以治疗为目的,需要筛选指证。
本中心的PGS指证包括本研究中的男女双方染色体异常、反复种植失败与反复自然流产。父母染色体异常是导致自发性流产的原因之一,其中任何一方的染色体平衡易位是最重要的原因,曾经有过异常胚胎核型的夫妇再次妊娠发生胚胎异常的概率比前次妊娠胚胎核型正常的夫妇高[11]。本研究中将男、女染色体异常患者分为两组分别统计,结果显示两组患者一般情况、体外受精-胚胎发育相关数据、PGS检测结果和FET临床结局等数据均无统计学差异,这部分患者是流产后常规检查发现一方染色体异常或是由于不孕来就诊筛查时发现染色体异常而转入PGS周期,所以年龄低于反复种植失败组和反复自然流产组的患者,而其移植失败次数与流产次数并无显著增高,体外受精-胚胎发育数据与反复种植失败组和反复自然流产组及本中心非PGS周期的平均数据均无显著差异,而正常胚胎比率显著低于其他两组,也说明胚胎质量和其携带染色体正常与否没有明显关系,两组患者都获得50%以上的临床妊娠率,流产率低于10%。
ESHRE PGD组织将反复种植失败定义为:3次移植高质量胚胎或者多次移植胚胎总和≥10枚,在移植5周以后B超下未探及胎囊[12]。胚胎染色体异常被认为是IVF反复种植失败的原因之一,而胚胎染色体异常在多大程度上影响植入前胚胎的形态目前仍然未知[13]。配子减数分裂过程中和卵母细胞受精后均可产生非整倍体,胚胎分裂时期产生的染色体异常绝大多数发生在前3次有丝分裂,产生嵌合体[14]。这是通过PGS选择正常胚胎移植来改善这部分患者妊娠结局的主要理论依据[4]。Greco等[15]的研究结果表明:反复种植失败的患者在进行PGS筛选胚胎后获得与非反复种植失败的PGS周期患者相同的临床妊娠率和着床率,而未行PGS的反复种植失败患者的临床妊娠率远远低于行PGS后的反复种植失败患者。本研究中反复种植失败患者体外受精-胚胎发育数据均与本中心非PGS周期的平均数据一致,正常胚胎比率显著高于染色体异常的患者,但是无正常胚胎可移植的周期比率与染色体异常患者是相似的,说明这部分患者中有部分反复种植失败与胚胎异常有关。本组FET的结局也是令人满意的,说明PGS技术对于反复种植失败的患者是有效的。
反复自然流产原因复杂,在排除了子宫异常、夫妇染色体异常和免疫性因素外,仍然有大约一半的患者被定义为不明原因反复自然流产,而胚胎染色体的异常经常是其原因,PGS是降低这部分患者流产率的有效办法[16-17]。而Murugappan等[18]对PGS的成本-获益分析表明:PGS与期待疗法相比并不是经济有效的方式,IVF/PGS的活产率需达到91%才可与期待疗法相当。但是对于反复自然流产或者有过不良生育史的女性来说,再次流产对身心都是巨大的伤害,PGS仍然是个好的选择。本研究中这一组患者的PGS胚胎数/D3有效胚胎数的比率显著高于其他指证的患者,而正常胚胎比率显著高于染色体异常组,无正常胚胎周期率显著低于其他3组患者,说明反复流产患者无论从胚胎质量还是胚胎染色体都优于其他两类患者,妊娠率也为最高(但由于例数较少,未见统计学差异),而流产率也同样控制在比较低的水平(3.4%)。
本研究结果证明,染色体异常、反复种植失败和反复自然流产患者实施PGS均能达到满意的治疗效果,减少流产概率,减少无效移植次数,更快地成功妊娠。我们仍然需要进一步明确哪些患者可以从PGS技术最大获益,实施PGS的效率如何仍然需要更多更大样本的研究。
[1] Li X,Xu Y,Fu J,et al. Non-invasive metabolomic profiling of embryo culture media and morphology grading to predict implantation outcome in frozen-thawed embryo transfer cycles[J]. J Assist Reprod Genet,2015,32:1597-1605.
[2] Matsuura K,Hayashi N,Takiue C,et al. Blastocyst quality scoring based on morphologic grading correlates with cell number[J]. Fertil Steril,2010,94:1135-1137.
[3] 蔡笑梅.基于高密度单核苷酸多态性微阵列的胚胎植入前全面遗传检测[D]. 天津大学,2014.
[4] Harper JC,Sengupta SB. Preimplantation genetic diagnosis:state of the art 2011[J]. Hum Genet,2012,131:175-186.
[5] Munné S,Magli C,Cohen J,et al. Positive outcome after preimplantation diagnosis of aneuploidy in human embryos[J]. Hum Reprod,1999,14:2191-2199.
[6] Forman EJ,Hong KH,Ferry KM,et al. In vitro fertilization with single euploid blastocyst transfer:a randomized controlled trial[J]. Fertil Steril,2013,100:100-107.
[7] Goossens V,Harton G,Moutou C,et al. ESHRE PGD Consortium data collection IX:cycles from January to December 2006 with pregnancy follow-up to October 2007[J]. Hum Reprod,2009,24:1786-1810.
[8] Mastenbroek S,Twisk M,van Echten-Arends J,et al. In vitro fertilization with preimplantation genetic screening[J]. N Engl J Med,2007,357:9-17.
[9] Mastenbroek S,Twisk M,van der Veen F,et al. Preimplantation genetic screening:a systematic review and meta-analysis of RCTs[J]. Hum Reprod Update,2011,17:454-466.
[10] De Rycke M,Belva F,Goossens V,et al. ESHRE PGD Consortium data collection XIII:cycles from January to December 2010 with pregnancy follow-up to October 2011[J]. Hum Reprod,2015,30:1763-1789.
[11] Suzumori N,Sugiura-Ogasavara M. Genetic factors as a cause of miscarriage[J]. Curr Med Chem,2010,17:3431-3437.
[12] Harton G,Braude P,Lashwood A,et al. ESHRE PGD consortium best practice guideline for organization of a PGD centre for PGD/preimplantation genetic screening[J]. Hum Reprod,2011,26:14-24.
[13] Fragouli E,Alfarawati S,Spath K,et al. Morphological and cytogenetic assessment of cleavage and blastocyst stage embryos[J]. Mol Hum Reprod,2014,20:117-126.
[14] Fragouli E,Alfarawati S,Spath K,et al. The origin and impact of embryonic aneuploidy[J]. Hum Genet,2013,132:1001-1013.
[15] Greco E,Bono S,Ruberti A,et al. Comparative genomic hybridization selection of blastocysts for repeated implantation failure treatment:a pilot study[J]. Biomed Res Int,2014,2014:457913.
[16] Shahine LK,Lathi RB. Embryo selection with preimplantation chromosomal screening in patients with recurrent pregnancy loss[J]. Semin Reprod Med,2014,32:93-99.
[17] Rubio C,Buendia P,Rodrigo L,et al. Prognostic factors for preimplantation genetic screening in repeated pregnancy loss[J/OL]. Reprod Biomed Online,2009,18:687-693.
[18] Murugappan G,Ohno MS,Lathi RB. Cost-effectiveness analysis of preimplantation genetic screening and in vitro fertilization versus expectant management in patients with unexplained recurrent pregnancy loss[J]. Fertil Steril,2015,103:1215-1220.
[编辑:罗宏志]
Efficiency of preimplantation genetic screening in applying to different indications
SUNYi-juan,CAOYing,ZHANGShuo,FUJing,TENGBin,GURui-huan,WANGNing-yi,SUNXiao-xi*
JiAiGenetics&IVFInstitute,Obstetrics&GynecologyHospital,FudanUniversity,Shanghai200011
Objective:To explore the efficiency of preimplantation genetic screening (PGS)in applying to the patients with chromosome abnormality,recurrent implantation failure (RIF),and recurrent spontaneous abortion (RSA).Methods:A total of 328 PGS treatment cycles and 263 subsequent frozen embryo transfer (FET) cycles in our reproductive center from Jan. 2015 to Mar. 2016 were included in this study. The patients were divided into four groups according to different indications:group A with patients of husband’s chromosome abnormality,group B with patients of wife’s chromosome abnormality,group C with patients of RIF,and group D with patients of RSA. The basic information,the clinical outcomes including in vitro fertilization and embryo development,single nucleotide polymorphism (SNP) results and clinical outcome of FET cycles were analyzed among the four groups.Results:There were no differences in oocyte MII rate,fertilization rate,cleavage rate,usable embryo rate on Day 3 among the four groups (P>0.05). The number of oocytes retrieved in group A (12.93±5.73) or in group B (13.17±6.65) were significantly higher than that in group C (10.48±6.07) or group D (10.76±5.47). The ratio of the number of blastocysts available for PGS and the number of usable embryos on Day 3 in group D (57.2%) was significantly higher than that in group A (51.3%),group B (48.4%) or group C (50.0%) (allP<0.05). The rates of normal karyotype embryo in group C (71.6%) and group D (58.7%) were significantly higher than that of group A (39.0%) and group B (33.5%). The rate of cycles with no normal karyotype embryos for transplantation in group D (13.5%) was significantly lower than that in group A (31.3%),group B (33.3%) or group C (29.1%) (allP<0.05). The clinical outcomes including clinical pregnancy rate and abortion rate were not significantly different among the four groups (P>0.05).Conclusions:The patients with the three different indications can get satisfactory clinical outcomes by PGS. The couples with chromosome abnormality have lower probability to obtain normal karyotype embryos,but are effective in avoiding the risk of high abortion rate. The abortion rate of patients with RSA can be controlled at a low level (3.4%) by means of PGS technique.
Preimplantation genetic screening; Recurrent implantation failure; Recurrent spontaneous abortion; Single nucleotide polymorphism; Frozen embryo transfer
10.3969/j.issn.1004-3845.2017.04.003
2017-02-09;
2017-02-27
孙贻娟,女,山东莱芜人,博士,副主任医师,生殖医学专业.(*
)
