PET显像剂18F-氟化钠的制备、作用机制和临床应用
2017-04-21郭飞虎李明光冯婷婷尹长峰成伟华樊红强罗志福
郭飞虎,李明光,李 光,石 伟,冯婷婷,尹长峰,温 凯,成伟华,樊红强,罗志福
1.原子高科股份有限公司,北京 102413;2.中国原子能科学研究院,北京 102413
PET显像剂18F-氟化钠的制备、作用机制和临床应用
郭飞虎1,李明光1,李 光1,石 伟1,冯婷婷1,尹长峰1,温 凯1,成伟华1,樊红强1,罗志福2,*
1.原子高科股份有限公司,北京 102413;2.中国原子能科学研究院,北京 102413
18F-氟化钠是一种正电子发射计算机断层显像(PET)药物,主要用于成骨性反应活跃的骨疾病、尤其是恶性肿瘤骨转移的诊断。18F-氟化钠PET骨显像具有高灵敏度和高特异性的特点,能更早发现99Tcm-亚甲基二膦酸盐(99Tcm-MDP)单光子发射计算机断层显像(SPECT)不能探测到的病灶。这对肿瘤治疗方案的选择和预后判断具有重要的临床意义。另外,18F-氟化钠也能够有效鉴别破裂高风险的冠状动脉粥样硬化斑块。本工作就PET显像剂18F-氟化钠的制备、质量控制、药理作用、辐射安全和临床应用作出综述。
正电子计算机断层显像(PET);骨显像;肿瘤;18F-氟化钠
据《中国肿瘤登记年报2012》披露,全国每年新发肿瘤病例约为312万例,平均每天8 550人,每分钟有6人被诊断为恶性肿瘤[1]。肿瘤死亡率更高达80%以上,严重威胁人类生命。骨转移是恶性肿瘤疾病进展的晚期阶段,骨转移肿瘤多数为腺癌,其次为鳞状细胞癌(鳞癌),尤以乳腺癌、前列腺癌、肺癌、结直肠癌等肿瘤常见,其发生率为15%~70%,尤其是乳腺癌和前列腺癌晚期高达70%的患者存在骨转移。骨转移伴发的疼痛、骨折、功能障碍、心理障碍等严重影响肿瘤患者的生活质量,如肿瘤转移到机体承重骨,如颈椎、胸椎、腰椎等部位则可造成瘫痪的严重后果[2-4]。因此,骨肿瘤原发灶和转移瘤的早期发现、制定个性化治疗方案、判断预后和减少严重的并发症具有十分重要的意义。
18F-氟化钠注射液是一种正电子计算机断层显像(positron emission tomography, PET)药物,主要用于活跃的成骨性反应骨疾病的诊断。早在1962年Blau等[5]就发现其为一种优良的骨显像剂,1972年美国食品药品监督管理局(Food and Drug Administration, FDA)批准18F-氟化钠注射液用于临床,但1975年因商业原因暂停市场供应。近年来,由于PET和PET/CT技术的快速发展、18F-氟化钠PET显像的优越性及99Mo/99Tcm发生器99Mo原料面临的全球性供货短缺,国际上对18F-氟化钠用于骨显像的研究和应用重新引起了学者们的重视[6],Wong等[7]对骨显像剂99Tcm-亚甲基二膦酸盐(MDP)和18F-氟化钠的显像机理和应用情况进行了综述。国内王俊起[4]和张凯秀等[8]对18F-氟化钠PET评价骨转移瘤的临床应用情况进行了综述,邵付强等[9]对18F-氟化钠在骨外组织的摄取情况也进行了报道。本文就18F-氟化钠PET骨显像剂的制备、质量控制、药理作用、安全性和临床应用综述如下。
1 18F-氟化钠注射液的制备及质量控制
18F-氟化钠注射液的制备方法目前已经比较成熟。应用最多的方法为医用回旋加速器加速质子轰击H218O,经18O(p,n)18F核反应得到18F-,然后将18F-吸附在阴离子交换柱QMA柱上,用氯化钠注射液淋洗,再用0.22 μm的除菌滤膜过滤后得到18F-氟化钠注射液[10-13]。Hockley等[14]在上述基础上对合成工艺进行了优化,在Plus QMA柱前增加了Plus CM阳离子柱以吸附辐照过程中产生的阳离子杂质,再通过QMA柱俘获18F-,然后用灭菌注射用水淋洗QMA柱以除去残留的杂质,最后再用w=0.9%的氯化钠注射液淋洗,用0.22 μm的除菌滤膜过滤后得到18F-氟化钠注射液,降低了杂质残留。
18F-氟化钠注射液质量控制方法在美国药典和欧洲药典均有收录[15-16],其质量标准列于表1。其中测量放化纯所用的高效液相色谱法(high performance liquid chromatography, HPLC)有所不同,其中美国药典方法中所使用的检测器为电导检测器和放射性检测器,流动相为0.003 mol/L 硫酸,流速为0.8 mL/min,色谱柱L17色谱柱[15];欧洲药典方法中所使用的检测器为220 nm紫外检测器和放射性检测器,流动相为4 g/L NaOH溶液,流速为1 mL/min,柱温为20~30 ℃,色谱柱为强碱性阴离子交换树脂柱[16]。也有采用薄层色谱法(thin layer chromatography, TLC)测定18F-氟化钠注射液放化纯的文献报道[11]。

表1 18F-氟化钠注射液的质量标准
注:EU为细菌内毒素单位
2 18F-氟化钠注射液的作用机制
18F-氟化钠由静脉注射进入血液循环后,可选择性地吸附于骨骼系统。在血浆中以双指数模式清除。分布相半衰期为0.4 h,清除相半衰期为2.6 h。18F-氟化钠注射后1 h,大约只有10%的18F-保留在血液中[17]。18F-氟化钠不与血浆蛋白结合,可通过肾清除,肾功能正常的病人,约20%以上的18F-在静脉注射2 h后可通过尿液清除。18F-氟化钠的骨骼摄取依靠局部血流和骨骼的成骨性反应,主要沉积于骨转换活跃部位,在骨表面与骨骼羟基磷灰石晶体的羟基进行交换形成牢固的氟磷灰石[2]。18F-从毛细血管扩散到骨细胞外液,并通过化学吸附作用沉积在骨晶体表面,尤其是新生骨骼上。该过程分为两个阶段:第一阶段,18F-与骨质表面的羟基磷灰石中的OH—进行交换而定植;第二阶段,18F-继续迁移进入骨基质中,并一直保留到骨质的重建[3]。骨组织中羟基磷灰石晶体是18F-氟化钠骨显像的基础。Blau等[3]研究发现,18F-氟化钠进入血液后首先吸附到骨盐周围的水分子表面,进而吸附到骨盐晶体表面,18F-与羟基磷灰石化合物(Ca10(PO4)6OH2)中的OH-进行交换,形成氟磷灰石化合物 (Ca10(PO4)6F2),最后缓慢地进入骨盐晶体。
18F-进入骨骼后,18F核素发射出的正电子在体内组织中穿透大约1 mm后与组织中的负电子结合发生湮灭,产生两个能量相等(511 keV)、方向相反的γ光子。再由PET显像设备的探测器对γ光子符合事件进行采集、数据重建和数据处理后便得到人体各部位横断面、冠状断面和矢状断面的影像。符合事件的多少和组织对18F的摄取成正比,因此可通过影像判断不同部位对18F-的摄取情况,进而诊断是否有病变。
3 18F-氟化钠的动物体内分布情况
Marina等[10]对18F-氟化钠在瑞士雌性大鼠体内的生物学分布情况进行了研究,通过静脉注射70 kBq的18F-氟化钠到大鼠体内,注射后2.5~60 min处死,取不同器官和组织,并测量放射性
计数和质量,计算每克组织放射性摄取(%ID/g)。实验结果示于图1[17]。由图1可知,18F-氟化钠注入大鼠体内1 h后在血液中的放射性摄取值降为(4.50±0.35)%ID/g,并以双指数模式清除,在其它器官中的代谢也类似于血液代谢,均能够快速清除。但在骨中的代谢情况为:18F-氟化钠在骨中的放射性摄取在20 min内不断升高,在注射20 min后达到峰值(5.0±0.5)%ID/g,然后缓慢下降。Valdés-Martínez等[18]对18F-氟化钠在狗体内的研究表明,18F-氟化钠注入体内后血池和软组织中的摄取快速降低,而骨骼中的摄取快速增加,50 min时骨骼/背景值最佳,为显像最佳时间。
4 18F-氟化钠的临床应用情况
18F-氟化钠PET骨显像的临床研究和应用有大量的报道,也有学者与99Tcm-MDP SPECT骨显像进行了对比研究[19-20]。如Even-Sapir等[21]对18F-氟化钠PET/CT对骨转移病灶的显像的研究结果表明,当“无法定性”的病灶列入转移病灶时,18F-氟化钠PET/CT显像的灵敏度和特异性分别达99%和97%。Bridges等[19]报道了对同一例患者进行18F-氟化钠PET显像和99Tcm-MDP SPECT显像的研究结果,结果表明18F-氟化钠PET的显像效果更好,能够发现99Tcm-MDP SPECT显像所不能发现的病灶,显像结果示于图2[19]。Shirrmeister等[22]对44例不同原发肿瘤(前列腺癌、肺癌和甲状腺癌)病人分别进行18F-氟化钠PET显像和99Tcm-MDP骨扫描探测转移性骨肿瘤,18F-氟化钠PET显像共发现96个转移灶,而99Tcm-MDP骨扫描仅发现46个病灶,且所有发现的病灶在18F-氟化钠PET显像中均能发现。在用18F-氟化钠PET显像对肺癌骨转移诊断的准确率和效价分析中,18F-氟化钠PET显像较99Tcm-MDP骨扫描具有更高的效价比,使16.5%(17/103)的病人改变了治疗计划。而且PET显像仪空间分辨率明显高于SPECT,因此在探测骨转移瘤上具有更高的灵敏度,从而使18F-氟化钠PET显像在评价肿瘤骨转移上的优势更加明显。国内近年来也开展了大量的18F-氟化钠PET骨显像的研究[13,23-25],结果表明18F-氟化钠PET/CT用于骨转移瘤显像具有高灵敏度和高特异性兼备的优势,有更好的图像质量,假阳性及假阴性率低。以上研究结果表明:与99Tcm-MDP SPECT显像相比,18F-氟化钠PET能在更短的检查时间内发现99Tcm-MDP SPECT显像不能发现的病灶,即使成骨反应较弱的骨转移瘤对18F-氟化钠也有摄取,一些能够用18F-氟化钠探测到的病灶,尚不能被99Tcm-MDP发现[26]。与99Tcm-MDP骨显像相比,18F-氟化钠是从骨转移瘤产生的成骨反应角度进行评价的正电子示踪剂,其优点为:①18F-氟化钠与血浆蛋白的结合率很低,主要与红细胞结合,且能自由扩散到骨骼表面,注入体内1 h即有50%的18F-氟化钠吸附于骨骼系统;②18F-氟化钠在血液中以指数速度清除,1 h后血中仅残留10%左右的放射性[17],注射后间隔1 h即可用作显像;③18F-氟化钠PET显像软组织本底低,肾脏及膀胱显影浅淡,骨骼清晰;④ PET及PET/CT的空间分辨率高[7],18F-氟化钠PET显像在全身骨骼恶性疾病评价上的准确率更高。

图1 18F-氟化钠在瑞士雌性大鼠体内的生物学分布情况[17]Fig.1 Biodistribution of sodium 18F-fluoride in Swiss female rats[17]
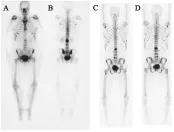
A——99Tcm-MDP SPECT正位扫描显像,B——99Tcm-MDP SPECT后位扫描显像,C——18F-氟化钠PET正位扫描显像,D——18F-氟化钠PET后位扫描显像图2 同一患者的99Tcm-MDP SPECT显像和18F-氟化钠PET显像[19]Fig.2 99Tcm-MDP SPECT and sodium18F-fluoride PET of the same patient[19]

显像剂18F⁃氟化钠99Tcm⁃MDP类别PET显像剂SPECT显像剂显像时间给药后1h给药后2~3h灵敏度更高高费用昂贵适中
除用于肿瘤骨转移的诊断外,18F-氟化钠PET显像还用于背痛[27-28]、不明原因骨痛[29]、虐待儿童导致骨骼损伤[30]、骨坏死[31]、关节增生[32]、骨代谢疾病[33]、佩吉特(Paget)疾病[34]、骨移植物可行性分析[35]、人工关节并发症[36-37]、骨质疏松康复生物材料的评价[38]等方面的研究。另外,由动脉粥样硬化斑块破裂引起的缺血性心脏病是人类主要致死原因之一。近年来研究人员发现18F-氟化钠也能够有效鉴别破裂高风险的冠状动脉粥样硬化斑块,有助于早期干预该疾病以防止不良临床事件[39-42]。根据苏格兰爱丁堡大学医学博士Joshi等[43]的研究表明,急性心肌梗死患者破裂的斑块和患有稳定心绞痛患者的高风险特征的斑块中,放射性示踪剂18F-氟化钠的摄取增加,18F-氟化钠可准确辨认和定位心脏中冠状动脉斑块,并且可以对即将破裂的斑块进行有效检测。这对该疾病的诊断和治疗具有重要的意义。
5 18F-氟化钠临床应用的辐射安全情况
18F-氟化钠为诊断用放射性药物,存在一定的辐射。人静脉注射18F-氟化钠后,用年龄/体重比进行分类,其辐射吸收剂量估算值列于表3,人的辐射吸收剂量数据来源于(美国)核管理委员会[44]和国际辐射防护委员会(ICRP)[45]。由于18F核素是短半衰期正电子放射性核素,在短的时间内会自动衰变,并且注射剂量非常低,18F-氟化钠PET/CT显像的辐射剂量低于安全限。
6 结论与展望
骨转移瘤是晚期恶性肿瘤患者常见并发症之一,其疼痛严重影响了患者的生存质量。骨转移瘤,尤其是骨肿瘤原发灶的准确诊断对制定恰当的治疗方案、判断预后具有十分重要的意义。而18F-氟化钠是一种高灵敏度的正电子显像剂,并且18F-氟化钠PET显像空间分辨率高,能更早发现99Tcm-MDP SPECT显像不能发现的病灶。其对骨骼肿瘤原发和转移灶进行早期诊断、复发、疗效及预后判断有重要临床应用价值。

表3 静脉注射18F-氟化钠后估算的辐射吸收剂量值
[1] 郝捷,陈万青.中国肿瘤登记年报2012[M].北京:军事医学科学出版社,2012:1-302.
[2] Wootton R, Dore C. The single-passage extraction of18F in rabbit bone[J]. Clinical Physics and Physiological Measurement, 1986, 7(4): 333-343.
[3] Blau M, Ganatra R, Bender M.18F-fluoride for bone imaging[J]. Semin Nucl Med WB Saunders, 1972, 2(1): 31-37.
[4] 王俊起,高硕.PET评价骨转移瘤[J].国际放射医学核医学杂志,2006,30(2):87-90.
[5] Blau M, Nagler W, Bender M A, et al. Fluorine-18: a new isotope for bone scanning[J]. J Nucl Med, 1962(3): 332-334.
[6] Grant F D, Fahey F H, Pakarda B, et a1. Skeletal PET with18F-fluoride: applying new technology to an old tracer[J]. J Nucl Med, 2008, 49(1): 68-78.
[7] Wong K K, Piert M. Dynamic bone imaging with99Tcm-labeled diphosphonates and18F-NaF: mechanisms and applications[J]. J Nucl Med, 2013, 54(4): 590-599.
[8] 张凯秀,郝喜燕,王芳,等.18F-氟化钠PET-CT显像在恶性肿瘤骨转移的临床应用与进展[J].内蒙古医科大学学报,2014,36(6):555-560.
[9] 邵付强,陈跃.PET显像剂18F-NaF骨外组织摄取的原因及相关报道[J].泸州医学院学报,2015,38(5):519-521.
[10]Marina B S, Marcella A S, Eduardo S V, et al. Synthesis, quality control and dosimetry of the radiopharmaceutical18F-sodium fluoride produced at the center for development of nuclear technology-CDTN[J]. Brazilian Journal of Pharmaceutical Sciences, 2010, 46(3): 563-569.
[11]Nandy S K, Rajan M G R, Soni P S. Production of sterile [F-18] NaF for skeletal PET imaging[J]. Indian J Nucl Med, 2007, 281: 16-23.
[12]Hockley B G, Scott P J H. Radiochemical syntheses (radiopharmaceuticals for positron emission tomography)[M]. Hoboken, New Jersey: John Wiley & Sons Inc, 2012: 15-19.
[13]程竞仪,章英剑,王新村,等.Na18F用于肿瘤骨转移病灶显像及其诊断效能[J].上海医学影像,2012,21(3):173-178.
[14]Hockley B G, JHScott P. An automated method for preparation of [18F]sodium fluoride for injection, USP to address the technetium-99m isotope shortage[J]. Appl Radiat Isot, 2010, 68(1): 117-119.
[15]The United States Pharmacopieial Convention. U S pharmacopoeia: sodium fluoride F-18 injection, USP39-NF34[M]. US: The United States Pharmacopieial Convention, 2015: 3965-3966.
[16]European Directorate for the Quality Control of Medicines. European pharmacopoeia: sodium fluoride(18F) injection, EP8.8[M]. Strasbourg: European Directorate for the Quality Control of Medicines, 2013: 1168-1169.
[17]Blake G M, Park-Holohan S J, Cook G J R, et al. Quantitative studies of bone with the use of18F-fluoride and99Tcm-methylene diphosphonate[J]. Seminars in Nuclear Medicine, 2001, 31(1): 28-49.
[18]Valdés-Martínez A, Kraft S L, Brundage C M, et al. Assessment of blood pool, soft tissue, and skeletal uptake of sodium fluoride F-18 with positron emission tomography-computed tomography in four clinically normal dogs[J]. American Journal of Veterinary Research, 2012, 73(10): 1589-1595.
[19]Bridges R L, Wiley C R, Christian J C, et al. An introduction to Na18F bone scintigraphy: basic principles, advanced imaging concepts, and case examples[J]. J Nucl Med Technol, 2007, 35: 64-67.
[20]de Arcocha M, Portilla-Quattrociocchi H, Medina-Quiroz P, et al. Current status of the use of18F-sodium fluoride in bone disease[J]. Rev Esp Med Nucl, 2012, 31(1): 51-57.
[21]Even-Sapir E, Metser U, Flusser G, et al. Assessment of malignant skeletal disease: initial experience with18F-fluoride PET/CT and comparison between18F-fluoride PET and18F-fluoride PET/CT[J]. J Nucl Med, 2004, 45(2): 272-278.
[22]Shirrmerster H, Guhlmann A, Slsner K, et al. Sensitivity in detecting osseous lesions depends on anatomic localization: planar bone scintigraphy versus18F PET[J]. J Nucl Med, 1999, 40(10): 1623-1629.
[23]房娜,张宁,崔新建.核素骨扫描及PET显像诊断骨转移瘤的价值[J].齐鲁医学杂志,2009,24(1):85-89.
[24]于泽东,韩春起,李亚明.PET/CT骨骼显像方法学探讨[J].中国临床医学影像杂志,2011,22(4):296-297.
[25]王晓燕,饶良俊,罗炳棋,等.18F-氟化钠PET-CT显像在肺癌术前骨转移灶的诊断价值[J].中华医学杂志,2012,92(35):2495-2498.
[26]Schirrmeister H, Buck A, Guhlmann A, et al. Anatomical distribution and sclerotic activity of bone metastases from thyroid cancer assessed with F-18 sodium fluoride PET[J]. Thyroid, 2001, 11(7): 677-683.
[27]Ovadia D, Metser U, Lievshitz G, et al. Back pain in adolescents: assessment with integrated18F-fluoride positron-emission tomography-computed tomography[J]. J Pediatr Orthop, 2007, 27: 90-93.
[28]Lim R, Fahey F H, Drubach L A, et al. Early experience with fluorine-18 sodium fluoride bone PET in young patients with back pain[J]. J Pediatr Orthop, 2007, 27: 277-282.
[29]Fischer D R, Maquieira G J, Espinosa N, et al. Therapeutic impact of [18F]fluoride positron-emission tomography computed tomography on patients with unclear foot pain[J]. Skeletal Radiology, 2010, 39(10): 987-997.
[30]Drubach L A, Johnston P R, Newton A W, et al. Skeletal trauma in child abuse: detection with18F-NAF PET[J]. Radiology, 2010, 255 (1): 174-181.
[31]Raje N, Woo S B, Hande K, et al. Clinical, radiographic, and biochemical characterization of multiple myeloma patients with osteonecrosis of the jaw[J]. Clin Cancer Res, 2008, 14(8): 2387-2395.
[32]Laverick S, Bound G, Wong W L. [18F]-fluoride positron emission tomography for imaging condylar hyperplasia[J]. British Journal of Oral and Maxillofacial Surgery, 2009, 47: 196-199.
[33]Uchida K, Nakajima H, Miyazaki T, et al. Effects of alendronate on bone metabolism in glucocorticoid-induced osteoporosis measured by18F-fluoride PET: a prospective study[J]. J Nucl Med, 2009, 50: 1808-1814.
[34]Installe J, Nzeusseu A, Bol A, et al.18F fluoride PET for monitoring therapeutic response in paget’s disease of bone[J]. J Nucl Med, 2005, 46(10): 1650-1658.
[35]Brenner W, Vernon C, Conrad E U, et al. Assessment of the metabolic activity of bone grafts with18F-fluoride PET[J]. Eur J Nucl Med Mol Imaging, 2004, 31: 1291-1298.
[36]Temmerman O P, Raijmakers P G H M, Heyligers I C, et al. Bone metabolism after total hip revision surgery with impacted grafting: evaluation using H215O and [18F]fluoride PET: a pilot study[J]. Mol Imaging Biol, 2008, 10: 288-293.
[37]Ullmark G, Sörensen J, Nilsson O. Bone healing of severe acetabular defects after revision arthroplasty: a clinical positron emission tomography study of 7 cases[J]. Acta Orthopaedica, 2009, 80(2): 179-183.
[38]Cheng Caixia, Alt V, Pan Leyun, et al. Application of F-18-sodium fluoride (NaF) dynamic PET-CT (dPET-CT) for defect healing: a comparison of biomaterials in an experimental osteoporotic rat model[J]. Med Sci Monit, 2014, 20: 1942-1949.
[39]van der Wall E E. Molecular imaging of coronary atherosclerosis: predictive of an acute myocardial infarction?[J]. Neth Heart J, 2014, 22: 1-2.
[40]Dweck M R, Chow M W L, Joshi N V, et al. Coronary arterial18F-sodium fluoride uptake: a novel marker of plaque biology[J]. J Am Coll Cardiol, 2012, 59(17): 1539-1548.
[41]Rubeaux M, Joshi N, Dweck M R, et al. Motion correction of18F-sodium fluoride PET for imaging coronary atherosclerotic plaques[J].J Nucl Med, 2016, 57(1): 54-59.
[42]Adamson P D, Vesey A T, Joshi N V, et al. Salt in the wound: (18)F-fluoride positron emission tomography for identification of vulnerable coronary plaques[J]. Cardiovasc Diagn Ther, 2015, 5(2): 150-155.
[43]Joshi N V, Vesey A T, Williams M C, et al.18F-fluoride positron emission tomography for identification of ruptured and high-risk coronary atherosclerotic plaques: a prospective clinical trial[J]. The Lancet, 2014, 383(9918): 705-713.
[44]Stabin M G, Stubbs J B, Toohey R E. Radiation dose estimates for radiopharmaceuticals, NUREG/CR-6345[R]. Nuclear Regulatory Commission Report, 1996: 10.
[45]Harrison J D. Radiation dose to patients from radiopharmaceuticals[R]. ICRP publication 53, Annals of the ICRP, 1987, 18(1-4): 15, 74.
Preparation, Imaging Mechanism and Clinical Application f PET Imaging Agent Sodium18F-Fluoride
GUO Fei-hu1, LI Ming-guang1, LI Guang1, SHI Wei1, FENG Ting-ting1, YIN Chang-feng1, WEN Kai1, CHENG Wei-hua1, FAN Hong-qiang1, LUO Zhi-fu2,*
1.Atom-Hitech Company, Beijing 102413, China; 2.China Institute of Atomic Energy, P. O. Box 275(12), Beijing 102413, China
Sodium18F-fluoride is a radioactive diagnostic agent for positron emission tomography (PET) indicated for imaging of bone to define areas of altered osteogenic activity, especially used to diagnosis of tumor bone metastases. The characteristics of sodium18F-fluoride PET bone imaging are high sensitivity and high specific, and it can earlier find more lesions that99Tcm-methylene diphosphonate (99Tcm-MDP) single-photon emission computed tomography(SPECT) imaging can not find. It is very important to the choice of tumor treatment plan and prognosis. Moreover, sodium18F-fluoride can be used to effectively identify vulnerable coronary atherosclerotic plaque. This review provides a critical and thorough overview of the preparation, quality control, pharmacological effects, radiation safety and clinical application of PET imaging agent sodium18F-fluoride.
positron emission tomography (PET); bone imaging; tumor; sodium18F-fluoride
2016-03-24;
2016-09-12
郭飞虎(1981—),男,甘肃会宁人,博士,副研究员,核技术及应用专业,E-mail: guofh@163.com *通信联系人:罗志福(1962—),男,四川资阳人,研究员级高工,E-mail: luozhifu@ciae.ac.cn
R817.4
A
0253-9950(2017)02-0138-07
10.7538/hhx.2017.YX.2016023
