紫苏粕中迷迭香酸的提取与富集工艺研究
2017-04-14梅喜刚李曼娜
梅喜刚,张 琦,李曼娜,马 超
(北京林业大学生物科学与技术学院,北京100083)
紫苏粕中迷迭香酸的提取与富集工艺研究
梅喜刚,张 琦,李曼娜,马 超*
(北京林业大学生物科学与技术学院,北京100083)
本研究的目的为从紫苏粕中提取并富集富含迷迭香酸的多酚提取物,为紫苏粕的综合利用提供技术支持。以多酚和迷迭香酸的提取率为指标,在单因素实验的基础上采用响应面法,对提取用硫酸溶液浓度、温度和时间三个参数进行优化;在此基础上分别以多酚和迷迭香酸的吸附和解吸率为指标,从8种不同型号的大孔树脂中筛选出吸附和解吸效果最佳的树脂类型进行富集工艺研究。实验表明,最佳提取工艺条件为硫酸浓度8%,温度90 ℃,时间1.5 h,提取得到的迷迭香酸提取率为(0.541±0.02) mg/g DW;8种树脂中,HPD-200A树脂分离效果最优,最佳洗脱溶剂为60%乙醇,最终得到的提取物中,迷迭香酸含量为26.8%。该提取、富集工艺简便、快捷、高效,为紫苏粕资源的进一步开发利用提供了理论基础。
紫苏,响应面,大孔树脂,迷迭香酸
紫苏(Perillafrutescens)是唇形科紫苏属一年生草本植物,在我国以油用和药用为主,兼做香料和食用[1]。传统中医认为紫苏具有发汗、顺气、镇痛、利尿、解毒、安胎、镇咳和化痰之功效[2-4]。紫苏叶和种子中多种多酚类成分具有护肝、抗过敏、抗抑郁、抗肿瘤和抗血小板凝集[5-11]作用,其中以迷迭香酸作用最为突出,被认为是紫苏中的主要功效成分[6]。紫苏种子榨油后的残渣(紫苏粕)往往被用作饲料,甚至作为废弃物被丢弃,造成资源的巨大浪费。研究表明,紫苏粕中含有迷迭香酸、迷迭香酸-3-o-葡萄糖苷、咖啡酸、咖啡酸-3-o-葡萄糖苷、芹菜素等多种多酚类成分,具有显著的抗氧化活性[12]。植物中迷迭香酸的提取与富集常常采用有机溶剂提取、色谱分离纯化的方法,如Hao Huang等人用95%乙醇、硅胶柱色谱、重结晶、沉淀硅胶柱色谱等方法从山地香菜中得到了少量迷迭香酸及其衍生物[13-14]。但是,该方法只能提取出可溶性、游离的迷迭香酸及其衍生物,而结合态的迷迭香酸及其衍生物却无法被提取出来[12]。为了提高紫苏粕资源的综合利用效率,本实验以紫苏粕为原料,采用单因素和响应面实验设计方法对酸解法提取紫苏粕多酚的提取工艺进行优化,并对大孔树脂富集工艺进行研究,以期得到富含迷迭香酸的多酚提取物,从而为紫苏粕的精深加工提供经济、合理的提取富集工艺。
1 材料和方法
1.1 材料与仪器
紫苏种子 购自甘肃兰州,充分干燥压榨法去除油脂后低温(4 ℃)保存待用;HPD-100、HPD-200A、HPD-450A、HPD-826、HPD-400、HPD-600、D-101、ADS-17等8种大孔树脂 均购自河北沧州宝恩吸附材料科技有限公司;没食子酸和迷迭香酸对照品 购自中国食品药品检定研究所;其它试剂 购自北京化学试剂公司。
恒温水浴锅 江苏金坛市亿通电子有限公司;旋转蒸发仪 上海亚荣生化仪器厂;紫外分光光度计 北京普析通用仪器有限责任公司;高效液相色谱仪 岛津企业管理(中国)有限公司;高速离心机 上海安亭科学仪器厂;超声波清洗器 昆山市超声仪器有限公司。
1.2 实验方法
1.2.1 单因素实验 选取硫酸浓度、提取温度、提取时间3个因素进行研究,利用单因素实验确定出各个因素的较优水平。
1.2.1.1 硫酸浓度对总酚和迷迭香酸提取率的影响 取1.0 g紫苏粕粉末,固定提取温度50 ℃、提取时间2 h,分别加入10 mL不同浓度(2%、5%、10%、20%、30%)的硫酸溶液,提取液用浓NaOH水溶液中和至pH7.0,然后用去离子水补足至10 mL,考察不同硫酸浓度对总酚和迷迭香酸提取率的影响。
1.2.1.2 温度对总酚和迷迭香酸提取率的影响 取1.0 g紫苏粕粉末,加入10 mL固定浓度为10%的硫酸溶液、提取时间2 h,分别在不同温度(30、50、70、80、90、100 ℃)提取,提取液用浓NaOH水溶液中和至pH7.0,然后用去离子水补足至10 mL,考察不同温度对总酚和迷迭香酸提取率的影响。
1.2.1.3 提取时间对总酚和迷迭香酸提取率的影响 取1.0 g紫苏粕粉末,加入10 mL固定浓度为10%的硫酸溶液、提取温度90 ℃,分别提取(1、2、4、6、7、8 h),提取液用浓NaOH水溶液中和至pH7.0,然后用去离子水补足至10 mL,考察不同提取时间对总酚和迷迭香酸提取率的影响。
1.2.2 Box-Benhnken实验设计 在单因素实验基础上,根据Box-Benhnken实验原理优化提取工艺条件。选取酸浓度、提取温度和提取时间3个因素,以迷迭香酸提取率为响应值进行提取条件的优化,实验因素水平编码设计[15]见表1。
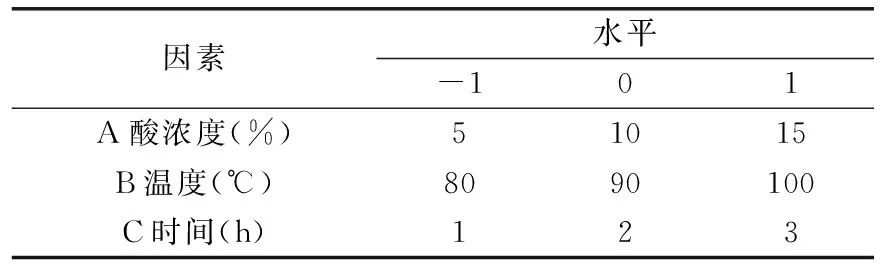
表1 响应面设计实验因素及水平
1.2.3 总酚含量的测定
1.2.3.1 标准曲线的绘制 精确称取没食子酸标准样品5.00 mg,去离子水溶解并定容于50 mL容量瓶中,得到浓度为0.10 mg/mL的标准溶液。将标准溶液进一步进行系列稀释,得到浓度为0.0125~0.10 mg/mL的系列稀释标准溶液。分别准确量取上述标准液0.40 mL于5 mL试管中,各加3.00 mL蒸馏水并振荡摇匀,再各加入0.25 mL Folin酚试剂,摇匀。1 min后,各加入20%碳酸钠溶液0.75 mL,混匀后定容至5 mL,避光静止30 min后,于760 nm波长下测定吸光值[16]。以吸光值为纵坐标,对照品浓度为横坐标,线性拟合得标准曲线回归方程:Y=0.095421X+0.020474(Y是吸光值,X是没食子酸浓度),R2=0.99746,表明没食子酸在0~0.10 mg/mL浓度之内线性关系良好。
1.2.3.2 紫苏粕总酚提取率测定 精确称取待测样品,去离子水溶解,然后稀释至合适浓度。精确量取0.20 mL待测溶液至5 mL试管中,按照1.2.3.1方法进行显色并测定吸光值,然后通过标准曲线以没食子酸当量(gallic acidequivalent,GAE)计算总酚提取率。
1.2.4 HPLC法测定迷迭香酸提取率
1.2.4.1 色谱条件 色谱柱:迪马公司Diamonsil RP-C18column(250 mm×4.6 mm,5 μm);流动相:甲醇(A),0.2%甲酸水(B);线性洗脱:A,0~25 min 30%~50%,25~28 min 50%~30%;28~35 min 30%;流速:1.0 mL/min;柱温:30 ℃;检测波长:330 nm;运行时间:35 min。
1.2.4.2 标准曲线的绘制 精确称取迷迭香酸标准品10.0 mg,用甲醇溶解并定容于100 mL的容量瓶中,并稀释得到20.0~100.0 mg/L系列浓度的标准品溶液。将标准品溶液按照1.2.4.1 HPLC条件进行检测,然后以迷迭香酸峰面积(Y)为纵坐标,标准溶液浓度(X)为横坐标[17],拟合得到回归方程为Y=8426.9X+16853,R2=0.9992,表明在20.0~100.0 mg/L浓度范围内线性关系良好。
1.2.5 大孔树脂分离富集实验
1.2.5.1 紫苏粕多酚粗提液的制备 按照上述单因素和响应面研究结果优化得到的最优提取条件,取约100 g紫苏粕粉末,加入1 L浓度为8%的硫酸溶液,在90 ℃下水浴加热提取1.5 h,冷却后过滤,所得滤渣再用同样方法提取一次,冷却后过滤;合并两次所得滤液,用NaOH溶液中和,离心后即得紫苏粕粗提液。
1.2.5.2 大孔树脂预处理 分别取HPD-100、HPD-200A、HPD-450A、HPD-826、HPD-400、HPD-600、D-101、ADS-17等8种大孔树脂适量置于三角瓶中,先用95%乙醇浸泡24 h,再用95%乙醇淋洗至流出液与水混合后无白色浑浊,再用大量水冲洗至无明显醇味。
1.2.5.3 静态吸附和解吸附实验 分别称取预处理过的8种型号的大孔吸附树脂各1.0 g置于100 mL三角瓶中,然后各加入30 mL紫苏粕粗提液,置于摇床上,25 ℃下100 r/min振荡15 h使其达到饱和吸附。分别测定吸附前和吸附后紫苏粕提取液中总酚和迷迭香酸浓度,计算各大孔树脂的吸附率。过滤除去紫苏粕粗提液后,所得吸附后的大孔树脂用蒸馏水洗两次(20 mL/次),然后加入30 mL 60%乙醇于各树脂中,同样置于摇床上,25 ℃下100 r/min振荡解吸附6 h,再次测定解吸液中总酚和迷迭香酸浓度。吸附率和解吸率的计算公式分别如下:
式中:C0为粗提液初始总酚浓度(mg/mL);C1为吸附平衡时粗提液总酚浓度(mg/mL);V1为加入的原液体积(mL);M1为吸附率(%);C2为洗脱液浓度(mg/mL);V2为洗脱液体积(mL);M2为解吸率(%)。
1.2.5.4HPD200A大孔树脂静态吸附动力学过程 准确称取预处理的HPD200A树脂1.0g于锥形瓶中,加入30mL己知浓度的样品液,25 ℃下振荡至吸附平衡,定时取样进行分析,计算静态吸附量,绘制出静态吸附动力学曲线。
1.2.5.5 动态吸附和解吸附实验 采用湿法装柱,将预处理后的HPD200A型树脂装入层析玻璃柱中。紫苏粕粗提液100mL上样,流速为2mL/min。达到吸附平衡时,再依次以水、20%乙醇、40%乙醇、60%乙醇、80%乙醇为洗脱剂进行洗脱分馏,每个洗脱剂浓度下洗脱2BV,将5个馏分分别进行HPLC检测。
2 结果与讨论
2.1 单因素实验
2.1.1 硫酸浓度对总酚和迷迭香酸提取率的影响 图1表明在硫酸浓度低于10%时,总酚和迷迭香酸提取率随酸浓度增加而升高,大于10%时总酚提取率趋于稳定,但迷迭香酸提取率急剧下降,可能是因为迷迭香酸在硫酸浓度较高条件下发生了转化或者是结构的破坏,导致迷迭香酸提取率的减少,而多酚物质则可能是在此硫酸浓度条件下达到了平衡。因此,将酸浓度10%确定为最佳浓度。
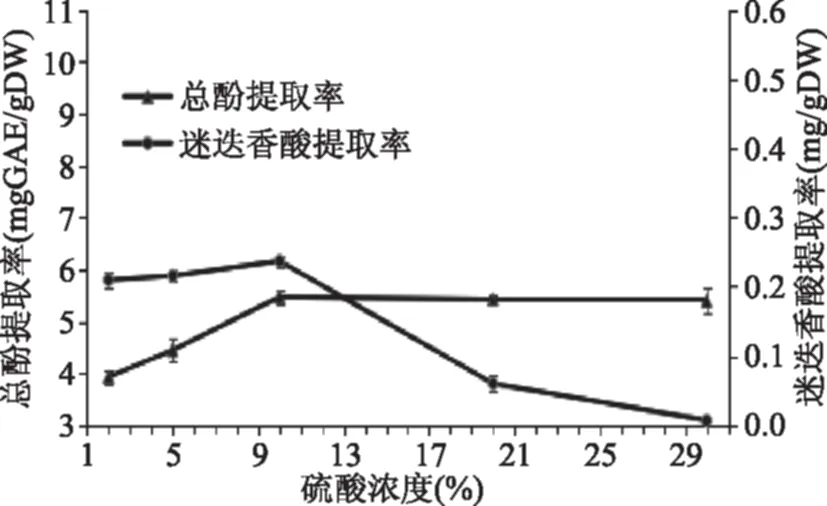
图1 硫酸浓度对总酚和迷迭香酸提取率的影响Fig.1 Effect of acid concentration on extraction yield of total phenols and rosmarinic acid
2.1.2 提取温度对总酚和迷迭香酸提取率的影响 图2表明,在温度低于90 ℃时,总酚和迷迭香酸的提取率随温度升高而上升,可能是低温条件利于紫苏粕中多酚物质溶出。高于90 ℃时,总酚含量缓慢下降,迷迭香酸含量则快速下降,可能是因为在高于90 ℃时会破坏多酚和迷迭香酸的结构,导致其含量减少,因此将90 ℃确定为最佳提取温度。
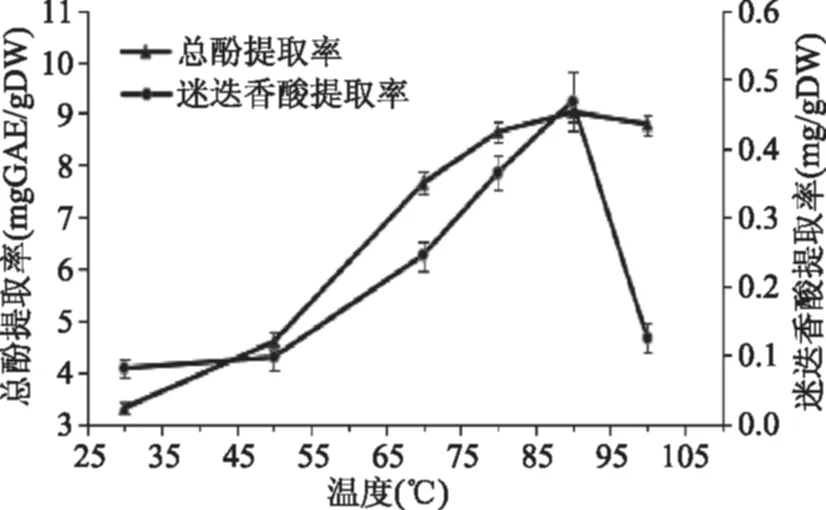
图2 温度对总酚和迷迭香酸提取率的影响 Fig.2 Effect of temperature on extraction yield of total phenols and rosmarinic acid
2.1.3 提取时间对总酚和迷迭香酸提取率的影响 图3表明,提取时间低于2 h时,总酚和迷迭香酸提取率都呈上升趋势,总酚含量上升明显,迷迭香酸提取率缓慢升高;2~6 h之间,总酚提取率持续升高而迷迭香酸提取率降低,可能随着提取时间延长,迷迭香酸发生降解,而降解产物咖啡酸等的含量升高。综合考虑两种物质的提取率,确定2 h为最佳提取时间。

图3 提取时间对总酚和迷迭香酸提取率的影响Fig.3 Effect of extraction time on extraction yield of total phenols and rosmarinic acid
2.2 响应面实验结果
2.2.1 Box-Benhnken中心组合结果分析 以迷迭香酸含量为主要指标的,是为了富集迷迭香酸,总酚含量只是作为参考,所以在响应面中只对迷迭香酸提取工艺进行优化。根据单因素实验,由Design-Expert 21.0软件设计的实验方案及实验结果如表2所示。
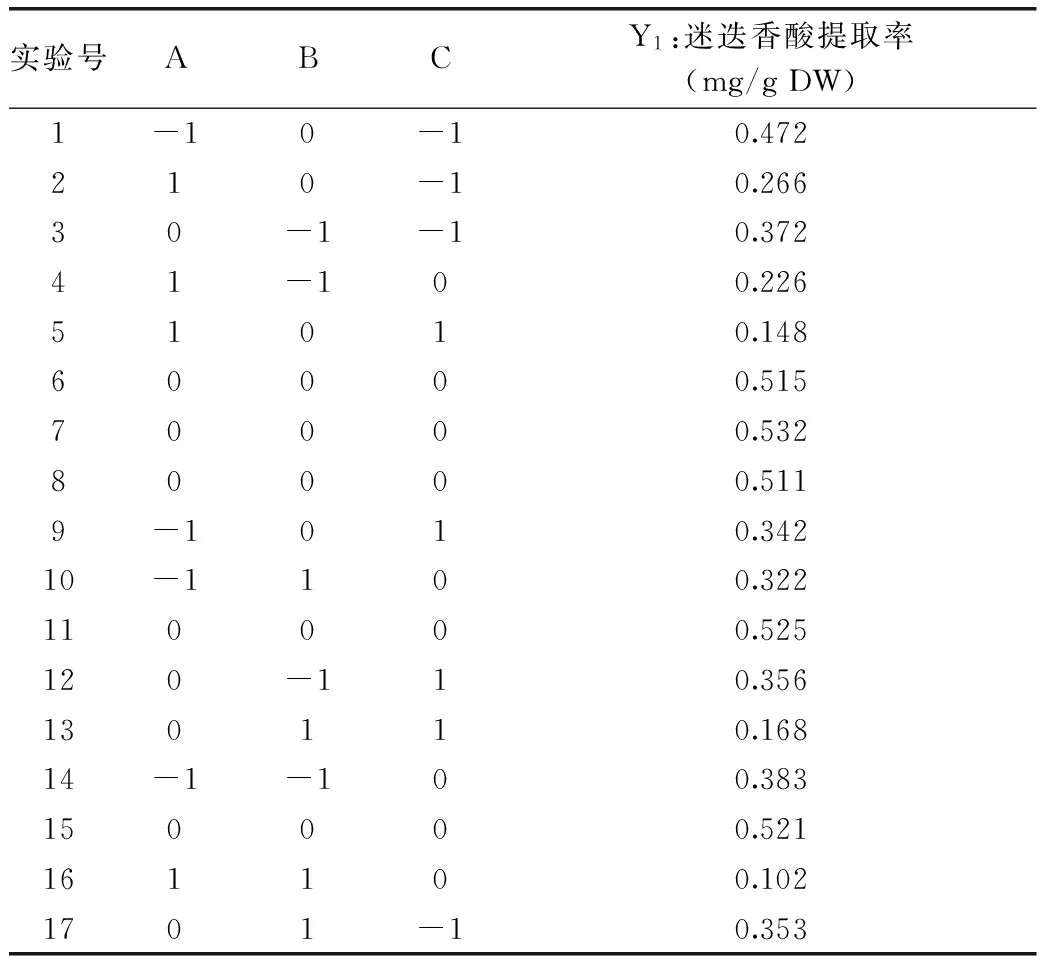
表2 响应面实验设计及响应值
采用Disign-Expert 21.0软件对数据进行回归分析,结果如表3所示。拟合后得到A、B、C的二次多项回归模型:Y1=0.52-0.097A-0.049B-0.056C-0.016AB+3.000E-003AC-0.042BC-0.13A2-0.13B2-0.080C2。
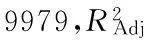

表3 回归模型方差分析
注:**表示p<0.01,极显著,*表示p<0.05,显著。
2.2.2 影响紫苏粕迷迭香酸提取率的因素分析 各因素及其交互作用对紫苏粕迷迭香酸提取率的影响可直观的通过等高线图和响应面图反映出来。图4(a)和图4(b)曲面陡峭,说明硫酸浓度和提取温度、提取温度和提取时间之间交互作用比较显著,与方差分析结果一致。图4(a)为固定提取时间为零水平,提取温度和硫酸浓度对迷迭香酸含量的影响和二者间的交互作用,硫酸浓度较低时,随着温度的升高,迷迭香酸提取率先上升再趋向平缓,当超过一定温度时,迷迭香酸提取率开始下降。当固定温度不变时,随着硫酸浓度升高,迷迭香酸提取率先上升后下降;图4(b)为固定硫酸浓度,提取温度和提取时间对迷迭香酸含量的影响和二者间的交互作用,随着温度升高,迷迭香酸含量先上升后下降,随提取时间的延长,迷迭香酸提取率呈下降趋势。
2.2.3 验证实验 通过分析得到酸法提取迷迭香酸的理论最佳工艺参数为:酸浓度8.20%,温度88.86 ℃,时间1.67 h,此条件下预测紫苏粕中迷迭香酸的最大提取率为0.550 mg/g。为提高实验的可操作性,调整最佳工艺参数为酸浓度8%,温度90 ℃,时间1.5 h,结果迷迭香酸提取率(0.541±0.02) mg/g,接近于模型预测值。
2.3 大孔树脂分离富集工艺
2.3.1 树脂型号的选择 八种树脂对总酚和迷迭香酸的吸附率与解吸率如图5所示,综合考虑八种大孔树脂的吸附和解吸特性,最终优选出HPD-200A大孔树脂进行后续实验。该树脂对多酚的吸附率、解吸率分别为46.46%、79.15%,迷迭香酸的吸附率、解吸率分别为87.99%、69.33%。
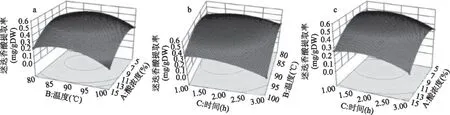
图4 各因素交互作用对迷迭香酸提取率的影响Fig.4 Response surface plots of variable parameters on the yield of rosmarinic acid

图5 八种大孔树脂对迷迭香酸和多酚的吸附率、解吸附率的比较Fig.5 Comparison of the adsorption and desorption rate of eight kinds of macroporous resins to rosmarinic acid and polyphenol
2.3.2 HPD-200A大孔树脂静态吸附与解吸特性 HPD-200A树脂对紫苏粕总酚和迷迭香酸的静态吸附动力学曲线如图6(A)所示,结果表明,在0~3 h内HPD-200A大孔树脂的吸附能力随时间延长而迅速增大,3 h时大孔树脂的吸附能力达到饱和状态。
HPLC方法分别对水、20%乙醇、40%乙醇、60%乙醇、80%乙醇洗脱液进行检测,结果如图6(B)所示,结果表明,60%乙醇洗脱液中多酚含量占上样液中总酚的24.08%,迷迭香酸的量占上样液中迷迭香酸的82.7%,分离得到的提取物中迷迭香酸的含量由上样前粗提物的7.8%提高到26.8%,是粗提液中迷迭香酸所占总酚比例的3.43倍,说明60%乙醇作为洗脱液有效实现了迷迭香酸的富集。

图6 HPD-200A大孔树脂对紫苏粕提取物中迷迭香酸和总酚的静态吸附动力学曲线(A)及动态洗脱分布(B)Fig.6 Kinetics of static absorption of rosmarinic acid and total phenolic(A), and their distribution in gradient elution(B)
3 结论
为得到紫苏粕中富含迷迭香酸的多酚物质,本论文以含有迷迭香酸和迷迭香酸糖苷等多酚成分的紫苏粕为材料,采用单因素和响应面法对紫苏粕中多酚和迷迭香酸的提取工艺进行优化,建立了迷迭香酸提取率的回归模型,最终确定最佳提取工艺条件为硫酸浓度8%,温度90 ℃,时间1.5 h,提取得到的迷迭香酸得率为(0.541±0.02) mg/g,与模型预测值接近;通过研究八种大孔树脂对迷迭香酸和多酚的吸附和解吸特性,最终优选出HPD-200A为最佳分离纯化类型,该大孔树脂最佳富集条件为洗脱溶剂60%乙醇,流速2 mL/min,收集液2 BV。最终得到的多酚提取物中,迷迭香酸的含量可达到26.8%。本研究为得到富含迷迭香酸的多酚物质提供了一种简便快速的方法,同时对提高紫苏粕的综合利用率和精深加工提供了很好的借鉴。
[1]陆洁静,任文彬.紫苏的研究概况[J].农产品加工·学刊,2009(6):32-34.
[2]Ishikura N. Anthocyanin and flavones in leaves and seeds of Perilla plant[J]. Agric Biol Chem,1981,45(8):1855-1860.
[3]Kitada C,Gong Z,Tanaka Y,et al. Differential expression of two cytochrome P450s involved in the biosynthesis of flavones and anthocyanins in chemovarietal forms of Perilla frutescens[J]. Plant Cell Physiol,2001,42(12):1338-1344.
[4]Kondo T,Tamura H,Yoshida K,et al. Structure of malonylshisonin,a genuine pigment in purple leaves ofPerillaocimoidesL.var. crispa Benth[J]. Agric Biol Chem,1989,53(3):797-800.
[5]张志军. 紫苏研究与产品开发[M]. 北京:化学工业出版社,2011:74-76.
[6]Gu L H,Wu T,Wang Z T. TLC bioautography-guided isolation of antioxidants from fruit ofPerillafrutescensvar.acuta[J]. LAT-Food Science and Technology,2009,42(2):131-136.
[7]Yang SY,Hong CO,Lee GP,et al. The hepatoprotection of caffeic acid and rosmarinic acid,major compounds ofPerillafrutescens,against t-BHP-induced oxidative liver damage[J]. Food and Chemical Toxicology,2013,55(3):92-99.
[8]Makino T,Furuta Y,Wakushima H,et al. Anti-allergic effect ofPerillafrutescensand its active constituents[J]. Phytotherapy Research,2003,17(3):240-243.
[9]Takeda H,Tsuji M,Inazu M,et al. Rosmarinic acid and caffeic acid produce antidepressive-like effect in the forced swimming test in mice[J]. European Journal of Pharmacology,2002,449(3):261-267.
[10]Makino T,Ono T,Matsuyama K,et al. Suppressive effects ofPerillafrutescenson IgA nephropathy in HIGA mice[J]. Nephrol Dial Transplant,2003,18(3):484-490.
[11]Fattahi M,Nazeri V,Torras-Claveria L,et al. A new biotechnological source of rosmarinic acid and surface flavonoids:Hairy root cultures of Dracocephalum kotschyi Boiss[J]. Industrial Crops and Products,2013,50(10):256-263.
[12]Xiaojing zhou,Linlin Yan,Chao Ma,et al. Structural characterisation and antioxidant activity evaluation of phenolic compounds from cold-pressedPerillafrutescensvar. arguta seed flour[J]. Food Chem,2014,164(3):150-157.
[13]周平,吕晓玲,胡淳罡.大孔吸附树脂分离纯化迷迭香酸的研究[J]. 离子交换与树脂,2011,27(4):304-314.
[14]Huang H,Sun H-D,Wang M-S,et al. Phenolic compounds of Isodon oresbius[J]. Journal of Natural Products,1996,59(11):1079-1080.
[15]陈茵茹,康健,赵芙蓉. 超声微波双辅助提取葡萄籽低聚原花青素的研究[J]. 中国酿造,2012,31(8):23-28.
[16]Chun OK,Kim D O,Smith N,et al. Daily consumption of phenolics and total antioxidant capacity from fruit and vegetables in the American diet[J]. J Sci Food Agri,2005,85(10):1715-1724.
[17]李荣贵,腾大为,杜贵彩,等. 紫苏愈伤组织迷迭香酸的纯化及抗菌活性的研究[J]. 微生物学通报,2000,27(5):324.
Extraction and enrichment of rosmarinic acid from residues of perilla seeds
MEI Xi-gang,ZHANG Qi,LI Man-na,MA Chao*
(College of Biological Science and Technology,Beijing Forestry University,Beijing 100083,China)
The aim of the present study is to extract and enrich polyphenol extracts rich in rosmarinic acid from perilla seed residues,and provide technical support for the comprehensive utilization of perilla seed residues. Extraction of rosmarinic acid was optimized through single factor experiment and response surface method. Enrichment of rosmarinic acid was carried out using macroporous resins chromatography. The absorption capacity and desorption ratio of polyphenol and rosmarinic acid were used as criteria to select the most suitable resins. Results showed that the optimum extraction conditions were with the H2SO4concentration of 8%,extraction temperature of 90 ℃,extraction time of 1.5 h,under which the extraction yield of rosmarinic acid reached(0.541±0.02) mg/g DW. HPD-200A resin was the most suitable for enrichment of rosmarinic acid,and the best elution solvent was 60% ethanol(v/v). The content of rosmarinic acid in the final extract was 26.8%. The optimized extraction and enrichment procedure is simple,quick and efficient,and provide fundamental information for the further utilities of the seed residues of perilla.
Perillafrutescens;response surface;macroporous resin;rosmarinic acid
2016-09-22
梅喜刚(1989-),男,硕士研究生,研究方向:天然产物与功能性食品,E-mail:15600804800@163.com。
*通讯作者:马超(1979-),男,博士,副教授,主要从事天然产物与功能性食品方面的研究,E-mail:machao@bjfu.edu.cn。
北京市与中央在京高校共建项目(2014GJ01)。
TS201.1
B
1002-0306(2017)06-0250-06
10.13386/j.issn1002-0306.2017.06.039
