不同来源DHA提取技术及其在食品工业中的应用进展
2017-04-13胡文忠姜爱丽王倩影
李 鹤,胡文忠,姜爱丽,于 雪,王倩影
(大连民族大学生命科学学院,辽宁大连 116600)
不同来源DHA提取技术及其在食品工业中的应用进展
李 鹤,胡文忠*,姜爱丽,于 雪,王倩影
(大连民族大学生命科学学院,辽宁大连 116600)
二十二碳六烯酸(DHA)不仅是婴幼儿的成长因子,也是成年人不可缺少的营养健康元素。随着人们对健康营养食品需求的增加,DHA的提取分离精度要求也不断提高,同时,人们从常规食物中摄入的DHA量有限,需额外补充,因此DHA强化深加工食品具有良好开发前景。本文结合DHA的来源分类及性质差异,综述了DHA提取分离技术的研究进展,并分析DHA关键生产技术,为DHA提取新技术的开发提供新思路,同时阐述了DHA在食品工业中的应用进展,对DHA在食品工业中的应用前景进行了展望。
DHA来源,提取技术,食品工业,应用
DHA(Docosahexaenoic acid,二十二碳六烯酸)俗称脑黄金,是ω-3系列多不饱和脂肪酸家族中的重要成员,人体必需脂肪酸中亚麻酸的重要转化子体成分之一[1]。DHA主要存在于大脑的灰质部分中,在大脑皮层中所含比例高达20%,是脑神经细胞、大脑细胞膜和视网膜的重要构成成分,同时也是大脑细胞在生长发育过程中优先利用的脂肪酸,人体摄入的大部分DHA直接进入血液被肝或脑等器官吸收[2]。大量研究表明,DHA参与人体生长发育,能够促进视网膜光感细胞的成熟,尤其对婴幼儿视力、智力的发育具有明显的促进作用[3],同时,能够减轻母体产后抑郁[4];此外,DHA对普通人群也具有预防和治疗多种慢性疾病的作用,如预防及治疗癌症、治疗脑血栓、降低血脂、改善记忆、预防老年痴呆、抑制炎症、增强免疫力等[5]。
DHA作为食品营养补充剂逐渐被人们重视,其在食品工业生产中的应用前景也十分广阔。不同来源的DHA因其纯度、结构、吸收特性等差异,在应用研究中有所侧重,同时,DHA的提取技术从传统的混合EPA(Eicosapntemacnioc Acid,二十碳五烯酸)等成分的粗提取方法到对提取纯度要求较高的进一步纯化分离方法的研究也有了新的进展。DHA来源的可靠性、安全性以及高效提取技术的不断更新,是目前国内外研究的热点[3,6]。本文从DHA的来源分类出发,对比阐述国内对DHA初步提取、进一步纯化技术的研究进展,同时根据DHA在食品工业中的应用现状,对DHA的提取技术研究及其在食品工业中的应用方向进行进一步分析。
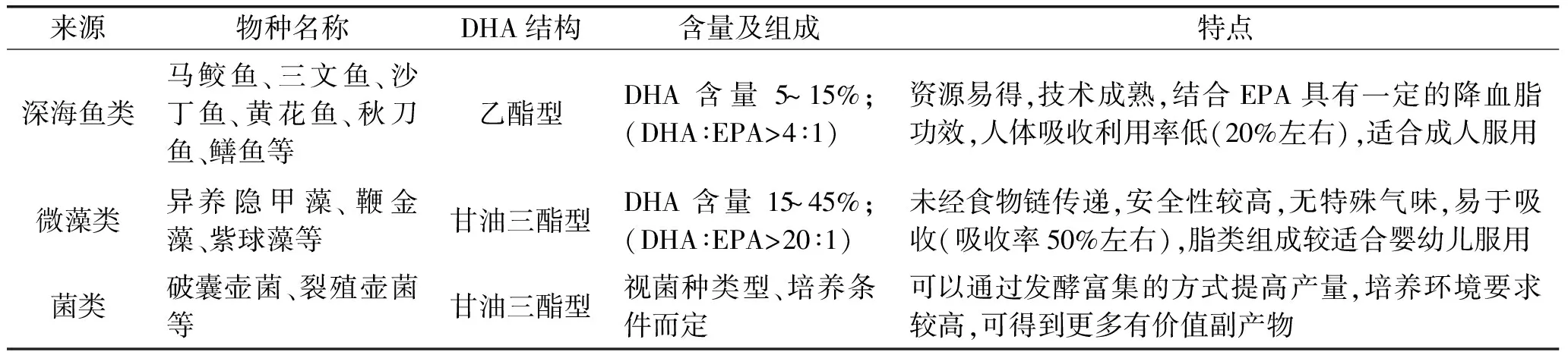
表1 不同来源DHA特性比较[9-16]Table 1 Comparison of DHA characteristics of different sources[9-16]
1 DHA来源
1.1 DHA的食物来源
通常人们摄入DHA的食物来源主要有:母乳、深海鱼类、坚果类等。乳汁中DHA的含量取决于母亲三餐的食物结构,而随地域性及饮食习惯差异性较大,如日本母亲乳汁中DHA含量高达22%,美国最低为7%。相关研究表明,有计划的摄入油脂、深海鱼类食物能够提高母乳中DHA含量[7]。DHA含量高的鱼类有沙丁鱼、金枪鱼、黄花鱼、秋刀鱼、鳝鱼、带鱼等,通常含量在5%~14%左右。坚果类食物如核桃、杏仁、花生、芝麻等,其中所含的α-亚麻酸可在人体内转化成DHA进而被吸收利用[4,8]。
1.2 DHA的提取原料
相比于人们通过食物摄取DHA的方式,用于生产工业化提取DHA的来源更为广泛,涉及动物、植物、微生物等,不同来源DHA性质差异较大。
1.2.1 动物来源——深海鱼类 动物来源的DHA一般是从含脂肪较高的深海鱼中提取所得,早期研究大多从深海鱼类油脂中获得 EPA 和 DHA,但因处理过程复杂,成本高,产品腥味难以去除,且因鱼在海洋食物链中占有较高的地位,其体内可能累积不同种类的持续性有机物和重金属等污染物[9-10]。
1.2.2 植物来源——微藻类 微藻是海洋中存在的一种单细胞藻类,蕴藏量大,种类繁多,比深海鱼油易得,脂肪酸组成更简单,易于提取分离,大有取代深海鱼成为 DHA的主要来源之势[11]。研究表明,金藻类、甲藻类、硅藻类、红藻类、绿藻类、隐藻类等多种海洋微藻的某些品系中含有较高的DHA。
1.2.3 微生物来源——菌类 许多低级真菌中含有较多的 DHA,富含DHA真菌的主要纲目有壶菌纲、卵囊菌纲、水霉目、结合菌纲、虫霉目等,其中破囊壶菌和裂殖壶菌等类藻海洋真菌研究较深[13]。利用筛选、优化发酵、培养条件等方法增殖富含DHA的菌类是近年来DHA来源研究的热点,此外,在针对性的高产DHA真菌培养过程中,可同时富集胞外多糖等具有较好理化特性的副产物[14]。朱婧瑶[15]等以裂殖壶菌为材料,对不同的细胞破碎方法提取油脂和DHA的综合情况进行了比较研究,认为酸热法和酶法提取的油脂含量和DHA含量均较高,且操作简单,其中酶法DHA提取率高达约23%,相应EPA含量极低。
不同来源的DHA结构差异及性质特点,见表1。
值得一提的是,与DHA同样为ω-3系列不饱和脂肪酸的二十碳五烯酸(Eicosapentaenoic Acid,EPA)在深海鱼油中也广泛存在,近代研究表明,DHA与EPA的比例能够直接影响人体血清中的胆固醇含量,平衡低密度脂蛋白与高密度脂蛋白含量,Liang Liu[16]等研究发现,成人饮食中DHA与EPA摄入比例4∶1时能达到最佳的抗动脉粥样硬化效果。而EPA作为AA(花生四烯酸)的竞争性抑制剂,在一定程度上会影响婴幼儿生长发育,根据2004年世界卫生组织(WHO)和联合国粮农组织(FAO)联合专家委员会建议婴幼儿奶粉中DHA和EPA添加比例应大于10∶1[17]。DHA和EPA在特殊人群体内的代谢机理,以及其抗癌、消炎等功能性研究表明,单一成分DHA比EPA具有更高的临床抗癌活性,而适当控制EPA含量对其相应功能具有一定的增效作用[18-19],可见DHA与EPA等类似脂肪酸的有效分离和具有功能针对性的合理比例的研究具有十分重要的意义。
总而言之,植物来源的DHA具有广阔的研究前景。相比鱼类,微藻中的脂肪组成不像鱼油那么复杂,使得微藻DHA的分离纯化工艺相对简单,所得DHA产品无鱼腥味和其它异味,只有独特的海藻味[20]。相比微生物类,微藻的培养受季节和地域的影响较小,借助于生物反应器更易实现工业化大规模培养;目前微藻成为最重要的DHA生产原料,利用微藻培养生产DHA已成为国际上的一大研究热点[21]。
2 DHA提取技术
2.1 DHA前处理及初步提取方法
2.1.1 脂类富集法 脂类富集的前处理方法多用于鱼油中的DHA提取,辅助DHA富集方法主要有甘油三酸酯直接分离法、转变成脂肪酸乙酯分离法、转变为脂肪酸分离法。由于甘油三酸酯直接分离法温度降低时鱼油的粘度增大,致使分离困难,加上鱼油中脂肪酸的种类较多,脂肪酸在甘油三酸酯中分布的复杂性及降温时产生的混晶现象,使分离难以达到好的效果。所以,目前从鱼油中提取DHA多用脂肪酸乙酯转化分离法,如Fadhil[22]等采用KOH催化鱼油中不饱和脂肪酸乙酯化,发现KOH质量浓度0.75%时,醇油摩尔比9∶1,70 ℃反应60 min的条件下所分离富集的脂肪酸具有较低粘度等理想性状。而各种不同结构DHA向甘油三酯型DHA的转化,对扩展动物体来源的DHA应用范围具有重要意义。Fraser[23]等研究将各种长链不饱和脂肪酸通过脂肪酶催化或酸催化等方式选择性的与酰基化甘油合成甘油三酯型脂肪酸,对此领域的研究具有一定参考作用。
DHA初步提取方法主要有:低温分级法、酶催化法、溶剂提取法、尿素包合法、分子蒸馏法、超临界流体萃取法等[24]。传统方法一般得到的DHA不再是天然形态存在的甘油三酯型DHA,而是乙酯型DHA,且提取过程中易导致脂类氧化,活性降低。其中超临界流体萃取法因具有安全、高效、分离性好等特点,被广泛应用于DHA的提取分离[25-26]。Ferdosh[27]等运用响应面法优化工艺超临界CO2萃取金枪鱼头中不饱和脂肪酸,发现SC-CO2超临界流体在40 MPa,65 ℃,3 mL/min条件下获得最高ω-3脂肪酸提取率为22.3%,通过此方法将脂类溶解度从2.9 g/100 g提升至14.2 g/100 g。然而,单纯使用超临界CO2萃取法难于分离碳原子数相同的不同种类脂肪酸,较难实现DHA的纯化与分离,故超临界CO2萃取法和尿素包合、精馏等方法的结合,是DHA进一步分离纯化的研究重点[28]。
2.1.2 细胞破壁法 细胞破壁法多用于海藻、菌类等具有细胞壁的DHA原料。机械细胞破碎法主要有固相作用法(如玻珠研磨法、X-press法等)和液相作用法(如超声波破碎、高压匀浆、微射均质法等);而非机械细胞破碎法主要有热解法、渗透压冲击法等物理方法,酸碱分解等化学方法以及酶催化分解法[29]。几种方法相比,研磨法等适用于小型实验,难以规模化生产;超声、微波等方法对于设备的要求较高,增加了前期投入;均质法为工业常用的破壁方法,但机器损耗大;而工业酶的价格低廉且易得,酶法提取具有高效、经济、可行性强等特点,具有较好的工业化生产前景[13,30]。
吴海龙[31]等比较反复冻融法、超声法、高速匀浆法、碱热法和研磨法对破囊壶菌(Aurantiochytrium)进行破壁处理后采用正己烷提取油脂成分,发现碱热法破壁效果最佳,油脂提取率达61.33%,且DHA含量高达41.33%,产量2.192 g/L。杨钦[32]等比较木瓜蛋白酶、中性蛋白酶和纤维素酶的破壁效果,并结合相应破壁条件确定了单酶——4000 U/mL木瓜蛋白酶在pH6.5,45 ℃,4 h下为最优酶解条件,而复合酶可进一步提高油脂提取率达56.37%±1.41%,DHA提取率12.82%±0.66%。实验表明,酶法、超声破碎法、索氏提取法相比,索氏提取法提取油脂效率最高,而酶法破壁效果最好。
2.2 高纯度 DHA 的分离提取方法
传统的初步DHA提取方法逐渐难以满足研究及实际应用需求,更高纯度DHA的分离提取方法也倍受国内外研究者关注。目前应用较多的DHA纯化分离法有:超临界流体色谱法、超临界二氧化碳精馏与硝酸银络合结合法、低温结晶、减压蒸馏及薄层色谱逐步提纯法、脂肪酶催化反应法等[33-34]。
Medina[35]等采用RP-HPLC分离PUFA,以甲醇/水为流动相,从微藻提取物中可分离得到纯度为96%的EPA或纯度为94%的DHA,回收率分别为96%和100%;若同时分离EPA和DHA,则二者的纯度均为92%,回收率分别为84%和88%。可见多种高效提取分离技术的联合运用,能够显著提高DHA分离纯化效果,有助于高纯度DHA提取新方法的开发。
脂肪酶催化反应法是目前研究热点方法。其原理是利用酶选择性催化或抵制EPA和 DHA发生反应而达到分离纯化的目的。该技术关键在于找到对不同类脂肪结构具有一定区域选择性的特异性较强的酶作为催化剂[36]。Akanbi[37]等采用芥花籽油、鳀鱼油脂等原料结合气相色谱(GC)、核磁共振(NMR)等技术对猪胰脂肪酶(PPL)的脂肪分解选择性进行实验,发现亚麻酸(ALA)和二十二碳五烯酸(DPA)被优先分解,而DHA和EPA等脂类则分解缓慢。Valverde[38]等在醇条件下分别采用两种特异性脂肪酶(细毛嗜热霉脂肪酶QLG和产碱菌脂酶TLIM)对金枪鱼和沙丁鱼油中的DHA和EPA进行富集提取,使得样品中DHA和EPA提取率均提高2倍以上,同时结合酶法使用乙醇-水-己烷双相体系液-液分馏得到DHA高达64.4%的纯度97.6%的酰基甘油酯。
3 DHA在食品工业中的应用
3.1 婴幼儿、儿童食品
DHA作为对婴幼儿生长发育不可或缺的营养成分,多以营养补充剂的形式用于婴儿配方液态奶、乳粉、奶酪、软糖、饼干等上市产品的辅助添加[39]。国内伊利、蒙牛等知名乳制品生产企业近几年也推出了加有藻油 DHA 的婴幼儿配方乳粉和儿童液态乳制品。该类食品中应用DHA来源多为鱼油提取,具有一定的腥气味,一定程度上阻滞了其在食品当中的应用速度。藻类来源的DHA以其更合理的脂肪组成、自然的风味、低污染等优势,在婴幼儿、儿童食品中的应用将逐步取代鱼油类DHA[40]。
3.2 成人食品
市场上多见DHA保健品,而添加DHA成分的饮料、乳制品、烘焙食品、粮油制品等深加工的日常食品较少。彭云[41]等对植物来源的DHA添加到蛋糕的效果进行了实验研究,表明在保持DHA功能的前提下并不影响蛋糕的品质。此外,DHA藻油油剂和微胶囊粉剂分别在土司面包中的添加研究显示,DHA 净添加量为0.10~2.20 mg/g时,在7 d保质期内,添加物对吐司面包的外观、滋气味、口感、酸值、过氧化值等指标均无明显影响,且粉剂的DHA损失率更低[42]。
4 展望
由于DHA的脂质特性及其特殊的气味等条件限制,一定程度上阻碍了其在食品中的广泛应用,有助于提高产品性质的DHA深加工处理技术的研究具有十分广阔的开发前景。如微胶囊技术能够提高DHA的耐水、耐热、抗剪切、氧化稳定性[43-44];纳米技术与DHA脂质载体结合,能够提高DHA水溶性、有利于其在人体的吸收[45-46];此外,各种脱腥技术也将成为DHA前期处理的研究热点。
总之,DHA提取原料方面的研究重心已经从深海鱼类向藻油、海洋真菌等来源转移,更加优质的菌种、藻种的开发及相应培育条件的筛选,包括新培养溶剂组成的研发将成为该领域研究的难点[47],而DHA生物体内合成过程及机理的研究,结合人体机能代谢原理的深入探究也具有十分重要的意义[48];在分离提取技术方面的研究热点是联合运用多种高效手段进一步纯化DHA,生物工程技术结合酶法提取技术将在食品行业继续发展;在分离得到的DHA应用方面将复合处理技术有助于扩大其在食品工业中的应用范围,也是功能性食品研发的热点问题,相比于早期的特殊人群食品及保健品,DHA在普通成人功能食品中的添加及新产品的开发具有较广阔的前景。
[1]Joanne Bradbury. Docosahexaenoic Acid(DHA):An Ancient Nutrient for the Modern Human Brain[J]. Nutrients,2011,3(5):529-554.
[2]Rapoport Stanley I,Igarashi Miki. Can the rat liver maintain normal brain DHA metabolism in the absence of dietary DHA?[J]. Prostaglandins Leukotrienes & Essential Fatty Acids,2009,81(2-3):119-123.
[3]杨贤庆,吕军伟,林婉玲,等. DHA功能特性以及抗氧化性研究进展[J]. 食品工业科技,2014,35(2):390-394.
[4]Sandra Gellert,Jan Philipp Schuchardt,Andreas Hahn. Higher omega-3 index and DHA status in pregnant women compared to lactating women-results from a german nation-wide cross-sectional study[J]. Prostaglandins,Leukotrienes and Essential Fatty Acids(PLEFA),2016,109:22-28.
[5]贺敏,胡世伟,吴胜强,等. 高含量EPA/DHA甘油三酯型鱼油对小鼠的免疫调节作用[J]. 中国海洋药物,2013(4):43-48.
[6]Artur N. Rombenso,Jesse T. Trushenski,David Jirsa,et al. Docosahexaenoic acid(DHA)and arachidonic acid(ARA)are essential to meet lc-pufa requirements of juvenile California Yellowtail(Seriola dorsalis)[J]. Aquaculture,2016,463(5):123-134.
[7]陈雪妍,吴义霞,刘国良,等. 514例乳母乳汁中AA和DHA水平及其影响因素分析[J]. 吉林大学学报(医学版),2016,42(2):390-394.
[8]张坚,孟丽苹,姜元荣,等. 中国成人膳食脂肪酸摄入和食物来源状况分析[J]. 营养学报,2009(5):424-427.
[9]Arnar Halldorsson,Bjorn Kristinsson,Caroline Glynn,et al. Haraldsson. Separation of EPA and DHA in fish oil by lipase-catalyzed esterification with glycerol[J]. Journal of the American Oil Chemists’ Society,2003,80(9):915-921.
[10]Anonymous. Coromega® Issues Statement in Response to Fish Oil Lawsuit Assuring Consumers of its Compliance with Proposition 65[OL].
[11]温雪馨,李建平,侯文伟,等. 微藻DHA的营养保健功能及在食品工业中的应用[J]. 食品科学,2010,31(21):446-450.
[12]梅志刚. 隐甲藻生产DHA的研究[D].广州:华南理工大学,2011.
[13]张明亮,江贤章,王灿,等. 微生物发酵生产DHA的研究进展[J]. 食品工业科技,2014,35(21):395-400.
[14]Lee Chang K,Nichols C,Blackburn S,et al. Comparison of ThraustochytridsAurantiochytriumsp.,Schizochytriumsp.,Thraustochytriumsp.,andUlkeniasp. for Production of Biodiesel,Long-Chain Omega-3 Oils,and Exopolysaccharide[J]. Marine Biotechnology,2014,16(4):396-411.
[15]朱婧瑶,张红漫,胡耀池,等. 面向工业化的裂殖壶菌DHA油脂提取方法研究[J]. 食品科技,2011,36(9):32-35,40.
[16]Liang Liu,Qinling Hu,Huihui Wu,et al. Protective role of n6/n3 PUFA supplementation with varying DHA/EPA ratios against atherosclerosis in mice[J]. The Journal of Nutritional Biochemistry,2016,32:171-180.
[17]姜悦. 乳制品中的DHA:微藻油还是鱼油?[J]. 食品工业科技,2006,27(12):191-192.
[18]S Serini,E Fasano,E Piccioni,et al. Differential Anti-Cancer Effects of Purified EPA and DHA and Possible Mechanisms Involved[J]. Current Medicinal Chemistry,2011,18(26):4065-4075.
[19]Julie M Nauroth,Ying Chun Liu,Mary Elswyk,et al. Docosahexaenoic Acid(DHA)and Docosapentaenoic Acid(DPAn-6)Algal Oils Reduce Inflammatory Mediators in Human Peripheral Mononuclear CellsInVitroand Paw EdemaInVivo[J]. Lipids,2010,45(5):375-384.
[20]姜剑锋,赵丽芹,陈涛,等. DHA的来源及寇氏隐甲藻生产DHA的研究[J]. 内蒙古农业科技,2011(3):109-112.
[21]Won-Kyung Hong,Anna Yu,Baek-Rock Oh,et al. Large-Scale Production of Microalgal Lipids Containing High Levels of Docosahexaenoic Acid upon Fermentation ofAurantiochytriumsp. KRS101[J]. Food and Nutrition Sciences,2013,4(9):1-5.
[22]Fadhil A B,Ahmed A I. Ethanolysis of fish oil via optimized protocol and purification by dry washing of crude ethyl esters[J]. Journal of the Taiwan Institute of Chemical Engineers,2015,58:71-83.
[23]Fraser B H,Perlmutter P,Wijesundera C. Practical Syntheses of Triacylglycerol Regioisomers Containing Long-chain Polyunsaturated Fatty Acids[J]. Journal of Oil & Fat Industries,2006,84(1):11-21.
[24]何键东,王朋,胡烨,等. 鱼油制备及EPA和DHA富集纯化技术研究进展[J]. 农业机械,2011(20):56-59.
[25]Rubio-rodriguez N,Diego S. M,Beltran S,et al. Supercritical fluid extraction of fish oil from fish by-products:A comparison with other extraction methods[J]. Journal of Food Engineering,2012,109(2):238-248.
[26]Trevaud Amiguet V,Krampk L,Mao J Q,et al. Supercritical carbon dioxide extraction of polyunsaturated fatty acids from Northern shrimp(Pandalus borealis Kreyer)processing by products[J]. Food Chemistry,2012,130(4):853-858.
[27]Ferdosh S,Sarker M Z I,Rahman N N N A,et al. Supercritical carbon dioxide extraction of oil from Thunnus tonggol head by optimization of process parameters using response surface methodology[J]. Korean Journal of Chemical Engineering,2013,30(7):1466-1472.
[28]肖艳,牛荣丽. 超临界流体制备EPA和DHA的研究进展[J]. 农业机械,2012,27:62-66.
[29]梁蕊芳,徐龙,岳明强. 细胞破碎技术应用研究进展[J]. 内蒙古农业科技,2013(1):113-114.
[30]章莹颖,邓春芳,崔岩,等. 不同方法对微藻细胞破碎及油脂提取效果的影响[J]. 中国油脂,2016,41(3):61-65.
[31]吴海龙,崔岩,刘瑛,等. 破囊壶菌细胞破壁及DHA提取的研究[J]. 广东农业科学,2015,42(24):162-166.
[32]杨钦. 裂殖壶菌脂肪酸合成相关蛋白过表达菌株的构建和酶法破壁提取油脂工艺的研究[D]. 青岛:中国海洋大学,2015.
[33]肖艳,牛荣丽. 超临界流体制备EPA和DHA的研究进展[J]. 农业机械,2012,27:62-66.
[34]石雨,田媛,李磊,等. EPA、DHA的生理功能及提取方法的研究进展[J]. 黑龙江科学,2014,5(10):24-25,23.
[35]Marion Létisse,Murielle Rozières,Abel Hiol,et al. Enrichment of EPA and DHA from sardine by supercritical fluid extraction without organic modifier I. Optimization of extraction conditions[J]. Journal of Supercritical Fluids,2006,38(1):27-36.
[36]Akanbi T O,Adcock J L,Barrow C J. Selective concentration of EPA and DHA using Thermomyces lanuginosus lipase is due to fatty acid selectivity and not regioselectivity.[J]. Food Chemistry,2013,138(1):615-620.
[37]Akanbi T O,Sinclair A J,Barrow C J. Pancreatic lipase selectively hydrolyses DPA over EPA and DHA due to location of double bonds in the fatty acid rather than regioselectivity[J]. Food Chemistry,2014,160(10):61-66.
[38]Valverde L M,Moreno P A G,Cerdán L E,et al. Concentration of docosahexaenoic and eicosapentaenoic acids by enzymatic alcoholysis with different acyl-acceptors[J]. Biochemical Engineering Journal,2014,91:163-173.
[39]Gould J F,Anderson A J,Yelland L N,et al. Maternal characteristics influence response to DHA during pregnancy[J]. Prostaglandins Leukotrienes & Essential Fatty Acids,2016,108:5-12.
[40]汪志明,肖敏,王海堂. 藻油 DHA 在功能性乳品及新资源食品中的应用[J]. 食品工业科技,2012(17):38-40.
[41]彭云,李汴生,林应胜,等. 微藻DHA 在蛋糕中的应用[J]. 现代食品科技,2012(2):200-203.
[42]黄巍峰,郑晓辉,曾远平,等. 微藻 DHA在吐司面包中的应用[J]. 食品工业科技,2013(14):292-295.
[43]Li Di. DHA microcapsule food additives,DHA soft capsule health product and uses thereof[P]. CN 1927050 B,2010.
[44]胡本涛. DHA固体脂质纳米颗粒(SLN)制备、性质及应用[D]. 哈尔滨:东北农业大学,2013.
[45]Subbaiah P V,Dammanahalli K J,Peng Y,et al. Enhanced incorporation of dietary DHA into lymph phospholipids by altering its molecular carrier[J]. Biochimica et Biophysica Acta,2016,1861(8):723-729.
[46]Karthik P,Anandharamakrishnan C. Enhancing omega-3 fatty acids nanoemulsion stability and in-vitro digestibility through emulsifiers[J]. Journal of Food Engineering,2016,187:92-105.
[47]Choi S A,Jung J Y,Kim K,et al. Effects of molten-salt/ionic-liquid mixture on extraction of docosahexaenoic acid(DHA)-rich lipids fromAurantiochytriumsp. KRS101[J]. Bioprocess & Biosystems Engineering,2014,37(11):2199-2204.
[48]Prostek A,Gajewska M,Baasińska B. The influence of eicosapentaenoic acid and docosahexaenoic acid on expression of genes connected with metabolism and secretory functions of ageing 3T3-L1 adipocytes.[J]. Prostaglandins & Other Lipid Mediators,2016,125:48-56.
Advance in different sources of DHA separation and extraction technology and its application in food industry
LI He,HU Wen-zhong*,JIANG Ai-li,YU Xue,WANG Qian-ying
(College of Life Science,Dalian Nationalities University,Dalian 116600,China)
Docosahexaenoic(DHA)acid is not only an infant’s growth factor,but also an essential nutrient for adults. With the increasing demand of health nutrition food,DHA extraction separation accuracy requirements is also rising. At the same time,the amount of DHA that people intake from the conventional food is not enough. So deep processing of DHA fortified food is a good prospect for development. The application of DHA separation technology course of study was concluded in this paper,combining with different sources of DHA and their classification differences. At the same time,the application of DHA in food industry was described,then analysis of DHA production technology and the prospects of the application of DHA in food industry were also discussed.
source of DHA;extraction technology;food industry;application
2016-09-29
李鹤(1989-),女,在读硕士,研究方向:食品加工与质量安全控制, E-mail:hewutaofei@126.com。
*通讯作者:胡文忠(1959-),男,博士,教授,研究方向:食品加工与质量安全控制,E-mail:hwz@dlnu.edu.cn。
TS201.1
A
1002-0306(2017)07-0390-05
10.13386/j.issn1002-0306.2017.07.067
