肠道微生物调控肠道肿瘤的相关性研究进展
2017-04-13杨立娜朱力杰
杨立娜,朱力杰,王 勃,马 涛
(渤海大学食品科学与工程学院,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁锦州 121013)
肠道微生物调控肠道肿瘤的相关性研究进展
杨立娜,朱力杰,王 勃,马 涛*
(渤海大学食品科学与工程学院,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁锦州 121013)
肠道微生物与肿瘤的发生发展密切相关,一直是基础医学、生物学和食品安全等多个领域的研究热点。由于肠道微生物的种类、机体肿瘤类型及其研究方法多样化,所以目前肠道微生物与肿瘤的关系尚未完全明晰。文章对近几年国内外关于肠道微生物与肿瘤发生抑制的关系及其分子机理等相关研究文献进行了梳理,以期为肠道微生物防治肿瘤提供参考。
肠道微生物,肿瘤调控,肠道肿瘤,益生菌
人体表及与外界相通的腔道中寄居着数以万亿的不同种类的微生物,其中78%的微生物存在于大肠和小肠,即肠道菌群[1]。肠道菌群与宿主形成共生关系,通过参与宿主体内三大营养物质(糖类、脂肪和蛋白质)的代谢(分解、消化与吸收),促进肠上皮生长发育和调控宿主免疫防御来维持宿主的生理健康。正常生理状态下,肠道菌群与宿主、外界环境间维持一种动态的生态平衡,此时肠道菌群的结构、种类、数量保持相对稳定。随着宿主饮食习惯、心理压力的改变以及免疫功能障碍、抗菌药物的治疗和环境变化等,肠道微生态平衡会被打破,从而导致肠道菌群失调,此时潜在的有害菌种大量繁殖,产生硫化氢、乙醛、酚类等有毒的代谢产物,诱导肠黏膜炎症或直接导致肠道细胞DNA 损伤,从而促进一系列疾病的发生,如肠易激综合征、炎症性肠病、糖尿病、肥胖和肿瘤等[2-5]。近些年研究发现[6-7],肠道菌群除了诱导结直肠癌、肝癌、乳腺癌等恶性肿瘤的发生发展外,其有益菌还参与肿瘤相关的细胞信号转导通路而抑制肿瘤的生长,因此本文综述了肠道微生物促癌抑癌的相关性研究进展,以期为肠道微生物防治肿瘤提供新的思路。
1 肠道微生物
1.1 肠道微生物的组成与代谢
拟杆菌(Bacteroides)、双歧杆菌(Bifidobacterium)、乳酸菌(Lactobacillus)及梭状芽孢杆菌(Clostridiumprazmowski)等厌氧菌是肠道的优势菌,其中数量最多的双歧杆菌是肠道最主要的益生菌,具有营养及免疫调节作用,对大肠杆菌(Escherichiacoli)等潜在致病菌生长起拮抗作用,与其他厌氧菌一起构成生物屏障,阻止致病菌的入侵和定植;肠球菌与肠杆菌等兼性厌氧菌是肠道的非优势菌群,若与其它肠道菌群呈动态平衡时,会与免疫系统相互作用保持稳定状态,构成宿主的生物屏障,若菌群平衡失调,则对人体有害;变形杆菌(Proteusbacillusvulgaris)和假单胞菌(Pseudomonadaceae)等病原菌侵入宿主体内后直接破坏机体的结构和功能。
肠道内的双歧杆菌和大肠杆菌等可以利用膳食纤维产生维生素B、维生素K、叶酸和氨基酸等,为人体提供营养物质。碳水化合物和蛋白质等经肠道菌群降解发酵后的主要代谢产物为短链脂肪酸(醋酸、丙酸、丁酸、次级胆汁酸等),95%的短链脂肪酸被结肠吸收用于维持肠上皮内稳态与平衡[8],其中丁酸盐能够诱导多种肿瘤细胞凋亡并抑制癌症发生,主要通过超活化p300介导的细胞因子/连环蛋白信号途径以及借助p21 WAF1抑制组蛋白H3乙酰化来发挥作用,另外还可以抑制硝胺和过氧化氢对结肠细胞基因毒作用[9-10]。
代谢产物还包括CO2,甲烷,氨气,硫化氢,吲哚等,其中大部分属于有害物质,被肠壁吸收后在肝脏解毒。如果肠道菌群失衡,导致有害代谢产物大量产生,长期以往,会造成肝脏疾病[11-12]。Venkatesh[13]却发现吲哚丙酸与孕烷受体相互作用后通过TLR4信号调控肠粘膜完整性,进而抑制炎症性肠道肿瘤。
1.2 膳食成分对肠道微生物的影响
随着不同人群膳食习惯和营养元素摄入的改变,人体内肠道微生物的种类、数量和动态平衡也发生了显著的变化,这也许是当今社会肿瘤肆意发生的一个潜在因素。膳食多酚通过结合或破坏微生物细胞膜选择性地抑制致病菌的生长,促进双歧杆菌等有益菌的生长[14]。低聚果糖和低聚半乳糖都能够增加双歧杆菌、普拉梭菌(Feacalibacteriumprausnitzii)等有益菌的丰度,抑制病原菌生长,减少肠道炎症的发生[15]。糖化牛血清白蛋白可以显著提高肠道拟杆菌和梭状芽孢杆菌等有害菌数量,抑制双歧杆菌和直肠真杆菌(Eubacteriumrectal)等有益菌的繁殖[16]。关于膳食脂肪类成分对于人体肠道菌群的影响研究较少,大部分处于实验动物水平:高脂饮食引起小鼠肠道拟杆菌、柔膜菌(Hymenoscyphus)、直肠真杆菌、双歧杆菌等有益菌丰度显著下降[17];n-6多不饱和脂肪酸可以降低拟杆菌和厚壁菌的数量,破坏小鼠肠道平衡,通过添加鱼油可以改善小鼠肠道失衡[18];在高脂饮食中适当添加益生元和低聚糖等有助于恢复肠道菌群平衡[19]。因此控制高脂高蛋白饮食可以改善肠道微生态,避免肠道炎症和结直肠癌等多种疾病的发生。
2 肠道菌群与肿瘤发生关系的研究进展
2.1 肠道菌群失调诱发肿瘤
微生物群落的组成和结构的变化改变了肠道菌群的稳态,进而调节肿瘤的发生与发展[20]。早期研究报道称肠道菌群与大肠癌发生发展的关系最为密切,无菌环境下IL-10缺陷鼠和TCRβ/p53双基因敲除鼠没有出现大肠癌,这就证明大肠癌的发生与肠道菌群密不可分[21]。众所周知,慢性炎症会发展成肿瘤,因此炎症性肠病的存在增加了大肠癌的发病风险。产肠毒素脆弱拟杆菌(ETBF)分泌的毒素,通过与结肠上皮细胞结合刺激细胞粘附因子E-cadherin(肿瘤抑制蛋白)裂解,引发结肠炎[22]。此外,大肠杆菌和粪肠球菌(Enterococcusfaecalis)定植的IL-10缺陷小鼠都患上结肠炎,但是大肠杆菌定植的IL-10缺陷小鼠出现了结肠癌,粪肠球菌定植的IL-10缺陷小鼠并未出现结肠癌[12];由散发性结直肠癌小鼠粪便菌群定植的悉生鼠肿瘤的发病率也明显提高[5]。关于肠道菌群失调诱发结直肠癌的研究相对较多,这些研究发现有助于我们了解结直肠癌发病的分子机理,提早预防癌症发生。
2.2 分子机制
拟杆菌、具核梭杆菌(Fusobacteriumnucleatum)和大肠杆菌等诱发大肠癌主要通过引起肿瘤微环境的炎症状态[23-24]和产生致癌物质[12]两种途径。关于肿瘤所在微环境的炎症状态,一些研究报道称具核梭杆菌产生粘附因子FadA并借助其粘附于肠上皮,FadA与肠上皮细胞的钙粘附蛋白E(E-Cadherin)结合并致其磷酸化水平升高,β-链蛋白(β-Catenin)磷酸化水平降低,激活转录增加促炎基因(TCF和NF-κB)和致癌基因(Myc和Cyclin D1)表达,增加炎症反应并激活促肿瘤反应信号通路,诱发大肠癌(图1)[23-27];结直肠癌患者大肠杆菌NC101的聚酮合酶(PKS)基因和ETBF毒素基因表达高于健康人,主要是由于慢性肠道炎症诱导肠道菌群失调,大肠杆菌异常增殖进入宿主肠上皮细胞,释放PKS和ETBF毒素,导致肠上皮功能被破坏,进而诱发结直肠癌[11-12];高丰度的拟杆菌和厚壁菌增加了趋化因子CCL20、CXCL1,促炎因子IL-17a、IL-23、IL-8,损伤因子MMP-13和生长因子SERP1基因表达,而CXCL1增加结直肠癌细胞的存活,并促进肿瘤血管生成[28-30](表1)。
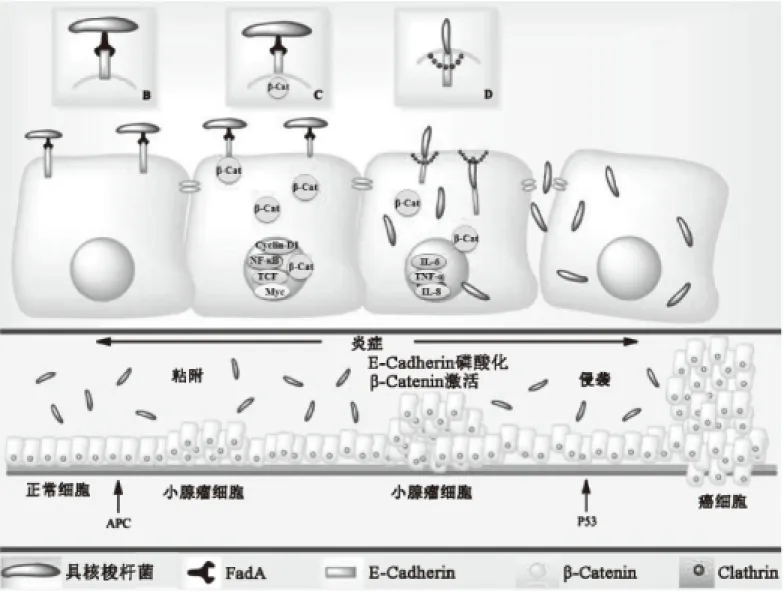
图1 具核梭杆菌诱发大肠肿瘤可能的分子机制模式图[27]Fig.1 Potential mechanisms of Fusobacterium nucleatum promotes colorectal carcinogenesis[27]
到目前为止,肠道菌群失调诱导癌症发生发展的研究已经从动物水平发展到临床水平,肠道菌群失调引发的炎症反应是大肠癌发生的重要因素,致病菌释放的有毒代谢产物也无疑雪上加霜,促进了癌症的发生[7-8,31]。既然肠道菌群失调的危害如此之大,那么促进有益菌的繁殖、恢复菌群平衡也许可以改善肿瘤微环境降低肿瘤的发生,减少有毒代谢产物的排放最终达到治愈肿瘤的目的。

表1 肠道微生物促癌或抑癌的分子机制Table 1 Molecular mechanism of gut microbiota cancer-promoting and-inhibiting
3 肠道菌群与肿瘤抑制的研究进展
3.1 肠道益生菌抑制肿瘤
一些肠道微生物可以保护宿主对抗结肠癌,主要通过代谢产物、诱导免疫耐受和战胜致病菌等途径来完成[4,32-33]。早期研究表明,肠道益生菌(如双歧杆菌)有抗癌性,主要通过抑制肿瘤细胞的增殖和降解肠内致癌物来抵抗癌症[34];还可以产生抗氧化剂,降低结肠pH,直接预防癌变的发生[35]。有研究显示,益生菌形式的持久治疗或高纤维饮食可以影响肠道菌群,进而提高了通过改变肠道微生物种类控制肿瘤的可能性[36-37]。例如,益生菌(乳酸杆菌和干酪乳杆菌Lactobacilluscasei)治疗8周后,轻度和中度溃疡性结肠癌活跃期患者临床活动指数评分明显提高[31];双歧杆菌菌株养乐多和低聚半乳糖共同治疗1年后,轻度和中度溃疡性结肠癌患者临床症状明显改善,髓过氧化物酶的数量、粪便中类杆菌的数量以及粪便pH都显著降低了[38]。在结肠炎相关癌症的小鼠模型中,干酪乳杆菌可以通过抑制IL-6信号转导进而抑制结肠炎相关癌症,并且伴随着肠道菌群失衡的改善[39]。
近些年来随着研究的不断深入,肠道菌群对肠外肿瘤(肝癌和乳腺癌)也有一定程度的改善。香港大学生物科学学院研究者报道称新型益生菌混合物prohep抑制了肝癌HCC的生长[7]。美国阿肯色大学医学院学者报道称肠道菌群多样化程度与绝经后女性乳腺癌发病密切相关,机体肠道菌群多样化程度高增加了体内雌激素代谢产物存留量,降低绝经后女性患乳腺癌的风险[6]。
3.2 分子机制
目前益生菌抑制结肠癌的分子机制主要有两种,一是益生菌通过下调结肠癌细胞ErbB2和ErbB3分泌,降低转录因子E2F-1和周期调控蛋白cyclin D1的表达,从而阻断肿瘤发展密切相关的ErbB信号通路,抑制肿瘤细胞的生长;二是益生菌通过抑制结肠上皮细胞Toll样受体4(TLR4)的表达减少炎性因子TNF-α的产生,阻断TLR4介导的Wnt/β-catenin信号通路拮抗大肠癌的发生[40-41]。
最近香港大学研究员于PNAS杂志上报道了益生菌治疗肠外肿瘤的分子调控机制,称新型益生菌混合物prohep主要通过调节肠道菌群增加有益菌丰度,释放抗炎因子IL-10,并降低促炎因子IL-17及其上游免疫T细胞Th17等代谢产物的表达,进而阻止炎症和肿瘤血管生成[7](表1)。到目前为止,关于肠道微生物抑制肿瘤的分子机制还不完全清楚。
到目前为止,益生菌参与肿瘤抑制的分子机制的大部分研究都是从抗炎因子出发,从而减少肿瘤微环境的炎症反应进而抑制肿瘤的生长。原癌基因激活也是肿瘤发生的一个重要因素,也许可以通过激活抑癌基因来调控机体反应[42],最终达到消灭肿瘤的目的。
4 肠道微生物对肿瘤临床预后的影响
肠道微生物除了参与肿瘤的发生发展外,还对肿瘤患者治疗的临床预后有一定作用。Wei等[43]研究发现,具核梭杆菌(Fusobacteriumnucleatum)、脆弱拟杆菌(BacteroidesFragilis)和柔嫩梭菌(Faecalibacteriumprausnitzii)是结直肠癌预后的生物标志物,而且主要通过增加炎症反应来加重患者的预后情况,其中预后较差的结直肠癌患者肿瘤组织中具核梭杆菌和脆弱类杆菌的丰度较高,而预后较好的结直肠癌患者肿瘤组织中柔嫩梭菌的丰度高。高丰度的具核梭杆菌增加了炎症因子TNF-β、β-catenin和NF-κB的表达,高丰度的脆弱拟杆菌增加了炎症因子COX-2、MMP-9和NF-κB的表达,可以识别高危患者的菌血症[43]。不同的肠道微生物组合可以预测结肠癌的发生,而且改变肠道微生物的种类可以改变结肠癌的发生[20]。肠道微生物对肿瘤预后的影响将是未来发展的一个有益的研究方向。
5 展望
肠道菌群失调与平衡可以诱导或缓解肠道炎症反应并释放不同的代谢产物,调控肿瘤血管生成、细胞增殖或凋亡,最终促进或抑制肿瘤细胞的发生发展,所以深入研究肠道微生物促癌抑癌的分子机理将是肿瘤防治与研究的重点。目前关于肠道微生物与结直肠癌的体内外研究相对较多,而与肠外肿瘤的关系缺乏全面、系统的探究,知之甚少。因此,在结直肠癌方面,我们还应该探寻肠道微生物的多样性组成,细菌分布与疾病分期的关系以及与结直肠癌相关的微生物标志物,以便为癌症患者提供精准的预防与治疗服务;在肠外肿瘤方面,我们应该寻找与肠道微生物有关的不同肿瘤类型,探讨癌症发生发展的分子机制以及开发新的特效药,以期为癌症患者提供有效的预防治疗手段。近年来,随着人们对健康的要求不断提高,益生菌食品及相关保健品也大量出现,这不仅增加了人们对有益菌生理功能的认识,而且为通过调节肠道微生物来预防肿瘤奠定了基础。
[1]Tlaskalova-Hogenova H,Stepankova R,Kozakova H,et al. The role of gut microbiota(commensal bacteria)and the mucosal barrier in the pathogenesis of inflammatory and autoimmune diseases and cancer:contribution of germ-free and gnotobiotic animal models of human diseases[J]. Cell Mol Immunol,2011,8(2):110-120.
[2]刘慧,孙涛. 肠道菌群失调的研究进展[J]. 医学综述,2014,20(3):468-471.
[3]任洁,罗彦英. 肠道微生物与肠道疾病[J]. 中国中西医结合外科杂志,2015,21(6):632-635.
[4]Zhu Y,Michelle Luo T,Jobin C,et al. Gut microbiota and probiotics in colon tumorigenesis[J]. Cancer Lett,2011,309(2):119-127.
[5]Zackular J P,Baxter N T,Iverson K D,et al. The gut microbiome modulates colon tumorigenesis[J]. MBio,2013,4(6):e00692-00713.
[6]Fuhrman B J,Feigelson H S,Flores R,et al. Associations of the fecal microbiome with urinary estrogens and estrogen metabolites in postmenopausal women[J]. J Clin Endocrinol Metab,2014,99(12):4632-4640.
[7]Li J,Sung C Y,Lee N,et al. Probiotics modulated gut microbiota suppresses hepatocellular carcinoma growth in mice[J]. Proc Natl Acad Sci U S A,2016,113(9):E1306-15.
[8]Topping D L,Clifton P M. Short-chain fatty acids and human colonic function:roles of resistant starch and nonstarch polysaccharides[J]. Physiol Rev,2001,81(3):1031-1064.
[9]Fung K Y,Brierley G V,Henderson S,et al. Butyrate-induced apoptosis in HCT116 colorectal cancer cells includes induction of a cell stress response[J]. J Proteome Res,2011,10(4):1860-1869.
[10]Lazarova D L,Wong T,Chiaro C,et al. p300 Influences Butyrate-Mediated WNT Hyperactivation In Colorectal Cancer Cells[J]. J Cancer,2013,4(6):491-501.
[11]Arthur J C,Gharaibeh R Z,Muhlbauer M,et al. Microbial genomic analysis reveals the essential role of inflammation in bacteria-induced colorectal cancer[J]. Nat Commun,2014(5):4724.
[12]Arthur J C,Perez-Chanona E,Muhlbauer M,et al. Intestinal inflammation targets cancer-inducing activity of the microbiota[J]. Science,2012,338(6103):120-123.
[13]Venkatesh M,Mukherjee S,Wang H,et al. Symbiotic bacterial metabolites regulate gastrointestinal barrier function via the xenobiotic sensor PXR and Toll-like receptor 4[J]. Immunity,2014,41(2):296-310.
[14]Sirk T W,Friedman M,Brown E F. Molecular binding of black tea theaflavins to biological membranes:relationship to bioactivities[J]. J Agric Food Chem,2011,59(8):3780-3787.
[15]Ramirez-Farias C,Slezak K,Fuller Z,et al. Effect of inulin on the human gut microbiota:stimulation of Bifidobacterium adolescentis andFaecalibacteriumprausnitzii[J]. Br J Nutr,2009,101(4):541-550.
[16]Mills D J,Tuohy K M,Booth J,et al. Dietary glycated protein modulates the colonic microbiota towards a more detrimental composition in ulcerative colitis patients and non-ulcerative colitis subjects[J]. J Appl Microbiol,2008,105(3):706-714.
[17]Zhang C,Zhang M,Pang X,et al. Structural resilience of the gut microbiota in adult mice under high-fat dietary perturbations[J]. ISME J,2012,6(10):1848-1857.
[18]Ghosh S,Molcan E,DeCoffe D,et al. Diets rich in n-6 PUFA induce intestinal microbial dysbiosis in aged mice[J]. Br J Nutr,2013,110(3):515-523.
[19]Neyrinck A M,Possemiers S,Druart C,et al. Prebiotic effects of wheat arabinoxylan related to the increase in Bifidobacteria,Roseburia and Bacteroides/Prevotella in diet-induced obese mice[J]. PLoS One,2011,6(6):e20944.
[20]Zackular J P,Baxter N T,Chen G Y,et al. Manipulation of the Gut Microbiota Reveals Role in Colon Tumorigenesis[J]. mSphere,2016,1(1):e00001-00015.
[21]Kado S,Uchida K,Funabashi H,et al. Intestinal microflora are necessary for development of spontaneous adenocarcinoma of the large intestine in T-cell receptor beta chain and p53 double-knockout mice[J]. Cancer Res,2001,61(6):2395-2398.
[22]Rhee K J,Wu S,Wu X,et al. Induction of persistent colitis by a human commensal,enterotoxigenic Bacteroides fragilis,in wild-type C57BL/6 mice[J]. Infect Immun,2009,77(4):1708-1718.
[23]Kostic A D,Chun E,Robertson L,et al.Fusobacteriumnucleatumpotentiates intestinal tumorigenesis and modulates the tumor-immune microenvironment[J]. Cell Host Microbe,2013,14(2):207-215.
[24]Rubinstein M R,Wang X,Liu W,et al.Fusobacteriumnucleatumpromotes colorectal carcinogenesis by modulating E-cadherin/beta-catenin signaling via its FadA adhesin[J]. Cell Host Microbe,2013,14(2):195-206.
[25]McCoy A N,Araujo-Perez F,Azcarate-Peril A,et al. Fusobacterium is associated with colorectal adenomas[J]. PLoS One,2013,8(1):e53653.
[26]Flanagan L,Schmid J,Ebert M,et al.Fusobacteriumnucleatumassociates with stages of colorectal neoplasia development,colorectal cancer and disease outcome[J]. Eur J Clin Microbiol Infect Dis,2014,33(8):1381-1390.
[27]Keku T O,McCoy A N and Azcarate-Peril A M.Fusobacteriumspp. and colorectal cancer:cause or consequence?[J]. Trends Microbiol,2013,21(10):506-508.
[28]Flemer B,Lynch D B,Brown J M,et al. Tumour-associated and non-tumour-associated microbiota in colorectal cancer[J]. Gut,2016. pii:gutjnl-2015-309595.
[29]Acharyya S,Oskarsson T,Vanharanta S,et al. A CXCL1 paracrine network links cancer chemoresistance and metastasis[J]. Cell,2012,150(1):165-178.
[30]Wang D,Wang H,Brown J,et al. CXCL1 induced by prostaglandin E2 promotes angiogenesis in colorectal cancer[J]. J Exp Med,2006,203(4):941-951.
[31]Mitsuyama K and Sata M. Gut microflora:a new target for therapeutic approaches in inflammatory bowel disease[J]. Expert Opin Ther Targets,2008,12(3):301-312.
[32]张国亮,冀朵朵,金苏,等. 乳酸菌抑制ACE及病原菌代谢产物研究进展[J]. 食品工业科技,2009,30(11):332-335.
[33]李少慧,张英春,张兰威,等. 乳酸菌及其代谢产物对肠道炎症的调控作用研究进展[J]. 食品工业科技,2014,35(18):366-369.
[34]Achuthan A A,Duary R K,Madathil A,et al. Antioxidative potential of lactobacilli isolated from the gut of Indian people[J]. Mol Biol Rep,2012,39(8):7887-7897.
[35]Matthews G M,Howarth G S,Butler R N. Short-chain fatty acids induce apoptosis in colon cancer cells associated with changes to intracellular redox state and glucose metabolism[J]. Chemotherapy,2012,58(2):102-109.
[36]Tanriover M D,Aksoy D Y,Unal S. Use of probiotics in various diseases:evidence and promises[J]. Pol Arch Med Wewn,2012,122(Suppl 1):72-77.
[37]Walker A W and Lawley T D. Therapeutic modulation of intestinal dysbiosis[J]. Pharmacol Res,2013,69(1):75-86.
[38]Ishikawa H,Matsumoto S,Ohashi Y,et al. Beneficial effects of probiotic bifidobacterium and galacto-oligosaccharide in patients with ulcerative colitis:a randomized controlled study[J]. Digestion,2011,84(2):128-133.
[39]Matsumoto S,Hara T,Nagaoka M,et al. A component of polysaccharide peptidoglycan complex on Lactobacillus induced an improvement of murine model of inflammatory bowel disease and colitis-associated cancer[J]. Immunology,2009,128(Suppl 1):e170-180.
[40]Ma E L,Choi Y J,Choi J,et al. The anticancer effect of probiotic Bacillus polyfermenticus on human colon cancer cells is mediated through ErbB2 and ErbB3 inhibition[J]. Int J Cancer,2010,127(4):780-790.
[41]Yang X,Fu Y,Liu J,et al. Impact of probiotics on toll-like receptor 4 expression in an experimental model of ulcerative colitis[J]. J Huazhong Univ Sci Technolog Med Sci,2013,33(5):661-665.
[42]Sun T,Liu S,Zhou Y,et al. Evolutionary biologic changes of gut microbiota in an ‘adenoma-carcinoma sequence’ mouse colorectal cancer model induced by 1,2-Dimethylhydrazine[J]. Oncotarget,2016,[Epub ahead of print].
[43]Wei Z,Cao S,Liu S,et al. Could gut microbiota serve as prognostic biomarker associated with colorectal cancer patients’ survival? A pilot study on relevant mechanism[J]. Oncotarget,2016.[Epub ahead of print].
Advance in research of the relationship between gut microbiota and intestinal tumor regulation
YANG Li-na,ZHU Li-jie,WANG Bo,MA Tao*
(College of Food Science and Technology,Bohai University,National & Local Joint Engineering Research Center of Storage, Processing and Safety Control Technology for Fresh Agricultural and Aquatic Products,Jinzhou 121013,China)
Gut microbiota was closely related to tumor development. It had been a hot topic in many fields of basic medicine,biology and food safety. Due to the diversity of gut microbiota species,tumor types and research methods,there was not a clear relationship between gut microbiota and tumor. Therefore,in order to provide reference for gut microbes treat tumor,the recent paper about relationship between gut microbiota and tumor development and molecular mechanism were described.
gut microbiota;tumor regulation;intestinal tumor;probiotics
2016-09-29
杨立娜(1987-),女,博士,讲师,主要从事食品营养与肿瘤防治研究,E-mail:398510872@qq.com。
*通讯作者:马涛(1962-),男,博士,教授,主要从事粮油与植物蛋白工程研究,E-mail:matao-09@163.com。
国家自然科学基金青年基金项目(31601510)。
TS201
A
1002-0306(2017)07-0371-05
10.13386/j.issn1002-0306.2017.07.063
