响应面法优化木瓜蛋白酶提取红稗多糖工艺
2017-04-13母应春李泽秀黎以栾
苏 伟,宋 玉,母应春,李泽秀,黎以栾
(贵州大学酿酒与食品工程学院,贵州贵阳 550025)
响应面法优化木瓜蛋白酶提取红稗多糖工艺
苏 伟,宋 玉,母应春,李泽秀,黎以栾
(贵州大学酿酒与食品工程学院,贵州贵阳 550025)
在单因素实验基础上应用响应面法对木瓜蛋白酶提取红稗多糖工艺进行优化。优化的木瓜蛋白酶提取红稗多糖的最佳工艺条件如下:加酶量0.3%、酶作用时间1.0 h、酶作用pH6.5、酶作用温度50 ℃,在此条件下,多糖得率为28.47%。优化的木瓜蛋白酶法提取红稗多糖工艺合理、可行。
木瓜蛋白酶,红稗多糖,工艺优化
红稗(Bacca sedge)是一种表皮为红褐色的粒子,也叫野红米草、红米和芭茅草等,最初记载于《滇南本草》,属于莎草科苔属植物[1]。红稗是贵州,四川,云南等西南地区的一种特色杂粮,是云南民间一种习用药。在很早以前,民间就将红稗当成食物食用,但因其产量低,且不是主要粮食,所以对其研究较少。红稗营养价值丰富,主要含有粗蛋白质5.20%,总糖76.73%,粗纤维2.57%,水分10.15%,粗脂肪2.66%,灰分2.21%,红稗所含的必需氨基酸组成比例和人体需求相近,与FAO/WHO推荐模式较为符合[2],所以,红稗将来很有可能成为一种较好的功能性食品原料。目前,研究发现多糖及其复合物,可参与和介导细胞的各种生命现象调节,具有抗氧化、抗肿瘤、免疫调节、降血糖、抗病毒、降血脂等生物活性[3]。
李泽秀[4]等对红稗多糖超声提取工艺进行了系统的研究,但其使用的是sevage法(三氯甲烷∶正丁醇=5∶2)来除掉蛋白,这种方法不仅耗时,而且提取率也比较低(仅23.82%)。因此,优化红稗中多糖的提取工艺对红稗多糖的开发利用具有一定意义。目前,最常用于多糖提取的方法主要有水提醇沉法[5-7]、超声辅助提取法[8-11]以及微波辅助提取法[12-16]、酶提法[17-22]等。本实验采用响应面法优化木瓜蛋白酶法提取红稗多糖工艺,简化了除蛋白的过程,为以后开发和利用红稗多糖提供理论基础和科学依据。
1 材料与方法
1.1 材料与仪器
红稗 由贵州省遵义市君惠园食品有限公司提供;木瓜蛋白酶(酶活性80万U/g) 购自广西庞博生物工程有限公司;其他试剂 均为国产分析纯。
FW135粉碎机、DK-98-IIA电热恒温水浴锅 天津市泰斯特仪器有限公司;101型电热鼓风干燥箱 北京市光明医药仪器厂;BS124S电子天平 赛多利斯科学仪器(北京)有限公司;HN88-Hl超声波细胞粉碎机 上海汗诺仪器有限公司;TDl8M台式低速冷冻离心机 长沙湘仪器仪表有限公司;T6新世纪紫外分光光度计 北京市普析通用仪器有限责任公司。
1.2 实验方法
1.2.1 葡萄糖标准曲线的绘制 提取液中的多糖含量测定采用苯酚硫酸法[23],称105 ℃干燥至质量恒定的葡萄糖50 mg,用超纯水溶解并定容至50 mL,精确量取2.5 mL葡萄糖溶液用超纯水定容至50 mL的容量瓶中,配制成葡萄糖标准溶液,精确量取配制好的葡萄糖标准溶液0.0、0.1、0.2、0.4、0.6、0.8、1.0 mL,分别置于干燥带塞的试管中,加超纯水到1.0 mL,依次加入1.0 mL的5%苯酚溶液,摇匀,再依次滴加5.0 mL的浓硫酸,摇匀,盖好玻璃塞于室温下静置30 min,于490 nm下,调空白对照组的吸光度为零,测定其吸光度。以吸光度(A)为纵坐标、葡萄糖浓度(C)为横坐标绘制葡萄糖的标准曲线图,其回归方程为:Y=0.0036x-0.0036(R2=0.9987)。
1.2.2 红稗多糖提取工艺流程 红稗→除杂→粉碎→过筛→烘干→乙醇浸泡脱色→烘干→甲醇回流脱脂→烘干→磷酸氢二钠-柠檬酸缓冲溶液超声波破碎提取→加酶→水浴提取→离心取上清液→加苯酚和浓硫酸→紫外分光光度计测吸光值→乙醇沉淀→乙醇、丙酮洗涤→真空冷冻干燥→红稗粗多糖[24]。
1.2.3 多糖的提取与含量测定 新鲜红稗清洗,除杂,粉粹,过120目筛,烘干,用乙醇溶剂脱色3次,每次15 min,再用甲醇在冷凝管中回流脱脂,在80 ℃的水浴锅中加热6 h,烘干,称取1.0 g的红稗粉于烧杯中,加入20倍体积的pH4.5磷酸氢二钠-柠檬酸缓冲溶液,用超声破碎提取15 min,加木瓜蛋白酶水解,然后4000 r/min离心10 min,取上清液1 mL,用苯酚-硫酸法测定多糖含量,按式(1)计算红稗多糖的得率。
式(1)
式中:Y为红稗多糖的得率(%);C为多糖的质量浓度(μg/g);F为样品稀释倍数;V为加入反应液的总体积(mL);m为样品准确称取的质量(g)。
1.2.4 单因素实验 选取加酶量,酶作用时间,酶作用pH和酶作用温度四个因素,每个因素设置3个水平,每个水平重复三次:准确称取脱脂过的红稗粉1.0 g左右,加入20倍体积的pH4.5磷酸氢二钠-柠檬酸缓冲溶液[25],超声15 min,冷却至室温,依次加入相当于红稗粉质量比0.1%、0.2%、0.3%、0.4%、0.5%的木瓜蛋白酶,于50 ℃的水浴锅中提取60 min,离心(10 min,4000 r/min),取上清液,使用苯酚-硫酸比色法检测多糖含量,考察不同加酶量对多糖得率的影响;固定加酶量为0.3%,酶作用pH为4.5,酶解温度为50 ℃,其余步骤同上,比较不同酶作用时间(30、45、60、75、90 min)对红稗多糖提取得率的影响;控制加酶量为0.3%,酶作用温度为50 ℃,酶作用时间为60 min,通过加入20倍体积的pH为3.5、4.5、5.5、6.5、7.5的磷酸氢二钠-柠檬酸缓冲溶液,比较不同酶解pH对红稗多糖得率的影响;控制加酶量为0.3%,酶作用时间为60 min,酶作用pH为6.5,比较不同酶解温度(20、30、40、50、60 ℃)对红稗多糖得率的影响。按照公式(1)计算多糖的得率。
1.2.5 优化实验 响应面法对红稗多糖提取条件优化,根据Box-Behnken的中心组合实验设计原理,选取4因素(加酶量,酶作用pH,酶作用时间,酶作用温度)3水平对红稗多糖提取条件进行优化,实验因子和水平见表1。
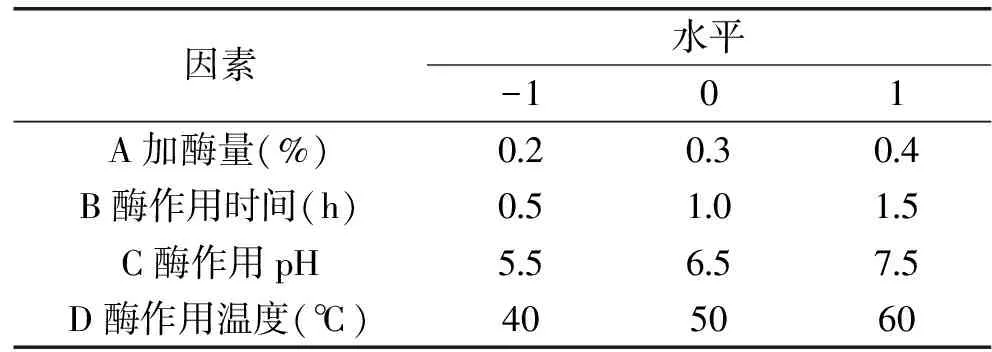
表1 Box-Behnken设计因素水平表Table 1 Factors and levels used in Box-Behnken
1.2.6 数据处理 实验数据采用Origin 9.0软件作图,Design-Expert 8.0.6软件进行方差分析。
2 结果与分析
2.1 单因素实验
2.1.1 木瓜蛋白酶加酶量对红稗多糖得率的影响 由图1可知,在加酶量低于0.3%时,随着木瓜蛋白酶加酶量的增大,红稗多糖得率逐渐增大,当加酶量超过0.3%以后,多糖得率趋于平缓。说明酶用量在0.3%之前,底物和酶没有充分的结合,而在0.3%的酶浓度时,底物和酶已经完全结合,多糖已经完全释放,当再增大酶用量时,增加的酶分子也没有机会与底物结合,多糖得率就很难以有显著增加。因此,选择木瓜蛋白酶加酶量为0.3%。
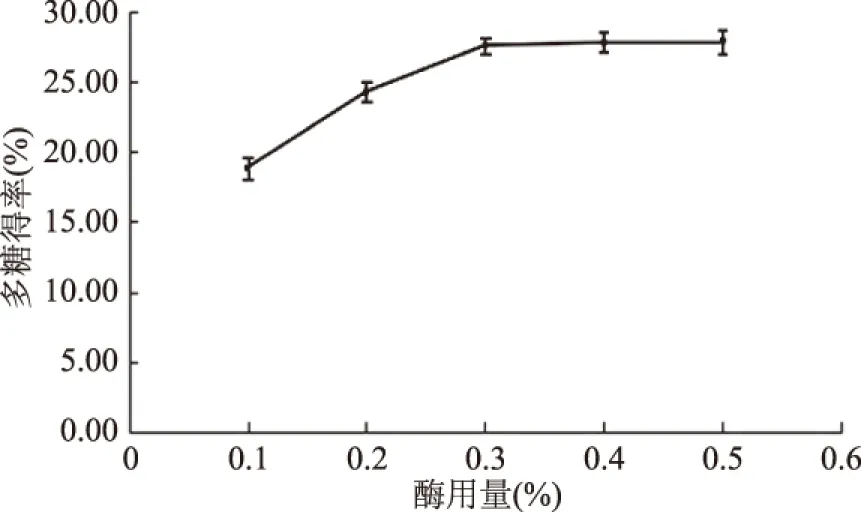
图1 不同加酶量对红稗多糖得率的影响Fig.1 Effect of enzyme amount on the extraction yield of polysaccharide of Baccage sedge

图2 不同酶作用时间对红稗多糖得率的影响Fig. 2 Effect of different enzymolysis time on the extraction yield of polysaccharide of Baccage sedge
2.1.2 木瓜蛋白酶作用时间对红稗多糖得率的影响 由图2可知,在60 min之前随着酶解时间的延长,红稗多糖得率呈上升趋向,在60 min时到达极值,而后随着酶解时间的延长,红稗多糖得率反而呈下降趋势,这估计是由于有些糖苷键因提取时间过长而在蛋白酶的催化作用下被裂解了,或者是提取时间太久使得多糖的结构发生了变化。因此选择酶作用时间为60 min。
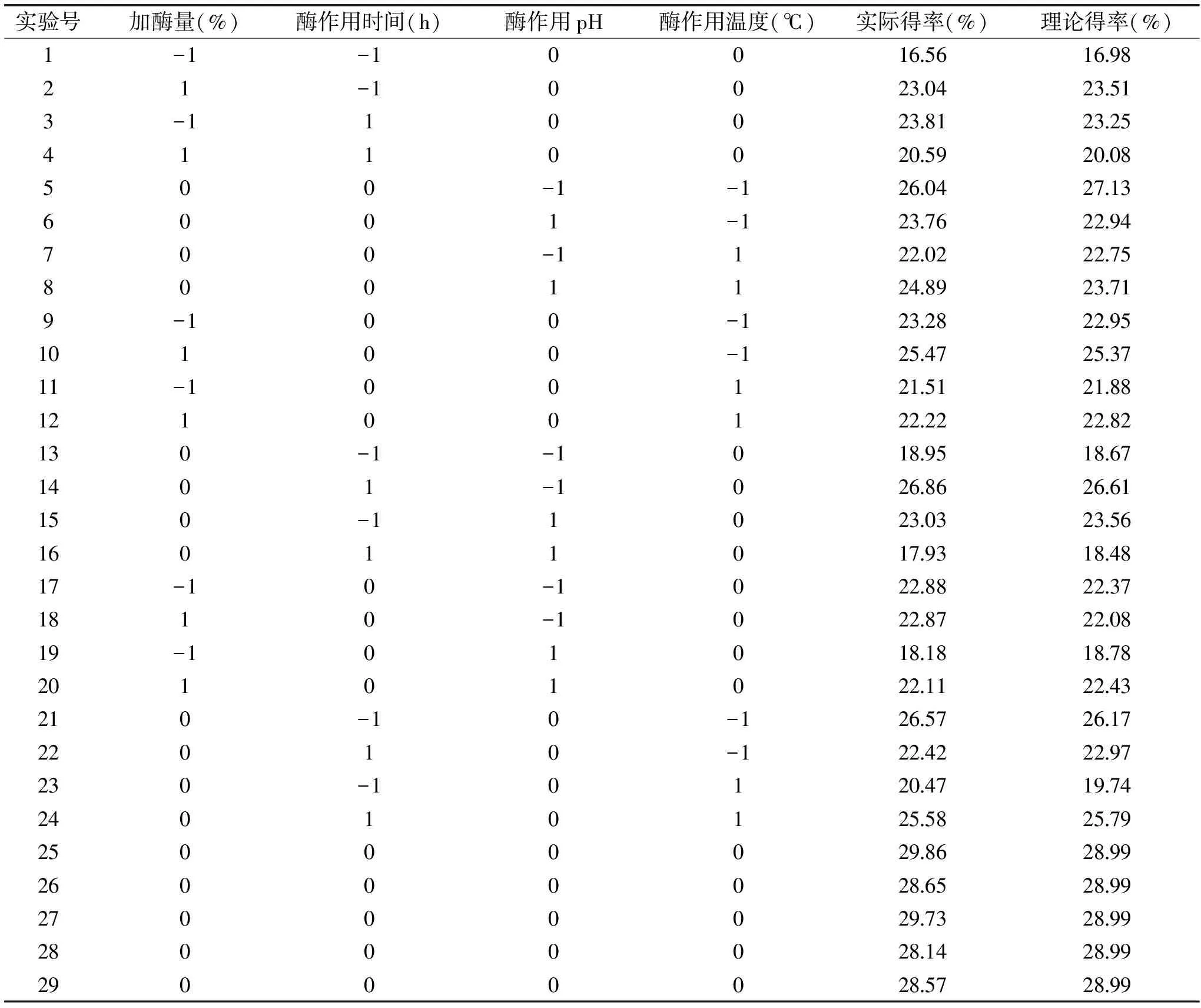
表2 响应面实验设计及结果Table 2 Experimental design and results for response surface analysis
2.1.3 木瓜蛋白酶酶解pH对多糖得率的影响 由图3可知,在pH6.5之前随着pH的增大,红稗多糖的得率逐渐增加,当增加到pH6.5时,红稗多糖的得率达到极值,随后再继续增大pH,红稗多糖得率反而呈下降趋势。因为木瓜蛋白酶的最适pH在6.5左右,pH除了对酶活性有很大影响外,对酶的稳定性也有很大影响。过高过低的pH会改变酶的活性中心的构象,甚至改变整个酶分子的结构使其变性失活,从而影响红稗多糖的得率。因此最佳pH选择6.5。
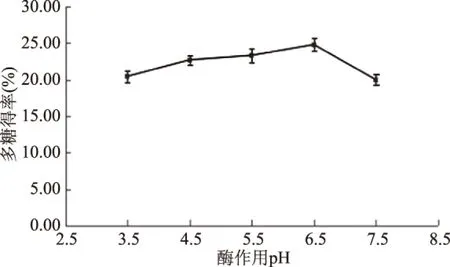
图3 不同酶作用pH对红稗多糖得率的影响Fig.3 Effect of different pH value on the extraction yield of polysaccharide of Baccage sedge
2.1.4 木瓜蛋白酶作用温度对红稗多糖得率的影响 由图4可得知,在50 ℃之前随着酶作用温度的升高,红稗多糖得率逐渐增大,于50 ℃时多糖得率达到最大值,而当温度大于50 ℃后多糖得率出现下降的趋势,出现以上的现象是因为温度对酶促反应和细胞扩散反应具有双重影响,木瓜蛋白酶的最适作用温度为50 ℃左右,当温度过高会使酶活力降低甚至失去活性,使得多糖得率下降。因此,最佳温度选择50 ℃。
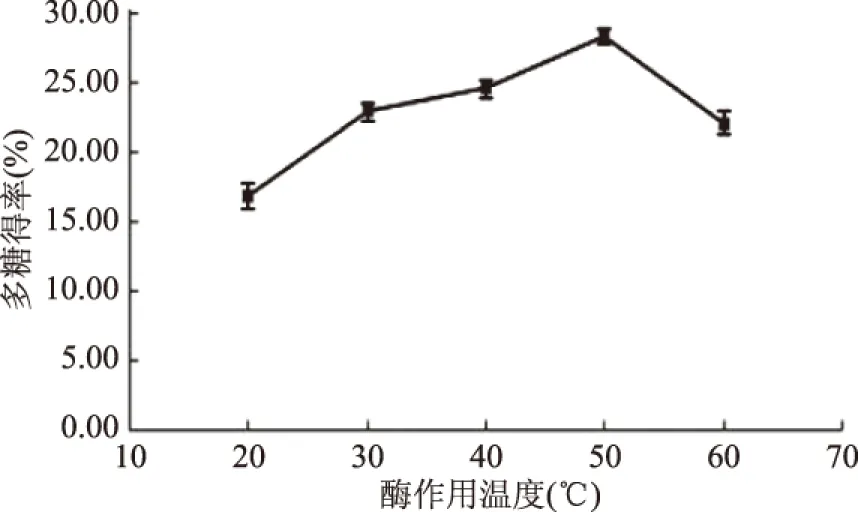
图4 不同酶作用温度对红稗多糖得率的影响Fig.4 Effect of different enzymolysis temperature on the extraction yield of polysaccharide of Baccage sedge
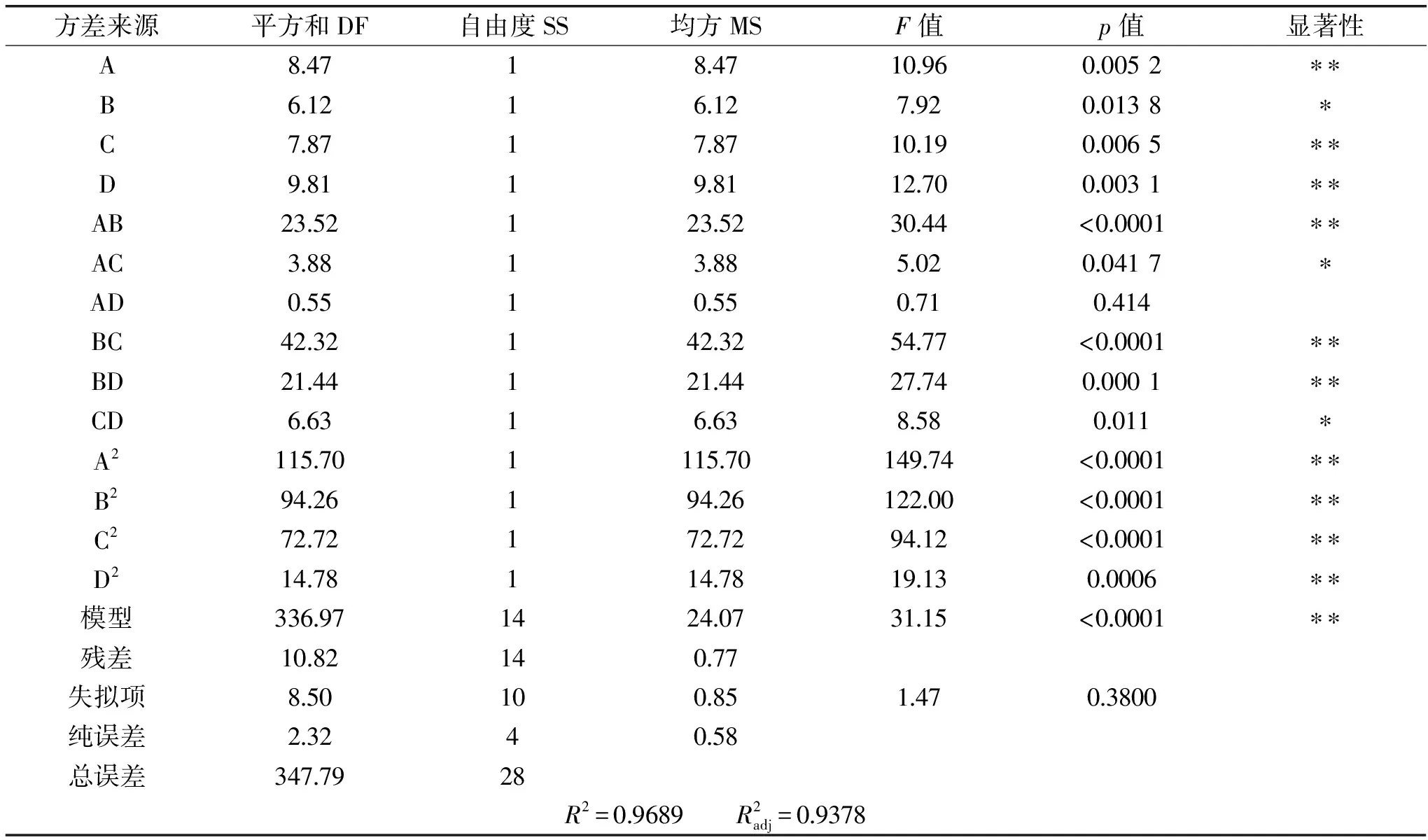
表3 响应面ANOVA分析结果Table 3 Response surface analysis results ANOVA
注:p<0.01,为差异极显著,用“**”表示;p<0.05,为差异显著,用“*”表示;p>0.05,为不显著。
2.2 响应面实验
2.2.1 木瓜蛋白酶对红稗多糖提取工艺的响应面优化 以单因素实验为基础,采用Box-Behnken的中心原理进行实验,以多糖得率(%)作为响应值。以加酶量(%),酶作用时间(h),酶作用pH,酶作用温度(℃)四因素作为自变量,结果如表2所示。
用响应面分析软件Design-Expert 8.0.6对表2的数据进行多元回归拟合,实验数据拟合分析(analysis of variance,ANOVA)结果见表3。
各个实验因素对响应值(红稗多糖得率)的影响,可以通过以下回归拟合后与红稗多糖得率(Y)的回归方程表示:
Y=28.99+0.84A+0.71B-0.81C-0.90D-2.43AB+0.98AC-0.37AD-3.25BC+2.31BD+1.29CD-4.22A2-3.81B2-3.35C2-1.51D2

2.2.2 各因素对红稗多糖得率交互影响的响应面图 各图显示酶作用时间,酶作用温度,加酶量,酶作用pH任意两个因素之间的交互作用对红稗多糖得率(Y)的影响,由响应面三维图的最高点可以看出,在所选因素的范围内有极值存在,这个值就是响应面的最高点。
使用Design Expert 8.0.6软件对实验数据进行处理,并绘制得出加酶量、酶作用时间、酶作用pH及酶作用温度对响应值红稗多糖得率的交互影响的曲面图,各因素固定值为0水平值,结果如图5所示。
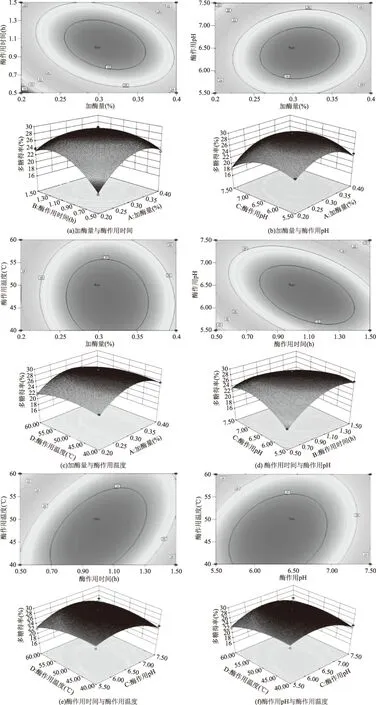
图5 各因素对红稗多糖得率交互影响的响应面图Fig.5 Response surface graphs showing the interactive effects of hydrolysis conditions on Baccage sedge
由图5(a)、图5(c)、图5(d)、图5(e)、图5(f)得,等高线呈椭圆形,说明加酶量和酶作用时间、加酶量和酶作用温度、酶作用时间和酶作用pH、酶作用时间和酶作用温度、酶作用pH和酶作用温度均存在交互作用。由图5(b)可知,其等高线形状接近圆形,说明加酶量和酶作用时间这两因素交互作用不明显。用软件Design Expert 8.0.6 分析得到最优工艺参数为:加酶量0.31%,酶作用时间1.02 h,酶作用温度50.39 ℃,酶作用pH6.35,红稗多糖的得率为29.28%。
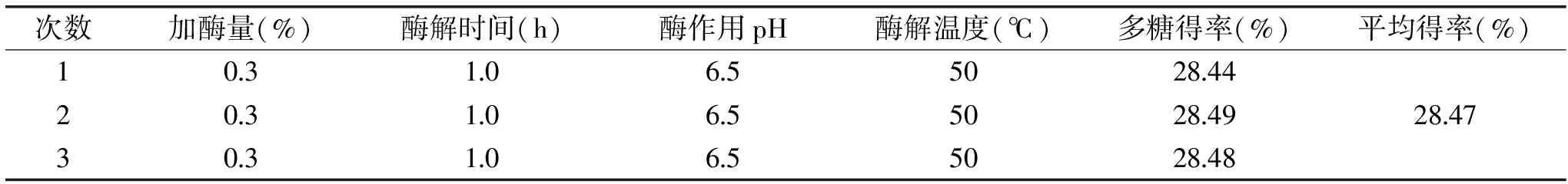
表4 最佳提取条件验证实验Table 4 Verification experiment of the optimal extraction conditions
2.2.3 验证实验 为了验证响应面法的可行性,采用得到的最佳提取条件进行红稗多糖浸提的验证实验,见表4,同时考虑到实际操作和生产条件等因素,修正工艺参数为:加酶量0.3%,酶作用时间1.0 h,酶作用温度50 ℃,酶作用pH6.5,进行3次平行实验得到的多糖实际得率28.47%,与预测值29.28%,相对误差为0.81%。因此,响应面法优化木瓜蛋白酶对红稗多糖提取条件是可行的,得到的红稗多糖提取条件是具有实际应用价值的。
3 结论
木瓜蛋白酶是一种含巯基(—SH)肽链内切酶,具有蛋白酶和酯酶的活性[25],在红稗多糖提取过程中可使红稗中的游离蛋白质发生水解,并进一步水解蛋白等结合蛋白中的蛋白质,减少它们与红稗多糖的结合力,有利于红稗多糖的溶出,同时也提高了红稗多糖的纯度,简化了红稗多糖的提取工艺。
本实验采用响应面法优化木瓜蛋白酶提取红稗多糖工艺,通过F值得出,四个因素对红稗多糖得率的影响顺序从大到小依次为:酶作用的温度>加酶量>酶作用的pH>酶作用的时间。经单因素和响应面实验,得出木瓜蛋白酶提取红稗多糖的最佳工艺为加酶量0.3%、酶作用pH6.5、酶作用时间1.0 h、酶作用温度50 ℃,在此条件下得到的实际多糖得率为28.47%,与预测值的相对误差仅为2.77%,表明Box-Benhnken设计法用于木瓜蛋白酶提取红稗多糖工艺优化是可行的。李泽秀[4]等人采用超声波辅助分离提取红稗多糖,实验结果得到实际多糖得率为23.82%,这表明木瓜蛋白酶辅助提取红稗多糖优于超声提取。
[1]《全国中草药汇编》编写组.全国中草药汇编[G].北京:人民卫生出版,1975.
[2]徐本刚,苏伟.红稗的营养成分分析[J].贵州农业科学,2010,38(9):76-77.
[3]Martin Gericke,Thomas Heinze. Homogeneous tosylation of agarose as an approach toward novel functional polysaccharide materials[J].Carbohydrate Polymers,2015,127:236-245.
[4]李泽秀,文飞,苏伟,等.红稗多糖提取工艺优化及其流变学特性研究[J].食品科技,2015,40(12):148-149.
[5]孙莹,纪跃芝,马爱民,等.水提醇沉法提取大黄多糖工艺优化研究[J].中国实用医药,2015,5(18):6-8.
[6]张颖,潘俊羽.枇杷叶多糖水提醇沉法的提取条件优化[J].贵州农业科学,2014,42(6):161-163.
[7]高凯翔,李秋庭.茶皂素的提取工艺研究[J].粮油食品科技,2010,18(5):22-25.
[8]郑东宝,郑金贵,曾绍校,等.果蔬多糖的研究状态及应用前景[J].食品科学,2003,24(18):152-153.
[9]莫开菊,谢笔均,汪兴平,等.葛仙米多糖的提取、分离与纯化技术研究[J].食品科学,2004(10):103-108.
[10]Li H,Pordesimo l,Weiss J. High intensity ultrasound-assisted extraction of oil from soybeans[J].Food Research Internation,2004,37:731-738.
[11]Zeng H,Zhang Y,Zhao Y,et al. Extraction optimization,structure and antioxidant activities of fortunella margarita Swingle polysaccharides[J].International Journal of Biological Macromolecules,2015,74:232-242.
[12]Preethi S,Mary Saral A. Screening of natural polysaccharides extracted from the fruits of pithecellobium dulce as a pharmaceutical adjuvant.[J].Internation Journal of Biological Macromolecules,2016,92:347-356.
[13]刘青梅,杨性民,邓红霞,等.采用微波技术提取紫菜多糖的工艺研究[J].农业工程学报,2005,21(2):153-156.
[14]毕春慧,沈莲清.响应面分析法优化雷丸多糖提取工艺的研究[J].食品科技,2010(8):217-221.
[15]江和源,蒋迎.茶叶多糖的微波辅助提取技术研究[J].食品科技,2003(10):17-19.
[16]唐仕荣,刘全德,苗敬芝.两种微波辅助萃取法萃取牛蒡多糖[J].食品科学,2009,30(18):102-105.
[17]可成友,梁宏斌,边蔷,等.北五味子多糖的酶法提取工艺研究[J].现代中药研究与实践,2010,24(2):47-50.
[18]Wu Z,Li H,Yang Y,et al. Ultrasonic extraction optimization of L. macranthoides polysaccharides and its physicochemical properties[J]. International Journal of Biological Macromolecules,2015,74:224-231.
[19]张高丽,李银平.浒苔多糖的酶法降解及其工艺条件优化的研究[J].食品工业科技,2016,18:202-207.
[20]Li SP,Zhao K J,Ji ZN,et al. A polysaccharide isolated from Cordyceps sinensis,a traditional Chinese medicine,protects PC12 cells against hydrogen peroxide-induced injury[J].Life Sciences,2003,73:2503-2513.
[21]Susan M Carnachan,Philip J Harris. Polysaccharide compositions of primary cell walls of the palms Phoenixcanariensis and Rhopalostylis sapida[J].Plant Physiology & Biochemistry,2000,38:699-708.
[22]龚文琼,刘睿.响应面法优化微波辅助提取普洱茶中茶色素工艺研究[J].食品科学,2010,31(8):137-142.
[23]张惟杰.糖复合物生化技术研究[M].杭州:浙江大学出版社,1999:11-12.
[24]王碧,廖立敏.木瓜蛋白酶法提取洋葱多糖研究[J].食品工业科技,2013,41(16):232-234.
[25]聂志勇.酶法提取姬松茸多糖的研究[D].长沙:中南大学,2009.
Optimization of extraction of polysaccharides from Baccage Sedge using papain by response surface methodology
SU Wei,SONG Yu,MU Ying-chun,LI Ze-xiu,LI Yi-luan
(School of Liquor and Food Engineering,Guizhou University,Guiyang 550025,China)
Based on the single factor experiments,the response surface methodology(RSM)was employed to optimize the extraction conditions of polysaccharides from Baccage sedge using papain. The results of optimum extraction conditions were as follow:enzyme amount 0.3%,enzyme time 1.0 h,pH6.5,temperature of 50 ℃. Under these conditions,the average extraction yield was 28.47%. The optimization of Baccage sedge extraction process technology was reasonable and feasible.
papain;Baccage sedge polysaccharide;extraction process
2016-10-19
苏伟(1974-),男,博士,副教授,研究方向:食品加工与安全,E-mail:suwei1886@163.com。
贵州省科技厅农业攻关项目(黔科合NY[2013]3052号)。
TS201.2
B
1002-0306(2017)07-0256-06
10.13386/j.issn1002-0306.2017.07.042
