浓香型白酒酿造大曲及糟醅中功能芽孢杆菌的筛选
2017-04-13赵长青
赵长青,徐 莎,杨 阳,赵 阳
(四川理工学院生物工程学院,四川自贡 643000)
浓香型白酒酿造大曲及糟醅中功能芽孢杆菌的筛选
赵长青,徐 莎,杨 阳,赵 阳
(四川理工学院生物工程学院,四川自贡 643000)
为从白酒酿造中分离筛选出有助于提高浓香型白酒风味成分的芽孢杆菌,本文从浓香型白酒酿造的大曲和糟醅中分离得到了55株芽孢杆菌,通过筛选得到了一株在发酵液中产生较多己酸乙酯和较少正丙醇的菌株,编号为YB-16,该菌株所产己酸乙酯含量符合国标高度优级酒的范围,所产正丙醇含量符合国标特级食用酒精的范围。通过对该菌株进行形态特征观察、生理生化特征分析、分子生物学鉴定和构建系统发育树,发现YB-16与Bacilluscereusstrain CCM NBRC 15305聚为一个分支,亲缘关系最近,可将菌株YB-16鉴定为蜡质芽孢杆菌(Bacilluscereus)。若将筛选的该Bacilluscereus应用至浓香型白酒传统酿造工艺,将能够提升浓香型白酒的香味和品质。
浓香型白酒,功能菌,芽孢杆菌
中国白酒历史悠久,其中泸州老窖特曲酒为典型代表的浓香型白酒。多年的研究证实,酿造过程中功能菌液的质量影响着窖泥微生物生态功能及酒糟发酵生态,从而决定着浓香型白酒的质量和风格特征[1]。浓香型白酒酿造微生物主要来源于酿酒大曲、窖泥、糟醅、原料及环境携带,但参与发酵产香微生物主要来自于大曲、窖泥、糟醅及人工添加的生香菌纯培养或复合菌液、强化曲、人工窖泥等[2-3]。
随着微生物学的发展和应用,我国对浓香型白酒产香或参与产香细菌的认识愈发细致,对其种群和分布情况做了深入研究。张丽莺研究了泸州老窖糟醅中的细菌区系,发现以芽孢杆菌和芽孢乳杆菌为主要类群[4]。施安辉研究了山东兰菱美大曲和崋县酒厂发酵糟醅中的细菌类群,发现优势菌为芽孢菌属[5]。刘莉萌等发现糟醅和窖泥中的乳酸菌以乳酸片球菌和芽孢乳杆菌为主[6-7]。还有研究表明:对浓香型白酒香气贡献最大的是梭状芽孢杆菌,其主要代谢产物是己酸、丁酸和氢[8]。由上述可知,窖池中的产香细菌均以芽孢杆菌为主。有报道称,芽孢杆菌也是大曲中数量较多的细菌之一,它具有一定水解蛋白质和淀粉的能力,在白酒固态发酵中能代谢生成多种风味成分[9]。因此,本文希望能够从酿酒大曲和糟醅中分离筛选出有助于提高浓香型白酒风味成分的芽孢杆菌。而己酸乙酯被确定为浓香型白酒的主体香味物质,成为制约浓香型白酒优质酒产率的重要因素[10-11]。
在分离高产己酸乙酯的芽孢杆菌时,应注意到所分离菌株产杂醇油的问题。由于杂醇油的含量过高则容易引起上头、口干[12];同时它也是白酒产生白色浑浊的原因之一[13],因此,我国对白酒中杂醇油的含量有明确的规定。作为杂醇油的重要组分之一,被认为是酒精发酵副产物的正丙醇已经成为我国新食品酒精质量标准中的一项质量指标[14]。因此,本文希望能够分离出高产己酸乙酯和低产正丙醇的功能芽孢杆菌。
1 材料与方法
1.1 材料及仪器
大曲和糟醅 均由泸州老窖提供,取样于2015年1月;色谱纯己酸乙酯、正丙醇、乙酸正戊酯(规格:5 mL) 天津市光复精细化工所;无水乙醇(优级纯) 成都市科龙化工试剂厂;气相色谱仪(型号:GC-7860) 上海宜友电子科技有限公司;色谱柱(型号:DB-WAX) 南京伽诺色谱技术有限公司。
1.2 培养基
富集培养基:乙酸钠改良培养基:乙酸钠5 g,硫酸铵0.5 g,磷酸氢二钾0.4 g,七水硫酸镁0.2 g,酵母膏1 g,碳酸钙5 g,蒸馏水1000 mL,pH6.0~pH6.5,以121 ℃灭菌20 min,接种前加无水乙醇20 mL[14]。
苏氨酸液体发酵培养基:葡萄糖30 g,酵母膏1 g,氯化钠6 g,巴豆酸 2 g,苏氨酸 2.5 g,蒸馏水1000 mL,115 ℃灭菌30 min[14]。
LB(Luria-Bertani)培养基[15]:蛋白胨10 g,酵母膏5 g,氯化钠10 g,琼脂15 g,蒸馏水1000 mL,pH7.0,121 ℃灭菌20 min。
1.3 芽孢杆菌的分离
取2.0 g大曲和糟醅混合样品于100 mL灭菌蒸馏水中,充分震荡3~5 min后,过滤。然后取2 mL滤液于100 mL富集培养基中,置于37 ℃、150 r/min培养箱中培养24 h。富集培养完成后,将富集培养基放在90 ℃水浴锅中加热5 min,杀灭菌体,使芽孢得到富集。再取富集的芽孢杆菌液稀释到10-20~10-1二十个梯度。稀释完成后,将不同浓度的菌液分别接种到LB培养基上进行平板涂布,然后置于37 ℃培养箱中倒置培养24 h。从平板上选择菌落形态不同且处于单独位置的菌株,待长出菌苔后,进行镜检,按无菌操作方法在LB培养基上进行划线分离,置于37 ℃恒温箱中培养,每隔6 h观察菌体生成情况。重复此操作,直至出现单一菌落后,将该单一菌落接种到LB培养基斜面中,然后分别进行编号[15-16]。
1.4 芽孢杆菌的筛选
将经过初筛后保藏于斜面培养基中的各株芽孢杆菌分别接种2环至100 mL已灭菌的苏氨酸液体发酵培养基中,使其初始菌落数为107~3×107CFU/mL,置于28 ℃、120 r/min摇床中培养4 d。发酵结束后,将发酵液取出,用超高速离心机以10000 r/min于4 ℃离心20 min,取上清液。过滤后用气相色谱仪测定发酵液中的乙酸乙酯和正丙醇含量,筛选出能在发酵液中生成较多己酸乙酯和较少正丙醇的芽孢杆菌。
气相色谱条件:色谱柱为DB-WAX 60 m×250 μm×0.25 μm,进样口温度210 ℃;检测器温度230 ℃。柱箱升温程序:40 ℃保持5 min,然后以5 ℃/min升至80 ℃,保持2 min,最后以10 ℃/min到升至230 ℃,保持5 min,运行时间35 min。载气:N2,N2:H2=80∶20,载气流量:5 mL/min,载气压力:0.08 MPa,进样量1 μL。
标准溶液配制:准确吸取色谱纯标准试剂2 mL于100 mL容量瓶中,万分之一分析天平称重数为2%的标准溶液,浓度单位为(mg/100 mL)。准确吸取体积分数为2%的各标准溶液3 mL于25 mL容量瓶中,用60%乙醇(超纯水稀释无水乙醇得)定容至刻度,由此配制成混合标准溶液,用于建立系统模板和计算校正因子。
模板建立及校正因子的计算:根据各种物质在同一色谱柱和相同仪器条件下有确定不变的保留值,因此可以定性混合标准液中各种成分,从而确定其出峰顺序。取混合标准液1 μL进样色谱分析,进样4次。出峰顺序依次为:正丙醇、乙酸正戊酯(内标)、己酸乙酯。根据峰面积和混合标准样品的质量浓度(mg/100mL)计算校正因子。校正因子=内标物的峰面积×标准物质的浓度/内标物的浓度/标准物质的峰面积。
发酵液测定:取各样品1.5 mL,加入0.15 mL体积分数为2%的标准内标物(乙酸正戊酯),内标物浓度208.596 mg/100 mL。混匀后,在与 f 值测定相同的条件下进样,根据保留时间确定己酸乙酯和正丙醇峰的位置,并测定己酸乙酯和正丙醇与内标峰面积,求出峰面积之比,计算出样品中己酸乙酯和正丙醇的含量。己酸乙酯和正丙醇的浓度=校正因子×香气物质的峰面积×内标物的质量浓度/内标物的峰面积。
1.5 芽孢杆菌的鉴定
1.5.1 形态观察 将所筛选的菌株进行菌落形态观察、菌体形态观察、革兰氏染色和芽孢染色[15]。
1.5.2 生理生化鉴定 将所筛选的菌株进行生理生化鉴定,包括甲基红实验、V.P实验、淀粉水解实验、明胶水解实验、过氧化氢酶实验[17]。
1.5.3 分子生物学鉴定 参考文献[18] 利用十六烷基三甲基溴化铵(CTAB)法在高离子强度的溶液中可以与蛋白质和多聚糖形成复合物,但是却不能沉淀核酸的原理,并充分结合酶法、SDS法提取DNA,通过有机溶剂的抽提去除蛋白质、多糖、酚类等杂质(胶孔里没有明显的蛋白质残留,条带清晰),并加入异丙醇沉淀使核酸分离出来。
步骤如下:首先接种2环菌种于液体LB培养基中,150 r/min、37 ℃摇床培养12 h。然后收集0.2 g菌体于2 mL离心管中,再加入500 μL CTAB溶液和50 μL溶菌酶(100 mg/mL),置于225 r/min、37 ℃摇床培养过夜。在经过溶菌酶作用后的菌液中加入250 μL,20% SDS和25 μL蛋白酶(20 mg/mL),置于65 ℃恒温水浴锅中水浴1 h,每15 min震荡混匀1次。当水浴完成过后,将离心管于-80 ℃冰箱冷冻15 min后又置于65 ℃恒温水浴锅中水浴15 min,如此反复三次。再加入与离心管中液体等体积tris酚-氯仿-异戊醇(25∶24∶1),经过涡旋混匀后静置10 min。然后以12000 r/min于4 ℃离心15 min,取上清液,重复至无白色沉淀为止。然后,加入等体积氯仿-异戊醇(24∶1),经过涡旋混匀后静置10 min,于12000 r/min离心15 min,取上清液。在取得的上清液中加入0.6倍体积的预冷异丙醇并混匀,放入-20 ℃冰箱中沉淀1 h。沉淀完成后,于4 ℃,12000 r/min离心15 min,弃去上清液取沉淀。随后用1 mL乙醇(70%)洗涤,再于4 ℃,12000 r/min离心15 min,取沉淀重复一次。然后将离心管于超净工作台烘干至无酒精味后加入50 μL无菌双蒸水,放入65 ℃恒温水浴锅中水浴1 h。最后将所提取的DNA送至上海杰李生物技术有限公司测序,获得DNA拼接序列。测序结果在NCBI数据库(http://www. ncbi.nlm.nih. gov/)中进行比对并采用MEGA 6.0软件(邻接法)构建16S rRNA 系统发育树。

表1 混合标准液的校正因子Table 1 Correction factors for the mixed standard solution
2 结果与讨论
2.1 校正因子
如表1所示,混合标准样品(正丙醇、乙酸正戊酯、己酸乙酯)中3种成分相对标准偏差(RSD)相对较小,校正因子可靠,适用于香气成分定量分析。
2.2 色谱图
图1是混合标准样品(正丙醇、乙酸正戊酯、己酸乙酯)的气相色谱离子流色谱图。由图1可知,三种混合标准样品的溶液离子流色谱图出峰清楚,因此是可信的。
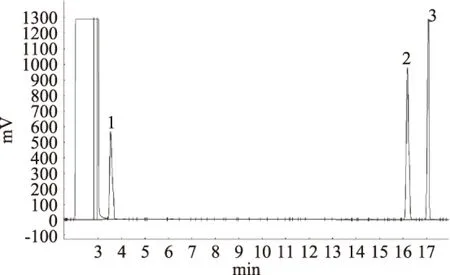
图1 混合标准溶液离子流色谱图Fig.1 Total ion current chromatogram of mixed standard solution注:1:正丙醇;2:乙酸正戊酯;3:己酸乙酯。
2.3 芽孢杆菌的筛选
经稀释平板法筛选出菌株共55株,从YB-1到YB-55编号后分别于斜面试管培养基中培养,然后接种于发酵培养基中。培养后按与校正因子值测定相同的条件下进样,测其发酵液中产生的己酸乙酯和正丙醇含量。各菌株发酵液中测定出的己酸乙酯含量和正丙醇含量如表2所示。
己酸乙酯是浓香型白酒的主体香味物质,能较大程度提高白酒的风味成分,正丙醇较少能够降低因正丙醇含量过高而带来的上头、口干[10-12]。中国国标GB/T 10781.1-2006《浓香型白酒》规定,高度优级酒的己酸乙酯含量为120~280 mg/100 mL。而国标GB/T 10343-2008《食用酒精》规定,特级食用酒精中的正丙醇含量应≤2.0 mg/L。由表2可以看出,YB-12、YB-13和YB-16菌株产己酸乙酯量较多,分别为245.99、256.62、233.70 mg/100 mL,但YB-12和YB-13产正丙醇含量也较多,分别为4.6792、3.9235 mg/100 mL,超过了优级酒中的正丙醇含量要求。YB-16产正丙醇含量为0.0392 mg/100 mL,符合优级酒对正丙醇含量的要求。此外,YB-8菌株产的正丙醇含量(0.0356 mg/100 mL)略低于YB-16,但YB-8产己酸乙酯量(76.59 mg/100 mL)远小于YB-16。因此,可选择YB-16菌株作为本实验的目的菌株,即高产己酸乙酯、低产正丙醇。
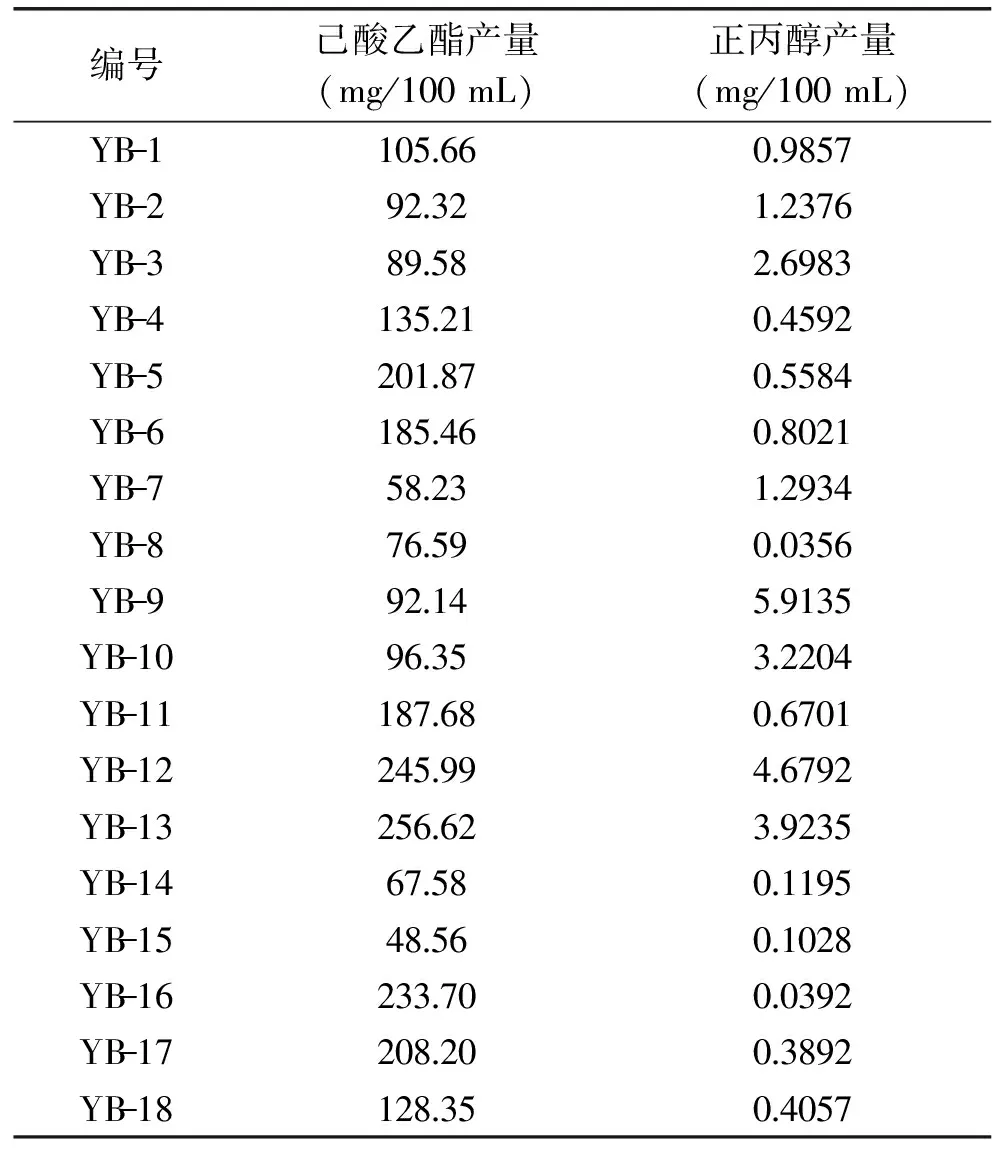
表2 各菌株产己酸乙酯与正丙醇产量Table 2 The ethyl hexanoate and propanol yields for each strain
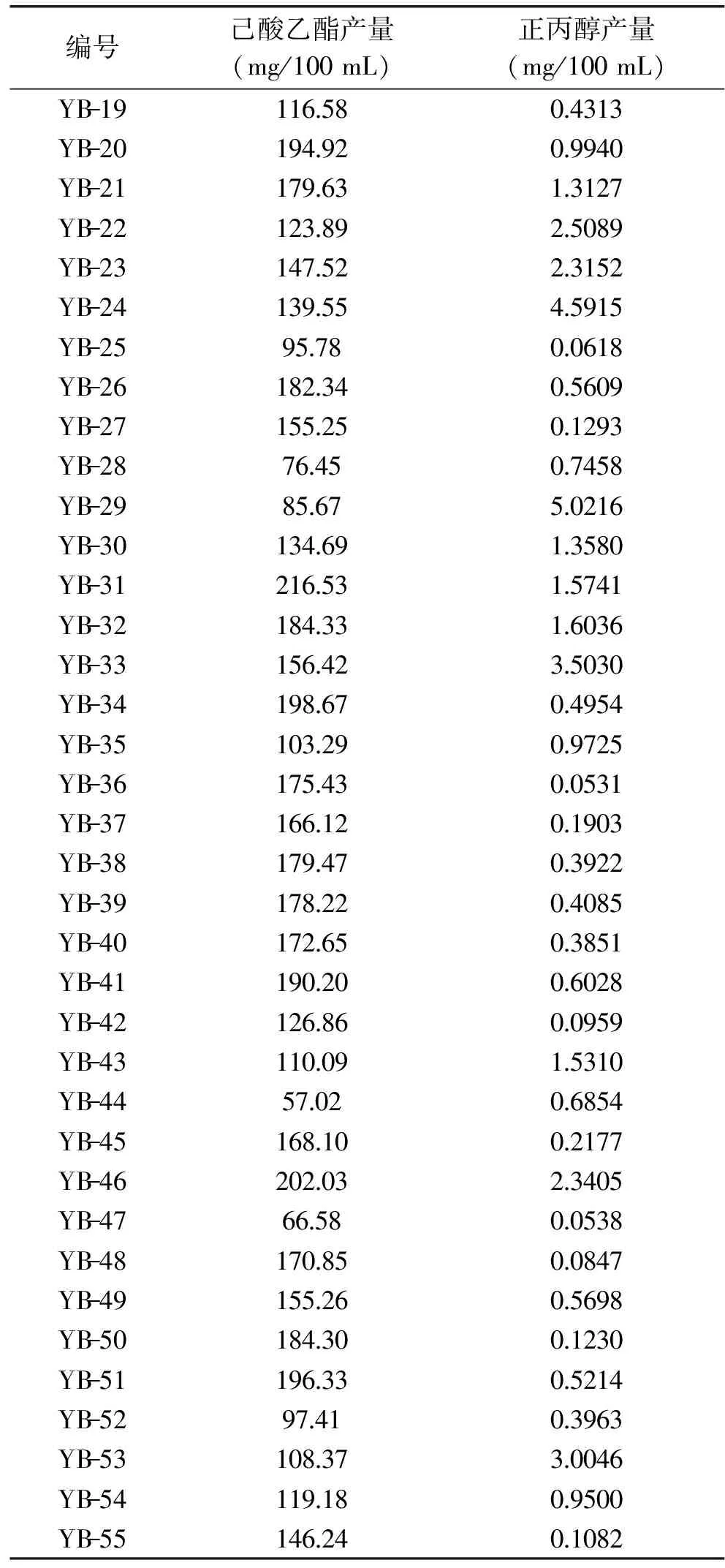
续表
2.4 菌株的形态观察

表3 生化实验鉴定结果Table 3 Identification of physiological and biochemical characteristics
注:“+”表示“有”或“阳性反应”。在普通琼脂培养基上,用低倍物镜(10倍)观察菌株YB-16菌落特征为:菌落大,直径约为5 mm,表面粗糙、扁平、不规则。在高倍镜(40倍)下观察,该菌株YB-16菌体呈杆状,菌体细胞杆状,成短或长链。革兰氏染色实验中,在油镜(100倍)下观察,该菌体被染成蓝紫色,证明为革兰氏阳性菌。芽孢染色实验中,如图3所示,在油镜(100倍)下观察,有芽孢,芽孢呈椭圆形,约1.0 μm,位于菌体中央,芽孢囊不膨大。
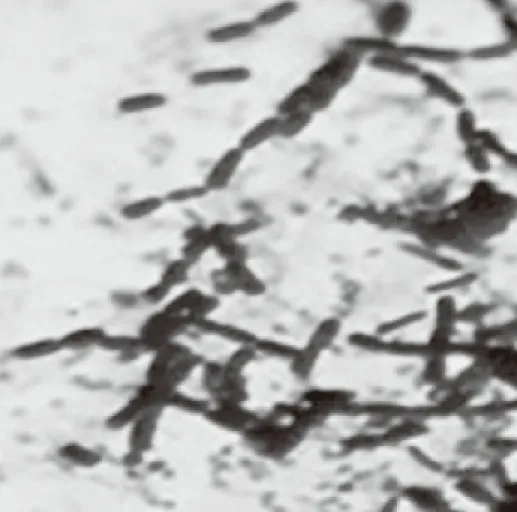
图2 革兰氏染色(1000×)Fig.2 Gram staining image(1000×)

图3 芽孢染色(1000×)Fig.3 Spores staining image(1000×)
2.5 生理生化鉴定结果
该YB-16菌株的生理生化鉴定结果如表3所示。由表3知,甲基红实验、V.P反应、吲哚实验、淀粉水解、明胶水解和过氧化氢酶反应均为阳性,说明YB-16在糖代谢过程中,具有发酵葡萄糖产酸的能力;具有发酵葡萄糖产生乙酰四基甲醇的能力;能水解淀粉和蛋白质;能将H2O2催化分解成H2O和O2。参照《伯杰细菌鉴定手册》和《常见细菌系统鉴定手册》,初步认定YB-16为芽孢杆菌属。
2.6 目的菌DNA序列的鉴定

图5 YB-16的系统发育树Fig.5 The phylogenetic tree for strain YB-16
将如图4的16S rDNA序列输入NCBI网站(http://www.ncbi.nlm.nih.gov/blast)中,在NCBI数据库中进行比对,发现目地菌株YB-16与蜡质芽孢杆菌(Bacilluscereus)具有最高同源性达100%。建立系统发育树,如图5所示,观察发现,YB-16菌株与Bacilluscereusstrain NBRC 15305聚为一个分支,亲缘关系最近。查阅《伯杰细菌鉴定手册》及《常见细菌系统鉴定手册》,发现YB-16菌株的形态特征和生理生化特征与蜡状芽孢杆菌(Bacilluscereus)基本一致。因此,将YB-16号菌株鉴定为蜡质芽孢杆菌(Bacilluscereus)。

图4 YB-16序列测序结果Fig.4 The DNA sequencing result for YB-16
3 讨论与结论
蜡质芽孢杆菌在工业化社会中常被认为是食物病源菌。它能产生一种呕吐毒素和肠毒素,主要引发呕吐和腹泻型食物中毒[19]。但近年来,蜡质芽孢杆菌也被认为是一种有益的微生物。应用微生物产生的次生代谢产物来防治植物病害是目前生物防治的一种主要方式,蜡质芽孢杆菌是芽孢菌属中具有生防应用价值的拮抗细菌之一[20]。杨春霞、廖永红等人对酒醅中的蜡质芽孢杆菌进行发酵风味分析,发现其在发酵液中能形成12种风味物质,其中含己酸乙酯1.54%;发酵液中含有数量较多的酯类和醛酮类化合物,占总数的58%;蜡质芽孢杆菌不产醚类、含氮化合物和酸类化合物[21]。而本实验所筛选的蜡质芽孢杆菌能够产生产己酸乙酯含量为233.70 mg/100 mL,符合国标高度优级酒的范围;而正丙醇产量为0.0392 mg/100 mL,符合国标特级食用酒精的范围。
本文从浓香型白酒酿酒大曲和糟醅中富集培养共分离出了55株芽孢杆菌,以高产己酸乙酯和低产正丙醇为指标,筛选出了一株能在发酵液中形成较多己酸乙酯和较少正丙醇的芽孢杆菌,命名为YB-16的菌株。通过对该菌株进行形态特征观察、生理生化特征鉴定和DNA序列分析,将YB-16菌株鉴定为蜡质芽孢杆菌。该菌株所产己酸乙酯含量符合国标高度优级酒的范围,所产正丙醇含量符合国标特级食用酒精的范围。若将筛选的该蜡质芽孢杆菌应用至浓香型白酒传统酿造工艺,将有利于提高浓香型白酒的风味,并具有一定降低上头、口干的作用。
[1]涂向勇,姚继承. 窖泥与基酒成分关系的比较研究[J]. 酿酒科技,2009,185(11):90-93.
[2]姚惟琦,陈茂彬,镇达,等. 浓香型白酒酒醅中乳酸菌分离及其对模拟固态发酵的影响[J]. 酿酒,2010,37(3):37-41.
[3]熊俐,胡洋,刘俊,等.窖泥己酸菌的分离培养与诱变选育[J].四川理工学院学报:自然科学版,2010,23(3):324-327.
[4]张丽莺. 窖池微生态资源库的建立、管理及菌种保藏[D]. 成都:四川大学,2006.
[5]施安辉. 浓香型白酒发酵过程窖中微生物区系的分析[J]. 酿酒,1986(4):24-29.
[6]姚惟琦,陈茂彬,镇达,等. 浓香型白酒酒醅中乳酸菌分离及其对模拟固态发酵的影响[J].酿酒,2010,37(3):37-41.
[7]刘莉萌,张斌,东秀珠,等.浓香型白酒窖池中片球菌的分离与鉴定[J]. 酿酒科技,2007,152(2):22-24,28.
[8]李大和,刘念,李国红. 浓香型大曲酒酿造中酯化菌研究的现状与展望[J]. 酿酒科技,2008,164(2):92-98.
[9]曾婷婷,章肇敏,吴生文,等. 芽孢杆菌对特香型白酒风味风格的影响研究[J]. 酿酒科技,2012,(7):32-34.
[10]张良,沈才洪,张宿义,等. 解析窖泥功能菌代谢能力的调控[J]. 酿酒科技,2008,(1):57-58,61.
[11]雷光电,姚万春,唐玉明,等. 泸州老窖窖泥中重要功能菌群分布及代谢产物研究[J]. 酿酒科技,2012,(11):54-57.
[12]Genovese A,Piombino P,Gambuti A,et al. Simulation of retronasal aroma of white and red wine in a model mouth system. Investigating the influence of saliva on volatile compound concentrations[J]. Food Chem,2009,114(1):100-107.
[13]Ferreira L,Kaminski M[J].,Mawson A J,et al. Development of a new tool for the selection of pervaporation membranes for the separation of fusel oils from ethanol/water mixtures[J]. J Membrane Sci 2001,182:215-226.
[14]柏永昊,张明春,缪礼鸿. 芽孢杆菌对白酒发酵过程中正丙醇含量的影响[J]. 酿酒科技,2013,(11):26-29.
[15]沈萍,陈向东. 微生物学实验[M].第4版.北京:高等教育出版社,2007.
[16]黄思敏,刘军,朱文优,等. 传统麸醋醋醅中一株芽孢杆菌的筛选和鉴定[J]. 中国调味品,2013,38(5):18-22.
[17]RE布坎南,N E吉本斯. 中国科学院微生物研究所《伯杰细菌鉴定手册》 翻译组译. 伯杰细菌鉴定手册(第八版)[S]. 北京:科学出版社,1984.
[18]郑琦,邓波,关雄.酒糟和窖泥中苏云金芽孢杆菌的分离及鉴定[J]. 基因组学与应用生物学. 2014,33(2):93-298.
[19]袁志明. 蜡状芽孢杆菌(Bacilluscereus)污染及其对食品安全的影响[J]. 食品科学,2007,28(3):357-358.
[20]易龙,张亚,廖晓兰,等. 蜡状芽孢杆菌次生代谢产物的研究进展[J]. 农药,2013,52(3):162-164.
[21]杨春霞,廖永红,刘峻雄,等.芽孢杆菌分离鉴定及发酵风味分析[J]. 食品工业科技,2012,33(9):70-74.
Selecting of functionalBacillusstrain from omagari and fermented grains of Luzhou-flavor liquor
ZHAO Chang-qing,XU Sha,YANG Yang,ZHAO Yang
(College of Bioengineering,Sichuan University of Science and Engineering,Zigong 643000,China)
To isolateBacillusstrain from Luzhou-flavor liquor so that the flavor components could be improved,55 strains ofBacilluswere obtained in the omagari and fermented grains of Luzhou-flavor liquor in total in this study. Through screening,one strain producing high-yield ethyl hexanoate and low-yield propanol was screened out which was then named as YB-16. The produced ethyl hexanoate belonged to excellent strong liquor of the national standard and the produced propanol belonged to extra edible alcohol of the national standard. After strain morphology,physiological and biochemical characteristics,molecular biology assay and the constructed phylogenetic tree,YB-16 andBacilluscereusstrain CCM NBRC 15305 clustered into a branch and were each other’s closest relatives. Thus,YB-16 was identified asBacilluscereus. It is expected that the application ofBacilluscereusstrain to the traditional brewing process of Luzhou-flavor liquor could improve its flavor and quality.
Luzhou-flavor liquor;functional strain;Bacillus
2016-10-28
赵长青(1981-),女,博士,副教授,研究方向:食品微生物,E-mail:zhaocq2010@163.com。
酿酒生物技术及应用四川省重点实验室项目(NJ2015-11);四川理工学院“泸州老窖科研奖学金”项目(15ljzk09);四川省大学生创新创业训练计划项目(201510622054)。
TS201.3
A
1002-0306(2017)07-0151-05
10.13386/j.issn1002-0306.2017.07.021
