全自动氨基酸分析仪法测定4 种贝类肌肉中谷胱甘肽和游离氨基酸含量
2017-03-27张苏平邱伟强陈舜胜
张苏平,邱伟强,卢 祺,陈舜胜
(上海海洋大学食品学院,上海水产品加工及贮藏工程技术研究中心,上海 201306)
全自动氨基酸分析仪法测定4 种贝类肌肉中谷胱甘肽和游离氨基酸含量
张苏平,邱伟强,卢 祺,陈舜胜*
(上海海洋大学食品学院,上海水产品加工及贮藏工程技术研究中心,上海 201306)
建立一种测定贝类肌肉中谷胱甘肽和游离氨基酸的全自动氨基酸分析仪法,以4 种常见贝类为研究对象,采用0.02 mol/L盐酸溶液作为提取剂,体积分数5%磺基水杨酸溶液为蛋白沉淀剂,同时优化了缓冲溶液的组成及洗脱程序,并对该方法的线性范围、检出限、精密度以及回收率进行测定。结果表明:贝类肌肉中的谷胱甘肽和游离氨基酸有着较好的分离效果,线性关系良好,相关系数为0.999 1~0.999 9,检出限(RSN=3)为0.07~0.27 μmol/L,加标平均回收率为86.40%~102.42%,日内和日间相对标准偏差分别为0.31%~0.73%和1.14%~2.60%。4 种贝类肌肉组织中的游离氨基酸含量比较丰富,总游离氨基酸含量分别为1 396.39、1 016.04、911.15、287.01 mg/100 g,文蛤>青蛤>缢蛏>牡蛎,主要的游离氨基酸为牛磺酸(Tau)、谷氨酸(Glu)、丙氨酸(Ala)、精氨酸(Arg);谷胱甘肽含量分别为103.20、82.53、61.77、33.37 mg/100 g,青蛤>文蛤>缢蛏>牡蛎。该方法适用于贝类肌肉中谷胱甘肽和游离氨基酸含量的测定与分析。
贝类肌肉;谷胱甘肽;游离氨基酸;全自动氨基酸分析仪法
贝类属软体动物门中的瓣鳃纲(或双壳纲),常见的螺类、蛤类、扇贝、牡蛎等都属于该类,贝类具有非常高的食用价值和药用价值。由于其生存环境的复杂性,使得贝类含有很多陆地生物没有的具有特殊生理活性的物质,含有非常丰富的活性肽和氨基酸等非挥发性的含氮物质[1]。
谷胱甘肽(glutathione,GSH)一直因为其独特和重要的生理功能为国内外学者所研究,如参与氨基酸的吸收和转运、维持细胞正常生长、抗氧化作用[2-3]等,目前对于植物和血浆中的GSH含量的测定已经作出过很多研究[4-5],但是关于贝类肌肉中GSH含量的测定方法研究较少。
游离氨基酸(free amino acids,FAA)是非蛋白氮的重要组成部分,它们对水产食品新鲜度的评价和风味的贡献有非常重要作用,如丙氨酸、谷氨酸以及甘氨酸都会影响其风味以及口感。丙氨酸和谷氨酸具有甜味,谷氨酸尤其在甲壳类动物肌肉中起重要的鲜味作用[6]。此外,FAA还可作为许多鱼类以及甲壳类动物品质评价的重要鲜度潜在指标[7-8]。章超桦等[9]在研究翡翠贻贝肉的食品化学特性时认为呈味FAA对甜味、甘味有重要贡献;杨文鸽等[10]通过对缢蛏冰藏保活期间呈味物质的变化研究发现FAA对缢蛏鲜味风味起到重要作用,精氨酸能够赋予海鲜一个适宜的整体风味[11]。关于植物中游离氨基酸含量的测定方法为大多国内外学者所青睐[12-16],但是关于贝类肌肉中的游离氨基酸却没有一种简便快捷的测定方法。
目前国内外相关测定GSH和FAA的方法有很多,主要有高效液相色谱法[17-21]、比色法[22-26]、毛细管电泳法[27]、氨基酸自动分析(amino acid analyzer,AAA)法[28-31]等。AAA法是最常用的一种分析方法,它是以阳离子交换树脂为固定相,酸性缓冲液为流动相,在柱后采用茚三酮溶液与氨基酸衍生生成具有可见光吸收的衍生物进行检测,具有重复性好、仪器稳定、结果可靠等优点。现有的方法主要表现在对GSH或FAA含量的单独测定,并且贝类中GSH或FAA的测定方法相关的研究较少,针对贝类肌肉中GSH和FAA的测定鲜见一种快速、有效的方法。
本实验将通过调节缓冲液pH值以及优化洗脱程序,建立一种测定贝类肌肉中GSH和FAA的AAA法,同时对该方法进行方法学验证,确定该方法的准确性和稳定性,为建立贝类资源的开发提供数据基础和理论依据。
1 材料与方法
1.1 材料与试剂
文蛤、青蛤、缢蛏、牡蛎 上海临港芦潮港水产市场;运回实验室立即处理,并于4 ℃条件下保存。
GSH标准品、多种氨基酸混合标准溶液 美国Sigma公司;二水合5-磺基水杨酸(分析纯),柠檬酸钠、氢氧化钠、氯化钠(均为色谱纯),柠檬酸、乙醇、盐酸(均为优级纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
L-8800氨基酸全自动分析仪 日本日立公司;FJ-200高速分散均质机 上海标本模型厂;501XL全自动研磨机 普瑞科学仪器公司;BSA124S电子天平 大连格莱瑞机械有限责任公司;TopPette手动固定移液器、PH-240A干燥培养箱 上海精密仪器仪表有限公司;FRQ-1010HT超声波清洗器 杭州法兰特超声波科技有限公司;GL-26M/MI立式高速冷冻离心机 上海赵迪生物科技有限公司。
1.3 方法
1.3.1 混合标液的配制
准确称量76.83 mg GSH标准品,用超纯水定容至100 mL容量瓶中,即得2.5 μmol/mL标准溶液,从中准确取出2 mL混合溶液,加入2 mL含有多种标准氨基酸组分(2.5 μmol/mL)的混合液,用超纯水定容至50 mL,即为0.10 μmol/mL混合标准溶液,保存至4 ℃冰箱。
1.3.2 样品前处理
样品处理方法采用Tanimoto等[32]测定牡蛎在冷藏过程中FAA的变化为基础,稍加修改。
准确称量1 g贝类肉组织,加入15 mL 0.02 mol/L稀盐酸,充分均质后用超声波清洗5 min,然后用冷冻离心机(5 000 r/min,4 ℃)离心10 min,收取上清液。将剩余残渣加入10 mL 0.02 mol/L稀盐酸后搅拌,再次离心(5 000 r/min,4 ℃)5 min,合并上清液,定容至50 mL。定容后移取2 mL,加入2 mL体积分数5%磺基水杨酸溶液,再次离心(10 000 r/min,4 ℃)10 min,然后经0.22 μm水相过滤膜过滤,上机测定。3 组平行实验,测定结果取平均值。
1.3.3 缓冲溶液的配制
缓冲溶液的配制及茚三酮反应液的组成如表1、2所示。

表1 缓冲液的配制Table1 Preparation of buffer solution

表2 茚三酮反应液的组成Table2 Composition of reaction systems containing ninhydrin
1.3.4 洗脱程序及升温过程优化
采用氨基酸全自动分析仪的梯度洗脱程序在原有基础上修改,如表3所示。

表3 氨基酸分析仪的梯度洗脱以及升温程序优化Table3 Gradient elution of amino acid analyzer and optimization of heating process
1.3.5 氨基酸自动分析仪参数条件
分离柱(4.6 mm×60 mm),树脂为阳离子交换树脂;分离柱温度57 ℃;检测波长570 nm(脯氨酸为440 nm);进样量20 μL;缓冲液流速0.35 mL/min;反应液:茚三酮试剂,流速0.35 mL/min;单元温度135 ℃;使用自带软件进行数据分析。
1.3.6 回收率和精密度测定
各取1 g文蛤肌肉组织,样品中添加高、中、低3 种不同浓度的混合标准溶液,按1.3.2节方法进行样品处理,按照1.3.5节方法进行参数设定并上机检测,每种浓度进样5 次,用外标法计算其实际含量与加标平均回收率。
对同一样本溶液在1 d内进行5 次重复实验分析日内变化,对同一样本连续测定5 d(每天测定1 次)的变化,分别确定日内与日间精密度。回收率按下式计算:

2 结果与分析
2.1 混合标准溶液与样品图谱
L-8800全自动氨基酸分析仪的基本原理是以不同pH值梯度的缓冲溶液来洗脱出(酸性、中性、碱性)FAA,与茚三酮反应液会发生显色反应,从而对FAA进行定性与定量分析[33]。由于GSH中的氨基在弱酸性溶液中与茚三酮反应生成蓝紫色化合物,于波长570 nm处有最大吸收峰,因此也可以对此进行定性和定量分析。


图1 标准混合溶液和4 种贝类肌肉样品图谱Fig.1 Amino acid profiles of mixed standard solution and muscle samples from four shellfish species
由图1可以看出,标准混合溶液和4 种贝类肌肉的样品图谱在经过优化后,GSH与FAA达到了较好的分离效果,其中图1C、D、E中GSH处有其他物质干扰,可能为青蛤、缢蛏、牡蛎肌肉中的其他FAA或者活性肽,有待进一步的分析与研究。
2.2 方法性能评价
通过线性范围、检出限、精密度以及回收率等指标来评价该方法性能[34-35]。
2.2.1 线性范围、检出限测定结果
将标准混合溶液用0.02 mol/L盐酸溶液进行适当稀释,使其质量浓度分别为1、10、50、100、250 μg/mL,按1.3.5节方法进行测定,每个质量浓度的标准混合溶液分别进样3 次,通过保留时间作为定性的依据,以所测色谱的峰面积和其相对应的质量浓度作出标准曲线,用线性相关系数(R2)评价[18];根据信噪比,当所测物质色谱峰的峰高为噪音3 倍时(RSN=3),确定其混合标准组分的检出限,当色谱峰的峰高为噪音10 倍时(RSN=10),确定其混合标准组分定量限[36]。
如表4所示,在1~250 μg/mL范围内,GSH和FAA的线性相关系数R2在0.999 1~0.999 9之间,表明优化过后的全自动氨基酸分析仪法中色谱峰的面积与质量浓度之间有着比较好的线性关系,混合标准溶液中的各组分的定量限在0.21~0.94 μmol/L之间,检出限在0.07~0.27 μmol/L之间。表明优化过后的全自动氨基酸分析仪法对于测定贝类肌肉中的GSH与FAA有着较好的灵敏度。
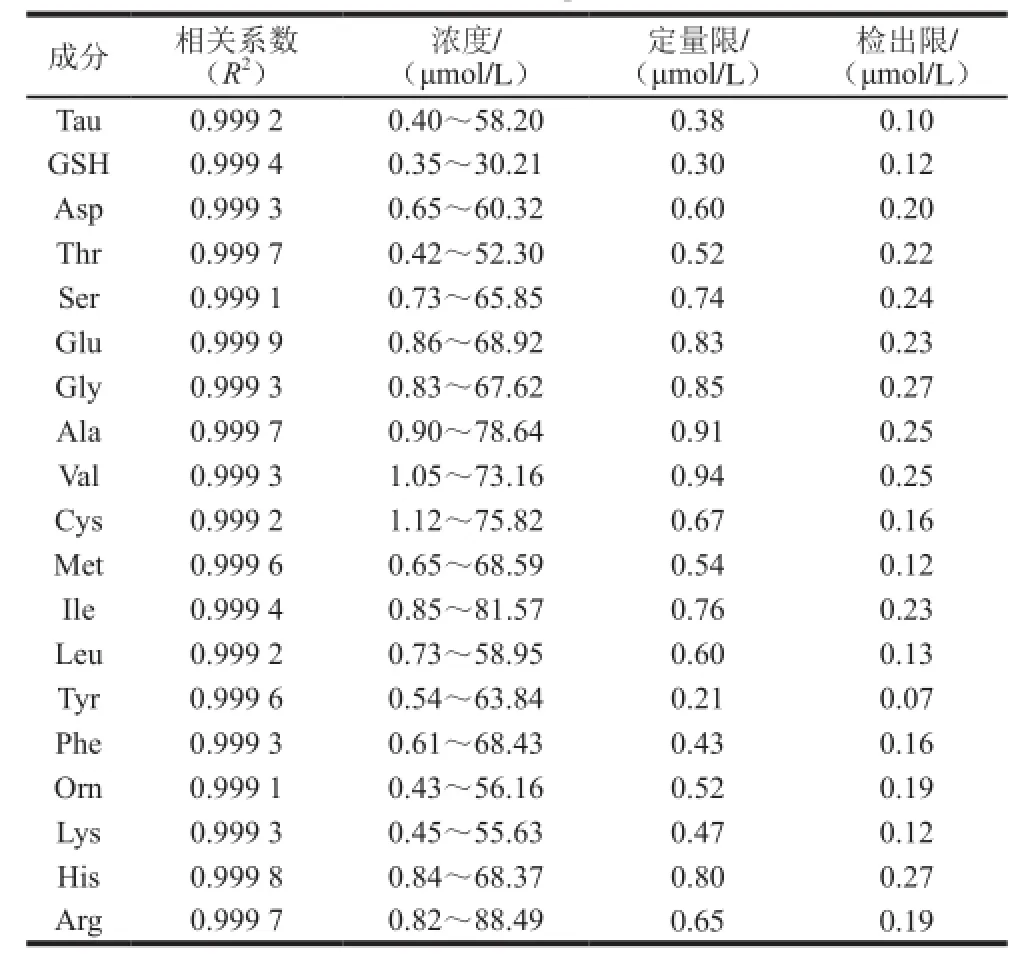
表4 GSH与多种氨基酸标准混合溶液线性相关系数、检出限和定量限Table4 Linear correlation coeff i cients, detection limits and quantitation limits of mixed standard solution of glutathione and amino acids
2.2.2 回收率和精密度测定结果

表5 GSH与氨基酸混合标准溶液加标回收率和精确度(n=5)Table5 Recovery and precision of mixed standard solution of glutathione and amino acids (n= 5)
通过加标实验以及加标回收率的计算,由表5可知,混合标准溶液各组分加标平均回收率在86.40%~102.42%之间,日内相对标准偏差在0.31%~0.73%之间,日间相对标准偏差在1.14%~2.60%之间,符合实验室质量控制规范中食品理化检测[37]的相关要求。
2.2.3 GSH、氨基酸含量测定与分析
贝类之所以食用起来口感独特,味道鲜美以及营养丰富,这其中与GSH以及FAA的含量有着很大的关系。GSH由于其具有独特的生理活性具有抗氧化、抗菌、降血压等生理功能[3],FAA则是水产品新鲜度和风味的重要评价指标,也是非蛋白氮的重要组成部分;不同的FAA具有不同的滋味,呈现鲜、甜、酸、苦等多种滋味,会直接反应出水产品食物的味道以及鲜美程度。如甘氨酸(Gly)、丙氨酸(Ala)主要呈味特性为甜味,为食物本身提供清香的甜味,Glu主要呈味特性为鲜味,是FAA中最重要的鲜味剂,具有保护肝脏的功能,有着非常高的营养价值以及生理功能[38]。

表6 4 种贝类肌肉中GSH与FAA的组成及含量(n=3)Table6 Contents of glutathione and free amino acids in four species of shellfish (n=3)
取每种贝类肌肉组织各1 g平行做3 个样品,按照1.3.2节进行样品的处理,并按照参数条件进行检测,对检测数据进行SPSS分析,并得出显著性,如表6所示。4 种贝类肌肉组织中FAA和GSH非常丰富,总FAA含量方面,文蛤含量最高,为1 396.39 mg/100 g,牡蛎为287.01 mg/100 g。总FAA含量为文蛤>青蛤>缢蛏>牡蛎,这与刘云等[39]对烟台近海3 种贝类中FAA的测定结果略有不同,可能是由于贝类在不同地域以及不同生长环境的原因导致体内FAA的含量以及比例存在差异;呈味氨基酸占总FAA的比重较大,其中牡蛎肌肉中呈味氨基酸的含量为143.55 mg/100 g,占总FAA的50.02%,达到一半的比例;青蛤中呈味氨基酸比例最低,为32.91%;呈味氨基酸含量为文蛤>缢蛏>青蛤>牡蛎;贝类肌肉中含有人体必需的大部分氨基酸,缢蛏肌肉中必需氨基酸含量为103.49 mg/100 g,占总FAA的11.36%,牡蛎虽然含量稍低,为54.19 mg/100 g,但比例为18.88%;必需氨基酸含量为缢蛏>青蛤>牡蛎>文蛤,文蛤最低,只有48.15 mg/100 g,占比3.45%。
FAA组成方面,文蛤肌肉组织中主要的FAA为Tau、Glu、Ala、Arg,占FAA含量的比例分别为37.26%、10.55%、32.54%、7.12%,这4 种氨基酸的比例达到了87.47%,这与Konosu等[40]对蛤中FAA的组成成分分析结果相同;青蛤肌肉中主要的FAA为Tau(42.58%)、Glu(11.00%)、Ala(15.12%)、Arg(9.48%);缢蛏肌肉中主要的FAA为Tau(22.70%)、Glu(5.99%)、Ala(30.47%)、Arg(16.74%),这与杨文鸽等[10]冰藏期间对缢蛏中FAA含量及比例差别不大;牡蛎肌肉中主要的FAA为Tau(18.89%)、Glu(10.95%)、Gly(19.00%)、Ala(16.94%)、Arg(4.08%),这与Je等[41]测定牡蛎中主要的FAA结果相同;通过对比可以发现,贝类肌肉中主要的FAA为Tau、Glu、Ala、Arg,占FAA总量中很大的比例,这与Chen Dewei等[42]对北部湾双壳类软体动物中FAA的组成测定的结果相同。
贝类肌肉组织中含有丰富的GSH,和其他水产生物相比含量较高,和陆地生物血液中的含量相当,远高于植物中的GSH[43]。文蛤、青蛤、缢蛏、牡蛎的含量分别为82.53、103.20、61.77、33.37 mg/100 g;通过比较得知,青蛤中GSH的含量最高,含量从高到底依次为青蛤>文蛤>缢蛏>牡蛎,这与张静等[25]利用荧光分光光度法测定海洋生物中的GSH中含量略有差异,可能由于部分FAA没有检测出,与GSH的特征峰重叠。由于GSH的独特的生理活性和功能,通过GSH含量的分析也反应了贝类具有非常高的营养价值。
2.2.4 氨基酸呈味效果及味道强度值分析
味道强度值(taste activity value,TAV)通常是指各种呈味物质在样品中的含量与其相对应的呈味阈值的比值。一般情况下,当TAV大于1时,认为该呈味物质对样品的呈味效果有比较重要的贡献[44]。相反的,如果TAV小于1,可以判定该呈味物质呈味效果不显著,贡献不大。

表7 常见贝类主要FAA呈味特征、呈味阈值及TAV分析[42]Table7 Taste characteristics, taste threshold and TAV analysis of the main free amino acids in the common shellf i shes
如表7所示,对文蛤肌肉呈味贡献最大的是Ala,TAV为7.57,其次是Glu、Arg,TAV分别为4.91、1.99,呈味效果显著;对青蛤、缢蛏呈味贡献较大的为Glu、Ala、Arg,其中青蛤TAV分别为3.73、2.56、1.93,缢蛏TAV分别为1.82、4.63、3.05;对牡蛎肌肉呈味贡献比较大的只有Glu,其TAV为1.05,这与杨文鸽等[10]测定结果相似;通过比较可以发现,对贝类呈味贡献较大的为鲜味和甜味氨基酸,这也是贝类具有非常强烈的鲜味以及口感甘甜的重要原因。
3 讨 论
本实验以4 种常见贝类为研究对象,采用0.02 mol/L盐酸溶液作为提取剂,以体积分数5%磺基水杨酸溶液为蛋白沉淀剂,同时优化了缓冲溶液的组成及洗脱程序,采用L-8800全自动氨基酸分析仪测定,可以实现较好的分离效果,并对贝类肌肉组织中的GSH与FAA进行了准确定量。经过方法学的验证,该方法具有良好的线性关系、检出限、精密度以及回收率,此方法适用于贝类肌肉组织中GSH与多种FAA的测定。
4 种常见贝类肌肉中FAA含量比较丰富,文蛤含量最高,为1 396.39 mg/100 g,牡蛎为287.01 mg/100 g。总FAA含量为文蛤>青蛤>缢蛏>牡蛎,呈味氨基酸含量为文蛤>缢蛏>青蛤>牡蛎,必需氨基酸含量为缢蛏>青蛤>牡蛎>文蛤;贝类肌肉中主要的FAA为Tau、Glu、Ala、Arg;此外,GSH的含量从高到底依次为青蛤>文蛤>缢蛏>牡蛎,对4 种贝类呈味贡献较大的鲜味和甜味氨基酸,主要包括Glu、Ala、Arg,这也是贝类具有非常强烈的鲜味以及口感甘甜的重要原因。
由于GSH水溶液在常温条件下容易氧化[45],在样品处理过程中如何防止GSH被氧化,使用何种浓度以及种类的抗氧化剂来保证GSH水溶液不被氧化且不会影响FAA的含量,有待进一步深入研究。此外,本研究只测定出18 种FAA与GSH的含量,还有部分FAA和活性肽没有检测出或者特征峰没有分离出来,还有待进一步的研究、分离以及优化。
[1] 吴晓洒, 蔡路昀, 曹爱玲, 等. 水产品加工废弃物中的蛋白及生物活性肽的研究进展[J]. 食品工业科技, 2014, 35(23): 372-376; 381. DOI:10.13386/j.issnl002-0306.2014.23.070.
[2] 齐剑英. 谷胱甘肽的光学性质及其分析测定研究[D]. 广州: 暨南大学, 2003.
[3] 宋增廷, 姜宁, 张爱忠, 等. 谷胱甘肽生物学功能的研究进展[J].饲料研究, 2008(9): 25-27.
[4] 朱亚玲. 枸杞中谷胱甘肽的含量测定研究[D]. 延吉: 延边大学, 2010.
[5] 蔡鹏, 刘叙仪, 王萍. 谷胱甘肽还原酶循环法测定血浆谷胱甘肽含量在肿瘤化疗中的意义[J]. 中国肿瘤临床, 1994, 21(10): 717-719.
[6] 李婉君. 南极磷虾与南美白对虾营养与滋味成分比较[D]. 上海:上海海洋大学, 2015.
[7] 陈桂平. 草鱼低温贮藏期间质构及风味物质变化研究[D]. 长沙:湖南农业大学, 2014.
[8] 李春萍. 臭鳜鱼发酵中营养和风味变化的研究[D]. 杭州: 浙江工商大学, 2014. DOI:10.7666/d.Y2531617.
[9] 章超桦, 洪鹏志, 邓尚贵, 等. 翡翠贻贝肉的食品化学特性及其在海鲜调味料的应用[J]. 水产学报, 2000, 24(3): 267-270. DOI:10.3321/ j.issn:1000-0615.2000.03.013.
[10] 杨文鸽, 徐大伦, 孙翠玲, 等. 缢蛏冰藏保活期间呈味物质的变化[J]. 中国食品学报, 2009, 9(3): 181-186. DOI:10.3969/ j.issn.1009-7848.2009.03.030.
[11] 陈德慰, 苏键, 刘小玲, 等. 广西北部湾3 种贝类中主要呈味物质的测定及呈味作用评价[J]. 食品科学, 2012, 33(10): 165-168.
[12] 李丹, 黄龙, 朱巍, 等. 反相高效液相色谱法测定烟叶中的游离氨基酸[J]. 烟草科技, 2003, 24(2): 54-57. DOI:10.3969/ j.issn.1002-0861.2003.02.009.
[13] SHIBA T, SHIRAKI N, FURUSHITA M, et al. Free amino acid and ATP-Related compounds in sterile tiger puffer fi sh (Takifugu rubripes) fi llets stored at 4 ℃[J]. Journal of Food Processing and Preservation, 2014, 38(3): 791-797. DOI:10.1111/jfpp.12031.
[14] WU L, ZHOU J, XUE X, et al. Fast determination of 26 amino acids and their content changes in royal jelly during storage using ultraperformance liquid chromatography[J]. Journal of Food Composition and Analysis, 2009, 22(3): 242-249. DOI:10.1016/j.jfca.2008.10.022.
[15] 王敏, 张敬书, 赵艳丽, 等. HPLC法测定玉米浆中游离氨基酸的含量[J]. 中国酿造, 2010, 29(5): 156-159. DOI:10.3969/ j.issn.0254-5071.2010.05.047.
[16] 山广志, 左利民, 余立, 等. 柱前衍生HPLC法测定脾氨肽口服液中17 种游离氨基酸[J]. 中国新药杂志, 2013(11): 1255-1258.
[17] 陈芬, 赵晓燕, 饶钦雄, 等. HPLC测定姬松茸中谷胱甘肽的含量[J].天然产物研究与开发, 2014(9): 1454-1457.
[18] 魏斌, 李鹏, 崔胜云. HPLC法测定莲子中还原型谷胱甘肽(GSH)和总巯基(-SH)含量[J]. 食品研究与开发, 2015(8): 68-72. DOI:10.3969/j.issn.1005-6521.2015.08.019.
[19] 陈文, 王光辉, 李丹, 等. 反相高效液相色谱法测定烟叶中的游离氨基酸[J]. 氨基酸和生物资源, 2003, 24(2): 54-57. DOI:10.3969/ j.issn.1006-8376.2002.01.020.
[20] CSAPÓ J, ALBERT C, LÓKI K, et al. Separation and determination of the amino acids by ion exchange column chromatography applying postcolumn derivatization[J]. Acta Universitatis Sapientiae-Alimentaria, 2008: 5-29.
[21] PARAMÁS A M G, BÁREZ J A G, MARCOS C C, et al. HPLC-fl uorimetric method for analysis of amino acids in products of the hive (honey and bee-pollen)[J]. Food Chemistry, 2006, 95(1): 148-156. DOI:10.1016/j.foodchem.2005.02.008.
[22] 邵金良, 黎其万, 董宝生, 等. 茚三酮比色法测定茶叶中游离氨基酸总量[J]. 中国食品添加剂, 2008(2): 162-165. DOI:10.3969/ j.issn.1006-2513.2008.02.039.
[23] 刘慧燕, 德力格尔桑, 方海田. 茚三酮比色法测定牛肉中游离氨基酸的试验研究[J]. 保鲜与加工, 2006, 6(2): 23-25. DOI:10.3969/ j.issn.1009-6221.2006.02.011.
[24] 郭黎平, 刘国良, 张卓勇, 等. 荧光光度法测定大豆提取液中还原型谷胱甘肽[J]. 东北师大学报(自然科学版), 2001, 33(1): 34-38. DOI:10.3321/j.issn:1000-1832.2001.01.007.
[25] 张静, 吉宏武, 周静, 等. 荧光分光光度法测定海洋生物中的谷胱甘肽[J]. 广东海洋大学学报, 2005, 25(4): 32-34. DOI:10.3969/ j.issn.1673-9159.2005.04.008.
[26] 景蓓蓓, 杨晓红, 张胜海, 等. 基于钙黄绿素的荧光分光光度法测定谷胱甘肽[J]. 现代生物医学进展, 2011, 11(7): 1359-1362.
[27] 沈佐君, 吴琳. 高效毛细管电泳法快速测定血清中游离氨基酸[J]. 中华医学检验杂志, 1998(3): 516-517. DOI:10.3760/ j:issn:1009-9158.1998.03.007.
[28] 曹让, 张林生, 张旺锋, 等. 用氨基酸分析仪测定棉花幼苗叶片中的还原型谷胱甘肽含量[J]. 植物生理学报, 2007, 43(4): 761-764.
[29] 莫润宏, 汤富彬, 丁明, 等. 氨基酸分析仪法测定竹笋中游离氨基酸[J].化学通报, 2012, 75(12): 1126-1131.
[30] 王曜, 陈舜胜. 野生与养殖克氏原螯虾游离氨基酸的组成及比较研究[J]. 食品科学, 2014, 35(11): 269-273. DOI:10.7506/spkx1002-6630-201411054.
[31] ZHANG H, WANG Z Y, YANG X, et al. Determination of free amino acids and 18 elements in freeze-dried strawberry and blueberry fruit using an amino acid analyzer and ICP-MS with micro-wave digestion[J]. Food Chemistry, 2014, 147(4): 189-194. DOI:10.1016/ j.foodchem.2013.09.118.
[32] TANIMOTO S, KAWAKAMI K, MORIMOTO S. Changes in the free amino acid content of the shucked oyster Crassostrea gigas stored in salt water at 3 ℃[J]. Fisheries & Aquatic Science, 2013, 16(2): 63-69. DOI:10.5657/FAS.2013.0063.
[33] 陈忠云. α-氨基酸和茚三酮显色反应机理[J]. 中国大学教学, 1991(2): 36-37.
[34] MA X, ZHAO D, LI X, et al. Chromatographic method for determination of the free amino acid content of chamomile fl owers[J]. Pharmacognosy Magazine, 2015, 11(41): 1324-1329. DOI:10.4103/0973-1296.149735.
[35] GUANG C, JUN L, ZHIWEI S, et al. Rapid and sensitive ultrasonicassisted derivatisation microextraction (UDME) technique for bitter taste-free amino acids (FAA) study by HPLC-FLD[J]. Food Chemistry, 2014, 143(1): 97-105. DOI:10.1016/j.foodchem.2013.07.099.
[36] 张梅秀, 王锡昌, 刘源. 薄层色谱和高效液相色谱联用测定暗纹东方鲀肌肉中肌肽和谷胱甘肽的含量[J]. 天然产物研究与开发, 2012, 24(7): 928-932. DOI:10.3969/j.issn.1001-6880.2012.07.017.
[37] 中国合格评定国家认可中心. 实验室质量控制规范: GB/T 27404—2008[S]. 北京: 中国标准出版社, 2008.
[38] 赵静, 丁奇, 孙颖, 等. 猪骨汤中的游离氨基酸及其呈味特征分析[J]. 食品研究与开发, 2015, 36(18): 1-6. DOI:10.3969/ j.issn.1005-6521.2015.18.001.
[39] 刘云, 宫向红, 徐英江, 等. 烟台近海3 种贝类中呈味核苷酸和氨基酸的测定及比较分析[J]. 中国水产科学, 2014, 21(2): 351-360.
[40] KONOSU S, FUJIMOTO K, TAKASHNNA Y, et al. Constituents of the extracts and amino acid composition of the protein of shortnecked clam[J]. Nippon Suisan Gakkaishi, 1965, 31(9): 680-686. DOI:10.2331/suisan.31.680.
[41] JE J Y, PARK P J, JUNG W K, et al. Amino acid changes in fermented oyster (Crassostrea gigas) sauce with different fermentation periods[J]. Food Chemistry, 2005, 91(1): 15-18. DOI:10.1016/ j.foodchem.2004.05.061.
[42] CHEN Dewei, SU Jian, LIU Xiaoling, et al. Amino acid profiles of bivalve mollusks from Beibu Gulf, China[J]. Journal of Aquatic Food Product Technology, 2012, 21(4): 369-379. DOI:10.1080/10498850.20 11.604820.
[43] 刘云国, 李八方, 汪东风, 等. 海洋生物活性肽研究进展[J]. 中国海洋药物, 2005, 24(3): 52-57. DOI:10.3969/j.issn.1002-3461.2005.03.013.
[44] CHEN Dewei, ZHANG Min. Non-volatile taste active compounds in the meat of Chinese mitten crab (Eriocheir sinensis)[J]. Food Chemistry, 2007, 104(3): 1200-1205. DOI:10.1016/j.foodchem.2007.01.042.
[45] 朱义福. 还原型谷胱甘肽的稳定性研究[J]. 现代食品科技, 2011, 27(8): 919-923. DOI:10.3969/j.issn.1673-9078.2011.08.013.
Determination of Glutathione and Free Amino Acids in Muscles of Four Shellf i sh Species by Automatic Amino Acid Analyzer
ZHANG Suping, QIU Weiqiang, LU Qi, CHEN Shunsheng*
(Shanghai Aquatic and Storage Engineering Technology Research, College of Food Science and Technology, Shanghai Ocean University, Shanghai 201306, China)
An analytical method was established for the simultaneous determination of glutathione and free amino acids in shellf i sh using a fully automatic amino acid analyzer. The extraction of the analytes was carried out using 0.02 mol/L hydrochloric acid solution as the extraction solvent followed by protein precipitation with 5% sulfonic acid solution. The buffer composition and the elution procedure were optimized at the same time. The linear range, limit of detection (LOD), precision and recovery rate of the method were determined. The results showed that good separation of glutathione and free amino acids in shellf i sh was achieved by this method with a good linear relationship. The correlation coeff i cients of the calibration curves were between 0.999 1 and 0.999 9. The minimum LODs at a signal to noise ratio (RSN) of 3 ranged from 0.07 to 0.27 μmol/L. The average recovery rates of spiked samples were between 86.40% and 102.42%. The relative standard deviations (RSDs) of intra-day and inter-day assays were 0.31%–0.73% and 1.14%–2.60%, respectively. Free amino acids were abundant in muscle tissue of four shellf i sh species, and their total free amino acid contents in decreasing order were clam (1 396.39 mg/100 g) > Cyclina sinensis (1 016.04 mg/100 g) > razor clam (911.15 mg/100 g) > oyster (287.01 mg/100 g). The main free amino acids were taurine, glutamic acid, alanine, and arginine. The glutathione contents of Cyclina sinensis, clam, razor clam and oyster were 103.20, 82.53, 61.77, and 33.37 mg/100 g, respectively. This method is suitable for the determination of glutathione and free amino acids in shellf i sh.
shellf i sh muscle; glutathione; free amino acids; automatic amino acid analyzer
10.7506/spkx1002-6630-201704027
TS254
A
1002-6630(2017)04-0170-07
2016-06-29
国家自然科学基金面上项目(31471685);上海海洋大学校科技发展专项(A2-0203-00-100208);上海海洋大学校博士启动基金项目(A2-0203-00-100340)
张苏平(1989—),男,硕士研究生,研究方向为水产品加工和贮藏。E-mail:626038339@qq.com
*通信作者:陈舜胜(1956—),男,教授,本科,研究方向为水产品加工、食品理化分析和食品感官评定。E-mail:sschen@shou.edu.cn
张苏平, 邱伟强, 卢祺, 等. 全自动氨基酸分析仪法测定4 种贝类肌肉中谷胱甘肽和游离氨基酸含量[J]. 食品科学, 2017, 38(4): 170-176. DOI:10.7506/spkx1002-6630-201704027. http://www.spkx.net.cn
ZHANG Suping, QIU Weiqiang, LU Qi, et al. Determination of glutathione and free amino acids in muscles of four shellf i sh species by automatic amino acid analyzer[J]. Food Science, 2017, 38(4): 170-176. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201704027. http://www.spkx.net.cn
