草甘膦人工抗原的制备及兔源多抗的ELISA鉴定
2017-03-27王方雨邓瑞广胡骁飞余秋颖郝俊芳邢云瑞侯玉泽
王 晶,王 耀*,王方雨,邓瑞广,胡骁飞,余秋颖,郝俊芳,邢云瑞,侯玉泽
(1.河南省农业科学院 河南省动物免疫学重点实验室,河南 郑州 450002;2.河南科技大学食品与生物工程学院,畜禽疫病诊断与食品安全检测河南省工程实验室,河南 洛阳 471023)
草甘膦人工抗原的制备及兔源多抗的ELISA鉴定
王 晶1,2,王 耀2,*,王方雨1,*,邓瑞广1,胡骁飞1,余秋颖1,郝俊芳1,邢云瑞1,2,侯玉泽2
(1.河南省农业科学院 河南省动物免疫学重点实验室,河南 郑州 450002;2.河南科技大学食品与生物工程学院,畜禽疫病诊断与食品安全检测河南省工程实验室,河南 洛阳 471023)
采用1-(3-二甲氨基丙基)-3-乙基碳二亚胺(1-ethyl-3-(3-dimethylaminopropyl) carbodiimide hydrochloride,EDC)法和戊二醛(glutaraldehyde,GA)法,合成了草甘膦(N-(phosphonomethyl) glycine,PMG)人工抗原,通过免疫制备高敏感性、特异性的兔PMG多克隆抗血清并进行鉴定。将PMG分别与牛血清白蛋白(bovine serum albumin,BSA)和鸡卵清白蛋白(ovalbumin,OVA)偶联,合成免疫抗原PMG-BSA和包被抗原PMG-OVA。经紫外扫描、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳鉴定后,免疫新西兰大白兔,制备多抗。利用间接酶联免疫吸附(enzyme linked immunosorbent assay,ELISA)方法测定多抗效价,间接竞争ELISA方法测定血清的敏感性和特异性。结果表明,免疫的3 只兔血清效价均达1∶104以上,2号兔多抗效果最好,半数抑制浓度(IC50)为30.9 μg/mL,且具备良好的特异性。本实验成功合成了PMG人工抗原,并制得了敏感性高、特异性好的兔多抗,为PMG的免疫学快速检测方法的提供参考。
草甘膦;人工抗原;多抗;酶联免疫吸附检测
近年来草甘膦残留引起人们的广泛关注,目前用于草甘膦残留检测的主要方法为仪器分析方法,包括光谱法[1]、气相色谱法[2]、高效液相色谱-串联质谱法[3]、离子色谱法[4-5]、毛细管电泳法[6]以及流动注射化学发光法[7]等,这些方法存在仪器设备昂贵、操作人员专业要求高以及样品前处理程序复杂等一系列弊端;而针对草甘膦(N-(phosphonomethyl) glycine,PMG)的简便快速检测方法发展迅速,主要是建立在免疫学反应基础之上,这些免疫学检测方法由于操作简便、检测成本低等优点而被广泛应用。Clegg等[8]制备了兔抗PMG多克隆抗体,采用间接竞争酶联免疫吸附反应检测PMG,最低检测限达7.6 μg/mL。Lee等[9]利用一个由双抗原和DNA胶体金微粒为探针组成的三明治夹心免疫传感器检测PMG,检测范围为0.01~100 μg/mL。González-Martínez等[10]将抗PMG免疫血清与酶标PMG以及荧光检测相结合,通过酶联免疫吸附反应(enzyme linked immunosorbent assay,ELISA)测定PMG含量,最低检测限达到21 ng/L。潘熙萍等[11]通过1-(3-二甲氨基丙基)-3-乙基碳二亚胺(1-ethyl-3-(3-dimethylaminopropyl) carbodiimide hydrochloride,EDC)法制备免疫原和包被原,对新西兰大白兔进行免疫制备多克隆抗体,建立PMG间接竞争ELISA检测方法,并应用于玉米粉和小麦粉中PMG的残留检测。
为了能够获得高质量的抗体,本实验利用EDC法和戊二醛(glutaraldehyde,GA)法,将PMG与载体蛋白进行偶联,并分别用紫外扫描、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electropheresis,SDS-PAGE)凝胶电泳方法对免疫原进行鉴定,经大白兔免疫后获得针对PMG的兔源多抗且免疫学特性良好,本研究所制备的PMG人工抗原可应用于ELISA快速检测方法的初步建立。
1 材料与方法
1.1 材料
1.1.1 实验动物
洁净级3 月龄雌性新西兰大白兔,由河南省农业科学院动物免疫学重点实验室提供。
1.1.2 试剂
PMG(纯度≥98%)、EDC、N-羟基琥珀酰亚胺(N-hydroxysuccinimide,NHS) 美国Thermo Scientific公司;GA 美国Sigma Aldrich公司;牛血清白蛋白(bovine serum albumin,BSA)、鸡卵清白蛋白(ovalbumin,OVA) 美国Pierce公司;羊抗兔酶标二抗(goat anti-rabbit IgG-horseradish peroxidase,GaRIgGHRP) 华美生物工程有限公司;双蒸水由动物免疫实验室自制;常规试剂均为国产分析纯。
1.1.3 溶液
2-吗啉乙磺酸(2-morpholinoethanesulfonic acid, MES,0.1 mol/L)缓冲液;磷酸盐缓冲溶液(phosphate buffered saline,PBS,0.01 mol/L);PBST洗液(V(PBS)∶V(Tween20)=2×103∶1);包被缓冲溶液(0.05 mol/L NaHCO3/Na2CO3缓冲液);封闭液(V(PBST)∶V(猪血清)=20∶1);TMB显色液;终止液(2 mol/L H2SO4)。
1.1.4 仪器与设备
AE260电子天平 德国Mettler公司;HI9321酸度计意大利Hanna公司;恒温磁力搅拌器 上海亚荣仪器厂;Nano Drop 1000微量紫外-可见分光光度计 美国Thermo Fisher公司;JM-250电泳仪 大连捷迈科贸有限公司;凝胶成像系统及分析软件 美国Syngene公司;3K-18高速冷冻离心机 德国Sigma公司;550型酶标仪 美国Bio-Rad公司;超纯水仪 德国Millipore公司;电热恒温水浴锅 上海一恒科技有限公司。
1.2 方法
1.2.1 人工抗原的合成
1.2.1.1 EDC法合成人工抗原
[12-13]合成抗原,利用EDC法进行人工抗原的合成,碳二亚胺EDC是一种化学性质很活泼的试剂,能使氨基和羧基间脱水缩合而形成酰胺键。使PMG的羧基先与EDC反应,生成中间产物,然后再与BSA的氨基反应,形成偶联产物。合成路线如图1所示,首先,称量PMG 10 mg,BSA 15 mg。将PMG用1 mL双蒸水溶解后得到溶液A,用1.5 mL的0.1 mol/L MES溶解BSA得到溶液B,称取30 mg的EDC和20 mg的NHS溶于1 mL MES溶液得到溶液C。将溶液C逐滴加入溶液A中反应5 min,使PMG得到充分活化,然后加入溶液B中。在室温条件下,磁力搅拌2 h。在PBS中透析72 h,5 000 r/min离心5 min取上清液,即得免疫抗原PMG-EDC-BSA,-20 ℃保存备用。同法制得包被抗原PMG-EDC-OVA。

图1 免疫原PMG-EDC-BSA合成示意图Fig.1 Synthesis scheme for immunogen PMG-EDC-BSA
1.2.1.2 GA法合成人工抗原
GA是一种同型双功能交联剂,它的两个醛基可分别与两个氨基化合物的氨基形成Schiff碱(—N=C—),在两个化合物之间插入一个五碳桥,合成路线如图2所示。首先,称量PMG 15 mg,BSA 12 mg。将PMG用1 mL双蒸水溶解后得到溶液A,用1.5 mL的PBS溶液溶解BSA得到B溶液。将A溶液逐滴加入B溶液中,然后加入GA 24 μL,室温避光磁力搅拌3 h。然后加入少量氰基硼氢化钠粉末,继续搅拌20 min后,取出溶液进行透析。在PBS中透析72 h,5 000 r/min离心5 min,取上清液,即得免疫抗原PMG-GA-BSA,-20 ℃保存备用。同法制得包被抗原PMG-GA-OVA。

图2 免疫原PMG-GA-BSA合成示意图Fig.2 Synthesis scheme for immunogen PMG-GA-BSA
1.2.2 人工抗原鉴定
1.2.2.1 紫外扫描鉴定
用PBS溶液配制BSA标准溶液,使其与免疫抗原的浓度相一致。用紫外-可见分光光度计扫描,在波长220~440 nm范围内可得最大吸收峰及特征值的扫描图。
1.2.2.2 SDS-PAGE鉴定
参照文献[14]的方法,配制电泳所需浓缩胶和分离胶。由于分离蛋白分子质量相对较大,因此选择浓缩胶(5%)、分离胶(10%),上样量20 μL、浓缩胶电压60 V,时间大约30 min。分离胶的电压为100 V,直到完全结束为止。考马斯亮蓝染色3~4 h后,置于脱色液中脱色,更换3~4 次脱色液。对SDS-PAGE胶进行扫描照相,依据蛋白条带位置差异来判断偶联效果。
1.2.3 免疫学方法制备兔多抗
将两种免疫原溶解于无菌PBS溶液中,首次免疫使用弗式完全佐剂,加强免疫使用弗式不完全佐剂,用乳化器对其进行乳化,待溶液变成白色乳浊液后进行免疫。选取洁净3 月龄新西兰大白兔3 只,分别编号1号为PMG-EDC-BSA,2号和3号为PMG-GA-BSA,在颈部的皮下4点进行注射。免疫剂量为1 mL/只,蛋白含量为150 μg/只。每次免疫间隔时间为3 周,第3次免疫之后30 d,对大白兔进行耳缘静脉采血。取血10 μL溶于990 μL生理盐水中,5 000 r/min离心5 min,取出上清液,4℃保存待用。
1.2.4 多抗效价测定
采用间接ELISA方法对多抗进行效价进行检测。取PMG-OVA包被好的聚苯乙烯板。第1步,用双蒸水铺底50 μL/孔(第1行不加),在第1行内加入兔血清100 μL/孔,从第1行内取出50 μL/孔,加入第2行,依次向下倍比到最后一行。由于要保持实验中溶液体系一致,在倍比后的每孔中都加入50 μL双蒸水。实验中设计有空白对照组,室温放置30 min,洗涤4 次;第2步,加入羊抗兔二抗,用PBST溶液1∶1 000倍稀释,50 μL/孔,室温放置30 min,洗涤4 次;第3步,加入TMB显色液100 μL/孔,室温反应10 min;最后,每孔加入50 μL 2 mol/L H2SO4终止反应。用酶标仪进行读数OD450nm。以待测孔OD450nm值不小于空白对照 OD450nm值的2.1 倍(P/N≥2.1),判定为阳性孔。
1.2.5 多抗半数抑制浓度的测定
将效价测定步骤的第一步中,倍比后的50 μL双蒸水,替换为不同浓度的标准品。其他的实验步骤同1.2.4节。
1.2.6 多抗交叉反应的测定
使用有机磷类农药亚胺硫磷、毒死蜱、马拉硫磷、敌敌畏,对硫磷以及载体蛋白BSA和OVA作为竞争物,利用间接竞争ELISA测定兔多抗对各竞争物的IC50。以兔多抗对PMG的IC50与各竞争物的IC50的百分比作为其交叉反应率(cross-reactivity,CR)。
2 结果与分析
2.1 人工抗原的鉴定结果
2.1.1 紫外扫描鉴定结果

图3 BSA、PMG、PMG-EDC-BSA、PMG-GA-BSA紫外扫描图谱Fig.3 UV absorption spectra of BSA, PMG, PMG-EDC-BSA and PMG-GA-BSA
如图3可以看出,BSA在280 nm波长处有吸收峰。PMG-BSA偶联后的紫外吸收峰与BSA相比发生了一定的位移,两种偶联物在波长310 nm和330 nm处均出现吸收峰,说明偶联成功。
2.1.2 SDS-PAGE鉴定结果

图4 PMG-BSA的SDS-PAGE鉴定结果Fig.4 Identifi cation of PMG-BSA by SDS-PAGE
SDS-PAGE鉴定结果如图4所示,BSA和免疫原PMGBSA的分子质量均在63~75 kD之间,但PMG-BSA的迁移距离小于未偶联的BSA。经过对比可知,PMGBSA的分子质量较BSA有所增加,可初步说明人工抗原偶联成功。
2.2 多抗的鉴定结果
2.2.1 间接ELISA效价测定结果

表1 间接ELISA测定多抗效价Table1 Titer of antisera detected by indirect ELISA
由表1可知,免疫3 只兔子效价均达到1∶1×104以上,其中1号兔子的血清效价最高,可达到1∶5.12×104,即证明免疫原注射得到了较好的免疫效果,同时ELISA结果也表明实验合成的包被原也具有良好的效果。
2.2.2 多抗的敏感性鉴定结果

表2 多抗敏感性的间接竞争ELISA测定的OD450nm值Table2 Sensitivity of polyclonal antiserum detected by indirect competitive ELISA
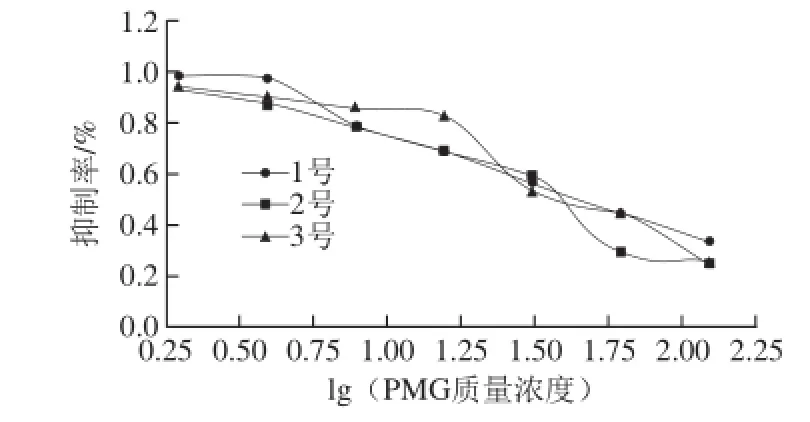
图5 多抗对PMG的间接竞争ELISA抑制曲线Fig.5 Inhibitory curve for pAb against PMG detected by indirect competitive ELISA
由表2可知,3 只大白兔的多抗均对PMG农药有抑制,抑制曲线如图5所示,其中1号大白兔的IC50为43.4 μg/mL,2号大白兔的IC50为30.9 μg/mL,3号大白兔的IC50为41.1 μg/mL。表明2号兔子的多抗对PMG农药的敏感性较强。
2.2.3 多抗的特异性鉴定结果
实验中用1号兔子的多抗与有机磷类农药进行交叉反应。由表3可知,多抗与有机磷类农药亚胺硫磷、毒死蜱、马拉硫磷、敌敌畏,对硫磷以及载体蛋白BSA和OVA的CR低,具有很好的特异性。

表3 多抗与其他有机磷类农药的交叉反应Table3 Cross-reactivity of rabbit antiserum with other organophosphorus pesticides
3 讨 论
3.1 抗原的设计合成
针对半抗原的设计、修饰、载体的选择、半抗原与载体的偶联、人工抗原的鉴定等方面进行全面的设计与分析[15],才能得到良好的人工抗原,以刺激动物产生针对半抗原的特异性抗体。因此,本实验设了两种不同的方法进行人工抗原的偶联,针对不同的偶联方法,要选择合适的偶联条件,还应注意偶联时的加入顺序,避免蛋白发生自身偶联。
3.2 人工抗原的鉴定
在合成人工抗原后,通常先进行物理化学方法的初步鉴定,常用的小分子人工抗原鉴定方法有可见-紫外分光光度法[16-17]、SDS-PAGE电泳[18]、示踪同位素法[19]、三硝基苯磺酸法[20]、电喷雾离子化质谱法[21]、基质辅助激光解吸离子化质谱法[22]等。本实验利用了前两种方法对偶联效果进行了鉴定,方法简单易操作、可行性高,且两种方法的鉴定结果相吻合。
3.3 免疫剂量的选择
根据以上免疫学特性鉴定结果可知,所合成的免疫原经免疫大白兔之后,获得了敏感性好,特异性强的多抗。免疫剂量对多抗的效价有很重要的作用,因此免疫的剂量选择也是关键问题。根据前人对于免疫剂量的探索,本实验选择的免疫剂量为1 mL/只,蛋白含量为150 μg/只。
3.4 合成方法对多抗的影响
免疫大白兔后得到的多抗,其效价有一定差异,分析其原因大致为两种。其一,免疫前所设计免疫剂量相同,但免疫时由于人工注射,可能存在一定的误差;其二,免疫动物存在个体差异,导致抗体的效价差异。EDC法的操作相对简单,所需要的条件稳定,得到兔源多抗的效价较高。而GA法,需要避光反应,且反应所需药品毒性较强,合成的人工抗原稳定性较差。
4 结 论
本实验通过EDC法和GA法成功合成了PMG人工抗原,并免疫新西兰大白兔得到了高效、敏感、特异的兔源多抗,对PMG的免疫学检测体系进行了初步的探索。通过对比表明,两种偶联方法都可行。本实验成功制备兔源多抗,为今后进一步筛选鼠源的单抗提供参考依据。
参考文献:
[1] 张莉, 陈亮, 刘菲. 快速分光光度法同步测定地下水中赤霉素和草甘膦的相互影响[J]. 光谱学与光谱分析, 2015(4): 966-970. DOI:10.3964/j.issn.1000-0593(2015)04-0966-05.
[2] 王天玉, 武秀停, 赵静, 等. 固相萃取-气相色谱法测定薏苡仁、白茯苓和山药中的草甘膦残留[J]. 分析科学学报, 2014(1): 63-66.
[3] 诸力, 陈红平, 周苏娟, 等. 超高效液相色谱-串联质谱法测定不同茶叶中草甘膦、氨甲基膦酸及草铵膦的残留[J]. 分析化学, 2015(2): 271-276. DOI:10.11895/j.issn.0253-3820.140708.
[4] 王海涛, 赵钰玲, 陆地, 等. 淋洗液在线发生离子色谱法测定水中的草甘膦[J]. 食品研究与开发, 2013, 34(22): 43-45. DOI:10.3969/ j.issn.1005-6521.2013.22.013.
[5] 刘丽菁, 邱文倩, 杨艳. 免试剂离子色谱法测定饮用水中草甘膦残留量[J]. 海峡预防医学杂志, 2014(5): 48-50.
[6] 李小娟, 孟品佳, 王燕燕, 等. 毛细管电泳-间接紫外法测定饮用水中草甘膦、草铵膦及其代谢产物[J]. 理化检验: 化学分册, 2015, 51(3): 307-311.
[7] 于福利, 宋正华. 流动注射化学发光技术在农药残留检测中的应用[J]. 农药, 2006(9): 584-586. DOI:10.3969/ j.issn.1006-0413.2006.09.003.
[8] CLEGG B S, STEPHENSON G R, HALL J C. Development of an enzyme-linked immunosorbent assay for the detection of glyphosate[J]. Journal of Agricultural and Food Chemistry, 1999, 47(12): 5031-5037. DOI:10.1021/jf990064x.
[9] LEE H U, SHIN H Y, LEE J Y, et al. Quantitative detection of glyphosate by simultaneous analysis of UV spectroscopy and fluorescence using DNA-labeled gold nanoparticles[J]. Journal of Agricultural and Food Chemistry, 2010, 58(23): 12096-12100. DOI:10.1021/jf102784t.
[10] GONZÁLEZ-MARTÍNEZ M Á, BRUN E M, PUCHADES R, et al. Glyphosate immunosensor. Application for water and soil analysis[J]. Analytical Chemistry, 2005, 77(13): 4219-4227.
[11] 潘熙萍, 楼佳俊, 张高精, 等. 草甘膦残留的酶联免疫分析方法的建立[J]. 湖北农业科学, 2012(5): 1002-1005. DOI:10.3969/ j.issn.0439-8114.2012.05.044.
[12] 孙亚宁, 胡骁飞, 邓瑞广, 等. 赭曲霉毒素A人工抗原的合成与鉴定[J].食品工业科技, 2011, 32(5): 172-175.
[13] 王耀, 胡骁飞, 裴亚峰, 等. 伏马菌素B1人工抗原的合成及鼠源多克隆抗血清的制备[J]. 核农学报, 2012(1): 113-117.
[14] 林方养, 杨耀东, 万婕, 等. 几种SDS-PAGE凝胶电泳染色方法的比较[J]. 安徽农业科学, 2014(8): 2295-2296. DOI:10.3969/ j.issn.0517-6611.2014.08.029.
[15] 宋娟, 王榕妹, 王悦秋, 等. 半抗原的设计、修饰及人工抗原的制备[J]. 分析化学, 2010(8): 1211-1218. DOI:10.3724/ SP.J.1096.2010.01211.
[16] 刘燕婷, 钟青萍, 雷红涛, 等. 基于不同载体免疫原制备河豚毒素抗体的研究[J]. 卫生研究, 2008(2): 234-236. DOI:10.3969/ j.issn.1000-8020.2008.02.031.
[17] YANG Jinyi, WANG Hong, JIANG Yueming, et al. Development of an enzyme-linked immuno-sorbent assay (ELISA) method for carbofuran residues[J]. Molecules, 2008, 13(4): 871-881. DOI:10.3390/ molecules13040871.
[18] 雷红涛, 庞杰, 贺丽苹, 等. 半抗原-载体蛋白偶联物的三种电泳鉴定方法[J]. 中国农业科学, 2010(3): 565-570. DOI:10.3864/ j.issn.0578-1752.2010.03.017.
[19] GRIFFITHS G L, CHANG C H, MCBRIDE W J, et al. Reagents and methods for PET using bispecific antibody pretargeting and68Garadiolabeled bivalent hapten-peptide-chelate conjugates[J]. Journal of Nuclear Medicine, 2004, 45(1): 30-39.
[20] TOMINAGA J, KAMIYA N, GOTO M. An enzyme-labeled protein polymer bearing pendent haptens[J]. Bioconjugate Chemistry, 2007, 18(3): 860-865. DOI:10.1021/bc060161d.
[21] ADAMCZYK M, BUKO A, CHEN Y Y, et al. Characterization of protein-hapten conjugates. 1. Matrix-assisted laser desorption ionization mass spectrometry of immuno BSA-hapten conjugates and comparison with other characterization methods[J]. Bioconjugate Chemistry, 1994, 5(6): 631-635. DOI:10.1021/bc00030a019.
[22] ADAMCZYK M, GEBLER J C, MATTINGLY P G. Characterization of protein-hapten conjugates. 2. Electrospray mass spectrometry of bovine serum albumin-hapten conjugates[J]. Bioconjugate Chemistry, 1996, 7(4): 475-481. DOI:10.1021/bc960035h.
Preparation of Artif i cial Antigen and ELISA Identif i cation of Rabbit Polyclonal Antiserum for the Detection of Glyphosate
WANG Jing1,2, WANG Yao2,*, WANG Fangyu1,*, DENG Ruiguang1, HU Xiaofei1, YU Qiuying1, HAO Junfang1, XING Yunrui1,2, HOU Yuze2
(1. Henan Key Laboratory of Animal Immunology, Henan Academy of Agriculture Sciences, Zhengzhou 450002, China; 2. Henan Engineering Laboratory of Livestock Disease Diagnosing and Food Safety Testing, College of Food and Bioengineering, Henan University of Science and Technology, Luoyang 471023, China)
To obtain polyclonal antiserum with high sensibility and specificity, artificial antigens were synthesized by coupling glyphosate (PMG) with the carrier proteins bovine serum albumin (BSA) and ovalbumin (OVA) separately by 1-ethyl-3-(3-dimethylaminopropyl) carbodiimide hydrochloride (EDC) and glutaraldehyde (GA) methods in this study. As a result, the immune antigen PMG-BSA and detection antigen PMG-OVA were obtained and identif i ed by UV spectroscopy and SDS-PAGE. New Zealand white rabbits were immunized with PMG-EDC-BSA and PMG-GA-BSA, respectively to obtain polyclonal antisera. The titer of the antisera was determined by indirect ELISA and their sensibility and specif i city were determined by indirect competitive ELISA. The results showed that the titer of antiserum of all three immunized rabbits was higher than 1:104. The antiserum of rabbit 2 exhibited the highest sensibility with an IC50of 30.9 μg/mL and good specif i city. The successful synthesis of artif i cial antigens and the obtainment of PMG polyclonal antiserum with high sensibility and specif i city may lay the foundation for rapid immunological detection of PMG.
glyphosate; artif i cial antigen; polyclonal antiserum; ELISA
10.7506/spkx1002-6630-201704011
S482.4
A
1002-6630(2017)04-0065-05
王晶, 王耀, 王方雨, 等. 草甘膦人工抗原的制备及兔源多抗的ELISA鉴定[J]. 食品科学, 2017, 38(4): 65-69.
DOI:10.7506/spkx1002-6630-201704011. http://www.spkx.net.cn
WANG Jing, WANG Yao, WANG Fangyu, et al. Preparation of artificial antigen and ELISA identification of rabbit polyclonal antiserum for the detection of glyphosate[J]. Food Science, 2017, 38(4): 65-69. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201704011. http://www.spkx.net.cn
2016-03-28
“十二五”国家科技支撑计划项目(2014BAD13B05);河南科技大学博士科研启动基金项目(13480062);河南省基础与前沿项目(142300413222)
王晶(1991—),女,硕士研究生,研究方向为食品安全检测。E-mail:15038551637@163.com
*通信作者:王耀(1986—),男,讲师,博士,研究方向为食品安全检测。E-mail:wangyao@haust.edu.cn
王方雨(1978—),男,副研究员,博士,研究方向为食品安全检测。E-mail:sprinkle.w@126.com
