大鼠结肠平滑肌细胞分离及电生理功能鉴定
2017-03-23邱素华
邱素华
消化道的运动依赖消化道平滑肌的收缩, Ca2+是触发平滑肌肌丝滑行的关键因素, 细胞内Ca2+在兴奋收缩耦联中起重要作用, Ca2+浓度改变会导致一系列病理生理过程[1-5]。膜片钳技术可观察结肠平滑肌细胞膜Ca2+电流特征, 为研究及治疗相关疾病提供新的思路[6-10]。膜片钳技术需要高产量和高质量的细胞, 传统的机械分离法对平滑肌细胞的损伤较大, 细胞存活率低, 存活时间短, 难以满足电生理实验需求,因此建立分离结肠平滑肌细胞的方法成为必然。本研究通过查阅国内外现行的平滑肌细胞的分离方法并加以改进[11-15],建立了适合电生理研究的结肠平滑肌细胞分离方法, 该方法操作简便, 重现性好。
1 材料与方法
1.1 试剂及溶液 试剂: 胶原酶Ⅱ、大豆胰蛋白酶抑制剂、HEPES及EGTA购于Sigma 公司, 其他试剂均为市售产品。无钙台氏液(mmol/L): 氯化钠(NaCl)137, 氯化钾(KCl)5.4, 六水合氯化镁(MgCl2·6H2O)1, 磷酸二氢钠(NaH2PO4)0.33, 葡萄糖10, 羟乙基哌嗪乙硫磺酸(HEPES)10, 氢氧化钠(NaOH) 调pH至7.40。消化液:含0.1%胶元酶Ⅱ和0.01%大豆胰蛋白酶抑制剂的无钙台氏液。KB液(mmol/L) : KCl 40, KH2PO420, MgCl2·6H2O 3, L-谷氨酸 50, 牛磺酸 20, HEPES 10, 氢氧化钾(KOH) 80, 葡萄糖10, 乙二醇双(2-氨基乙基醚)四乙酸(EGTA)0.5, KOH调pH至7.40。Ca2+电极内液(mmol/L):氯化铯(CsCl)120, 二水氯化钙 (CaCl2·2H2O)1, MgCl2·6H2O 5, 5 5-三磷酸腺苷二钠(ATP-Na2), EGTA 11, HEPES 10, 葡萄糖11,KOH调pH至7.20。Ca2+细胞外液(mmol/L): NaCl 120, CsCl 5, CaCl2·2H2O 1, MgCl2·6H2O 1, 氯化四乙胺 (TEA-Cl)20,Glucose 5.5, HEPES 10, NaOH调pH至7.35。溶液使用前均需氧饱和。
1.2 方法
1.2.1 单个结肠平滑肌细胞的分离 参照Bitar法加以改进, Wistar大鼠, 180~220 g, 雌雄不限, 实验前禁食24 h, 自由饮水。颈椎脱臼处死, 剖开腹腔, 快速自肛门上2 cm取结肠约10 cm, 并放置在4℃无钙台氏液中, 冲洗结肠内残余粪便。将冲洗干净的肠段移入含无钙台氏液的塑料培养板中,体视显微镜下采用机械法小心的刮除黏膜层、黏膜下层及浆膜层, 将较纯的平滑肌组织层剪成1~2 mm3的碎块, 加入到消化液中, 37℃恒温水浴震荡20 min, 200 g/min 离心5 min,弃消化液。再加入10 ml消化液, 37℃恒温水浴震荡20 min,加2倍无钙台氏液中止消化, 用玻璃吸管柔和吹打3 min, 使细胞自由脱落, 尼龙网过筛(孔径500 μm), 离心, 弃上清, 加适量KB液悬浮细胞, 4℃冰箱储存待用, 电生理实验一般在8 h内使用。
1.2.2 细胞形态观察 单个结肠平滑肌细胞在KB 液中保存1 h后, 离心, 采用梯度复钙法, 使细胞外Ca2+终浓度恢复至1 mmol/L后, 取一滴细胞悬液置于倒置显微镜下观察细胞形态。
1.2.3 细胞活性检测 0.4%台盼蓝溶液与细胞悬液1∶1混合, 室温放置3~5 min, 取20 μl细胞悬液置于血细胞计数板上, 高倍镜下观察细胞存活状况。死细胞染成淡蓝色, 而活细胞不染色并保持正常形态。
1.2.4 细胞钙电流记录 细胞池中预先冲入钙电流细胞外液, 取已复钙的细胞悬液加入细胞池中, 静止10 min使细胞贴壁。将充灌电极内液的玻璃微电极与细胞膜接触, 给予轻微负压开始封接, 当封接电阻大于1 GΩ后即形成高阻封接,破膜, 形成全细胞模式, 采用Axopatch 200B 放大器(AXON公司)记录细胞膜钙电流。电极尖端电阻以 2~6 MΩ为宜。
1.2.5 钙电流数据采用Clampfit10软件进行分析, 并通过Sigmaplot软件进行作图及曲线拟合。
2 结果
2.1 单个结肠平滑肌细胞的分离及质量测定 光镜下观察,细胞呈梭形, 横纹清晰, 遮光性较强, 长度各异, 有的舒张,有的收缩, 细胞成活率90%左右(图1a), 细胞外Ca2+浓度恢复至1 mmol/L后, 细胞仍能保持长梭形, 细胞边缘清晰, 有光泽(图1b)。经台盼蓝染色, 80% 以上的长梭状平滑肌细胞不染色并保持正常形态, 提示细胞成活率达80%。

图1 a 分离的大鼠结肠平滑肌细胞

图1 b 复钙后的大鼠结肠平滑肌细胞
2.2 细胞钙电流记录
2.2.1 -80 mV钳制电压钳制细胞, 给予10 ms的快速刺激,使快钠通道失活, 再给予-40 mV的钳制电压, 从-40 mV开始, 以10 mV的阶跃刺激连续去极化至+50 mV, 持续500 ms,刺激频率0.5 Hz, 记录细胞钙稳态激活电流(图2a)。
2.2.2 ICa-L电流-电压(I-V)曲线:大鼠结肠平滑肌细胞最大激活电压为-10 mV, 反转电位为33 mV(图2b)
2.2.3 采用双脉冲刺激, 保持电压-80 mV, 先给予条件脉冲从-90 mV, 每隔10 mV连续去极化至0 mV, 持续300 ms, 然后至-40 mV, 间期1 ms, 再跟一固定的去极化至0 mV, 持续140 ms的测试脉冲。记录细胞钙稳态失活曲线(图2c)。
2.2.4 采用双脉冲刺激, 保持电压-40 mV, 先给予去极化至0 mV, 持续260 ms的条件脉冲, 再给一同样的刺激脉冲, 两脉冲的间隔时间从0~1 s逐渐增加, 每次75 ms。记录细胞钙稳态失活曲线(图2d)。

图2 a 大鼠结肠平滑肌细胞L-型钙稳态激活电流

图2 c 大鼠结肠平滑肌细胞L-型钙稳态失活曲线
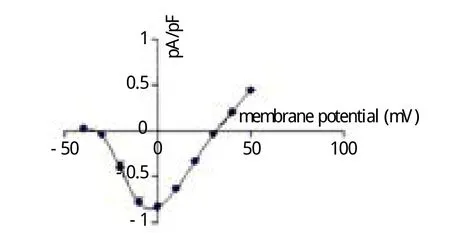
图2 b ICa-L电 流-电压(I-V)曲线

图2 d 大鼠结肠平滑肌细胞L-型钙稳态失活后恢复曲线
3 讨论
Ca2+是细胞内重要的第二信使, 几乎存在于所有的可兴奋细胞中, 它参与调节机体多种生命活动过程, 如:神经传导、肌肉收缩等[16-20]。Ca2+在平滑肌的收缩反应中起核心作用, 胞浆内Ca2+浓度的变化是启动平滑肌兴奋-收缩耦联的核心, 因此观察结肠平滑肌细胞膜钙电流的变化, 将为治疗相关疾病的研究提供新的思路[21-25]。本研究在成功分离大鼠结肠平滑肌细胞的基础上, 采用全细胞膜片钳技术记录细胞膜钙电流并观察了其激活、失活及失活后恢复曲线, 记录的钙电流电生理特征表明该方法得到的结肠平滑肌细胞具有完整的电生理活性。
新鲜分离的大鼠结肠平滑肌细胞更接近机体的自然状态, 且能排除机体体液及神经因素对实验的影响, 本实验从细胞形态、细胞活性和电生理功能特性三个方面, 鉴定了新鲜分离的大鼠结肠平滑肌细胞质量, 该方法操作简便, 重现性好。
[1] Cheong A, Li J, Sukumar P, et al.Potent suppression of vascular smooth muscle cell migration and human neointimal hyperplasia by KV1.3 channel blockers.Cardiovascular Research, 2011, 89(2):282.
[2] Beech DJ.Ion channel switching and activation in smoothmuscle cells of occlusive vascular diseases.Biochemical Society Transactions, 2007, 35(Pt5):890.
[3] 张婷, 胡京红, 王晶, 等.一种新型大鼠结肠纵行肌细胞分离培养方法的建立.中国药理学通报, 2013, 29(6):876-879.
[4] Bitar KN, Makhlouf GM.Receptors on smooth muscle cells:characterization by contraction and specific antagonists.American Journal of Physiology, 1982, 242(4):400-407.
[5] 梁宁霞, 衣兰娟, 田琳, 等.鼠结肠平滑肌细胞的分离、培养与鉴定.江苏医药, 2005, 31(6):433-435.
[6] Vogalis F, Lang RJ, Bywater RA, et al.Voltage-gated ionic currents in smooth muscle cells of guinea pig proximal colon.Am J Physiol,1993, 264(1):527-536.
[7] 周华, 李华, 张敏, 等.细胞内外钙在激动剂收缩结肠平滑肌中的作用.临床医药文献电子杂志, 2017, 4(8):1398-1399.
[8] Dai Y, Liu JX, Li JX, et al.Effect of pinaverium bromide on stressinduced colonic smooth muscle contractility disorder in rats.World Journal of Gastroenterology, 2003, 9(3):557-561.
[9] Hilleubanks DC, Werner ME, Heppner TJ, et al.Calcium Signaling in Smooth Muscle.Cold Spring Harbor Perspectives in Biology,2011, 3(9): a004549.
[10] 周华, 孔德虎, 马嵘,等.大鼠结肠平滑肌细胞的钙库操纵性通道.中国应用生理学杂志, 2006, 22(2):220-224.
[11] 王璐, 陈凤英, 吴雄灏,等.三种方法培养大鼠结肠平滑肌细胞的比较.中华生物医学工程杂志, 2016, 22(5):380-383.
[12] Yuan Y, Yingjuan YU.Isolation and culture of colonic smooth muscle cells with enzymolysis in diabetic rat.Jiangsu Medical Journal, 2011, 37(11):1241-1243.
[13] Liao D, Sevcencu C, Yoshida K, et al.Viscoelastic properties of isolated rat colon smooth muscle cells.Cell Biology International,2006, 30(10):854.
[14] Xiong Z, Sperelakis N, Noffsinger A, et al.Potassium currents in rat colonic smooth muscle cells and changes during development and aging.Pflügers Archiv European Journal of Physiology, 1995,430(4):563-572.
[15] Tanaka H, Hijikata T, Murakami T, et al.Localization of plectin and other related proteins along the sarcolemma in smooth muscle cells of rat colon.Cell Structure & Function, 2001, 26(2):61.
[16] Sun M, Feng W, Ping F.Insulin-like growth factor-1 inhibits colonic smooth muscle cell apoptosis in diabetic rats with colonic dysmotility.Regulatory Peptides, 2014, 194-195:41.
[17] Zhang M, Zang KH, Luo JL, et al.Magnolol inhibits colonic motility through down-regulation of voltage-sensitive L-type Ca2+channels of colonic smooth muscle cells in rats.Phytomedicine International Journal of Phytotherapy & Phytopharmacology, 2013,20(14):1272-1279.
[18] Wang Q, Lin L, Wang Y.254 Advanced Glycation End Products Cause Colonic Smooth Muscle Cells Hypertrophy in the Diabetic Rat via p38 MAPK Pathway.Gastroenterology, 2013, 144(5):S56.
[19] Giannarelli S, Balas D, Rampal P.Isolated smooth muscle cells of the human colon.Cytophysiological study.Gastroentérologie Clinique Et Biologique, 1993, 17(6-7):471.
[20] Boyer JC, Christen MO, Balmes JL, et al.Calcitonin gene-related peptide-induced relaxation of isolated human colonic smooth muscle cells through different intracellular pathways.Biochemical Pharmacology, 1998, 56(9):1097-1104.
[21] Zhou H, Kong D, Ma R, et al.Store--operated Ca~(2+) channels in rat colonic smooth muscle cells.Chinese Journal of Applied Physiology, 2006, 22(2):220.
[22] Kuemmerle JF.Synergistic regulation of NOS II expression by IL-1 beta and TNF-alpha in cultured rat colonic smooth muscle cells.American Journal of Physiology, 1998, 274(1 Pt 1):G178.
[23] Post JM, Hume JR.Ionic basis for spontaneous depolarizations in isolated smooth muscle cells of canine colon.American Journal of Physiology, 1992, 263(1):691-699.
[24] Bielefeld DR, Hume JR, Krier J.Action potentials and membrane currents of isolated single smooth muscle cells of cat and rabbit colon.Pflügers Archiv, 1990, 415(6):678-687.
[25] Chen ZY, Qi QH, Ma T, et al.Effect of emodin on motility signal transduction in colonic smooth muscle cells in rats with multiple organ dysfunction syndrome.Chinese Journal of Integrated Traditional & Western Medicine, 2004, 24(12):1106.
