巴沙鱼胶原蛋白支架材料的成骨效果评估
2017-03-23祖丽皮也朱庆丰王少海易杨华
陈 彤,吴 刚,祖丽皮也,朱庆丰,王少海,易杨华
巴沙鱼胶原蛋白支架材料的成骨效果评估
陈 彤1,吴 刚2,祖丽皮也1,朱庆丰1,王少海1,易杨华3
(1.第二军医大学附属长海医院口腔科 上海 200433;2.解放军第八五医院口腔科 上海 200052;3.第二军医大学海洋药物研究中心 上海 200433)
目的:验证一种来源于巴沙鱼皮的胶原蛋白支架材料作为屏障膜在兔颅骨引导骨再生(Guided Bone Regeneration,GBR)术中的成骨效果。方法:取新西兰大白兔12只,分别在其颅顶矢状缝左侧建立一个缺损,右侧建立两个缺损,缺损为圆形,直径8mm,共计36个骨缺损;然后按观察时间随机分为8周、12周两大组,每一大组随机分为3个亚组(n=4);A组缺损中只植入Bio-Oss骨粉,B组植入Bio-oss骨粉+巴沙鱼皮胶原支架材料;C组植入Bio-oss骨粉+Bio-Gide胶原膜。于术后8、12周处死相应组大白兔,切取骨缺损区标本并制作HE染色组织切片,定量分析各组骨缺损区骨组织再生的情况。结果:巴沙鱼胶原蛋白支架材料在GBR技术中能发挥屏障膜作用,引导和促进兔颅骨组织再生,其中B组与C组相比,8周时的成骨效果的差异无统计学意义(P>0.05),12周时C组成骨效果略高于B组(P<0.05);而A组在8周和12周时的成骨效果均显著低于B、C两组(P<0.05)。结论:巴沙鱼皮胶原蛋白支架材料作为屏障膜在兔颅骨缺损修复中起到了引导骨再生的作用。
引导骨组织再生;鱼类胶原蛋白;兔颅骨缺损模型;胶原蛋白支架材料;牙种植术
引导骨再生技术(Guided Bone Regeneration,GBR)是基于引导性组织再生(guided tissue regeneration,GTR)技术提出的一种促进骨组织再生的外科治疗方法。其原理为在骨缺损区域与上皮之间放置屏障膜,保护骨缺损空间,防止纤维结缔组织等的过快长入,从而促进骨修复的完成[1-2]。临床上常利用这种技术来解决种植区骨量不足或因牙周炎而造成重度牙槽骨吸收等问题。
在GBR技术中,屏障膜材料的选择是决定其引导骨组织再生效果的关键。可吸收性胶原膜是最常见的屏障膜材料之一,其最大的优点为可吸收,无需二次手术取出降低了感染的风险。同时胶原蛋白又具有低抗原性和创伤修复的优点,有利于机体的恢复,胶原蛋白还具有良好的生物相容性和组织亲和性,几乎不会引起机体的炎症或排斥反应。但胶原膜也存在着一些缺陷,例如机械强度差,空间维持能力低等[3]。前人的研究中已经证实胶原膜在GBR过程中能发挥良好的屏障作用[4]。大多数胶原膜的胶原成分来源于猪或者牛等陆生哺乳动物,由于传染病,口蹄疫等的原因,人们逐渐对此种来源的胶原蛋白制品产生了怀疑[5-6],除此之外,部分地区的宗教信仰也限制使用猪或者牛等来源的制品,这使传统的胶原蛋白制品的使用受到了一定的限制。
水生生物体内含有丰富的胶原蛋白,且具有着哺乳动物胶原不具备的优点,如低抗原性、低过敏性等,另外水生生物胶原蛋白来源丰富,价格也相对低廉,水产加工过程中产生的鱼皮鱼鳞鱼骨等废弃物中均含有丰富的胶原蛋白成分。七十年代起,人们就已经开始研究从水生生物体内提取胶原蛋白来,并取得了一定的成果,因此水生生物有可能逐步替代陆生动物成为胶原制品的主要原料来源[7-9]。本实验以巴沙鱼皮为原料,制备出了一种富含胶原蛋白的膜状支架材料。以兔为实验对象建立颅顶骨缺损动物模型[10-11],将巴沙鱼胶原蛋白支架材料应用于动物骨缺损GBR技术中[12-13],并以屏障效果肯定的胶原膜——Bio-Gide胶原膜作为阳性对照,以验证该新型原料来源的材料作为屏障膜引导骨组织再生的效果。
1 材料和方法
1.1 主要实验材料:新西兰大白兔12只,第二军医大学实验动物中心(动物使用许可证SYXK(沪)2012-0003)提供;巴沙鱼胶原蛋白膜12张(10mm×10mm),第二军医大学海洋药物研究中心提供;Bio-Gide胶原膜12张(10mm×10mm)(25mm×25mm,瑞士Geistilich公司);可吸收骨粉Bio-oss5瓶(0.25g,瑞士Geistilich公司)。
1.2 实验方法
1.2.1 巴沙鱼胶原蛋白膜的制备:速冻巴沙鱼皮,常温解冻后洗净风干至恒重,称重后依次用0.1%的NaOH溶液和3%的H2O2的溶液浸泡,用于脱色脱脂及去除部分杂蛋白。首次浸泡5h,待H2O2全部被还原,取出洗净,更换溶液继续浸泡24h。再用自来水冲洗至中性,然后在沥干水分情况下用适量洗洁精揉搓,再用自来水清洗。此过程重复5次。配置脱色液(甲醇︰乙酸︰水=250︰80︰670,体积比)进行脂脱杂蛋白处理。将材料置于脱色液中浸泡24h后取出,冲洗至中性。沥干水分的同时用适量洗洁精清洗5次,再用蒸馏水清洗3次,清洗完毕后置于蒸馏水中浸泡12h,用于去除鱼皮中残留其他物质。整个过程重复3次。最后将鱼皮取出,沥干水分,铺盘冷冻干燥后即可成形。
巴沙鱼皮胶原支架材料的热交联方法如下:将上述制备好的巴沙鱼胶原支架材料放置于真空干燥箱中,设置干燥箱温度为110℃,72h后取出,即可完成交联。
该材料呈膜状,厚薄均匀,厚度为(0.66±0.10)mm。经半微量凯氏定氮法可测得该材料的胶原蛋白含量高达95.20%。凝胶电泳实验分析可知该材料主要为I型胶原。
扫描电镜照片显示(图1),该胶原蛋白支架材料的一面较为粗糙(图1A),可见多孔结构,孔径大小不一,孔与孔之间相互通连,分布较为均匀。另一面则比较光滑(图1B),孔隙致密。

图1 巴沙鱼皮胶原膜扫描电镜图片(×200)
1.2.2 兔颅顶骨缺损模型的建立:取1~2周龄的健康雄性新西兰大白兔,12只(体质量1.5~2kg),3%戊巴比妥钠注射液耳缘静脉注射(1~1.5ml/kg体质量)麻醉后,颅顶部术区备皮,常规消毒,并于颅顶部颅中缝上方皮肤作竖型切口,切口长2~3cm,分离软组织和骨膜并暴露颅顶骨后,用慢速直机(卡瓦K4)分别在矢状缝两侧与两眼眶后缘连线一侧后5mm,对侧后3mm以及13mm处各制备一个直径8mm的全层颅骨缺损(见图2),注意保留完整的硬脑膜及骨膜组织。生理盐水冲尽骨屑并拭干,按以下分组进行相应的处理。
1.2.3 实验分组和GBR处理:将上述制备有颅顶骨缺损的12只大白兔按观察时间随机分为8周、12周两大组(每组6只,共18个骨缺损区);每一大组的18个骨缺损区再按不同处理方法各随机分为A、B、C3个亚组(每组6个骨缺损区)。其中A组骨缺损区植入Bio-Oss骨粉,不覆盖任何膜,缝合;B组骨缺损区植入Bio-Oss骨粉,用巴沙鱼皮胶原蛋白膜覆盖;C组骨缺损区植入Bio-Oss骨粉,用Bio-Gide膜覆盖,并缝合(见图3、4);术后24~48h肌肉注射10~20万单位的青霉素钠,连续注射3d。术后10d拆线。所有动物均于相同条件下饲养。

图2 建立兔颅骨骨缺损模型

图3 对各缺损区按分组分别进行不同处理
图4 缝合
1.2.4 取材和大体观察:分别于术后8周和12周处死相应组大白兔,分别截取各缺损区及其周围10mm以内的全层骨组织,并肉眼观察各缺损区愈合情况和屏障膜的降解情况。1.2.5 组织学观察:各组颅顶骨标本经常规固定后,置于EDTA脱钙液(500ml,BOSTER)中脱钙,树脂包埋,用组织切片机(Leica RM2235)垂直于骨组织面作水平方向切片(片厚5mm)。后取各标本中心层切片,进行HE染色,光学显微镜下观察新生骨组织成骨情况、新生组织血管化及纤维组织等其他组织学变化情况。用计算机图像分析系统随机采集同一样本不同成骨区域在40倍视野下HE染色切片的图像,各取14张,并用图像分析软件IMAGEPRO PLUS 6.0进行定量分析,计算同一图像下新生骨小梁面积(new bone area,NBA)占图像骨缺损初始面积(total defect area,TDA)的百分比。取同一样本所有图像百分比的均数作为该样本新生骨量的百分比(The percentage of new bone,PNB)
1.3 统计学分析:用SPSS18.0软件对数据(x¯±s)进行方差分析,两组间比较使用ANOVA检验,同组内两两比较使用t检验,检验水准α=0.05。
2 结果
2.1 大体观察:观察期间,各组动物进食、活动均正常,并健康成活至处死;术后10d拆线,各动物的创口愈合情况均良好。GBR术后8周,骨缺损区域无明显感染,B、C组屏障膜材料基本降解,与骨缺损区域无粘连,各组均可见未降解的骨粉颗粒,可探及实质性修复(见图5);GBR术后12周,骨缺损区域无明显感染,B、C组屏障膜已完全降解,各组均可探及实质性新生骨组织,可见少量散在的骨粉残余(见图6)。

图5 8周时的骨样本

图6 12周时的骨样本
2.2 组织学观察:8周时,各组均可见到早期新骨结构的形成(见图7~8)。其中空白组中可见到较多的纤维结缔组织的长入,实验组和对照组中则纤维结缔组织较少,各组均可见少量的炎症细胞和新生血管的存在,同时各组还可见未降解的骨粉颗粒组织。12周时,各组的新生骨小梁结构更为成熟,更多的纤维结缔组织有在向骨质分化的趋势,可见较多新生血管,炎症细胞和未降解的骨粉相比8周时有所减少(见图8~10)。
2.3 组织定量学分析:GBR术后各组织样本新生骨量定量分析结果显示:8、12周大组内,新生骨量均为C组>B组>A组(表1)。可见:B组与C组相比,8周时的成骨效果的差异无统计学意义(P>0.05),12周时C组成骨效果略高于B组(P<0.05);而A组在8周和12周时的成骨效果均显著低于
B、C两组(P<0.05)。

图7 8周A组成骨区,红色淡染为纤维结缔组织(黑色箭头),占了绝大部分(HE×40)
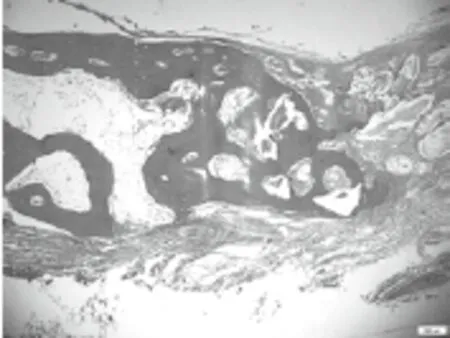
图8 8周B组成骨区,新生骨小梁明显增多。可见较多新生血管以及骨髓腔(HE×40)
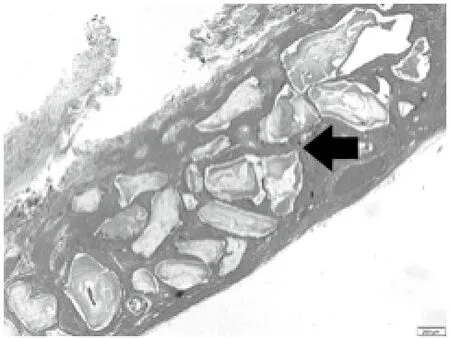
图9 8周C组成骨区,可见新生骨小梁以及未降解的骨粉颗粒(黑色箭头)(HE×40)
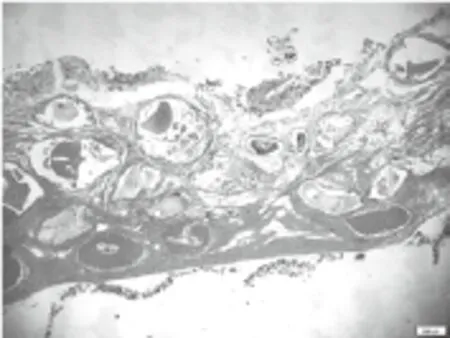
图10 12周A组成骨区,可见纤维结缔组织在向骨组织分化(HE×40)

图11 12周B组成骨区,可见较多成熟的骨组织(HE×40)
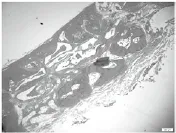
图12 12周C组成骨区,成熟骨组织数量增多,新生血管数量增多,未降解的骨粉减少(HE×40)
3 讨论
GBR技术中,屏障膜的使用是关键,它能够选择性阻挡上皮和成纤维细胞进入拟成骨空间,同时又不会妨碍组织缺损的自然愈合的过程[14]。屏障膜一方面可以在局部维持足够的成骨空间,以利于来充填足量的人工材料或自体骨;另一方面因其自身具有一定的稳定性,可保证有充足的时间让成骨细胞占据成骨空间,同时还可在其降解过程中引导新生血管的长入,从而促进和引导屏障膜两侧组织的自我修复过程。在所有可吸收性膜中,胶原膜因具有很强的生物活性和生物功能、较高的细胞黏附水平以及一定的生物降解率,同时具有较弱的抗原性和良好的生物相容性[15],已经成为临床上最常用的可吸收膜。但由于相关畜类疾病和某些宗教信仰限制了人们对陆生哺乳动物胶原蛋白及其制品的使用,利用水生生物来源的胶原蛋白逐渐成为人们研究的热点。
巴沙鱼(Pangasisushaniltoa)是一种优质的东南亚特产淡水鱼类,原产于越南湄公河三角洲和泰国湄南河流域,资源丰富,加工过程中产生下脚料如鱼皮、鱼肚、鱼鳍等数量巨大,原料来源广泛。I型胶原纤维为构成该种鱼胶原蛋白基本骨架的主要成分,其已被证实具有较低的免疫原性,优良的生物相容性以及良好的促进细胞增殖能力[16]。鱼I型胶原的主要特征之一为在酸溶液中具有极高的溶解性,因此较鸟类和哺乳类胶原蛋白更易于提取[17-18]。鱼类胶原的氨基酸组成也与哺乳动物类似[19-23],这说明鱼胶原蛋白与哺乳动物胶原蛋白具有相似的稳定性。在GBR过程中,以巴沙鱼皮胶原蛋白膜作为屏障膜,其空间三维网状结构能够调节、诱导并促进宿主细胞长入;随着成骨细胞、血管内皮细胞及多种生长因子的长入和增殖,便可形成新生骨组织和新生血管,并逐渐将膜内物质降解、吸收,替换成为有宿主自体特征的细胞外组织基质。
Bio-Gide胶原膜是一种已被实验证实能有效发挥屏障膜作用的胶原膜材料[24],以I型胶原纤维和III型胶原纤维为主要成分,构成空间三维网状结构,并通过双层膜的设计而使其能保持较长时间的屏障作用,面对缺损区的疏松多孔的一面具有聚集黏附成骨因子的作用,可诱导骨基质释放骨形态发生蛋白、转化生长因子、胰岛素样生长因子和成纤维细胞生长因子等,而面对结缔组织光滑致密的一面则不会表现骨诱导性。所以即使胶原本身并没有释放或结合这些成骨因子的能力,它结合了对这些因子具有高结合能力的细胞外基质蛋白[25],就可以使胶原膜聚集骨诱导因子,将先前迁移来的细胞分化成具有成骨性能的细胞,促进新骨的生成。同时,I型胶原蛋白可以在成骨细胞分化中起到直接和重要的作用[26-27]。同时,许多临床医生报道在GBR中使用Bio-Gide胶原膜取得了较高的成功率[4]。
本实验中将巴沙鱼皮胶原蛋白支架材料、Bio-Gide胶原膜和人工骨替代物Bio-Oss配合使用。分别于GBR术后的8、12周时观察发现,B组(巴沙鱼皮胶原蛋白膜)和C组(Bio-Gide胶原膜)在组织学表现上较为类似,8周即可观察到一定的新生骨小梁并伴有部分未骨化的纤维结缔组织和未完全降解的骨粉颗粒。l2周时两组的新生骨小梁数量均显著增加。无论8周还是12周,各组的新生骨量均为C组最高,其次为B组,8周时,B组与C组间的差异无统计学意义(P>0.05),而12周时,C组成骨量高于B组,两组间的差异有统计学意义(P<0.05);而A组(无膜覆盖组)的新生骨量则明显低于B、C组,差异具有统计学意义(P<0.05)。12周与8周相比,各组的新生骨量的差异均有统计学意义(P<0.05);组织学观察显示,12周时的所有实验组仍未形成完全成熟的致密骨板和哈弗系统,仅可见部分骨小梁融合和少量骨髓腔形成,骨粉均未完全降解完。本结果表明,巴沙鱼皮胶原蛋白膜和Bio-Gide胶原膜均能在GBR技术中发挥屏障膜作用,并促进兔颅骨缺损的骨组织再生和修复,成骨效果相差不多。但其促进和引导缺损区骨组织修复的远期效果是否存在差异尚需进一步的实验论证。
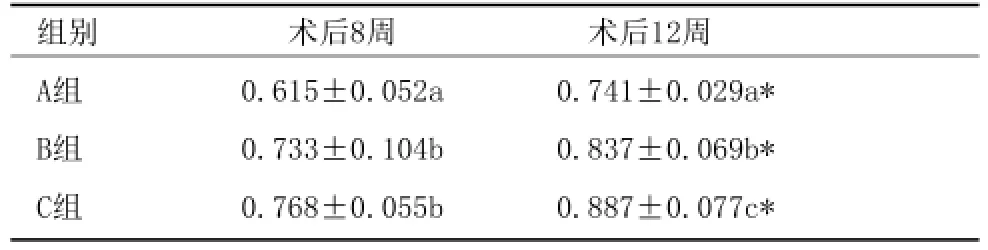
表1 各组新生骨量百分比比较 (%,x¯±s)
[1]Hong SK, Kim JT, Jung YJ,et al. Preparation of a porous chitosan/ fibroin-hydroxyapatite composite matrix for tissue engineering[J]. Macromol Res,2007,15(1):65-73.
[2]Won JY, Park CY, Bae JH, et al.Evaluation of 3D printed PCL/PLGA/ β-TCP versus collagen membranes for guided bone regeneration in a beagle implant model[J].Biomed Mater,2016,11(5):055013.
[3] Bottino MC,Thomas V,Janowski GM. A novel spatially designed and functionally graded electrospun membrane for periodontal regeneration[J].Acta Biomater,2011,7:216-224.
[4]Silva EC,Omonte SV,Martins AG,et al.Hyaluronic acid on collagen membranes: An experimental study in rats[J].Arch Oral Biol,2016,73:214-222.
[5]Pal GK, Suresh PV.Microbial collagenases: challenges and prospects in production and potential applications in food and nutrition[J]. RSC Adv,2016,6(23):33763-33780.
[6]Pal GK, Suresh PV. Sustainable valorisation of seafood byproducts: recovery of collagen and development of collagen-based novel functional food ingredients[J]. Innovative Food Sci Emerg Technol,2016,37:201-215.
[7]Benjakul S, Morrissey MT.Protein Hydrolysates from Pacific Whiting Solid Wastes[J]. J Agric Food Chem,1997,45(9):4323-3430.
[8]Taylar MM,Cabeza LF, Marmer WN,et al.Preparation of High Molecular Weight Products by Crosslinking Protein Isolated from the Enzymatic Processing of Chromium-Containing Collagenous Waste:I. Extraction of Gelatin [J].Leather Sci Eng,2005,15:76-99.
[9]曾名勇,李八方,陈胜军,等.红非鲫(Oreochromis niloticus)鱼皮胶原蛋白酶解条件的研究[J]. 中国海洋药物杂志,2005,24(5):24-29. [10]薛英,刘强.神经生长因子结合骨基质明胶修复兔颅骨缺损的实验研究[J].中国当代医药, 2012,19(23):15-17.
[11]李琦,周延民,翟静捷,等.富血小板纤维蛋白修复兔颅骨骨缺损的实验研究[J].口腔医学研究, 2011,27(7):587-589.
[12]Fugazoto PA. GBR using bovine bone matrix and resorbable and nonresorbable membranes.Part2:Clinical results[J].Int J Periodo Restor Dent,2003, 23(6):599-605.
[13]Clokie CM,Moghadam H,Jackson MT,et a1.Closure of critical sized defects with allogenic and alloplastic bone substitutes[J]. J Craniofac Surg,2002,13(1):122-123.
[14]Pati F,Datta P,Adhikari B,et al.Collagen scaffolds derived from fresh water fish origin and their biocompatibility[J]. J Biomater Mater Res,2012,100(4):1068-1079.
[15]Shoseyov O,Posen Y,Grynspan F.Human recombinant Type I collagen produced in plants[J]. Tissue Eng,2013,19(13-14):1527-1533.
[16]Yamamoto K,Igawa K,Sugimoto K,et al. Biological safety of fish (tilapia) collagen[J].Biomed Res Int,2014,2014(2):164-165.
[17]Gallop P M,Seier S. Preparation and properties of soluble collagens[J]. Methods Enzymol, 1963,6(4):635-641.
[18]Yamaguchi K,Lavety J,Love RM.The connective tissues of fish VIII. Comparative studies on hake, cod and catfish collagens[J]. Int J Food Technol,1976,11(4):389-399.
[19]Kimura S.Vertebrate skin type I collagen: Comparison of bony fishes with lamprey and calf[J]. Comp Biochem Physiol B:Biochem Mol Biol, 1983,74(3): 525-528.
[20]Kimura S,Zhu XP,Matsui R,et al.Characterization of fish muscle type I collagen[J]. J Food Sci,1988,53(5):1315-1318.
[21]Nagai T, Yamashita E, Taniguchi K,et al. Isolation and characterisation of collagen from the outer skin waste material of cuttlefish (Sepia lycidas) [J]. Food Chem, 2001,72(4):425-429.
[22]Nagai N, Yunoki S, Suzuki T,et al. Application of cross-linked salmon atelocollagen to the scaffold of human periodontal ligament cells[J]. J Biosci Bioeng, 2004,97(97):389-394.
[23]Bae I, Osatomi K, Yoshida A,et al. Biochemical properties of acidsoluble collagens extracted from the skins of underutilised fishes[J]. Food Chem, 2008,108(1):49-54.
[24]陈铁楼,王刚,陈婷,等.引导骨再生术和引导组织再生术治疗牙周根分叉病变的临床研究[J].口腔医学,2006,26(6):404-407.
[25]Chandy T,Sharma CP.Chitosan--as a biomaterial[J]. Artificial Cells,Blood Substitutes,and Biotechnology,1990,18(1):1-24.
[26]VandeVord PJ,Matthew HW,DeSilva SP,et al. Evaluation of the biocompatibility of a chitosan scaffold in mice[J]. J Biomed Mater Res,2002,59(3):585-590.
[27]Kang YH, Kim HC,Shin SH,et al. Osteoconductive Effect of Chitosan/Hydroxyapatite Composite Matrix on Rat Skull Defect[J]. Tissue Eng Regen Med,2011,8(1):23-31.
Osteogenetic Effects of Collagen Scaffold Material from Basa Fish (Pangasisushaniltoa) Skin on GBR of Rabbit Skull Defect
CHEN Tong1,WU Gang2,Zulpiye·Ablikim1,ZHU Qing-feng1,WANG Shao-hai1,YI Yang-hua3
(1.ChangHai Hospital Department of Stomatology,Shanghai 200433,China; 2.The 85 Hospital of People’s Liberation Army Department of Stomatology,Shanghai 200052, China; 3.School of Pharmacy, The Second Military Medical University,Shanghai 200433,China)
guided bone regeneration;fish collagen;rabbit skull defect models;collagen scaffold material from fish;Dental implants
Q591.2 R782.12
A
1008-6455(2017)02-0076-05
2016-11-12
2017-01-28
编辑/张惠娟
海洋公益性行业科研专项(201405015;201305013)资助;国家自然科学基金(81271177)资助
王少海(1974-),男,教授;研究方向:口腔修复学;E-mail:48321987@qq.com
易杨华(1946-),男,教授;研究方向:海洋药物;E-mail:yiyanghua@126.com
陈彤(1990-),女,硕士研究生;研究方向:口腔修复材料学
Abstract: ObjectiveTo research the effects of collagen scaffold material from Basa fish skin on the repair of the rabbit skull defects.MethodsAcycloid skull defect with the diameter of 8mm was made on both sides of the sagittal suture of 12 rabbits.The rabbits were randomly divided in to 3 groups.The skull defects were treated with implantation of Bio-Oss,collagen scaffold material from Basa fish skin+Bio-Oss, Bio-Gide+Bio-Oss, respectively. After 8 and 12 weeks,6 rabbits were sacrificed respectively and the bone samples were examined by HE staining.ResultsCollagen scaffold material from Basa fish skin could play a role as barrier membrane in guiding and promoting osteogenesis in rabbit skull defects. There was no significant difference between group B and group C in promoting osteogenesis at 8 week after treatment(P>0.05) but both more than group A(P<0.05).At 12 week, group B is better than group A(P<0.05)and worse than group C.ConclusionCollagen scaffold material from Basa fish skin can promote osteogenesis in bone defect.
