中学催化剂的种类及应用研究
2017-03-18华煜青杭州第十四中学康桥校区浙江杭州310015
华煜青(杭州第十四中学康桥校区,浙江 杭州 310015)
中学催化剂的种类及应用研究
华煜青(杭州第十四中学康桥校区,浙江 杭州 310015)
催化剂是化学中最常见的物质之一,它能改变化学反应速率,缩短或延长反应完成时间。几乎所有的化学反应都可以在催化剂的作用下提高生产效率,因此找到合适的催化剂至关重要。介绍催化剂的性质及其对化学反应的作用机理,举例说明中学用到催化剂的化学反应,并对其催化机理作简要分析,最后总结催化剂的发展趋势。
催化剂;种类;机理
催化剂又称之为触媒,是指改变化学反应速率,但其自身的化学性质和质量都不变的元素或化合物。催化剂用量小,作用大,分别应用于加氢、脱氢、聚合、酯化等催化反应。
中学课本里,对催化剂的催化解释是不参与化学反应,但在一些文献及试题中都有关于催化剂参与反应的问题。因此,本文对中学涉及到的催化剂进行探讨,介绍催化剂的性质,从催化机理上解释催化剂发挥作用的方式。通过举若干例子,对化学反应中的催化机理进行逐一分析,得出催化剂是否参与反应的结论。
1 催化剂与化学反应
1.1 催化剂的性质
催化剂是指改变反应物化学反应速率而不改变化学平衡,且本身的质量和化学性质在化学反应前后都没有发生改变的物质。
催化剂对化学反应的影响有正催化作用也有逆催化作用,正催化作用即加快化学反应速率,逆催化作用即减慢化学反应速率,根据化学反应的要求不同,利用催化剂对化学反应完成时间进行控制。在整个化学反应中,催化剂只是影响反应速率,因此它的质量化学性质不发生任何变化,但是其物理性质可能会变成变化。一般情况下,催化剂仅仅对改变某一化学反应有帮助,而对于其他的化学反应影响微乎其微,因此,催化剂具有选择性。此外,催化剂在参与化学反应时,可能需要一定的温度、压力,让催化剂达到最大的使用活性,即催化剂具有一定活性。
1.2 催化剂的作用机理
催化剂的作用机理有两种解释,即催化剂不参与化学反应和催化剂参与化学反应两种。
1.2.1 催化剂不参与化学反应
在中学课本上,催化剂在反应前后,本身的质量和化学性质都不发生变化,但是其物理性质可能发生变化,视具体的化学反应而呈现不同的变化形态。
1.2.2 催化剂参与化学反应
这种理论解释是基于活化能原理,所谓活化能是指分子从常态转化为容易发生化学反应的活跃状态所需的最小能量,这是由瑞典化学家阿伦尼乌斯提出的。催化剂在化学反应中参与反应,与反应物生成一种中间产物,该过程所需的活化能要比原反应物所需的活化能要小很多。反应过程可以表述如下

式中A,B是反应物,C是催化剂。
2 催化剂的种类及应用
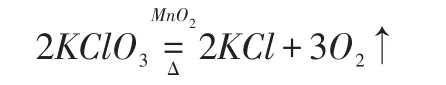
若按照催化剂参与化学反应的解释,催化剂首先与KClO3反应,生成高锰酸钾、氯气和氧气,如式(2)所示,而后高锰酸钾在加热的环境下分解成锰酸钾、二氧化锰和氧气,如式所示(3),最后,锰酸钾和氯气反应,生成氯化钾、二氧化锰和氧气,如式(4)。综上,要判断MnO2是否参与反应,只需测定生成的氧气中的纯度,是否混有氯气。目前,对于MnO2催化作用还没有完全弄清楚,主要是因为反应制得的氧气中含有氯气的气味。

二氧化锰的催化作用还被应用在过氧化氢H2O2分解实验中,这也是实验室制取氧气的一种方法。在常温下,过氧化氢就可以自分解成氧气和水,但是反应很慢,当在试管中加入少量的二氧化锰时,有大量的气泡冒出,由带火星的木条测试知是氧气,其化学反应方程式如式(5)所示,在这个反应中二氧化锰作为催化剂,通过降低反应的活化能,单位体积内的活化分子百分数增加,使得过氧化氢的分解速率加快。

2.1 金属催化剂
2.1.1 二氧化锰
二氧化锰是中学化学力最常见到的催化剂,如在氯酸钾(KClO3)分解制取氧气的实验中,让氯酸钾与二氧化锰(MnO2)进行混合加热到200℃,可以释放出氧气与氯化钾。这种方法是一种常见的实验室制氧法。通常会在反应堆里加入二氧化锰,能够很明显的观察到试管一端气体冒出。若催化剂不参与化学反应,则化学反应式可以表述为式(1);
2.2.2 铁触媒
铁触媒主要成分是指+2价铁和+3价铁组成的氧化物,工业制取氨气通常采用铁触媒作为催化剂,在高温500℃、高压20MPa~50MPa的反应炉里,氮气N2和氢气H2发生化学反应生成氨气.
3 催化剂的发展展望
3.1 催化剂的微观解释
几乎所有的金属催化剂都是过渡金属或者贵金属,它主要催化的化学反应是加氢、脱氧反应。对于过渡金属元素,其最外层有1~2个电子,次外层有1~10个电子,因此(n-1)dns有未成对的电子。即使d电子完全充满,根据能量跃迁原则,也有可能跃迁到s层轨道上,因此d轨道上有未成对的电子,从而产生化学吸附。所谓化学吸附是指吸附质和吸附剂的表面产生化学键,即原子间发生了电子交换、移动。因此,催化剂与反应物的化学吸附分析结果决定了催化剂是否能发挥作用。液体催化剂的催化是由于在液体中,反应物、催化剂以离子形式存在,增大了反应物与催化剂的接触机会,使得反应向右进行。对于酶,其分子结构是刚性的,但是其表面具有特定的形状,与反应物结构一一对应,而对于其他反应物的结构不起作用,这种目前对酶催化的一种微观解释。
3.2 催化剂的发展趋势
3.2.1 高效节能
催化剂的作用是改变化学反应的速率,就目前中学接触到的,都是正催化剂,即加快反应的进行。在实际的化学反应中也有负催化剂,如减缓某些气体产出的速率,防止压力骤增,发生爆炸。对于任何一款催化剂,选择标准是希望催化速率快、转化效率高,能够在较短的时间内发生作用,减小反应控制的难度,即在常温常压下即可发生作用。
3.2.2 绿色催化
随着资源数量的日益减少,环境质量的不断恶化,雾霾、沙尘,水土流失等现象越来越严重,工业发展与环境的和谐发展很早就被提出来了,虽然有一定的改善和进步,但还远远不断够。催化剂作为现代化工必不可少的一环,它的使用和处理也成为绿色化工中很重要的问题。虽然催化剂在化学反应前后化学性质不变,质量不变,但是在使用过程中受种种因素干扰,如某些外来反应物、反应温度过高、压力过大等,会使得催化剂缓慢甚至快速失活,而且这种失活是不可逆的。一旦催化剂失活,则在该化学反应中即是废料,如何对废料处理,变废为宝是绿色化工中一直考虑的问题。因此,催化剂的选用、以及催化剂的处理是未来催化剂的一个重要研究方向,选择合适的催化剂,既能保证化学反应的正常进行,也能减少或者消除产生对人类健康和环境有害的产物。
4 结语
催化剂的研制及其技术的发展,是化学工业中优先发展的重点,找到一款合适的催化剂,化学反应就成功了一大半。现在中学课本接触到的催化剂大都是简单的实验室方法和部分工业方法,对于工业上使用催化剂要复杂的多。催化剂的理论研究仍在继续,活化能理论在一定程度解释了发生催化反应的实质,在微观层面上,如原子、电子等,一些新的催化理论正在进行当中。
[1]王祖浩.化学[M].江苏教育出版社,1999.
[2]陈文召.催化剂在化学中的角色及其应用[J].吉林教育, 2008(25):75-76.
华煜青(1999-),女。
