低温胁迫小麦苗冰结构蛋白纯化的研究
2017-03-14焦宇知梁家冰何志勇张晓晓刘永博孙芝杨翟玮玮
焦宇知,徐 桃,梁家冰,朱 云,何志勇,张晓晓,刘永博,孙芝杨,翟玮玮
(1.江苏食品药品职业技术学院,江苏淮安 223005;2. Purdue University,West Lafayette,IN,USA,47907;3.山东省莒县人民医院,山东莒县 276511;4.江南大学,江苏无锡 214122;5.山东朝能福瑞达生物科技有限公司,山东济南 250031)
低温胁迫小麦苗冰结构蛋白纯化的研究
焦宇知1,2,徐 桃1,梁家冰3,朱 云1,何志勇4,张晓晓1,刘永博5,孙芝杨1,翟玮玮1
(1.江苏食品药品职业技术学院,江苏淮安 223005;2. Purdue University,West Lafayette,IN,USA,47907;3.山东省莒县人民医院,山东莒县 276511;4.江南大学,江苏无锡 214122;5.山东朝能福瑞达生物科技有限公司,山东济南 250031)
以研究低温胁迫小麦苗冰结构蛋白(ISP)纯化为目的,以小麦苗为对象,经低温胁迫,并采用粗分离、饱和硫酸铵溶液沉淀、DEAE-Cellulose 52层析、sephadex-G75凝胶层析4个步骤对其中ISP进行纯化,分别采用差示扫描量热法(DSC)、热休克处理法和聚丙烯酰氨凝胶电泳(SDS-PAGE)测定各纯化步骤所得ISP的热滞活性(THA)、冰晶重结晶抑制能力(ICP)和分子质量(MW),并计算小麦苗存活率和各纯化步骤的得率。实验结果表明,梯度低温胁迫的小麦苗存活率与恒温低温胁迫相比提高了240%,小麦苗提取物(AWSE)中蛋白质含量与未低温胁迫小麦苗提取物(NAWSE)相比提高了7.8%;以THA表征的纯化倍数(T1)和以ICP表征的纯化倍数(T2)分别为451.15和137.60,得率为2.85%,THA为0.180 ℃(5 mg/mL),ICP为70.03%,分子质量范围为20.1~31.0 ku;与THA相比,ISP在较低浓度下即可达到ICP的峰值。小麦苗可作为制备冰结构蛋白的天然植物资源。
小麦苗,低温胁迫,冰结构蛋白,热滞活性,重结晶抑制能力
冰结构蛋白(ISP)作为一类对冰晶生长和重结晶有抑制能力的蛋白质,可非依数性的降低溶液冰点而不影响其熔点,从而引起熔点与冰点差异,这种差异被称为热滞活性(THA)[1]。ISP添加到冷冻面团[2-4]、冷冻肉制品[5]和冰淇淋[6-7]等冷冻食品或原料中,可通过吸附到冰晶表面并使冰晶的生长和重结晶而受到抑制,降低冰点,从而改善冷冻食品的质构和原料加工特性,应用潜力巨大。
目前已发现分布于植物、海洋鱼类、昆虫和微生物中的5类ISP,且发现和鉴定了越来越多不同来源的ISP,如沙棘[8]、黑麦草[9]、沙冬青[10]、白斑狗鱼[11]和光滑鳖甲[12]等。获取ISP的纯化方法主要有层析分离法[9]、电泳分离法[13]、冰特异性吸附分离法[14-15]、核磁共振法[16]和浊点萃取法[17]等。
由于ISP降低冰点幅度有限且产量小,与传统食用抗冻剂相比,ISP的高成本限制了其在食品中的广泛应用。因此,转基因[18]、低温胁迫[19-21]等诱导ISP合成的方法和探究更为廉价的ISP来源成为研究热点。植物由于原料广泛、易得和廉价,且其中的ISP具有良好的冰晶重结晶抑制能力(ICP),已成为生产ISP的重要原料之一[22]。小麦苗作为一种廉价易得植物,对其低温胁迫诱导产生具有抑制重结晶的蛋白质在国内外已有公开报道[6,9,23]。但麦种来源和低温胁迫条件不同,ISP结构和活性可能有较大差异[22]。本工作拟以淮麦33为麦种,以低温胁迫诱导产生ISP,利用粗分离、饱和硫酸铵溶液沉淀、DEAE-Cellulose 52层析、sephadex-G75凝胶层析对其进行纯化,采用差示扫描量热法(DSC)、热休克处理法和聚丙烯酰氨凝胶电泳(SDS-PAGE)法分别测定纯化各步骤所得ISP的THA、ICP和分子质量,计算低温胁迫小麦苗存活率以筛选最优低温胁迫方法,计算各纯化步骤的得率以评价纯化效果,以期为小麦苗来源的ISP开发提供参考。
1 材料与方法
1.1 材料与仪器
淮麦33 淮安市农科院提供;DEAE-Cellulose 52、考马斯亮蓝G250、N,N,N′,N′-四甲基乙二胺 美国sigma;sephadex-G75 瑞典Pharmacia公司;鸡蛋清溶菌酶、胰蛋白酶抑制剂、牛碳酸酐酶、兔肌动蛋白、牛血清白蛋白、兔磷酸化酶B 上海普欣生物科技公司;十二烷基硫酸钠(SDS)、巯基乙醇、溴酚蓝、甘油、过硫酸铵、乙二胺四乙酸二钠(EDTA)、苯甲基磺酰氟(PMSF)、硫酸铜、硫酸钾、氯化钾、硫酸、溴酚蓝、硫酸铵、盐酸等 国药集团;透析膜上海生工生物,截留分子质量MWCO 3.5 ku。
DSC-7差热分析仪 美国PE公司;GTOP-158D光照培养箱 浙江托普仪器公司;DW-86L288超低温冰箱 海尔公司;CX41显微镜、DP20成像系统 日本OLYMPUS公司;HCS410冷热台 美国INSTEC;GL-20G-II高速冷冻离心机 上海安亭科学仪器厂;K9840/SH220N凯氏定氮仪 济南海能仪器公司;HDB-3紫外检测仪、TH-1000梯度混合器、EBS-20自动部份收集器和记录仪 上海沪西仪器厂;FD-1台式冷冻干燥机 上虞艾科仪器公司;BG垂直电泳仪 北京百晶生物科技公司。
1.2 实验方法
1.2.1 小麦苗的低温胁迫 参照文献[6]的方法稍作改动。小麦苗长至一叶一心后,采用梯度低温胁迫,降温至8 ℃培育24 h,然后降至6 ℃培育48 h,再降至4 ℃培育96 h,昼夜温度一致。解除低温胁迫72 h后取小麦苗并超低温保存备用,以未低温胁迫处理的小麦苗和4 ℃低温胁迫168 h作为对照。以解除低温胁迫后72 h后恢复长势的小麦苗计算存活率(SR)。
其中:NR为解除低温胁迫后72 h后恢复长势的小麦苗数,NNCA为低温胁迫前小麦苗数。
1.2.2 小麦苗初提物(AWSE)的制备 每次称取150 g超低温小麦苗,加 600 mL预冷缓冲液(25 mmol/L Tris-HCl,pH7.8,0.1 mmol/L EDTA,1 mmol/L PMSF,0.1 mol/L KCl),搅拌粉碎,提取液于13000 r/min条件下冷冻离心30 min,上清液75 ℃水浴15 min后,于冰水浴中冷却,13000 r/min冷冻离心30 min,上清液冷冻干燥得AWSE,用同样方法制备未低温胁迫小麦苗初提物(NAWSE)。
1.2.3 饱和硫酸铵溶液沉淀初分离 AWSE复溶后用100%饱和度的硫酸铵溶液4 ℃低温沉淀10 h后,于13000 r/min条件下冷冻离心15 min。沉淀用超纯水复溶,用透析膜(MWCO 3.5 ku)对纯水透析过夜后浓缩冻干。
1.2.4 DEAE-Cellulose 52层析 参照文献[24]方法并作改动。层析柱(2.5 cm×45 cm)经缓冲液(5 mmol/L Tris-HCl,pH7.8,0.1 mmol/L EDTA,0.1 mol/L KCl)平衡后,用缓冲液配制20 mg/mL的样品,经0.45 μm 微滤膜过滤后进行离子交换层析:上样量5 mL,先用25 mmol/L Tris-HCl 缓冲液(pH7.8)洗脱1 h,再用0~1 mol/L的KCl溶液(含5 mmol/L Tris-HCl,pH7.8,0.1 mmol/L EDTA)进行梯度洗脱,流速1 mL/min,检测波长280 nm,收集热滞活性组分,对纯水透析过夜后浓缩冻干。
1.2.5 Sephadex-G75凝胶层析 参照文献[25]方法并作改动。经离子交换层析纯化后的冻干样品20 mg溶于0.5 mL洗脱液中(5 mmol/L Tris-HCl,pH7.8,0.1 mmol/L EDTA,0.1 mol/L KCl)中,经0.45 μm微滤膜过滤后进行凝胶层析:层析柱(1.5 cm×50 cm)先用洗脱液充分平衡,上样量0.5 mL,流速0.2 mL/min,检测波长280 nm,收集热滞活性组分,对纯水透析过夜后浓缩冻干。
1.2.6 THA测定 采用DSC法测定,参照文献[26]方法并作改动。取经离子交换和凝胶层析纯化的ISP组分各5 mg,用1 mL蒸馏水复溶,取10μL溶液密封于铝制坩埚中,置于DSC仪器样品池中央,以空池为参比。仪器稳定后,首先以1 ℃/min降温至-25 ℃,然后升温至25 ℃,再降温至-25 ℃,从扫描曲线上得到结晶温度(Tf,结晶放热峰起始点温度)、体系结晶热(ΔAm)和熔点(Tm,熔化吸热峰值温度)。以1 ℃/min升温至保持温度(Th,样品熔融峰所涵盖温度区间的某一温度),Th保持5 min后再降温至-25 ℃。记录扫描曲线上结晶放热峰初始温度T0和体系结晶热(ΔAf)。设定ΔAf为60%±10%时的Th为实验保留温度。冰晶含量(φ)的计算公式和热滞活性THA计算公式分别如下:
THA=Th-T0
1.2.7 ICP测定 参照文献[6]方法并稍作改动。冰淇淋中AWSE和NAWSE添加量均为10 mL(5 mg/mL),其与水的总体积保持75 mL不变,以基础配方为对照。冰淇淋硬化后置于程序制冷器中,待冰淇淋升温至-20 ℃后进行热休克处理,以1.67 ℃/h加热至-10 ℃后保温42 h,再以相同的速度冷却至-20 ℃并保温42 h,每周期共96 h,8个周期后测定热休克始末冰淇淋冰晶大小均值X50,冰晶大小增长百分比(IGP)定义为热休克处理周期末与周期始相比X50增加百分比;小麦苗ICP定义为与参照物水相比AWSE降低IGP的百分比,ICP计算公式如下:
1.2.8 ISP分子质量测定 采用SDS-PAGE电泳法,参照文献[27]方法并作改动。样品的制备:凝胶层析纯化后冻干样品10 mg溶于1 mL蒸馏水,10000 r/min离心5 min,取50 μL上清液加等体积样品缓冲液,沸水浴3 min后取出立刻离心并取上清液。浓缩胶浓度5%,分离胶浓度12%。
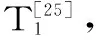
1.2.10 蛋白质含量测定 参照GB 5009.5-2010采用凯氏定氮法测定。
1.3 数据统计分析
所有实验均重复3次,采用IBM SPSS 20和OriginPro 8对数据进行分析。
2 结果与分析
2.1 低温胁迫对小麦苗存活率的影响结果分析
与对照组相比,低温胁迫处理后,小麦苗虽出现枯萎或长势明显下降的现象(表1),但采用梯度低温胁迫后,仍有76.8%的小麦苗存活并在测定期内恢复长势;与4 ℃恒温低温胁迫相比,梯度低温胁迫小麦苗存活率显著提高(表1,p<0.05),相比较提高了240%。由于恒温低温胁迫小麦苗的存活率低,后期实验未将其作为研究对象。梯度低温胁迫后,AWSE的蛋白质含量显著上升(表1,p<0.05),相比较提高了7.8%。原因可能是,蛋白质作为植物细胞保护物质之一,在低温胁迫下可通过调节渗透浓度从而启动脱落酸的形成,诱发新蛋白质的合成以提高抗寒性[28]。研究者常使用体内标记和mRNA 体外翻译等方法分离出低温诱导蛋白并获得其氨基酸序列,从而筛选出特异性基因用于作物抗冻性能和材料冷冻储藏性能的改良[29]。

表1 低温胁迫对小麦苗存活率和AWSE蛋白质含量的影响Table 1 Changes of survival rate of wheat seedling and protein content in AWSE after chilling stress
注:abcde值同一列不同字母差异性显著(p<0.05),数据为3次平行实验的均值±标准偏差,表2~表4同。
2.2 小麦苗ISP分离纯化结果分析
2.2.1 各纯化阶段得率和纯化倍数结果分析 AWSE经过饱和硫酸铵沉淀、离子交换和凝胶层析等纯化步骤后,ISP得率达到2.85%。以THA表征的纯化倍数T1和以ICP表征的纯化倍数T2分别为451.15和137.60(表2),两者存在较大差异的原因可能是AWSE初提物中ISP浓度低从而导致DSC仪器测定中取值方式的误差增加。由于除初始冰晶含量和一定范围内蛋白浓度等部分可控因素对ISP的THA测定结果有一定影响外,THA测定结果较为稳定,因此,本工作仍将THA变化作为纯化倍数的计算依据之一。有研究表明,低温胁迫诱导产生的ISP热稳定性高[30-31],因此本实验在制备AWSE时,加热处理去除了部分热不稳定蛋白,为ISP的后续纯化提供了便利,理论上提高了纯化倍数。
经低温胁迫后,AWSE初提物的质量高于NAWSE初提物(表2),表明低温胁迫诱导了新蛋白的合成,这与2.1的实验结果一致。
凝胶层析后的AWSE在5 mg/mL时THA达到了0.180 ℃,与Jia Chunli等[32]报道植物源ISP的活性在0.1~0.6 ℃之间一致。随着纯化的进行,AWSE中ISP浓度升高,THA也随之增加,表明ISP降低溶液冰点虽具有非依数性,ISP的THA与其浓度仍有一定的关系,这与张晖等[33]报道ISP非依数性约为具有依数活性物质的500倍,但在一定浓度范围内THA随浓度缓慢变化的结果一致[27]。
纯化过程中,ISP的ICP从AWSE初提物的17.83%增加至离子交换层析纯化后的69.65%(表2,p<0.05)。表明随着ISP浓度增加,AWSE对冰晶重结晶抑制能力显著增强。凝胶层析后,AWSE中的ISP浓度进一步增加,但其ICP增加不显著(p>0.05),说明ISP的非依数性存在极限浓度,达到该浓度时,其活性趋于饱和[33]。

表2 AWSE纯化过程参数变化Table 2 Variation of parameters during purification process of AWSE
注:停留温度Th=-2.00 ℃。表3、表4同。
原因可能是,根据“吸附-抑制”模型和“石头压海绵”模型理论,ISP分子在与冰淇淋冰晶表面结合时会导致冰晶局部表面曲率发生变化,覆盖的ISP分子之间存在尺度空间,覆盖率无法达到100%,同时冰淇淋冰晶分子表面积本身也有限,从而导致ISP的THA和ICP都存在阈值。与ISP的THA活性相比,AWSE的ISP在相对较低浓度下即可达到ICP最大值,因此可预测AWSE抑制冰晶重结晶能力要比其热滞活性更高,这与Hassas-Roudsari M等[1]报道一致,植物来源ISP主要作用不是阻止冰晶形成,而是抑制重结晶和降低过冷点[9,22]。经过8个周期的热休克处理后,NAWSE也检测出1.33%的ICP,可能是由于NAWSE的加入导致冰淇淋混合溶液冰点下降。
2.2.2 离子交换层析分离纯化结果分析 饱和硫酸铵沉淀所得AWSE在离子交换色谱图上出现8个洗脱峰(图1)。其中,P1、P2和P3与饱和硫酸铵沉淀初分离后AWSE相比,THA显著增加,ICP显著增加并接近或达到最高值(表3)。AWSE所含ISP在120 min内即可洗脱完全,这与公开报导的结果不完全一致[34],这可能与小麦苗品不同有关,另外低温胁迫方法不同诱导产生的ISP的结构和性质可能也存在较大差异[22],从而导致离子交换特性发生变化。P4的THA和ICP较无活性的P5~P8要高(表3),可能是由于组分分步收集时,微量P3组分混入P4所致,也有可能是DSC仪器测定中取值方式的误差所致。
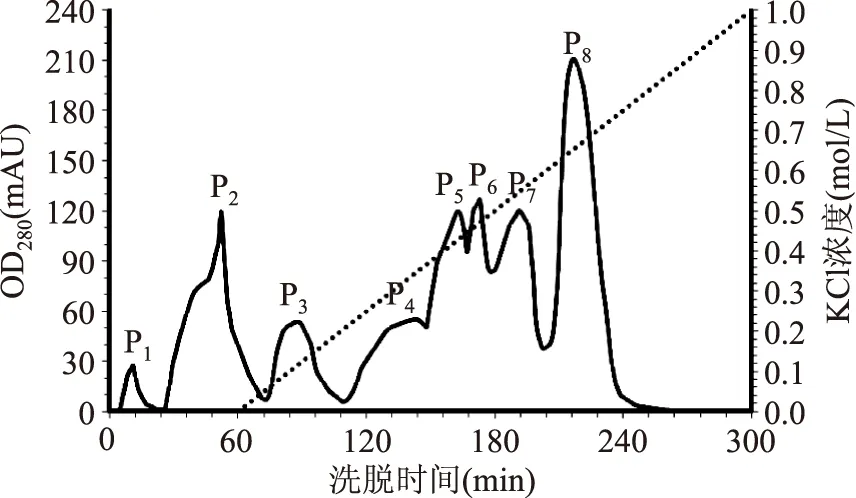
图1 AWSE离子交换层析图Fig.1 Ion exchange chromatography profile of AWSE

表3 AWSE离子交纯化后参数变化Table 3 Parameters variation after purification of AWSE by ion exchange chromatography
2.2.3 凝胶层析分离纯化结果分析 对离子交换色谱获得的P1、P2和P3(图1)进行凝胶层析分离后。P13、P23和P33显示出THA和ICP(图2~图4)。与凝胶色谱纯化前相比,THA显著增加,ICP达到饱和(表4)。电泳实验结果显示,P13、P23和P33的洗脱时间虽然存在差异,但电泳结果显示P13、P23、P33分子质量范围相同,为20.1~31.0 ku(图5),这与公开报道的结果20~40[9]和20~34 ku[34]一致但不完全相同,可能与麦种和低温胁迫方法的不同导致诱导产生的ISP不同有关系。P13、P23略有拖尾现象,可能是因为样品是具有相近相对分子质量的蛋白质混合物,也可能是由于在浓缩胶中蛋白质浓度过高而导致沉淀。P12、P22和P32的THA和ICP较P11、P21和P31高(表4),可能是由于分步收集时,微量活性组分混入P12、P22和P32所致,也有可能是DSC仪器测定中取值方式的误差所致。

图2 P1凝胶过滤色谱图Fig.2 Gel filtration chromatography profile of P1

图3 P2凝胶过滤色谱图Fig.3 Gel filtration chromatography profile of P2

图4 P3凝胶过滤色谱图Fig.4 Gel filtration chromatography profile of P3
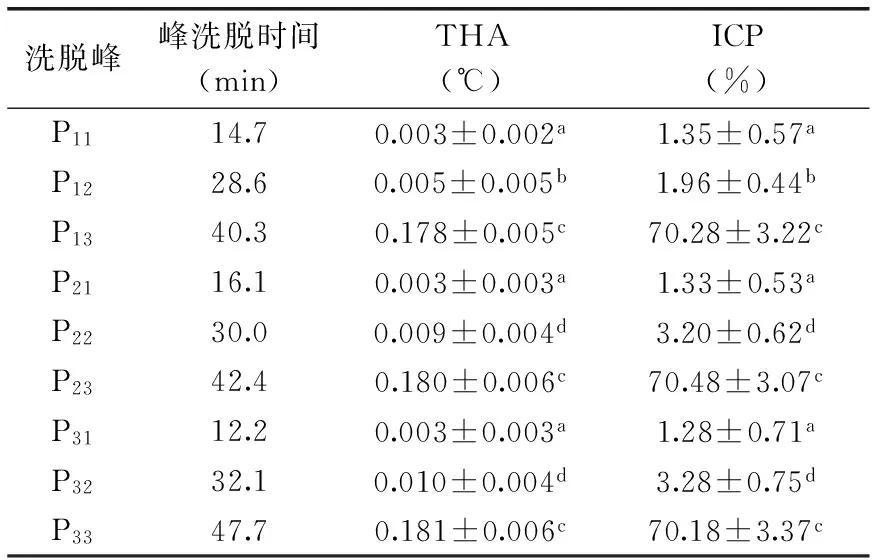
表4 AWSE凝胶层析纯化后参数变化Table 4 Parameters variation during purification of AWSE by iron exchange chromatography

图5 凝胶层析后AWSE各活性峰电泳图Fig.5 SDS-PAGE profile of P13、P23和P33 after gel filtration of AWSE
3 结论
以低温胁迫小麦苗为对象,采用粗分离、饱和硫酸铵溶液沉淀、DEAE-Cellulose 52层析、sephadex-G75凝胶层析对其中的ISP进行纯化,测定了纯化过程中样品的THA、ICP和分子质量,计算了小麦苗存活率和各纯化步骤的得率。梯度低温胁迫小麦苗存活率与恒温低温胁迫相比提高了240%,AWSE中蛋白质含量与NAWSE相比提高了7.8%;以THA表征的纯化倍数(T1)和以ICP表征的纯化倍数(T2)分别为451.15和137.60,得率为2.85%,THA为0.180 ℃(5 mg/mL),ICP为70.03%,分子质量(MW)范围为20.1~31.0 ku;与THA相比,ISP在较低浓度下即可达到ICP的峰值。
[1]Hassas-Roudsari M,Goff H.D. Ice structuring proteins from plants:Mechanism of action and food application[J]. Food Research International,2012,46(1):425-436.
[2]JIA Chunli,HUANG Weining,WU Chao,et al. Frozen bread dough properties modified by thermostable ice structuring proteins extract from Chinese Privet(Ligustrumvulgare)leaves[J]. Cereal Chemistry,2012,89(3):162-167.
[3]Zhang Yanjie,Zhang Hui,Wang Li,et al. Extraction of oat(AvenasativaL.)antifreeze proteins and evaluation of their effects on frozen dough and steamed bread[J]. Food & Bioprocess Technology,2015,8(10):2066-2075.
[4]Ding Xiangli,Zhang Hui,Wang Li,et al. Effect of barley antifreeze protein on thermal properties and water state of dough during freezing and freeze-thaw cycles[J]. Food Hydrocolloids,2015,47(5):32-40.
[5]Olijve L.L.,Meister K.,DeVries A.L.,et al. Blocking rapid ice crystal growth through nonbasal plane adsorption of antifreeze proteins[J]. Proceedings of the National Academy of Sciences,2016,113(14):3740-3745.
[6]焦宇知,翟玮玮. 低温胁迫小麦苗在小麦苗汁冰淇淋中的应用[J].食品科学,2014,35(12):249-253.
[7]Regend A,Goff H D. Ice Recrystallization inhibition in ice cream as affected by ice structuring proteins from winter wheat grass[J]. Journal of Dairy Science,2006(89):49-57.
[8]Gupta R,Deswal R. Low temperature stress modulated secretome analysis and purification of antifreeze protein from Hippophae rhamnoides,a Himalayan wonder plant[J]. Journal of Proteome Research,2012,11(5):2684-96.
[9]Gupta R,Deswal R. Antifreeze protein from freeze-tolerant grass has a beta-roll fold with an irregularly structured ice-binding site[J]. Journal of Molecular Biology,2012,416(5):713-724.
[10]Deng Longqun,YuHaoqiang,Liu Yanping,et al. Heterologous expression of antifreeze protein gene AnAFP from Ammopiptanthus nanus enhances cold tolerance in Escherichia coli and tobacco[J]. Gene,2014,539(1):132-140.
[11]巩子路,田童童,张建,等. 白斑狗鱼鱼肉中抗冻蛋白的分离纯化[J].中国酿造,2015,34(2):120-125.
[12]MAO Xianfang,LIU Zhongyuan,MA Ji,et al. Characterization of a novelβ-helix antifreeze protein from the desert beetle Anatolica polita[J]. Cryobiology,2011,62(2):91-99.
[13]丁香丽. 大麦籽粒抗冻蛋白的制备及抗冻机制的研究[D].无锡:江南大学,2015:1 28-32.
[14]Kuiper M.J.,Lankin C.,Gauthier S.Y.,et al. Purification of antifreeze proteins by adsorption to ice[J]. Biochemical and Biophysical Research Communications,2003,30(3):645-648.
[15]Gupta R.,Deswal R. Low temperature stress modulated secretome analysis and purification of antifreeze protein from Hippophae rhamnoides,a Himalayan wonder plant[J]. Journal of Proteome Research,2012,11(5):2684-2696.
[16]Brown J.R.,Seymour J.D.,Brox. T.I.,et al. Recrystallization inhibition in ice due to ice binding protein activity detected by nuclear magnetic resonance[J]. Biotechnology Reports,2014,3:60-64.
[17]Becker J S,Thomas O R T,Franzreb M. Protein separation with magnetic adsorbents in micellar aqueous two-phase systems[J]. Separation and Purification Technology,2009,65(1):46-53.
[18]陈亮亮,王达,张大伟,等.昆虫抗冻蛋白转基因植物表达载体的构建及转基因棉花T1代的检测[J]. 新疆农业科学,2012,49(10):1779-1786.
[19]Ding Xiangli,Zhang Hui,ChenHaiying.,et al. Extraction,purification and identification of antifreeze proteins from cold acclimated malting barley(HordeumvulgareL.).[J]. Food Chemistry,2015,175(5):74-81.
[20]Gupta R.,Deswal R. Refolding ofβ-stranded class I chitinases of Hippophae rhamnoides enhances the antifreeze activity during cold acclimation[J]. Plos One,2014,9(3):e91723.
[21]Ding Xiangli,Zhang Hui,Chen Haiying,et al. Extraction,purification and identification of antifreeze proteins from cold acclimated malting barley (HordeumvulgareL.)[J]. Food Chemistry,2015,175(5):74-81.
[22]徐化能,马淑凤,张连富. 植物抗冻蛋白分离纯化方法的研究进展[J].食品与生物技术学报,2013,32(4):347-352.
[23]Regend A,Goff H D. Freezing and ice recrystallization properties of sucrose solutions containing ice structuring proteins from cold-acclimated winter wheat grass extract[J],Journal of Food Science,2005(70):552-556.
[24]王维香,魏令波,张虎. 沙冬青热稳定抗冻蛋白的分离纯化及其部分性质研究[J],四川大学学报:自然科学版,2007,44(4):912-917.
[25]金周筠,刘宝林. 小麦麸皮抗冻蛋白的纯化及理化性质的研究[J],食品工业科技,2015,36(20):159-164.
[26]徐化能,黄卫宁,陈海英(江南大学). 一种植物冰结构蛋白的分离纯化方法[P].中国:200910033924.0,2009.5.27.
[27]张超,赵晓燕,马越,等. 使用差示扫描量热仪测定抗冻蛋白热滞活性方法的研究[J]. 生物物理学报,2008,24(6):465-473.
[28]Weiser C J. Cold resistance and injury in woody plants:knowledge of hardy plant adaptations to freezing stress may help us to reduce winter damage.[J]. Science,1970,169(3952):1269-1278.
[29]杨刚,史鹏辉,孙万仓,等. 白菜型冬油菜质外体抗冻蛋白研究[J]. 中国生态农业学报,2016,24(2):210-217.
[30]Kazuoka T.,Oeda K.. Heat stable COR(cold-regulated)proteins associated with freezing tolerance in spinach[J]. Plant and Cell Physiology,1992,33(8):1107-1114.
[31]Houde M.,Danyluk J.,Laliberté J.F.,et al. Cloning,characterization,and expression of a cDNA encoding a 50-kilodalton protein specifically induced by cold acclimation in wheat[J]. Plant Physiology,1992,99(4):1381-1387.
[32]Jia Chunli,Huang Weining,Wu Chao,et al. Characterization and yeast cryoprotective performance for thermostable ice-structuring proteins from Chinese Privet(LigustrumVulgare)leaves[J]. Food Research International,2012,49(1):280-284.
[33]张晖,张艳杰,王立,等. 抗冻蛋白在食品工业中的应用现状及前景[J]. 食品与生物技术学报,2012,31(9):897-903.
[34]郭丽红,仝向荣,王德斌,等. 小麦幼苗抗冻蛋白的分离及其抗氧化活性的研究[J]. 昆明师范高等专科学校学报,2006,28(4):71-74.
Studies on purification of ice structuring protein from cold-acclimated wheat seedlings
JIAO Yu-zhi1,2,XU Tao1,LIANG Jia-bing3,ZHU Yun1,HE Zhi-yong4,ZHANG Xiao-xiao1,LIU Yong-bo5,SUN Zhi-yang1,ZHAI Wei-wei1
(1.Jiangsu Food & Pharmaceutical Science College,Huai’an 223005,China;2.Purdue University,West Lafayette,IN,USA,47907;3.Civil Hospital of Juxian,Juxian 276511,China;4.Jiangnan University,Wuxi 214122,China;5.Chaoneng Freda Bio Co. Ltd.,Jinan 250031,China)
To investigate purification of ice structuring protein(ISP)from cold-acclimated wheat seedlings,wheat seedlings underwent cold acclimation and ISP from cold-acclimated wheat seedlings was purified by 4 sequential steps including coarse separation,saturated ammonium sulphate precipitation,DEAE-Cellulose 52 chromatography and sephadex-G75 gel filtration chromatography. Differential scanning calorimetry(DSC),heat shock treatments and polyacrylamide gel electro-phoresis(SDS-PAGE)were employed respectively for determination of thermal hysteresis activity(THA),ice recrystallization inhibition power(ICP)and molecular weight(MW)of ISPs during process of purification. Survival rate of cold-acclimated wheat seedlings and purification times of ISP during each purification step were calculated as well. Results showed an increase of 240% in survival rate of wheat seedlings using gradient cold-acclimation compared with constant cold-acclimation. Protein content of cold-acclimated wheat seedlings extract(AWSE)was increased by 7.8% in comparison to non-cold-acclimated wheat seedlings extract(NAWSE). Eventual purification times based on THA and ICP were 451.15 and 137.60 respectively. Yield,THA at 5 mg/mL,ICP and MW range of ISP were 2.85%,0.180 ℃,70.03% and 20.1~31.0 ku respectively. Maximal ICP of ISP was achieved at lower concentration compared with THA. Wheat seedlings can be a potential plant resource in production of ISP.
wheat seedlings;cold-acclimation;ISP;THA;ICP
2016-09-29
焦宇知(1979-),男,硕士,副教授,研究方向:植物功能因子开发,E-mail:ningmen3749574@163.com。
淮安市产学研协同创新计划(HAC2015006);江苏省“青蓝工程”中青年学术带头人计划(苏教师(2014)23号);淮安市食品技术研究院(HAP201301);江苏省首批高校优秀中青年教师境外研修计划(苏教师[2011]34号);企业委托横向项目(苏食院合字(2015)432号)。
TS229
A
:1002-0306(2017)03-0102-06
10.13386/j.issn1002-0306.2017.03.011
