氯化钠浓度对僵直前高压处理兔肉中肌球蛋白凝胶保水性及其胶凝过程中分子特性和结构变化的影响
2017-03-14薛思雯邹玉峰杨慧娟王梦瑶徐幸莲
薛思雯,邹玉峰,杨慧娟,钱 畅,王梦瑶,徐幸莲
(南京农业大学 肉品加工与质量控制教育部重点实验室,食品安全与营养协同创新中心,江苏省肉类生产与加工质量安全控制协同创新中心,江苏南京 210095)
氯化钠浓度对僵直前高压处理兔肉中肌球蛋白凝胶保水性及其胶凝过程中分子特性和结构变化的影响
薛思雯,邹玉峰,杨慧娟,钱 畅,王梦瑶,徐幸莲*
(南京农业大学 肉品加工与质量控制教育部重点实验室,食品安全与营养协同创新中心,江苏省肉类生产与加工质量安全控制协同创新中心,江苏南京 210095)
本实验以僵直前经200 MPa 15 s高压处理的兔肉肌球蛋白为实验对象,通过测定其凝胶保水性,升温过程中的流变特性,疏水相互作用,活性巯基含量以及蛋白质二级结构的变化,研究僵直前经高压变性的肌球蛋白在不同氯化钠浓度体系下(1.0%、1.5%、2.0%、2.5%、3.0%),其热凝胶形成过程中蛋白分子特性以及凝胶保水性和流变性能的变化。结果表明:在2.5%氯化钠体系中的肌球蛋白在加热过程中疏水基团暴露程度以及速度适中,且在升温后期无显著下降趋势;然而,巯基含量在55~70 ℃升温区间显著增加,随后显著减少;肌球蛋白(2.5%氯化钠)的α-螺旋结构在55~70 ℃急剧下降。最终在2.5%氯化钠条件下肌球蛋白形成的热凝胶保水性以及最终贮能模量都高于其他处理组。该研究结果可为超高压技术在肉类加工中的应用提供参考。
僵直前,肌球蛋白,高压处理,氯化钠,保水性
超高压加工(High pressure processing,HPP)技术是国际上新兴的非热加工科技,广泛应用于食品行业,作为强化灭菌技术已取得显著的成效[1]。近年来,随着人们对超高压技术研究的不断深入,发现HPP通过物理作用,能够改变蛋白分子空间结构,引起蛋白质的理化特性改变。而一般畜禽肉类中蛋白含量高达20%,属于高蛋白食品,其中最主要且唯一能形成凝胶的蛋白-肌球蛋白(myosin)约占肌原纤维蛋白含量的50%[2-4]。许多学者研究了在不同高压条件下肌球蛋白凝胶特性的变化,认为高压需协同热处理才能发挥出其优势[5]。由于高压参数的变动会显著的影响高压对蛋白的变性作用,因此了解高压作用对肌球蛋白的影响,将有利于肉品企业对HPP更好地利用。
兔肉是一种高蛋白,低脂肪的“白肉”。在我国其年产量能达到230万t/年(FAOSTAT)[6]。但是兔肉制品的匮乏限制了其进一步发展。利用兔肉高蛋白低脂肪的特性结合新兴的超高压技术,将有利于生产高附加值的兔肉制品并促进兔肉产业的发展。肉糜体系中的盐含量以及超高压处理对象和参数对最终凝胶品质都有显著影响[7-10]。Souza等[11]发现将僵直前的猪胴体在215 MPa条件下进行高压,仅需15 s即可显著提高猪肉及其火腿制品的保水性。然而,僵直前高压处理对肌球蛋白分子特性的影响鲜有研究,同时,盐浓度对该条件下蛋白的作用也未见报道。因此,本文的目的是期望通过研究僵直前经高压处理后提取的肌球蛋白在不同氯化钠含量的体系中凝胶分子特性及功能特性的变化,确定较优的氯化钠浓度,探讨凝胶机理变化,为扩大超高压技术在肉品行业中的应用提供参考。
1 材料与方法
1.1 材料与仪器
3月龄新西兰雄兔(2.5~3.0 kg) 江苏省农科院畜牧所;乙二醇二乙醚二胺四乙酸二钠(EGTA) 美国 Sigma公司;氯化钠,8-苯胺基-1-萘磺酸(ANS),5,5′-二硫代双(DTNB),氯化钾,磷酸氢二钾,磷酸二氢钾等化学试剂均为分析纯。
SANYO SIM-F124制冰机 日本三洋公司;ASC-30电子秤 沈阳朝阳衡器厂;Waring高速组织捣碎机 美国思伯明设备有限公司;Avanti J-E高速冷冻离心机 美国贝克曼有限公司;MCR 301流变仪 奥地利Physica公司;SpectraMax M2酶标仪 美国分子设备有限公司;圆二色谱仪 英国应用图像物理有限公司;聚酰胺/聚乙烯真空包装袋,20 ℃透氧率为1cm3/(m2·h) 北京华盾塑料有限公司;S-IL-100-850-9-W高压设备 英国Stansted Fluid Power公司。
1.2 实验方法
1.2.1 兔肉处理及高压过程 7只健康的新西兰雄性白兔,宰前充分休息,提供饮水,减少应激。头部机械致昏后,切断颈部血管放血,迅速剥皮去头、爪及内脏,自来水冲洗去除血迹,沥干淋水放入冰箱(4 ℃)约15 min后,剔取腰大肌。将兔腰大肌切成2 cm×3 cm的小块,将所有兔腰大肌混合,分装到真空包装袋中(75 g每袋),根据Souza等的实验结果,采用200 MPa 15 s对僵直前的兔腰大肌进行高压处理(25 ℃),高压后立即将兔肉放入冰水中冷却(4 ℃),进行肌球蛋白提取。
1.2.2 肌球蛋白提取 肌球蛋白提取方法参照Cao等[12]的操作,用双缩脲方法检测肌球蛋白浓度,最后用不同浓度的氯化钠溶液(1.0%、1.5%、2.0%、2.5%、3.0%)将肌球蛋白浓度调整到10 mg/mL,并在相应浓度的氯化钠溶液中进行透析(20 h),期间更换3次透析液。
1.2.3 肌球蛋白凝胶的制备 分别取6 mL的肌球蛋白溶液于10 mL离心管中,并置于水浴锅中从20 ℃程序升温(1 ℃/min)到85 ℃,保温20 min。凝胶在0~4 ℃下过夜(12 h)。所得的凝胶进行保水性测试。
1.2.4 保水性测试 保水性参照Kocher等[13]的方法,并做适当修改。在加入蛋白溶液前准确称量离心管的重量(W1),加入蛋白液后准确记录离心管和蛋白液的总重(W2),蛋白凝胶制备方法如上所述,将离心管两两配平,在8000×g(4 ℃)下离心10 min,取出除去水分,准确称量重量(W3)。
保水性(%)=(W3-W1)/(W2-W1)×100
1.2.5 流变特性测定 流变特性的测定参照Chen等[14]的方法,将肌球蛋白溶液浓度用相应浓度的氯化钠溶液调整到5 mg/mL。仪器条件:采用平行板,上板直径4 mm,频率为0.1 Hz,应变为0.01,狭缝0.5 mm,升温速率1 ℃/min,升温范围20~80 ℃,记录G′(贮能模量),G″(损耗模量),相位角ζ(tan ζ=G″/G′)。
1.2.6 表面疏水性测定 表面疏水性测定以ANS为荧光探针参照Chen等[14]采用的方法,并做适当修改。 将蛋白溶液用相应的氯化钠溶液调整浓度到1 mg/mL,各取4 mL稀释蛋白液于10 mL离心管中,每组处理下的蛋白需要15个样品,分别用于五个温度下的表面疏水性测定。将样品置于水浴锅中,从20~85 ℃程序升温,在25、40、55、70 以及85 ℃下保温5 min,取出后立即置于冰水中防止温度对蛋白的进一步影响。 在冷却后的蛋白液中加入20 μL ANS溶液(15 mmol/L溶解于 0.1 mol/L磷酸钾缓冲液,pH7.0),在室温下反应20 min,然后使用酶标仪检测在激发波长为375 nm,发射波长为470 nm条件下的荧光强度。
1.2.7 活性巯基含量测定 活性巯基含量测定利用DTNB参照Ellman[15]的方法,并做适当修改。升温等步骤与表面疏水性测定相同。蛋白液冷却后加入20 μL 10 mmol/L的DTNB 溶液(10 mmol/L溶解于 0.1 mol/L磷酸缓冲液中,pH7.0)。混匀后在暗处(4 ℃)反应1 h,取上清在412 nm条件下测定吸光值。
活性巯基含量(C0)=[(A/ε)·D]/C
其中:C0-巯基的摩尔浓度(mol/100 mg);A-吸光值;ε-吸光系数13600 L×(mol×cm)-1;D-稀释倍数;C-肌球蛋白浓度(mg/mL)。
1.2.8 蛋白质二级结构测定 蛋白质在升温过程的二级结构的变化测定参照Liu[16]等采用的方法,并做适当修改。将肌球蛋白浓度用相应的氯化钠溶液调整到0.3 mg/mL,在200~260 nm波长条件下测量分子椭圆率。采用20~90 ℃的程序升温(1 ℃/min),计算在25、40、55、70、85 ℃下肌球蛋白分子的二级结构(α-螺旋,β-折叠,β-转角以及无规卷曲),并以百分数形式表达。
1.3 数据统计
保水性,表面疏水性以及活性巯基含量的结果以平均值±标准差表示,其结果用SPSS 18.0 统计软件进行单因素方差分析(邓肯多重比较,Duncans’ multiple-range test),当p<0.05表示差异显著。
2 结果与讨论
2.1 保水性
图1是不同食盐含量条件下高压蛋白凝胶的保水性。1%和1.5%氯化钠处理组的高压蛋白凝胶的保水性没有显著(p>0.05)的差异,2%和3%氯化钠处理组的高压蛋白凝胶没有显著性差异(p>0.05),但是显著高于1%和1.5%处理组,保水性最好的处理组是2.5%氯化钠处理组。这与前人研究发现大于2%盐浓度下形成蛋白凝胶的保水性良好的结果相符[17]。蛋白凝胶的保水性和一系列因素有关,比如凝胶网络结构孔径的大小,促进凝胶形成的作用力,蛋白的溶解情况等[18]。当氯化钠含量达到2%及以上时,肌球蛋白能完全溶解,而当氯化钠含量低于2%时,有部分肌球蛋白不能溶解完全,在加热过程中不能均匀的分布在体系中,导致最终凝胶网络结构不均匀,凝胶保水性差[19]。因此推测高压蛋白所在的体系环境氯化钠浓度达到2.5%时,已经经过高压修饰的肌球蛋白在该盐浓度条件下呈单体状态分布,而蛋白-蛋白,蛋白-溶剂之间的相互作用与未经高压修饰的蛋白不同,可能导致蛋白质的热凝胶变性方式有所差异。本研究中经200 MPa 15 s高压处理过后提取的肌球蛋白在2.5%的盐浓度条件下,能保持住较多的水分,即表现为良好的保水性。而当盐含量达到3%时,溶液中的单体蛋白的更多基团偏向与盐离子发生结合,减少了蛋白质-水之间的相互作用,因此在形成凝胶的时候,结合的水分不如2.5%氯化钠含量的蛋白溶液体系中的多,保水性低于2.5%氯化钠体系处理组。

图1 氯化钠含量肌球蛋白凝胶保水性的影响Fig.1 Effects of sodium contents on water holding capacity of myosin gel 注:a~c不同字母之间表示显著性差异(p<0.05);样品处理条件200 MPa 15 s,图2~图5处理条件相同。
2.2 流变特性
蛋白的流变特性是反映蛋白凝胶在形成过程中凝胶弹性和状态变化的重要指标[20]。图2和图3是僵直前经高压处理后提取的肌球蛋白溶液(5 mg/mL)在20~80 ℃条件下的贮能模量(G′)和相位角(tan ζ)的变化结果。从图2中我们可以发现,在升温过程中,只有当氯化钠含量达到2.5%及以上时,蛋白样品的贮能模量才表现出弱凝胶形成阶段(43~57 ℃)以及贮能模量的显著升高。即在43 ℃左右时,2.5%和3.0%体系中肌球蛋白的贮能模量略有增加,当温度高于57 ℃时,贮能模量急剧增加。该现象说明,体系中肌球蛋白在43~57 ℃升温区间内头-头交联的弱凝胶形成,之后升温过程中肌球蛋白头-尾,尾-尾交联引起的凝胶网络形成。然而本结果与前人认为的2%的氯化钠浓度的肉蛋白体系就能够拥有良好的凝胶品质不同[21]。对比2.5%和3.0%氯化钠含量的高压蛋白分子的流变特性,发现两组之间的肌球蛋白头部对热的敏感性并没有改变(头部变性峰的峰顶时间均出现在50 ℃左右),但是2.5%组最终的贮能模量高于3.0%组,说明2.5%组的高压蛋白凝胶最终的弹性优于3.0%组。对此,我们认为蛋白体系中其它因素如磷酸盐等的存在是导致差异的主要原因[22]。另外,1%,1.5%和2%氯化钠体系中的肌球蛋白在升温过程中贮能模量的变化趋势基本重叠,可能是由于经高压变性后的肌球蛋白不能很好的溶解在氯化钠含量低于2.5%的体系中,导致肌球蛋白过早聚集,失去了形成弹性良好凝胶的能力
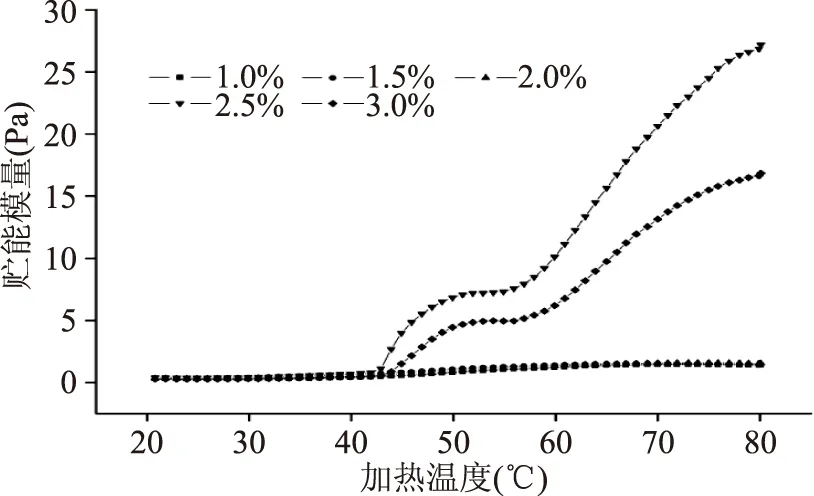
图2 氯化钠含量肌球蛋白分子流变特性的影响Fig.2 Effects of sodium contents on rheological properties of myosin solutions
相位角(tan ζ)是评估肌球蛋白凝胶网络好坏的重要指标,相位角(tan ζ)变化越稳定,则表示蛋白凝胶性质越稳定,而相位角(tan ζ)越小,表示该条件下凝胶黏弹特性越好[5]。从结果图3来看,所有处理组的相位角(tan ζ)的变化在50 ℃之后变化不大,趋于稳定,但2.5%和3%氯化钠体系中的高压蛋白的tan ζ低于其它三个处理组,说明在这两个食盐浓度条件下形成的蛋白凝胶性质稳定,且蛋白凝胶的黏弹特性优于其它处理组。
2.3 表面疏水性
图4是溶解在不同氯化钠缓冲液中的高压蛋白在加热过程中疏水相互作用的变化情况。荧光强度越强,表示疏水相互作用越强。从结果中可以看出,肌球蛋白中包埋的疏水基团随着温度增加不断的暴露出来,在40~70 ℃的升温阶段中暴露速度最快,最显著。从图4中可发现,氯化钠的加入会影响肌球蛋白分子的原始构象(25 ℃),氯化钠含量越高,蛋白的构象变化越剧烈,疏水基团暴露的越多越显著(p<0.05)。当氯化钠含量高于2%时,温度高于70 ℃之后蛋白分子之间的疏水基团减少,说明肌球蛋白分子之间发生聚集,胶凝作用。当温度高于40 ℃时,3%氯化钠水平的肌球蛋白溶液中肌球蛋白的疏水基团暴露的水平显著高于其他氯化钠浓度的肌球蛋白(p<0.05)。氯化钠浓度低于2%(对于高压处理过的肉提取的肌球蛋白来说),在温度的作用下,其凝胶形成过程中的变化不如在高盐体系中的蛋白明显。并且在1.0%和1.5%氯化钠浓度下,肌球蛋白溶解性显著下降,且经过一段时间的静置会有沉淀析出,可能是肌球蛋白在低盐条件下形成的聚集,该情况下形成的蛋白凝胶功能特性和流变特性差[23]。根据前人的研究,高压作为一种加工技术,会通过物理作用对僵直前的肉蛋白进行变性修饰,改变其理化特性,改变肌球蛋白分子的热凝胶特性以及蛋白的最终形成凝胶的功能特性[24]。
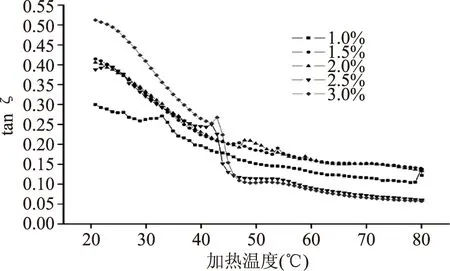
图3 氯化钠含量对200 MPa 15 s高压处理后提取肌球蛋白凝胶疏水相互作用的影响Fig.3 Effects of sodium contents on hydrophobicity of myosin solutions extracted from 200 MPa 15 s HPP treated pre-rigor rabbit muscle during heating
在热凝胶形成的关键温度区间(40~70 ℃),3%氯化钠水平的肌球蛋白溶液中肌球蛋白的疏水基团暴露的水平显著高于其他氯化钠浓度的肌球蛋白(p<0.05)。这从侧面反应出肌球蛋白在形成凝胶过程中,虽然疏水基团的暴露是前提条件之一,但是过多的暴露包埋的疏水基团对凝胶的功能特性并没有贡献,反而可能会起到反作用。如保水性的结果所示,过多暴露疏水基团可能不利于水分子包埋在凝胶网络中,从而导致凝胶保水性下降。
2.4 活性巯基含量
肌球蛋白包埋基团的暴露是蛋白质聚集和凝胶的前提条件,巯基含量越高,说明变性程度越高。图5中的是溶解在不同氯化钠缓冲液中的僵直前高压兔肉提取的肌球蛋白在加热过程中活性巯基含量的变化。从结果来看,除1%,1.5%和2.5%的处理组外,其它两组处理在40~55 ℃时,活性巯基含量变化最剧烈,1%氯化钠处理组的肌球蛋白的活性巯基含量在加热过程中增加不如其它处理显著,2.5%处理组的肌球蛋白在55~70 ℃时活性巯基含量变化剧烈,说明不同处理下的肌球蛋白在这几个温度区域内空间结构和二级结构变化剧烈,原本包埋的巯基逐步暴露出来。而2.0%氯化钠处理组的巯基暴露的最多,变性最显著。2.5%和3.0%氯化钠处理组的变性速率加快的温度区间不同,但是蛋白变性速率均小于2.0%氯化钠处理组,且在升温的最后阶段都有一定程度的下降。而2.0%处理组在最后阶段活性巯基含量基本保持不变,说明2.0%氯化钠处理组最后形成的凝胶中二硫键参与的比例没有2.5%和3.0%处理组的大[25]。这也部分解释了2.5%和3.0%氯化钠处理组最终形成的凝胶流变特性优于其它处理组的原因。

图4 氯化钠含量对肌球蛋白分子活性巯基含量的影响Fig.4 Effects of sodium contents on sulfhydryl contents of myosin solutions
2.5 二级结构
蛋白质二级构象的变化对蛋白功能特性有显著的影响[26]。而肌球蛋白在加热形成热凝胶的过程中,蛋白质二级结构不断发生改变,肌球蛋白的尾部开始解螺旋,在形成新的蛋白化学交联的过程中,蛋白二级结构中β-折叠以及其他无规则卷曲的相对含量不断增加。蛋白质的变性速率对蛋白凝胶的功能特性有显著影响[27]。图6中展示的是不同盐浓度条件下高压蛋白在加热过程中二级结构的变化。从图中可以得知,1.0%和1.5%氯化钠处理组的肌球蛋白分子的螺旋结构在最初阶段就显著低于其它处理组,且这两种处理组的二级结构在升温过程中变化不显著。这与蛋白质在升温过程中活性巯基的变化相一致,而高压蛋白在升温过程中疏水作用力显著增加,猜测该增加的疏水作用力是分子间的疏水相互作用,而不是蛋白分子变性后暴露出来的疏水基团导致的。2.0%~3.0%氯化钠处理组在升温过程中,螺旋结构随温度升高表现出显著减少的趋势,β-折叠结构(平行和反向平行结构)以及随机卷曲结构含量不断增加,这和文献报道也相符合[25]。如前所述,蛋白凝胶特性和蛋白分子特性之间显著相关[27],但是2.0%,2.5%和3.0%氯化钠处理组最终的蛋白凝胶的特性不同,可能是由于肌球蛋白分子在不同盐浓度下构象发生不同的变化,以及体系环境的不同,导致最终加热过程中蛋白分子的变性方式和变性速率都不尽相同,最终使得形成的凝胶功能特性不同。

图5 氯化钠含量对200 MPa 15 s高压处理后提取肌球蛋白分子在加热过程中二级结构的影响Fig.5 Effects of sodium contents on secondary structural changes of myosin extracted from 200 MPa 15 s HPP treated pre-rigor rabbit muscle during heating

图6 氯化钠含量对200 MPa 15 s高压处理后提取肌球蛋白分子在加热过程中二级结构的影响Fig.6 Effects of sodium contents on secondary structural changes of myosin extracted from 200 MPa 15 s HPP treated pre-rigor rabbit muscle during heating
3 结论
使用200 MPa 15 s超高压处理僵直期前兔肉,其肉中的肌球蛋白在不含磷酸盐的2.5%氯化钠体系中,表现出适当的变性程度(巯基基团以及疏水基团暴露程度)和热变性速率,最终表现为高保水性以及优越的流变特性。另外,低于2.5%氯化钠含量的溶液体系不利于高压修饰肌球蛋白的溶解,而盐含量过高不利于蛋白-水之间的相互作用,都不利于肌球蛋白形成良好的热凝胶。因此,2.5%氯化钠含量是僵直前200 MPa 15 s高压变性的兔肉肌球蛋白形成良好凝胶的最优浓度,该结论能为超高压在肉制品生产中提供参考。
[1]Bermúdez-Aguirre D,Barbosa-Cánovas G V. An update on high hydrostatic pressure,from the laboratory to industrial applications[J]. Food Engineering Reviews,2011,3(1):44-61.
[2]Chapleau N,Mangavel C,Compoint J P,et al. Effect of high-pressure processing on myofibrillar protein structure[J]. Journal of the Science of Food and Agriculture,2004,84(1):66-74.
[3]Colmenero F J,Ayo M,Carballo J. Physicochemical properties of low sodium frankfurter with added walnut:effect of transglutaminase combined with caseinate,KCl and dietary fibre as salt replacers[J]. Meat Science,2005. 69(4):781-788.
[4]Feiner G. Meat products handbook:Practical Science and Technology[M]. 2006:Elsevier.
[5]Iwasaki T,Washio M,Yamamoto K,et al. Rheological and Morphological Comparison of Thermal and Hydrostatic Pressure-Induced Filamentous Myosin Gels[J]. Journal of Food Science,2005,70(7):e432-e436.
[6]FAOSTAT(2015)http://faostat3.fao.org/download/Q/QP/E
[7].Anjaneyulu A N,Sharma N,Kondaiah,Specific effect of phosphate on the functional properties and yield of buffalo meat patties[J]. Food Chemistry,1990,36(2):149-154.
[8]Bell R R,Draper H H,Tzeng D Y,et al. Physiological responses of human adults to foods containing phosphate additives[J]. The Journal of Nutrition,1977,107(1):42-50.
[9]Sikes A L,Tobin A B,Tume R K. Use of high pressure to reduce cook loss and improve texture of low-salt beef sausage batters[J]. Innovative Food Science & Emerging Technologies,2009,10(4):405-412.
[10]Yang H,Han M,Bai Y,et al. High pressure processing alters water distribution enabling the production of reduced-fat and reduced-salt pork sausages[J]. Meat Science,2015,102:69-78.
[11]Souza C,Boler D D,Clark D L,et al. The effects of high pressure processing on pork quality,palatability,and further processed products[J]. Meat Science,2011,87(4):419-427.
[12]Cao Y,Xia T,Zhou G,et al. The mechanism of high pressure-induced gels of rabbit myosin[J]. Innovative Food Science & Emerging Technologies,2012,16:41-46.
[13]Kocher P,Foegeding E. Microcentrifuge-Based Method for Measuring Water-Holding of Protein Gels[J]. Journal of Food Science,1993,58(5):1040-1046.
[14]Chen X,Chen C,Zhou Y,et al. Effects of high pressure processing on the thermal gelling properties of chicken breast myosin containing κ-carrageenan[J]. Food Hydrocolloids,2014,40:262-272.
[15]Ellman G L. Tissue sulfhydryl groups[J]. Archives of Biochemistry and Biophysics,1959,82(1):70-77.
[16]Liu R,Zhao S,Xiong S,et al. Role of secondary structures in the gelation of porcine myosin at different pH values[J]. Meat Science,2008,80(3):632-639.
[17]Møller S M,Grossi A,Christensen M,et al. Water properties and structure of pork sausages as affected by high-pressure processing and addition of carrot fibre[J]. Meat Science,2011,87(4):387-393.
[18]Han M,Wang P,Xu X,et al. Low-field NMR study of heat-induced gelation of pork myofibrillar proteins and its relationship with microstructural characteristics[J]. Food Research International,2014,62:175-1182.
[19]彭增起.肌肉盐溶蛋白质溶解性和凝胶特性研究[D].南京:南京农业大学,2005.
[20]Hwang J S,Lai K M,Hsu K C. Changes in textural andrheological properties of gels from tilapia muscle proteins induced by high pressure and setting[J]. Food Chemistry,2007,104(2):746-753.
[21]Omana D A,Plastow G,Betti M. The use ofβ-glucan as a partial salt replacer in high pressure processed chicken breast meat[J]. Food Chemistry,2011,129(3):768-776.
[22]Inklaar P. Interaction between polyphosphates and meat[J]. Journal of Food Science,1967,32(5):525-526.
[23]Voutsinas L P,Nakai S,Harwalkar V R. Relationships Between Protein Hydrophobicity and Thermal Functional Properties of Food Proteins[J]. Canadian Institute of Food Science & Technology Journal,1983,16(3):185-190.
[24]Hugas M,Garriga M J,Monfort. New mild technologies in meat processing:high pressure as a model technology[J]. Meat Science,2002,62(3):359-371.
[25]Sun W,Zhao Q,Zhao M,et al. Structural evaluation of myofibrillar proteins during processing of Cantonese sausage by Raman spectroscopy.[J]. Journal of Agricultural & Food Chemistry,2011,59(20):11070-11077.
[26]Wu Z,Zhao Q,Zhao M,et al. Influence of aging and salting on protein secondary structures and water distribution in uncooked and cooked pork. A combined FT-IR microspectroscopy and 1H NMR relaxometry study[J]. Journal of Agricultural and Food Chemistry,2006,54(22):8589-8597.
[27]Xu X,Han M,Fei Y,et al. Raman spectroscopic study of heat-induced gelation of pork myofibrillar proteins and its relationship with textural characteristic[J]. Meat Science,2011,87(3):159-164.
Effects of sodium chloride contents on the molecular and gelation properties of myosin extracted from high pressure processed pre-rigor rabbit muscle
XUE Si-wen,ZOU Yu-feng,YANG Hui-juan,QIAN Chang,WANG Meng-yao,XU Xing-lian*
(Key Laboratory of Meat Processing and Quality Control,/Ministry of Education Synergetic Innovation Center of Food Safety and Nutrition/Jiangsu Collaborative Innovation Center of Meat Production and Processing,Quality and Safety Control,Nanjing Agricultural University,Nanjing 210095,China)
The aim of the study was to determine the optimum sodium chloride level for myosin that extracted from high-pressure processed pre-rigor rabbit muscle by means of estimating the water holding capacity of gels,rheological properties,hydrophobicity,reactive sulfhydryl contents and secondary structural changes of myosin under various sodium chloride contents(1.0%,1.5%,2.0%,2.5%,3.0%). The results demonstrated that the moderate exposure degree of hydrophobic groups as well as exposing rate of myosin were obtained in the solution with 2.5% of sodium chloride,moreover,the hydrophobic groups were not reduced in the latter stage of heating. However,the sulfhydryl contents underwent progressive enhancement first in the range of 55~70 ℃,and then decreased significantly with temperature rose,in addition,a sharp decrease of theα-helix content of myosin(in 2.5% sodium chloride system)were observed in the range of 55~70 ℃. The highest water-holding capacity and the ultimate storage modulus were obtained in the 2.5% NaCl group. The present result can provide valuable information to apply high-pressure technology to meat industry.
pre-rigor;myosin;high-pressure processing;sodium chloride;water holding capacity
2016-08-26
薛思雯(1993-),女,在读博士生,主要从事肌球蛋白高压凝胶形成机制研究,E-mail:vic_xsw0911@163.com。
*通讯作者:徐幸莲(1962-),女,博士,教授,主要从事肉品加工和品质形成机制研究,E-mail:xlxus@njau.edu.cn。
国家自然科学基金面上项目(31471601)。
TS251.1
A
:1002-0306(2017)03-0097-06
10.13386/j.issn1002-0306.2017.03.010
