荧光定量PCR检测原料乳中鲁氏不动杆菌方法的建立
2017-03-14张慧敏夏海磊王梦琦邢世宇毛永江杨章平
张慧敏,夏海磊,王梦琦,邢世宇,毛永江,岑 宁,杨章平
(扬州大学动物科学与技术学院,江苏扬州 225009)
荧光定量PCR检测原料乳中鲁氏不动杆菌方法的建立
张慧敏,夏海磊,王梦琦,邢世宇,毛永江,岑 宁,杨章平*
(扬州大学动物科学与技术学院,江苏扬州 225009)
为建立鲁氏不动杆菌(Acinetobacterlwoffii)的快速检测方法,本研究以A.lwoffii中的β-内酰胺酶基因(AL-blaOXA-134)为目的基因设计特异性引物,建立了SYBR Green Ⅰ实时荧光定量PCR检测A.lwoffii的方法。结果显示,该方法可快速检测A.lwoffii的存在,检测灵敏度为2.4×102cfu/mL,建立的标准曲线为y=-3.838x+40.93,相关系数为0.993。与其他原料乳中常见的微生物均未发现交叉反应。人工阳性样品乳中A.lwoffii的检测限为2.4×103cfu/mL。最后,对2015年11月至2016年1月长江下游地区8个牧场的原料乳进行监测。结果表明该检测方法具有较好的敏感性、特异性和实用性,为快速检测原料乳中的A.lwoffii提供了有力的技术支撑,有利于保障原料乳的质量安全。
原料乳,荧光定量PCR,鲁氏不动杆菌,β-内酰胺酶
鲁氏不动杆菌(Acinetobacterlwoffii)是革兰氏阴性菌,普遍存在于水和土壤中,并可在0~5 ℃下繁殖,所以低温食品极易受其污染,如奶制品、家禽及冷冻食品。此外,A.lwoffii是重要的机会致病菌,常引发败血症,肺炎,心内膜炎等[1-2]。A.lwoffii可产生耐热的β-内酰胺酶,它可水解β-内酰胺类抗生素(如碳青霉烯类),引发人体过敏反应及耐药性的增强。食品加工过程中的热杀菌工艺可以破坏微生物,但这些耐热酶的活性基本不受影响,给食品安全带来巨大的隐患[3-4]。Machado等[5]发现了不动杆菌属的微生物是原料乳低温贮藏期间的主要嗜冷菌之一。而吕元[6]以杭州周边牧场的原料乳为研究对象,经过微生物分离鉴定,确定A.lwoffii是优势嗜冷菌之一,然而目前并未有基于分子生物学的A.lwoffii检测方法的报道。由此可见,快速、准确地检测原料乳中A.lwoffii含量对保障原料乳质量安全有重要意义。
随着碳青霉烯类抗生素在临床上的广泛应用,近年来细菌对该类抗菌药物的耐药率正在逐年上升。不动杆菌属分泌的β-内酰胺酶是导致该菌抗生素耐药性的重要机制,这些耐药性菌株的出现给临床治疗带来了很大挑战[7-8]。常见的β-内酰胺酶主要包括A、B、D三类,其中B类(金属酶)和D类(OXA型苯唑西林酶)常见于不动杆菌属[9]。最近,在A.lwoffii中发现了一种新型的D类β-内酰胺酶基因(AL-blaOXA-134),可作为该菌的种间特异性识别基因[10-11]。本研究将根据AL-blaOXA-134设计一对特异性强的引物,以此建立荧光定量PCR检测原料乳中A.lwoffii的方法,并对该方法的灵敏度及特异性进行评价,旨在形成一套快速、准确的A.lwoffii检测方法,为原料乳的质量安全提供技术支撑。
1 材料与方法
1.1 材料与仪器
鲁氏不动杆菌ATCC15309、粘质沙雷氏菌ATCC14756、阪崎肠杆菌ATCC29544、荧光假单胞菌ATCC13525 美国模式培养物集存库(American type culture collection);大肠杆菌JM109、金黄色葡萄球菌ATCC29213 本实验室保藏;沙门氏菌ATCC13076、李斯特菌ATCC15313 扬州大学兽医学院药理与毒理实验室提供;pUCm-T质粒 上海Sangon公司;DNA Taq酶、DNA纯化试剂盒、SYBR® Premix Ex TaqTMII(Tli RNaseH Plus)和1000 bp DNA Ladder Marker 大连TaKaRa公司;细菌基因组DNA提取试剂盒DP302 天根生化科技有限公司;其他试剂均为国产或进口分析纯。
台式冷冻离心机 美国贝克曼库尔特有限公司;梯度PCR仪 美国赛默飞世尔科技公司;荧光定量PCR扩增仪7500 美国ABI公司。
1.2 实验方法
1.2.1 引物设计 首先根据A.lwoffiiATCC15309的β-内酰胺酶(AL-blaOXA-134)氨基酸序列(GenBank:WP_004728961),比对数据库中的各种A.lwoffii,如A.lwoffiistrain St17095(GenBank:AHA11126.1)、A.lwoffiiAL3(GenBank:ADM47435.1)和A.lwoffiistrain S459(GenBank:ALM26450.1),找出种间保守序列区段。此外,将AL-blaOXA-134与不动杆菌属其他菌株的β-内酰胺酶氨基酸序列进行比对,如鲍氏不动杆菌A.baumannii的blaOXA-23(GenBank:ABK34775、)和blaOXA-51(GenBank:4ZDX_A)及抗辐射不动杆菌A.radioresistens的blaOXA-23(GenBank:ACI26267),筛选同源性低的片段,最终对该段氨基酸序列的编码区序列进行同源比对,设计引物。
1.2.2 DNA的提取 微生物DNA提取:所有细菌在最适液体培养基中培养过夜,取1 mL菌液收集菌体,参照细菌DNA提取试剂盒说明书提取DNA。
牛奶DNA提取:将原料乳进行离心(12000×g,5 min),弃上层脂肪,无菌生理盐水洗涤两次,12000×g离心2 min,然后采用文献中报道的方法提取牛奶中的DNA[12]。
1.2.3 AL-blaOXA-134的扩增 以A.lwoffiiATCC15309的DNA为模板,利用引物AL-F和AL-R进行常规PCR,扩增产物经2%琼脂糖凝胶电泳鉴定后,割胶回收目的条带。将纯化的PCR产物直接与pUCm-T连接,转化JM109感受态细胞;经蓝白斑初选和PCR鉴定正确后,送上海Sangon公司测序。
1.2.4 荧光定量PCR标准曲线的建立 将A.lwoffiiATCC1530在脑心浸液培养基(BHI培养基)中过夜培养,用菌落平板记数法定量菌液,采用灭菌液体培养基进行10倍梯度稀释,得到不同浓度菌液。采用1.2.2中的方法提取不同浓度菌液的基因组DNA,然后使用SYBR Green I实时定量PCR试剂盒进行PCR扩增。PCR体系:SYBR Premix Ex Taq Ⅱ 10 μL,AL-F 0.8 μL,AL-R 0.8 μL,DNA模板 2.0 μL,ddH2O 6.0 μL,Rox Reference Dye Ⅱ 50 x 0.4 μL。PCR条件:95 ℃ 30 s;95 ℃ 5 s,55 ℃ 34 s,40个循环;在55 ℃退火阶段收集荧光值,并在上述扩增条件后增加60 ℃至95 ℃的融解曲线分析。得到每个浓度的Ct值,这个值对应荧光信号初次被检测到时的循环数,可以反映模板初始量,以菌落数的lg值和Ct值制作标准曲线。
1.2.5 特异性实验 利用1.2.2中的方法提取8种乳中常见微生物(粘质沙雷氏菌、金黄色葡萄球菌、大肠杆菌、沙门氏菌、李斯特菌、阪崎肠杆菌、荧光假单胞菌)的基因组DNA,并分别以其为模板,采用1.2.4中的荧光定量PCR方法对进行扩增,并选取A.lwoffii作为阳性对照,检测该方法的特异性。
1.2.6 荧光定量PCR与普通PCR检测方法灵敏度评价 以1.2.4中获得的梯度浓度A.lwoffiiATCC15309基因组DNA为模板,AL-F和AL-R为引物进行常规PCR,其反应条件为:95 ℃ 3 min,30个循环(95 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s),72 ℃ 10 min。评价荧光定量PCR与普通PCR检测方法的灵敏度。
1.2.7 人工阳性样品乳检测 将1.2.4中已经定量的菌液,采用灭菌全脂乳进行10倍梯度稀释,得到不同浓度菌液。采用1.2.2中的方法提取不同浓度菌液的基因组DNA,并按照1.2.4中的方法进行荧光定量PCR扩增。
1.2.8 荧光定量PCR检测原料乳中的A.lwoffii分别于2015年11月、12月及2016年1月,从江苏省长江下游地区8个奶牛场中采集桶样原料乳,按照1.2.2中的方法提取奶样DNA,进行荧光定量PCR,确定每个牧场的原料乳是否污染了A.lwoffii,以此监控每个牧场的奶源质量。
2 结果与分析
2.1 AL-blaOXA-134部分片段的克隆
同源比对结果显示,AL-blaOXA-134(GenBank:WP_004728961)与其他A.lwoffii来源的blaOXA-134氨基酸序列同源性高达95%,存在较多相似区域。同时将AL-blaOXA-134与不动杆菌属其他菌株的β-内酰胺酶氨基酸序列比对,发现它们的同源性较低,仅为57%,筛选其中同源性低的片段。结果如图1所示,符合条件的片段大部分集中在N末端及C末端。根据荧光定量PCR对片段长度的要求,我们选取了保守序列“LFDQAQS”和“ATTNEIFKWDGKKR”为引物设计区域,根据其编码区序列设计引物:AL-F(5′-TTATTTGATCAGGCGCAAAG-3′)和AL-R(5′-CGTTTCTTGCC ATCCCATTTA-3′),该引物扩增片段长度为197 bp。

图1 不同来源的blaOXA-134氨基酸序列同源比对结果Fig.1 Amino acid homology alignment of AL-blaOXA-134 with other β-lactamases
以A.lwoffiiATCC15309的DNA为模板,利用引物AL-F和AL-R进行PCR,扩增产物经2%琼脂糖凝胶电泳鉴定,结果如图2(泳道1)所示,扩增产物在200 bp处有一特异性条带,大小与预期一致,将PCR产物割胶回收后与pUCm-T连接,获得重组质粒,并对其进行测序,测序结果表明AL-blaOXA-134部分基因片段长度为197 bp,与拟克隆的基因序列一致,说明AL-blaOXA-134基因序列扩增正确。
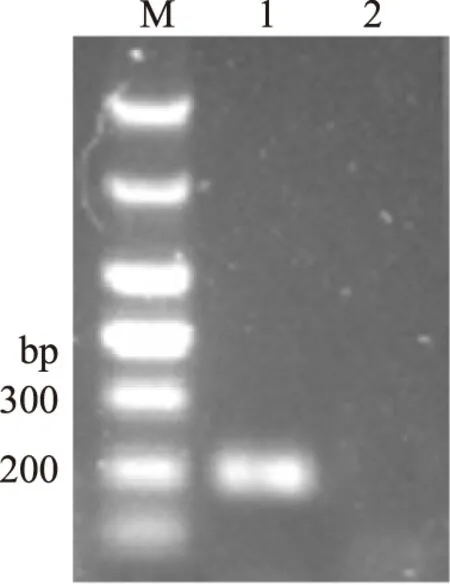
图2 AL-blaOXA-134部分片段的PCR扩增Fig.2 The PCR amplification of partial fragment of AL-blaOXA-134
2.2 荧光定量PCR标准曲线
将A.lwoffiiATCC1530过夜培养,采用菌落平板记数法定量菌液浓度为2.4×107cfu/mL,经灭菌液体培养基稀释后,得到不同浓度菌液(2.4×101、2.4×102、2.4×103、2.4×104、2.4×105、2.4×106、2.4×107cfu/mL)。以细菌数的lg值和Ct值制作荧光定量PCR的标准曲线:y=-3.838x+40.93,相关系数为0.993,表明不同梯度浓度细菌数的lg值与Ct值之间呈良好的线性关系。荧光定量PCR的Ct值与初始模板在6个lg浓度范围内呈现良好的线性关系。当菌落数达到2.4×101cfu/mL,进行扩增后其Ct值大于水的Ct 值(图3),故该浓度下不能对AL-blaOXA-134基因进行有效的检测。由此可知,该检测方法的最低检测限可达到2.4×102cfu/mL。

图3 荧光定量PCR扩增曲线图Fig.3 Amplification curves of fluorescence quantitative PCR
2.3 荧光定量PCR检测方法特异性评价
以9株菌株DNA为模板,进行荧光定量PCR扩增,其中只有A.lwoffiiATCC15309模板有典型荧光扩增曲线,而其它菌株均无荧光扩增曲线,为阴性结果(图4)。同时,A.lwoffiiATCC15309特异性融解曲线Tm值为84 ℃左右,符合荧光定量PCR的融解曲线呈现单一峰形。说明该方法检测A.lwoffiiATCC15309具有良好的特异性。

图4 荧光定量PCR方法特异性验证及A. lwoffii溶解曲线Fig.4 Specific curves of fluorescence quantitative PCR and melting curves of A. lwoffii
2.4 荧光定量PCR检测方法灵敏度评价
由2.2可知,荧光定量PCR检测A.lwoffiiATCC15309的灵敏度为2.4×102cfu/mL,然后以获得的不同浓度菌液的基因组DNA为模板,AL-F和AL-R为引物进行常规PCR,比较常规PCR与荧光定量PCR的敏感性。由图5可知,常规PCR检测A.lwoffii的灵敏度是2.4×103cfu/mL,由此可见荧光定量PCR的灵敏度高。

表1 不同牧场不同月份原料乳中A. lwoffii荧光定量PCR检测结果Table 1 The detection result of A. lwoffii in raw milk by fluorescence quantitative PCR in different pastures and different months
注:-表示未检出。

图5 普通PCR检测AL-blaOXA-134的灵敏度Fig.5 The sensitivity of detection of AL-blaOXA-134 by conventional PCR
2.5 人工阳性样品乳中A. lwoffii的检测限
将初始浓度为2.4×107cfu/mL的菌液,经灭菌全脂乳梯度稀释后,获得不同浓度人工污染A.lwoffii的牛奶(2.4×101、2.4×102、2.4×103、2.4×104、2.4×105、2.4×106、2.4×107cfu/mL)。经预处理后提取基因组进行荧光定量PCR,结果显示,当牛奶中污染细菌浓度大于2.4×103cfu/mL时,检测样品均获得较好的荧光信号,且Ct值<29.12,因此确定人工阳性样品乳中A.lwoffii的检测限为2.4×103cfu/mL。
2.6 荧光定量PCR检测原料乳中的A. lwoffii
收集2015年11月至2016年1月8个牧场的原料乳,然后提取DNA,利用本文中建立的方法对其进行检测。结果如表1所示,11月份和12月份原料乳的Ct值均不在检测范围之内(Ct值>29.12),检测不到A.lwoffii。而1月份所有8个牧场全都检测出了A.lwoffii,且菌落数均超过了2.4×103cfu/mL。
3 讨论与结论
在奶牛养殖过程中,由于抗生素的滥用,导致原料乳中抗生素残留现象日益严重,在经济利益的驱使下,可有效降解抗生素的β-内酰胺酶被违法添加,致使不合格的原料乳流入生产及消费环节。消费者食用后,可导致自身耐药性增强,给食品安全带来巨大隐患,因此,β-内酰胺酶被列入非法添加剂之列[13-14],目前,已经开发出许多方法来测定牛奶中的β-内酰胺酶含量,如杯碟法、HPLC及荧光探针法等[14-16]。除此之外,原料乳中的微生物也可以产生内源性β-内酰胺酶,如金黄色酿脓葡萄球菌、大肠杆菌、不动杆菌等[17-19]。因此,定量检测这些微生物对乳制品的安全生产具有重要意义。
OXA型β-内酰胺酶是不动杆菌耐药性的主要机制之一,根据氨基酸序列同源性,它可分为blaOXA-23、blaOXA-24/40、blaOXA-58及blaOXA-134等类型[19]。blaOXA-134是一大类A.lwoffii天然携带的OXA型β-内酰胺酶,可以用来做为A.lwoffii的鉴定标志。本研究采用SYBR GreenⅠ荧光定量PCR方法对纯培养物中的AL-blaOXA-134进行检测,标准曲线相关性达到0.993,灵敏度达到2.4×102cfu/mL,比常规PCR方法灵敏度高10倍。而且该方法的特异性强,与其他原料乳中常见的微生物均未发现交叉反应。此外,人工阳性样品乳中A.lwoffii的检测限为2.4×103cfu/mL。李一松等[20]采用荧光定量PCR方法检测乳中携带sea基因金黄色葡萄球菌,结果表明该方法的有效检测限是8.3×102cfu/mL,比常规PCR方法灵敏度高100倍。刘继超等[21]采用Taqman探针荧光定量PCR检测乳中产肠毒素D的金黄色葡萄球菌,结果表明该方法在人工阳性样品乳中金黄色葡萄球菌的有效检测限是1.0×102cfu/mL。张巧艳等[22]针对沙门氏菌invA基因建立了荧光定量PCR快速检测技术,该方法在原料乳中沙门氏菌检的出限为102cfu/mL,而且检测一个样品仅需3 h。由此可见,荧光定量PCR方法可快速、准确地检测原料乳中的微生物。
对长江下游地区8个不同牧场奶样进行检测时,1月份所有牧场原料乳中A.lwoffii检测均呈阳性,且菌落数均超过了2.4×103cfu/mL,重复实验结果也显示为阳性。分析可能的原因是8个牧场同时出现了A.lwoffii,或者是原料乳被奶罐车中的A.lwoffii所污染。这就要求养殖场及加工厂应当规范生产操作,执行严格的防疫消毒制度,降低微生物污染几率,提高原料乳的卫生质量[23]。
本研究建立的荧光定量PCR检测原料乳中A.lwoffii的方法,具有良好的灵敏度和特异性。检测方法简单、快捷,能够满足乳制品行业对原料乳进行质量检测的需要,对保障原料乳的质量安全有重要意义。
[1]Wang Y,Wu C,Zhang Q,et al. Identification of new delhi metallo-beta-lactamase 1 in Acinetobacter lwoffii of food animal origin[J]. Plos One,2012,7(5):37152.
[2]徐丽,吕瑞辰,王海燕,等. 携带blaNDM-1的质粒pNDM-BJ01在鲁氏不动杆菌中的适应度代价[J]. 微生物学报,2013,53(1):99-104.
[3]谢鲲昊,满朝新,卢雁,等. 原料乳中产β-内酰胺酶菌株的快速筛选和鉴定[J]. 食品科学,2013,34(7):162-165.
[4]楠丁呼思勤,母智深,陈芳,等. 影响牛奶品质耐热酶的研究进展[J]. 食品工业科技,2007,4:244-246.
[5]Machado S G,Bazzolli D M S,Vanetti M C D. Development of a PCR method for detecting proteolytic psychrotrophic bacteria in raw milk[J]. International Dairy Journal,2013,29(1):8-14.
[6]吕元. 原料奶中嗜冷菌的快速检测[D]. 杭州:浙江大学,2010.
[7]Hu Y,Zhang W,Liang H,et al. Whole-genome sequence of a multidrug resistant clinical isolate of Acinetobacter lwoffii[J]. Journal of Bacteriology,2011,193(19):5549-5550.
[8]王穆群,郭普,张永,等. 鲁氏不动杆菌耐药性研究[J]. 中华医院感染学杂志,2015,25(3):514-515.
[9]Jacoby G A. Beta-lactamase nomenclature[J]. Antimicrobial Agents and Chemotherapy,2006,50(4):1123-1129.
[10]Figueiredo S,Poirel L,Seifert H,et al. OXA-134,a naturally occurring carbapenem-hydrolyzing class Dβ-Lactamase from Acinetobacter lwoffii[J]. Antimicrobial Agents and Chemotherapy,2010,54(12):5372-5375.
[11]Turton J F,Hyde R,Martin K,et al. Genes encoding OXA-134-like enzymes are found in Acinetobacter lwoffii and A. schindleri and can be used for identification[J]. Journal of Clinical Microbiology 2012,50(3):1019-1022.
[12]张军伟. 牛奶中基因组DNA提取方法的建立及荷斯坦奶牛两个候选基因多态性研究[D]. 武汉:华中农业大学,2009.
[13]周蕊,丁颢,周爽,等. 我国部分地区市售巴氏杀菌乳中β-内酰胺酶含量调查[J]. 中国食品卫生杂志,2014,26(3):209-212.
[14]张秀芹,李欣南,田颖,等. 生鲜牛乳中内源性β-内酰胺酶的研究[J]. 中国乳业,2009(11):58-59.
[15]Zhou S,Wang D,Zhao Y,et al. A rapid HPLC method for indirect quantification ofβ-lactamase activity in milk[J]. Journal of Dairy Science,2015,98(4):2197-2204.
[16]Chen Y,Xianyu Y,Wu J,et al. Point-of-care detection ofβ-lactamase in milk with a universal fluorogenic probe[J]. Analytical Chemistry,2016,88(11):5605-5609
[17]蔡兴航,齐微微,姚宇秀,等. MALDI-TOF-MS对原料乳中产β-内酰胺酶菌株的鉴定[J]. 2016,44(1):12-14.
[18]Livermore D M,Woodford N. The beta-lactamase threat in Enterobacteriaceae,Pseudomonas and Acinetobacter[J]. Trends in Microbiology,2006,14(9):413-420.
[19]Li L,Ye L,Yu L,et al. Characterization of extended spectrum Β-Lactamase producing Enterobacteria and methicillin-resistant Staphylococcus aureus isolated from raw pork and cooked pork products in south China[J]. Food science,2016,81(7):1773-1777.
[20]李一松,王明娜,吕琦,等. SYBR Green I荧光定量PCR检测乳中携带sea基因金黄色葡萄球菌的研究[J]. 食品科学,2008,29(7):235-239.
[21]刘继超,姜铁民,刘丰,等. Taq Man探针荧光定量PCR检测金黄色葡萄球菌肠毒素D[J]. 食品工业科技,2014,35(21):159-161.
[22]张巧艳,陈亭亭,陈笑芸,等. 基于SYBR Green I 荧光定量PCR建立生乳及乳制品沙门氏菌快速检测技术[J]. 浙江农业学报,2012,24(5):914-921.
[23]刘双虎,胡海燕,武志敏. 关于规模奶牛场建设和经营管理的建议[J]. 黑龙江畜牧兽医,2014,1:29-30.
Study on fluorogenic quantitative PCR detection method ofAcinetobacterlwoffiiin raw milk
ZHANG Hui-min,XIA Hai-lei,WANG Meng-qi,XING Shi-yu,MAO Yong-jiang,Cen Ning,YANG Zhang-ping*
(Animal Science and Technology College,Yangzhou University,Yangzhou,225009)
In order to detect theAcinetobacterlwoffiiquickly and accurately,a real-time PCR detection based on SYBR Green Ⅰ was established with a pair of primers designed according to theβ-lactamase gene ofA.lwoffii(AL-blaOXA-134). The result showed that this method could detect theA.lwoffiiquickly in raw milk with a detection limit of 2.4×102cfu/mL,and without any cross-reaction to other microorganisms in raw milk. The standard curve was y=-3.838x+40.93,of which correlation coefficient was 0.993. The detection limit ofA.lwoffiiin artificial contaminated milk sample was 2.4×103cfu/mL by this method. Finally,milk sample collected from eight pastures in lower reaches of the Yangtze River since Nov.,2015 to Jan.,2016 was analyzed by this method. The method established in this study was specific,highly sensitive,which could be further used in detection ofA.lwoffiiin raw milk and helpful to improve the quality safety of raw milk.
raw milk;fluorogenic quantitative PCR;Acinetobacterlwoffii;β-lactamase
2016-07-14
张慧敏(1986-),女,博士,讲师,研究方向:畜产品安全生产及加工,E-mail:minmin-911@163.com。
*通讯作者:杨章平(1965-),男,博士,教授,研究方向:动物遗传育种与繁殖,E-mail:yzp@yzu.edu.cn。
江苏省乳品生物技术与安全控制重点实验室开放课题(K14008);江苏省博士后科研资助计划(1501118B);扬州大学交叉学科建设项目(jcxk2015-14);江苏省优势学科项目(PAPD)。
TS207.3
A
:1002-0306(2017)03-0309-05
10.13386/j.issn1002-0306.2017.03.051
