响应面法优化红胞藻中藻红蛋白提取工艺及体外抗氧化性研究
2017-03-14张坤生张彦青温志友任云霞刘军军
孟 晓,张坤生,*,张彦青,温志友,任云霞,刘军军
(1.天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134;2.美国爱荷华州立大学食品科学与人类营养学院,美国爱荷华州 50011)
响应面法优化红胞藻中藻红蛋白提取工艺及体外抗氧化性研究
孟 晓1,张坤生1,*,张彦青1,温志友2,*,任云霞1,刘军军1
(1.天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134;2.美国爱荷华州立大学食品科学与人类营养学院,美国爱荷华州 50011)
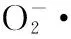
响应面法,红胞藻,藻红蛋白,提取工艺,抗氧化性
红胞藻(Rhodophytasalina)属隐藻门,隐藻纲,隐胞藻目,隐鞭藻科,红胞藻属,属于海水单细胞藻,是滤食性鱼类及许多草食性浮游动物的优良饵料。藻红蛋白(phycoerythrin,PE)是一种水溶性的藻胆蛋白,存在于蓝藻、红藻、隐藻和少数一些甲藻中,吸收光谱范围位于470~660 nm,主要功能是捕获叶绿素不易吸收的较弱的可见光(约470~660 nm)并向光系统中心传递[1]。藻红蛋白在食品和化妆品中被作为天然着色剂使用,然而它们主要的应用是在分子生物学和生物医学中:在流式细胞仪和免疫荧光标记,并作为光动力疗法的光敏剂治疗癌症[2-4]。
隐藻无细胞壁[5],红胞藻易于实验室培养,红胞藻细胞内只有藻红蛋白一种藻胆蛋白[6]且含量丰富[7],可成为藻红蛋白的优良来源。使用隐藻作为藻红蛋白的来源与传统的使用甲藻、红藻作为藻红蛋白的来源相比,使用隐藻提取藻红蛋白具有细胞破碎容易,后期提纯简单的优点。
目前对藻红蛋白提取的研究都集中在从大型海洋红藻中提取,对从红胞藻中提取藻红蛋白尚未见报道。本研究采用超声波破碎细胞提取藻红蛋白法,并对提取后的藻红蛋白进行体外抗氧化能力的测定,旨在对藻红蛋白的开发利用提供一定的理论依据和技术支持。
1 材料与方法
1.1 材料与仪器
红胞藻(Rhodophytasalina) 天津市食品生物技术重点实验室保藏;硫酸铵 国产分析纯;PMS、NADH、NBT、ABTS Sigma进口分装;水为去离子水;红胞藻培养基 为f/2-Si培养基。
UV-1600紫外可见分光光度计 上海美谱达仪器有限公司;ME204电子天平 美国METTLER TOLEDO公司;JY92-Ⅱ超声波细胞破碎机 宁波新艺超声设备有限公司;Heraeus Megafuge 8R台式冷冻离心机 美国Thermo Fisher公司;50D-37520冷冻干燥机 ALPHA公司。
1.2 实验方法
1.2.1 红胞藻藻红蛋白浓度的测定及蛋白得率的计算 取适量超声破碎后蛋白粗提液,9000 r/min离心10 min后取上清液,分光光度计在545 nm处测量吸光度。使用消光系数12.6(mg·mL-1·cm-1)-1按下式计算得藻红蛋白浓度[8-9]
取等量的藻液冷冻干燥后称量,记重量为W1,每次提取用溶液的量记为L1,使用以下公式计算藻红蛋白得率:
1.2.2 超声波破碎红胞藻提取蛋白工艺单因素实验 红胞藻培养条件温度为25 ℃,光通量为40 μmol photon/m2·s,使用f/2-Si培养基培养10 d。取100 mL红胞藻藻液,3000 r/min离心10 min弃上清液。在一定温度、功率、时间、溶剂用量下,进行超声破碎提取藻红蛋白,每次循环超声4 s,暂停8 s。温度作为单因素考察因素时,固定时间为10 min(包括暂停时间),功率为600 W,提取溶剂(dH2O)用量为10 mL;时间作为单因素考察因素时,固定提取温度为25 ℃,功率为600 W,提取溶剂用量为10 mL;功率作为单因素考察因素时,固定时间为10 min,温度为25 ℃,提取溶剂用量为10 mL;提取溶剂用量作为单因素考察因素时,固定时间为10 min,功率为600 W,温度为25 ℃。将所得细胞破碎提取液9000 r/min离心10 min,取上清液,分光光度计测545 nm处吸光度,计算蛋白得率。
1.2.3 响应面法优化超声波破碎细胞提取蛋白工艺 选温度、超声时间、超声功率为影响因素,采用三因素的Box-Behnken设计(BBD)优化提取工艺参数[10-13]。根据单因素实验结果,设定三个因素的变化范围及中心点值(表1)[14-16]。响应面实验包括5个重复的点中心共17个析因点(表3),使用Design-Expert software分析实验数据。
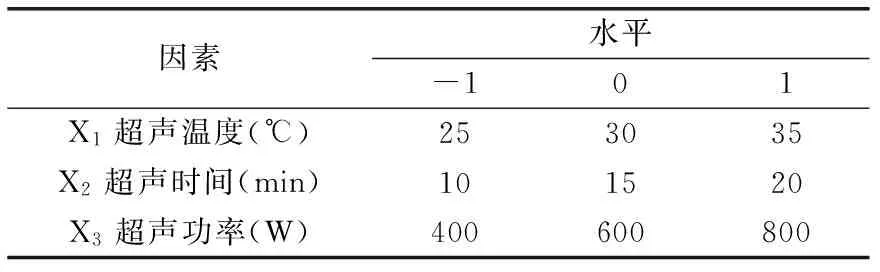
表1 Box-Behnken设计的因素与水平Table 1 Factors and levels of Box-Behnken design
1.2.4 硫酸铵沉淀法纯化藻红蛋白 取超声破碎后的提取溶液80 mL,9000 r/min离心10 min取上清液,向上清液中加入硫酸铵使硫酸铵溶液终浓度分别达到40%、50%、60%、70%、80%以沉淀藻红蛋白。将不同硫酸铵终浓度得到的藻红蛋白沉淀透析后冷冻干燥称重,取少量冻干蛋白溶于纯水,漩涡1 min,9000 r/min离心10 min,取上清液测吸光度OD565与OD280,使用公式OD565/OD280计算藻红蛋白的纯度[17-19]。
1.2.5 藻红蛋白体外抗氧化性研究
1.2.5.1 超氧阴离子自由基清除率的测定 在吩嗪硫酸甲醋(PMS)-NADH体系中,NADH氧化产生超氧阴离子,超氧阴离子可还原氮蓝四唑(NBT)为蓝色产物。使用(0.1 mol/L,pH7.4)磷酸盐缓冲液分别配制468 μmol/L NADH、150 μmol/L NBT和60 μmol/L PMS,取三试剂各1 mL以及0.5 mL不同浓度的试样,按NADH、PMS、试样、NBT的顺序依次加入试管中混匀,室温反应6 min,560 nm处测吸光度。以0.5 mL蒸馏水代替样品作为空白,以VC为阳性对照[20]。按下式计算藻红蛋白对超氧阴离子自由基的清除率:
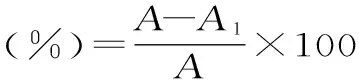
式中:A为空白体系的吸光度,A1为含试样体系的吸光度。
1.2.5.2 ABTS自由基清除率的测定 用2.45 mmol/L过硫酸钾溶液溶解ABTS,配成7 mmol/L ABTS储存液,室温避光静置12~16 h。用磷酸盐缓冲液(10 mmol/L,pH7.4)将ABTS储存液稀释为测定液,使测定液在734 nm处吸光度达到约0.7。测定时取4 mL ABTS测定液,加入1 mL样品,漩涡混匀30 s,反应一定时间后734 nm处测吸光度,以芦丁为阳性对照,蒸馏水为空白[21]。按下式计算藻红蛋白对ABTS自由基的清除率:
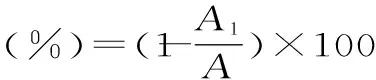
式中:A为空白体系的吸光度,A1为含试样体系的吸光度。
1.3 数据处理
数据使用SPSS 16.0.0.247,one-way ANOVA结合LSD分析。p<0.05为差异显著,p<0.01为差异极显著。
2 结果与分析
2.1 单因素实验
2.1.1 超声温度对蛋白得率的影响 不同超声温度对蛋白得率的影响结果如图1所示,温度较低时(10~20 ℃)温度对蛋白得率几乎无影响,20~30 ℃时随着温度的升高蛋白得率极显著增加(p<0.01),温度高于35 ℃时蛋白高温变性[22-24],导致得到的蛋白得率极显著降低(p<0.01)。将30 ℃作为最佳超声温度。
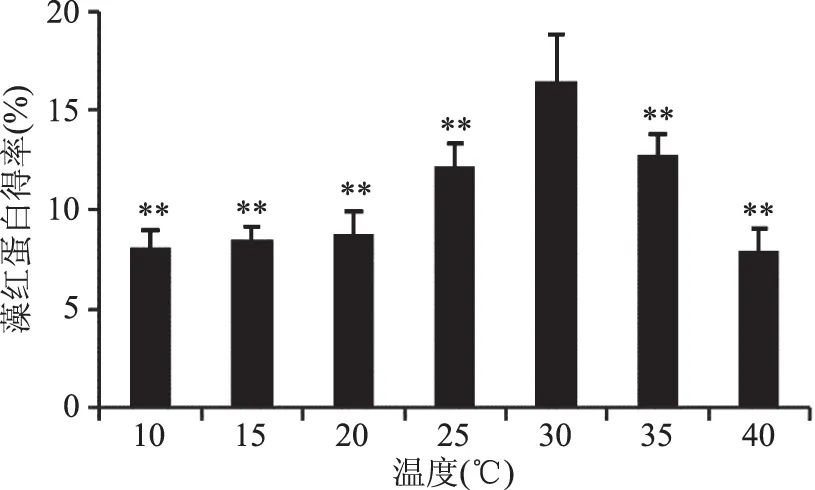
图1 温度对藻红蛋白得率的影响Fig.1 Effect of different temperature power on yield of phycocyanin
2.1.2 超声时间对蛋白得率的影响 不同超声时间对蛋白得率的影响结果如图2所示,当时间从5 min增加到15 min时藻红蛋白得率由9.15%显著上升到15.15%(p<0.05)。延长超声时间会使得更多细胞的细胞膜破碎,使细胞内蛋白更多的溶解出来,但时间过长时超声热效应使蛋白变性[25-26]。当时间超过15 min时,溶液温度随着超声时间的延长而增高,藻红蛋白的得率降低。将15 min作为最佳超声时间。
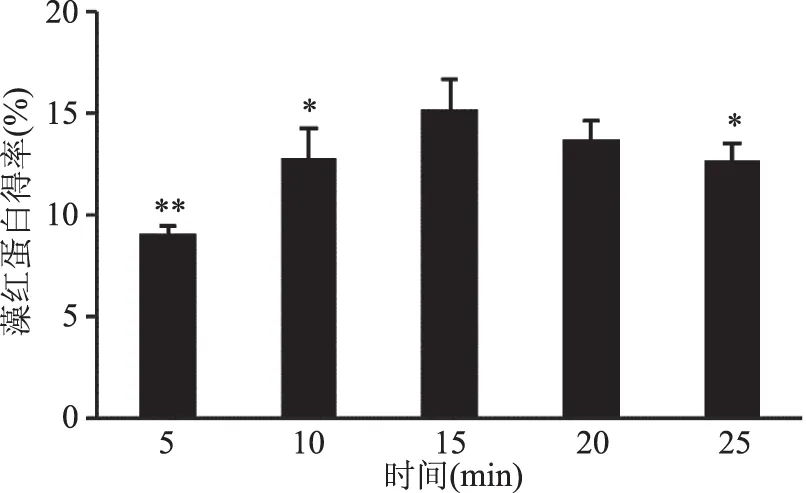
图2 时间对藻红蛋白得率的影响Fig.2 Effect of different time power on yield of phycocyanin
2.1.3 超声功率对蛋白得率的影响 不同超声功率对蛋白得率的影响结果如图3所示,当超声功率从200 W至1400 W时,较低的功率短时间内无法把蛋白全部溶出,功率过高时又会引起热效应,使溶出蛋白变性。得到随着超声功率的增加,溶出藻红蛋白先增高后降低,在600 W处达到最高值为17.28%,显著(p<0.05)高于200 W时的得率,之后随着功率的增高而降低。因此,将600 W作为最适超声功率。
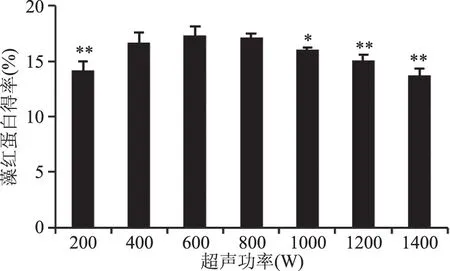
图3 超声功率对藻红蛋白得率的影响Fig.3 Effect of different power on yield of phycocyanin
2.1.4 提取溶剂用量对蛋白得率的影响 不同提取溶剂用量对蛋白得率的影响结果如图4所示,由于红胞藻数量较少,100 mL红胞藻藻液中仅能得到60 mg左右红胞藻干粉。使用溶剂太少不利于超声破碎实验的进行,溶剂使用太多不利于之后的硫酸铵沉淀和冷冻干燥过程,故选提取溶剂范围为5~25 mL。使用10~25 mL dH2O复溶提取藻红蛋白得率差异并不显著。
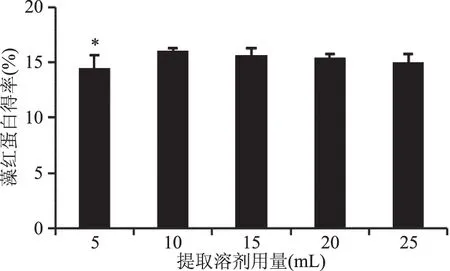
图4 提取溶剂用量对藻红蛋白得率的影响Fig.4 Effect of rations of dH2O to raw material on yield of phycocyanin
2.2 响应面实验
2.2.1 Box-Behnken实验结果 根据单因素实验结果,提取溶剂用量对蛋白得率影响并不显著,所以选定响应面实验因素为时间、温度和功率,用Design Expert software按照Box-Behnken响应面设计实验方案,共17个实验点,包括12个析因点和5个零点,每个实验组进行平行实验以减少实验误差,得到的结果见表2。
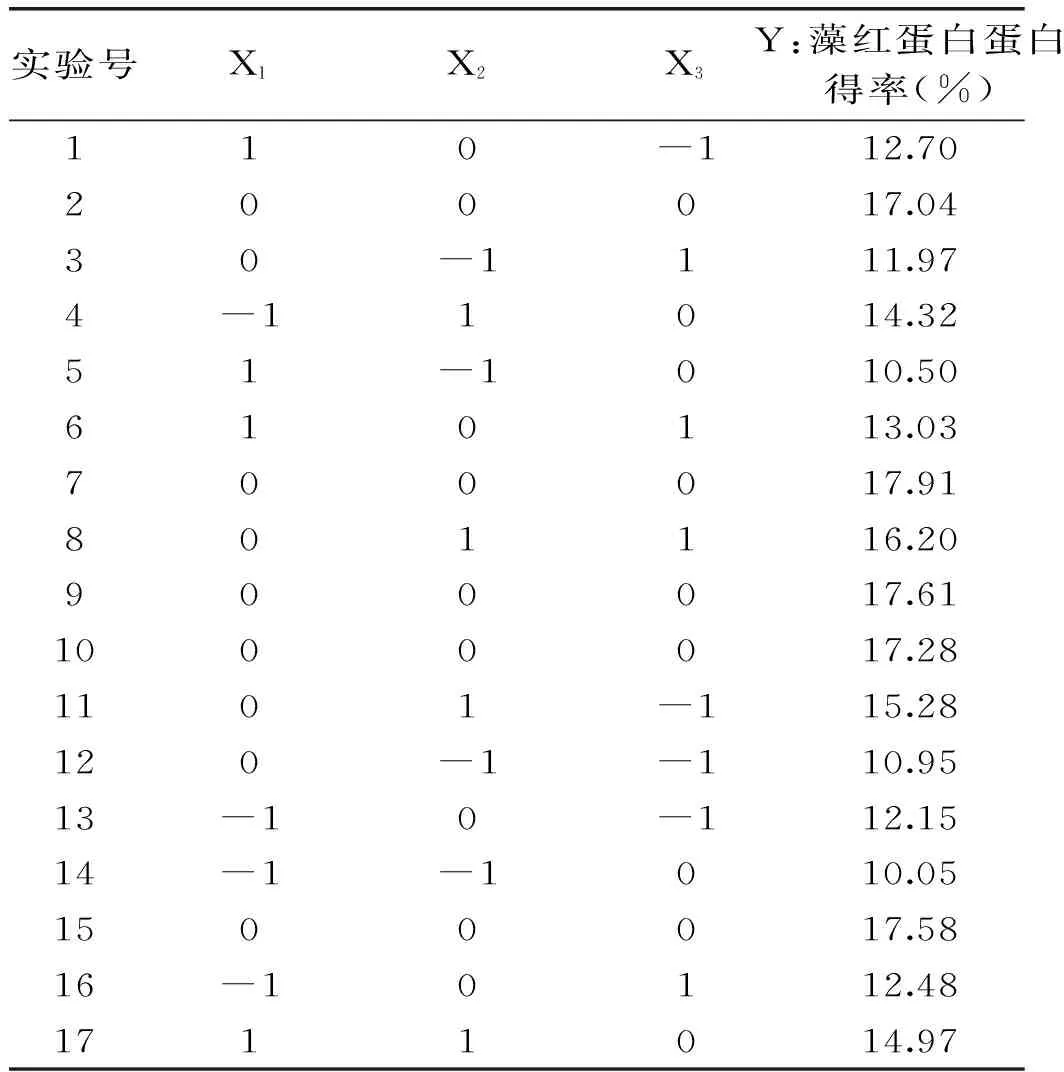
表2 Box-Behnken实验设计与实验结果Table 2 Results of Box-Behnken design
2.2.2 拟合模型的建立及显著性分析 通过统计分析软件Design Expert 8.0.6对表2中数据进行多元回归拟合分析,建立二次响应模型,根据得到溶液中藻红蛋白得率为优化指标得到蛋白得率对三个因素的多元二次回归模型:
Y=1.17+0.018X1+0.14X2+0.022X3+3.216×10-3X1X2+2.450×10-4X1X3-1.651×10-3X2X3-0.20X12-0.13X22-0.12X32
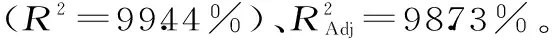
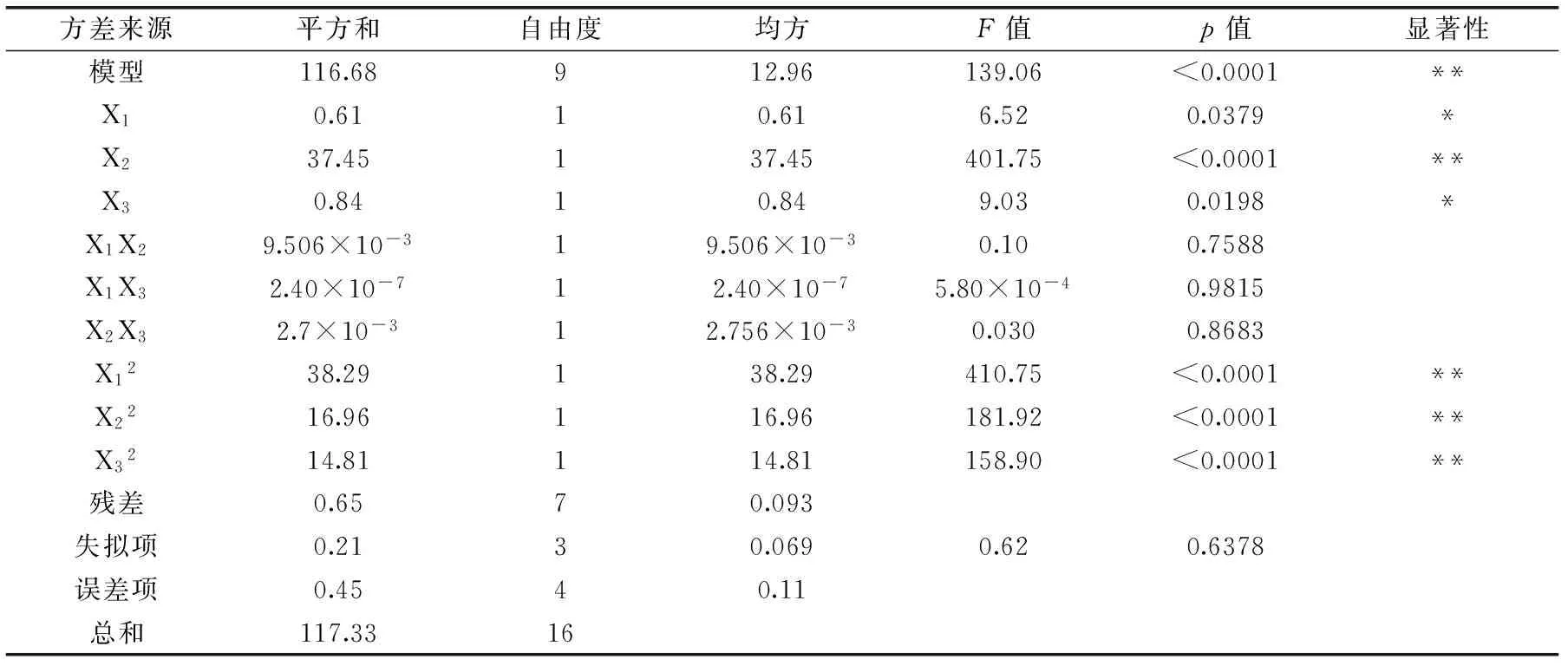
表3 回归模型方差分析Table 3 Analysis of variance for the regression model for adsorption capacity
注:“*”表示影响显著(p<0.05),“**”表示影响极显著(p<0.01)。
2.2.3 两因素间的交互效应分析 通过Design-Expert 8.0.6软件得到响应面和等高线图(图5~图7)。根据响应面实验的设计原理及分析,三维响应面图弯曲度越大,表示两因素间越显著,由此能有效的反映出各因素之间的交互作用对响应值OD的影响。比较图5~图7可知,两两因素之间的交互作用对藻红蛋白提取的影响不显著。
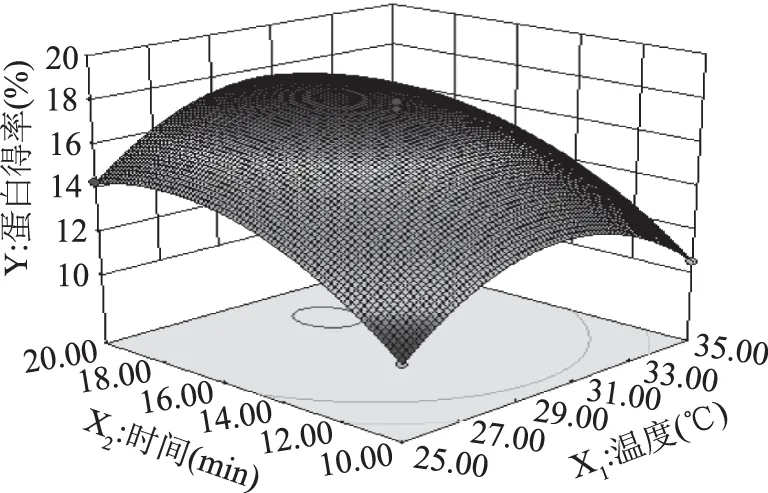
图5 时间与温度交互作用对蛋白得率的响应面Fig.5 Response surface of interaction effect of phycocyanin yield to time and temperature power
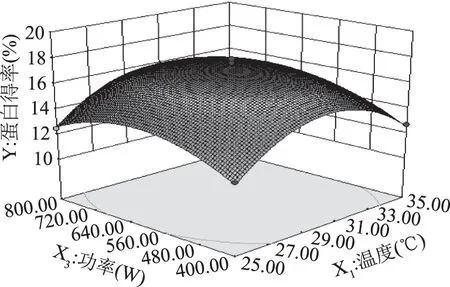
图6 温度与功率交互作用对蛋白得率的响应面Fig.6 Response surface of interaction effect of phycocyanin yield to temperature and power
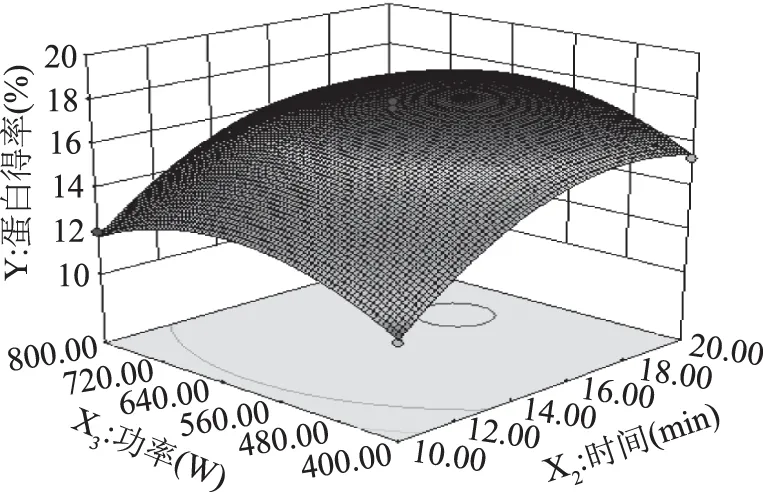
图7 功率与时间交互作用时蛋白得率的响应面Fig.7 Response surface of interaction effect of phycocyanin yield to power and time
2.2.4 响应面优化的工艺条件验证 在所选实验范围内,对响应面实验设计结果进行优化分析,计算得到温度、时间、功率分别为33 ℃、16 min、773 W时溶液藻红蛋白得率取得最大值为15.54%,按照模型预测的最佳条件,在33 ℃、750 W,时间为16 min的条件下进行验证性实验,得到的蛋白得率(15.93%)和预测值(15.54%)吻合良好,相对误差为2.50%。表明该模型工艺参数准确可靠,能够较好的预测实际情况。
2.3 硫酸铵沉淀对提取藻红蛋白的影响
将蛋白溶液进行多级沉淀[28],结果见图8。从图8中可看到,沉淀蛋白重量随硫酸铵浓度的升高而增加,当硫酸铵浓度为70%时,沉淀蛋白重量最大约为14.90 mg。在硫酸铵浓度为70%和80%处沉淀蛋白纯度最高约为2.20。为了兼顾得到藻红蛋白的量和藻红蛋白纯度,选择70%作为硫酸铵沉淀的最适浓度。
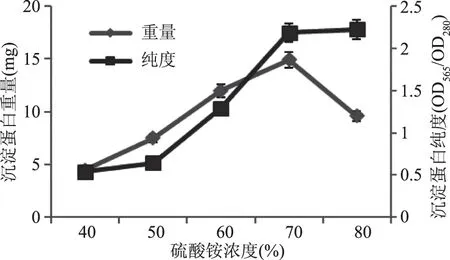
图8 不同浓度硫酸铵沉淀蛋白重量与纯度Fig.8 Weight and purity of protein precipitated by different concentrations of ammonium sulfate
2.4 藻红蛋白体外抗氧化活性初步研究
2.4.1 超氧阴离子自由基清除能力 从图9可看出,在测定范围内,随着藻红蛋白质量浓度的增大,对超氧阴离子自由基的清除率提高,在低浓度时,藻红蛋白对超氧阴离子的清除率大于VC。藻红蛋白对超氧阴离子的IC50为0.025 mg/mL,VC对超氧阴离子的IC50为0.012 mg/mL。
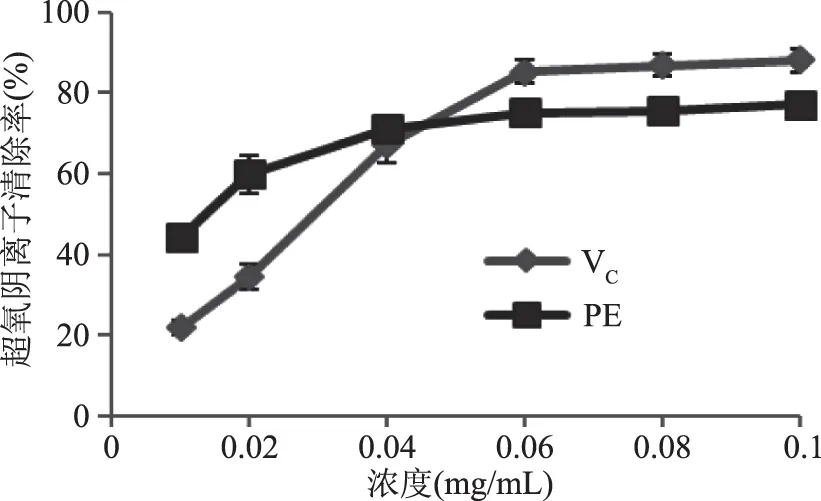
图9 藻红蛋白对超氧阴离子自由基的清除率Fig.9 Superoxide free radical scavenging effect of phycoerythrin
2.4.2 ABTS自由基清除作用 从图10可看出,在测定的质量浓度范围内,对ABTS自由基的清除率随着藻红蛋白浓度的增大而增大,在整个测定范围中藻红蛋白对ABTS自由基的而清除率均大于芦丁的。藻红蛋白对ABTS自由基清除作用的IC50为0.023 mg/mL,芦丁对ABTS自由基清除作用的IC50为0.054 mg/mL。
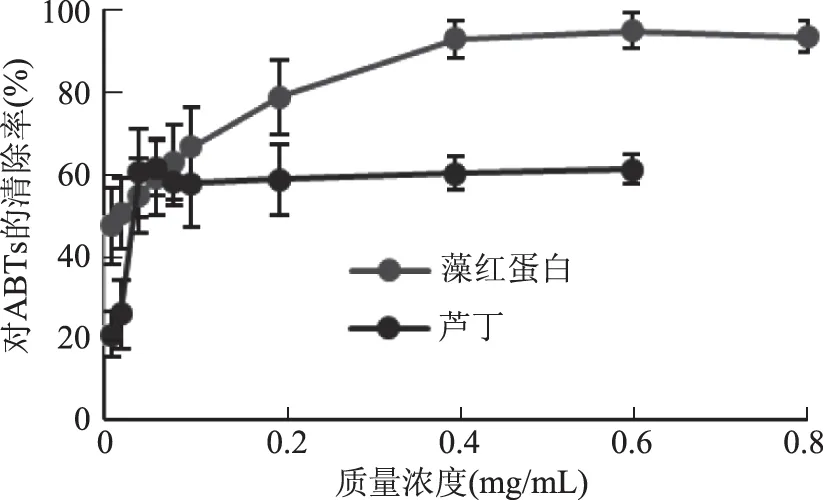
图10 藻红蛋白对ABTS自由基的清除率Fig.10 ABTS scavenging effect of phycoerythrin
3 结论
在单因素实验基础上,使用Box-Behnken响应面实验设计,利用Design-Expert 8.0.6软件进行分析,以温度、时间、功率为相应变量,选蛋白得率为响应值,得到二次线性回归方程的预测模型,所得回归模型能够较好的反映出各因素水平与响应值之间的关系,对提取藻红蛋白工艺进行了优化,得到了提取藻红蛋白最佳工艺为超声时间16 min、温度33 ℃、功率为750 W,在该条件下进行验证性实验,得到的蛋白溶液浓度为15.93%,与预测值相对误差为2.50%,表明经响应面法实验优化的工艺条件具有实用价值。
藻红蛋白的体外抗氧化能力的实验结果表明,藻红蛋白对不同的自由基的清除能力是不同的,且在一定的质量浓度范围内(0.01~0.6 mg/mL)呈正相关的关系,甚至在一定的浓度范围内(0.01~0.04 mg/mL)藻红蛋白清除超氧阴离子自由基的能力(IC50=0.025 mg/mL)大于VC(IC50=0.012 mg/mL)的。为今后藻红蛋白相关产品的开发利用提供了一定的参考和依据。
[1]Ravi S. Growth,pigments,and biochemical composition of marine red lga Gracilaria crassa[J].Appl Phycol,2014,26:2143-2150.
[2]Glazer AN. Phycobiliproteins:a family of valuable,widely used fluorophores[J].Appl Phycol,1994,6:105-112.
[3]蔡心涵,何立明. 螺旋藻藻蓝蛋白对癌激光疗法增敏作用的实验研究[J].中国海洋药物,1995,14(1):15-18.
[4]李冠武,王广策,陆雷,等. 多管藻R-藻红蛋白的激光光敏作用对体外培养的肿瘤细胞生存率的影响[J].激光生物学报,1997,6(3):1119-1121.
[5]Ricardo M. Chaloub Combined effects of irradiance,temperature and nitrate concentration on phycoerythrin content in the microalgaRhodomonassp.(Cryptophyceae)[J].Algal Research,2015,8:89-94.
[6]Chaloub R M,Motta N M S,Araujo S P,et al.Combined effects of irradiance,temperature and nitrate concentration onphycoerythrin content in the microalgaRhodomonassp. (Cryptophyceae)[J].Algal Research,2015,8:89-94.
[7]Marina A.The freshwater alga Chroothece richteriana(Rhodophyta)as a potential source of lipids[J].Food Chemistry,2014,162:143-148.
[8]Silva A F,Lourenço S O,Chaloub R M. Effects of nitrogen starvation on the photosynthetic physiology of a tropical marine microalgaRhodomonassp.(Cryptophyceae)[J].Aquatic Botany,2009,91(4):291-297.
[9]Maccoll R,Berns D S,Gibbons O.Characterization of Cryptomonad Phycoerythrin and Phycocyanin[J].Archives of Biochemistry and Biophysics,1976,177:265-275.
[10]刘宁,朱振宝,仇农学,等.苦杏仁蛋白提取工艺优化及氨基酸分析[J].中国油脂,2008,33(1):26-29.
[11]童洋,肖国民,潘晓梅.响应面法优化螺旋藻中叶绿素的超声提取工艺[J].化工学报,2009,60(11):2813-2819.
[12]王万能,周见,张潇骏,等.响应面法优化小球藻中叶绿素盐的超声波制取工艺[J].食品工业,2013,34(4),115-118.
[13]魏文恺,郝建平,王峰,等.响应面法优化野葛叶中叶绿素超声波提取工艺[J].食品工业科技,2014,11:202-213.
[14]马泽青,张宝善,赵舒欣,等.响应面法超声波辅助提取双孢蘑菇蛋白工艺优化[J].食品工业科技,2012,33(23):229-233.
[15]齐计英,姚依婧,岑琴,等.响应面法优化雨生红球藻虾青素的超声提取工艺[J].食品工业科技,2015,36(6):313-321.
[16]刘晓娟,伍颖华,何凤林,等.响应面法优化雨生红球藻中虾青素的提取条件[J].食品科技,2012,37(2):233-238.
[17]姜显光,侯冬岩,翁霞,等.马蔺叶中黄酮的超声提取工艺优化及抗氧化性能的测定[J].现代农业科技,2014(2):300-303.
[18]Siegelman HW,Kycia JH.Algal biliproteins:handbook of phycological method[M].Cambridge University Press,1979:71-79.
[19]Munier M,Morancais M,Dumay J,et al.One-step purification of R-phycoerythrin from the red edible seaweed Grateloupia turuturu[J].Journal of Chromatography B,2015,992:23-29.
[20]Siddhuraju P,Becker K. The antioxidant and free radical scavenging activities of processed cowpea seed extracts[J]. Food Chemistry,2007,10(1):10-19.
[21]Re R,Pellegrini N,Proteggente A,et al. Antioxidant activity applying an improved ABTS radical cation decolorization assay[J]. Free Radical Biology & Medicine,1999,26:1231-1237.
[22]Ruiz-Rui F,Benavides J,Rito-Palomares M,Scaling-up of a B-phycoerythrin production and purification bioprocess involving aqueous two-phase systems:Practical experiences[J]. Process Biochemistry,2013,48:738-745.
[23]钟秋平,林美芳,戴梓茹.超声波辅助提取扁藻多糖工艺的优化[J].南方农业学报,2013,44(10):1714-1717.
[24]尹文翠,陈雪峰.超声波辅助提取发菜藻蓝蛋白工艺的优化[J].食品科技,2012,37(3):250-254.
[25]Rossano R,Ungaro N,D′Ambrosio A,et al. Extracting and purifying R-phycoerythrin from Mediterranean red algae Corallina elongata Ellis & Solander[J]. Journal of Biotechnology,2003,101:289-293.
[26]邵明飞,张宏宇,杨金萍.响应面法优化螺旋藻藻蓝蛋白的超声波提取工艺[J].生物学杂志,2013,30(4):93-99.
[27]王永菲,王成国.响应面法的理论与应用[J].中央民族大学学报:自然科学版,2005,14(3):236-240.
[28]张发宇,赵冰冰,陈裕,等.两步盐析联合双水相萃取提取纯化蓝藻中藻蓝蛋白[J].食品科技,2015,36(22):6-9.
Optimization of ultrasonic wave extraction technique of phycoerythrin fromRhodophytasalinaby response surface analysis and its antioxidant activity
MENG Xiao1,ZHANG Kun-sheng1,*,ZHANG Yan-qing1,WEN Zhi-you2,*,REN Yun-xia1,LIU Jun-jun1
(1.School of Biotechnology and Food Science,Tianjin University of Commerce,Tianjin Key Laboratory of Food Biotechnology,Tianjin 300134,China;2.Department of Food Science and Human Nutrition,Lowa State University,Lowa 50011,Ames)
Response surface methodology was utilized to optimize ultrasonic wave extraction technique of phycoerythrin fromRhodophytasalina. Based on single factor test,ammonium sulfate fractionation precipitation was used to purify phycoerythrin with the tempreture,extraction power and extraction time as influential factors. A three-variable,Box-Behnken experiment design combined with response surface analysis was used to optimize the extraction technique. And the yield of phycoerythrin was selected as the response value. Results indicated that the optimal extraction process conditions were determined as 16 min,33 ℃ and 750 W for yield of phycoerythrin. Under this conditions,the yield of phycoerythrin was 15.93% with a 2.50% error compared with the actual value. Phycoerythrin had the ability to clear off superoxide free adicals(IC50=0.025 mg/mL)and ABTS free radical(IC50=0.023 mg/mL)
response surface methodology;Rhodophytasalina;phycoerythrin;extraction process;antioxidation activity
2016-08-16
孟晓(1991-),男,硕士研究生,研究方向:食品加工与贮藏,E-mail:mengx9950@163.com。
*通讯作者:张坤生(1957-),男,博士,教授,研究方向:食品加工与贮藏,E-mail:zhksheng@tjcu.edu.cn。 温志友(1971-),男,博士,教授,研究方向:生物能源、微藻研究,E-mail:wenz@iastate.edu。
天津特聘讲座教授科研项目资金。
TS201.1
B
:1002-0306(2017)04-0288-06
10.13386/j.issn1002-0306.2017.04.046
