两株拟除虫菊酯类农药降解菌的分离鉴定及其降解能力的研究
2017-03-14陈廷廷曾朝懿
刘 波,唐 洁,陈廷廷,史 颖,曾 林,曾朝懿
(西华大学食品与生物工程学院,四川成都 610039)
两株拟除虫菊酯类农药降解菌的分离鉴定及其降解能力的研究
刘 波,唐 洁*,陈廷廷,史 颖,曾 林,曾朝懿
(西华大学食品与生物工程学院,四川成都 610039)
通过富集培养、梯度驯化方法,以拟除虫菊酯类农药降解率为指标,从菜园耕地土壤中分离筛选到两株可广谱降解拟除虫菊酯类农药的降解菌Q-7和G-04。经形态学观察、生理生化实验及16S rRNA基因序列分析,菌株Q-7鉴定为蜡样芽胞杆菌(Bacilluscereus),菌株G-04鉴定为地衣芽孢杆菌(Bacilluslicheniformis)。两株降解菌都具备较强的拟除虫菊酯类农药耐受性,可在同时含高效氯氰菊酯、氰戊菊酯、氯菊酯、联苯菊酯,且累积浓度为640 mg/L的培养基中生长。两株降解菌能同时降解初始浓度分别为50 mg/L的高效氯氰菊酯、氰戊菊酯、氯菊酯和联苯菊酯,接种培养72 h后,菌株Q-7对高效氯氰菊酯、氰戊菊酯、氯菊酯、联苯菊酯的降解率分别为48.31%、64.31%、33.46%、26.52%,菌株G-04的相应降解率为66.94%、45.04%、29.40%、26.40%。研究结果表明,菌株Q-7和菌株G-04具备广谱降解拟除虫菊酯类农药的能力,可作为修复拟除虫菊酯类农药污染环境的优良微生物资源。
拟除虫菊酯类农药,蜡样芽胞杆菌,地衣芽孢杆菌,生物降解
农作物是人类赖以生存和发展的重要食品,易发生病虫害,常用农药防治,以提高农作物品质和产量。但农药的大量使用使作物、土壤及水源受到不同程度污染,严重威胁环境和食品安全。目前拟除虫菊酯类农药以其杀虫广谱、高效、低残留、性质稳定、安全系数高等优点,在防治农业害虫方面具有广泛应用[1];又因其应用范围广、接触人群多、有蓄积性等,从而引起农残超标、水土污染、人体中毒等现象频发[2-4]。由于拟除虫菊酯类农药理化性质比较稳定,具有耐光、热分解,且残留范围广,传统物理化学方法处理难度大、成本高[5]。与其他方法相比,微生物降解具有降解速度快、操作简单、成本低、无二次污染等优点[6-7]。目前,国内外学者已经从自然界中分离得到了包括细菌、真菌及放线菌等在内的拟除虫菊酯类农药降解菌株,如沙雷氏菌属(Serratia)[8]、微球菌属(Micrococcus)[9]、假单胞菌属(Pseudomonassp.)[10]、芽孢杆菌属(Bacillussp.)[11]、肠杆菌属(Ehterobactesp.)[12]、产碱杆菌属(Alcaligenessp.)[13]、鞘氨醇单胞菌属(Sphingomonassp.)[14]、气单胞菌属(Aeromonas)[15]、克雷伯菌属(Klebsiella)[16]、枝孢属(Cladosporium)[17]和红球菌属(Rhodococcus)[18]等。但多数是针对单一或少数几种拟除虫菊酯类农药进行的,以多种拟除虫菊酯类农药为底物筛选具备广谱降解能力微生物菌株的研究报道并不多见,且大多数拟除虫菊酯类农药降解菌对高浓度农药的适应性差,降解能力偏低。
我国耕地自然环境复杂,农药污染种类多,污染程度差异较大。因此,筛选高效广谱,适应性强,环境友好的降解菌株是解决上述问题的根本方法。本研究从耕地土壤中分离筛选出两株拟除虫菊酯类农药高效降解菌Q-7和G-04,通过形态学观察、生理生化实验以及16S rRNA序列分析,对菌株进行鉴定;并初步探讨了两菌株对四种拟除虫酯类农药降解能力的差异。研究结果可进一步丰富广谱性拟除虫菊酯降解菌资源库,为受拟除虫菊酯类农药污染农作物生长环境的生物修复及进一步保障其食用安全提供菌株资源和理论基础。
1 材料与方法
1.1 材料与仪器
菜园耕作层土壤 采自成都郫县某一长期施用拟除虫菊酯类农药的菜园;高效氯氰菊酯、氰戊菊酯、氯菊酯、联苯菊酯标准品(质量分数99.5%) 国家标准物质中心;高效氯氰菊酯、氰戊菊酯、氯菊酯、联苯菊酯原农药(质量分数96.0%) 南京荣诚化工公司;乙腈(色谱纯) 美国Adamas-beta公司;Bacteria DNA Kit提取试剂盒、多重PCR扩增试剂盒 天根生化科技有限公司;基础盐(MM)选择培养基 (NH4)2SO41.5 g,KH2PO40.5 g,K2HPO41.5 g,MgSO40.2 g,NaCl 0.5 g,蒸馏水1000 mL,pH7.5;Luria-Bertani(LB)富集培养基 胰蛋白胨10.0 g,酵母浸出粉5.0 g,NaCl 10.0 g,蒸馏水1000 mL,pH7.0;121 ℃灭菌20 min[19],灭菌后加入一定体积的各浓度拟除虫菊酯原药溶液使其为实验所需浓度,混匀备用;固体培养基同液体培养基加入2.0%(w/v)的琼脂制成固体培养基。
e2695型高效液相色谱仪、2998型光电二极管阵列检测器 美国Waters公司;Biometra PCR仪 德国Analytik Jena AG公司;Powerpac Basic电泳、凝胶成像系统 美国Bio-Rad公司;7200型可见分光光度计 美国UNICO公司;Heraeus Multifuge X1R高速冷冻离心机 美国thermo Scientific公司;HNY-2102C恒温培养振荡器 天津市欧诺仪器仪表有限公司;SW-CJ-1FD洁净工作台 苏州安泰空气技术有限公司。
1.2 实验方法
1.2.1 拟除虫菊酯类农药的检测及其标准曲线方程建立 取培养液1.0 mL并加入适量乙腈于10 mL具塞试管中,超声波(40 kHz,100 W)辅助提取30 min后用乙腈定容,混匀后12000 r/min离心30 min,取上清液用有机相滤膜过滤,收集滤液进行高效液相色谱(HPLC)检测。HPLC检测条件:色谱柱为Agilent Eclipse Plus C18(4.6 mm×150 mm,5 μm),流动相为乙腈/超纯水(90∶10,v/v),流速为1.0 mL/min,柱温为30 ℃,检测波长为210 nm,进样量为10 μL[20]。
分别配制浓度为10 mg/L的高效氯氰菊酯、氰戊菊酯、氯菊酯、联苯菊酯标准液,每种标准液依次进样量分别为1、2、5、10、20、50 μL,即质量分别为0.01、0.02、0.05、0.1、0.2、0.5 μg。拟合高效氯氰菊酯、氰戊菊酯、氯菊酯、联苯菊酯质量-峰面积的标准曲线。
1.2.2 降解菌的富集驯化 取1.0 g土样加入100 mL含高效氯氰菊酯、氰戊菊酯、氯菊酯、联苯菊酯浓度均为20 mg/L的MM培养基于30 ℃振荡(180 r/min)培养72 h后,取5 mL培养液转接至四种拟除虫菊酯类农药浓度均为40 mg/L的MM培养基中,再按上述培养条件培养72 h;按照上述操作连续转接3次,并逐次提高培养基中单种拟除虫菊酯类农药的浓度至160 mg/L,使最终总浓度达到640 mg/L。
1.2.3 降解菌的筛选和纯化 驯化后,将菌悬液(OD600 nm≈1.0)进行梯度稀释并分别涂布转接到高效氯氰菊酯、氰戊菊酯、氯菊酯、联苯菊酯浓度均为40 mg/L的LB固体培养基于30 ℃培养48 h,挑取单菌落于高效氯氰菊酯、氰戊菊酯、氯菊酯、联苯菊酯浓度均为40 mg/L的LB固体培养基连续划线纯化三代,挑选出菌落形态规则、生长速度较快的菌株,进行传代、涂布,直至LB培养基上的菌落形态完全一致为止。挑取单菌落划线培养后进行编号,菌株纯化后用20%甘油于-70 ℃冷冻保存。
1.2.4 降解菌降解能力测定 将筛选得到的菌株重新挑取转接到含单一拟除虫菊酯类农药(高效氯氰菊酯、氰戊菊酯、氯菊酯、联苯菊酯浓度分别为50 mg/L)的LB培养基中,接入同体积无菌水做空白对照,30 ℃振荡(180 r/min)培养48 h后取样对各降解体系进行残留量测定,并按下式计算各降解体系的降解率,筛选降解谱广、降解效率高的菌株进行后续研究。
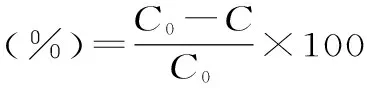
式中,C为样品液中高效氯氰菊酯、氰戊菊酯、氯菊酯、联苯菊酯质量;C0为空白对照中高效氯氰菊酯、氰戊菊酯、氯菊酯、联苯菊酯质量。
1.2.5 降解菌的鉴定 将筛选得到的降解菌株分别在MM、LB平板上划线接种,于37 ℃培养箱中倒置培养24 h,观察菌落形态。生理生化特征实验参照《伯杰细菌鉴定手册》第8版[21]进行。细菌总DNA提取参照文献[22]的SDS-CTAB原位裂解优化方法进行。
16S rRNA扩增、序列测定及系统发育树的构建:以细菌总DNA为模板,用16S rRNA的一对引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-AAGGAGGTGATCCAGCCGCA-3′)进行PCR扩增反应。PCR反应体系为50 μL,含有模板DNA 1.5 μL,27f primer 1 μL,1492r primer 1 μL,10×PCR Buffer 5 μL,Mixed dNTP 1 μL,Taq DNA聚合酶0.5 μL,ddH2O 40 μL。PCR反应条件:95 ℃预变性1.5 min,94 ℃变性0.5 min,55 ℃退火1.5 min,72 ℃延伸1.5 min,30个循环,最后于72 ℃保温扩展10 min[23]。扩增产物经过1%的琼脂糖凝胶电泳检测,电泳后所需要的DNA条带采用琼脂糖凝胶DNA回收试剂盒进行回收,回收产物委托擎科生物技术有限公司完成测序,将测序结果在NCBI(美国国立生物信息中心)的Genbank数据库中进行同源性比较[24],然后利用系统发育分析软件和Neighbor-Joining法构建系统发育树。
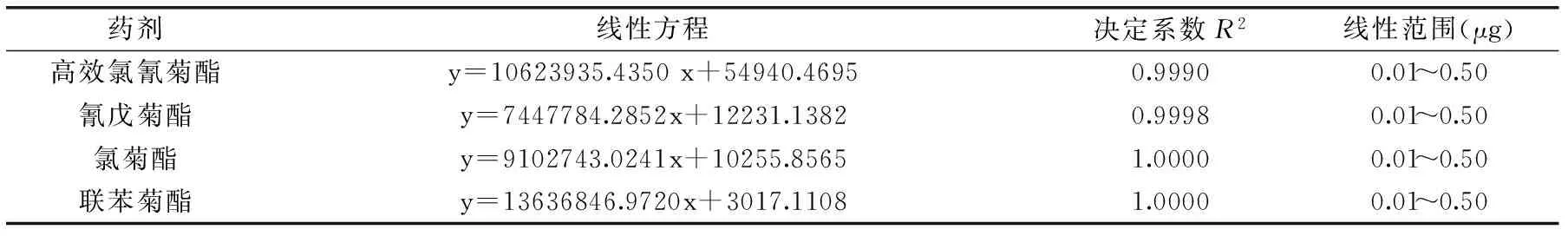
表1 四种拟除虫菊酯类农药线性方程Table 1 Linear equation of four kinds of pyrethroid pesticides
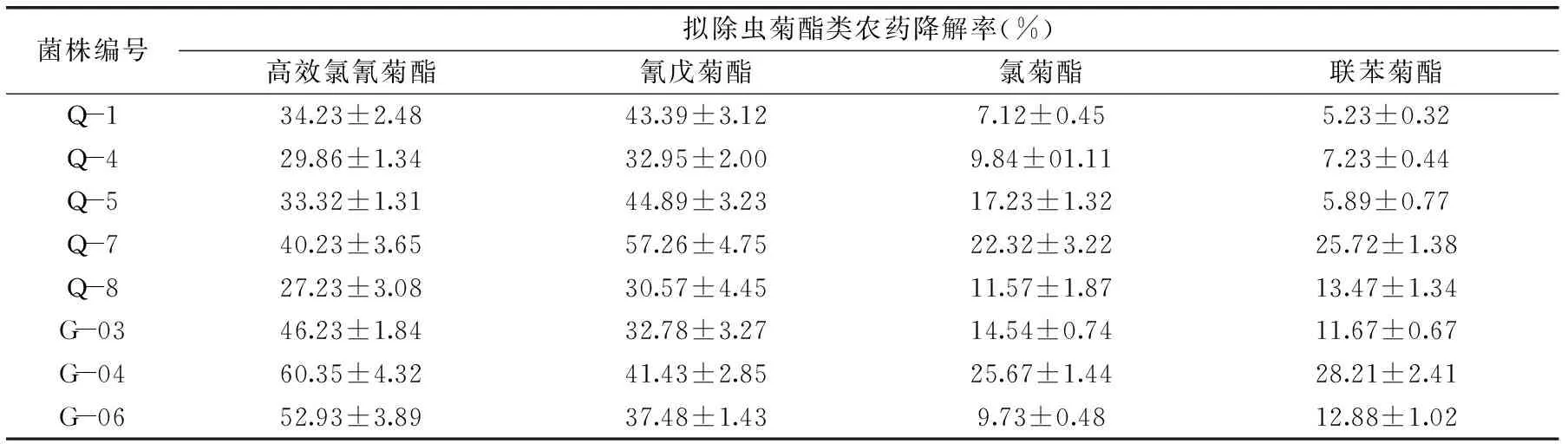
表2 不同菌株对拟除虫菊酯类农药的降解率Table 2 Degredation rate of pyrethroid pesticides by different strains
注:“Q”和“G”代表不同的耕地土壤源。
1.2.6 降解菌株的降解谱分析 将菌株菌悬液(OD600 nm≈1.0)按5.0%(v/v)的接种量分别接种于含高效氯氰菊酯、氰戊菊酯、氯菊酯、联苯菊酯各50 mg/L的LB培养基中,接入同体积无菌水作为空白对照,30 ℃振荡(180 r/min)培养72 h后,测定降解体系中残留高效氯氰菊酯、氰戊菊酯、氯菊酯、联苯菊酯质量,通过降解率的计算,分析降解菌株对四种拟除虫菊酯类农药的降解能力差异。
1.2.7 降解菌株对高效氯氰菊酯的降解过程分析 以高效氯氰菊酯作为拟除虫菊酯类农药的代表,分析降解菌株对其的降解过程。将菌株菌悬液(OD600 nm≈1.0)按5.0%(v/v)的接种量分别接种到高效氯氰菊酯浓度为50 mg/L的LB培养基中,接入同体积无菌水作为空白对照,30 ℃振荡(180 r/min)培养72 h,间隔12 h定量取样,测定培养液中高效氯氰菊酯残留量。间隔12 h吸取5 mL培养液,以无菌水做空白对照,于600 nm处测定其吸光度值。
1.2.8 数据分析 实验数据均有3个平行重复,结果用平均值±标准方差表示,数据的常规分析及图表绘制采用Excel 2013进行。菌株系统发育分析采用MEGA 5.1软件进行。
2 结果与讨论
2.1 拟除虫菊酯类农药的标准曲线
四种拟除虫菊酯类农药的高效液相色谱图如图1所示。因为存在同分异构体,高效氯氰菊酯和氯菊酯均有多个峰[17],各峰之间分离度较好,检测时间短,且峰型尖锐、对称性好。
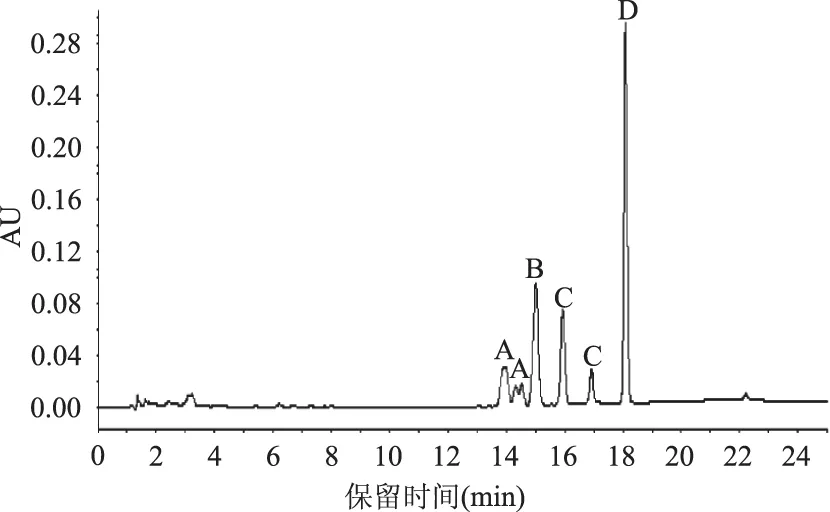
图1 四种拟除虫菊酯类农药色谱图Fig.1 Chromatogram of four kinds of pyrethriod pesticides
四种拟除虫菊酯标准曲线线性方程见表1,其相关系数R2均大于0.999,表明线性关系良好,线性范围为0.01~0.50 μg。
2.2 拟除虫菊酯类农药降解菌的分离鉴定
2.2.1 降解菌株的筛选及纯化 经富集驯化、分离后获得23株可同时耐受四种拟除虫菊酯类农药的菌株,其中8株具备降解高效氯氰菊酯、氰戊菊酯、氯菊酯、联苯菊酯的能力。通过对降解率进行测定,8株降解菌对四种拟除虫菊酯的降解率见表2。菌株Q-7和菌株G-04对四种拟除虫菊酯类农药降解能力最好,菌株Q-7对高效氯氰菊酯、氰戊菊酯、氯菊酯、联苯菊酯的降解率分别为40.23%、57.26%、22.32%、25.72%,菌株G-04的相应降解率分别为60.35%、41.43%、25.67%、28.21%。说明这两株降解菌能有效降解这四种拟除虫菊酯类农药,对该类农药的降解具备广谱性。
2.2.2 降解菌株的形态及生理生化特征 将纯化后的菌株Q-7、菌株G-04分别划线接种于MM、LB平板培养基中,37 ℃倒置培养24 h后,菌株Q-7在MM培养基上菌落呈圆形或椭圆形,边缘整齐、质地软、无色素、稍有光泽的白色菌落(似蜡烛样颜色),直径5~7 mm;在LB培养基上菌落为灰白色,不透明,表面较粗糙,似毛玻璃状或融蜡状,菌落较大;菌株G-04在MM培养基上菌落呈扁平圆形、白色、边缘锯齿状、表面皱褶,直径1~3 mm;在LB培养基上菌落为乳白色、边缘不整、直径2~6 mm。将纯化得到的两株降解菌株Q-7、G-04分别进行生理生化实验,结果见表3。
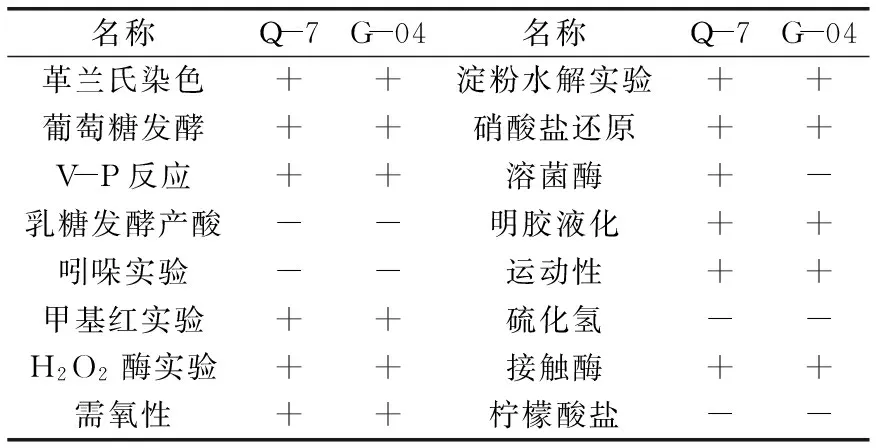
表3 降解菌株生理生化实验结果Table 3 Physiological and biochemical test results of strains
注:“+”为阳性;“-”为阴性。
2.2.3 降解菌株16S rRNA序列分析 对菌株Q-7和G-04的16S rRNA序列进行PCR扩增,经过1%的琼脂糖凝胶电泳检测分别获得大小约1500 bp的产物,如图2所示;扩增产物回收后测序,得到菌株Q-7和G-04的16S rRNA扩增序列。利用BLAST检索分析将菌株Q-7和G-04的16S rRNA扩增序列在Genbank数据库中进行同源性比对。结果发现,菌株Q-7序列与Bacilluscereus种的同源性最高,其中与BacilluscereusJCM 2152的同源性为100%;菌株G-04序列与Bacilluslicheniformis种的同源性最高,其中与BacilluslicheniformisCICC 10037的同源性为99%。对于16S rRNA序列同源性不小于97%,认为属于同种;同源性小于95%,属于不同属[25]。通过上述同源性比对,基本可以确定菌株Q-7为蜡样芽胞杆菌(Bacilluscereus),菌株G-04为地衣芽孢杆菌(Bacilluslicheniformis)。
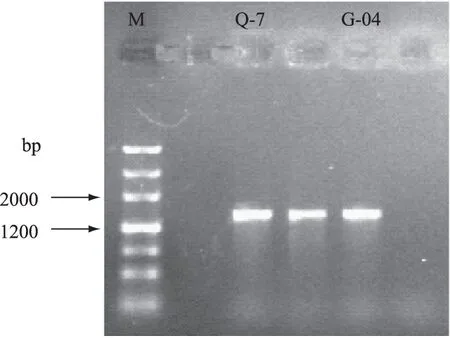
图2 16S rRNA 基因片段PCR扩增产物(Marker、Q-7、G-04)Fig.2 PCR products of 16S rRNA gene fragments of Marker,strain Q-7 and G-04
为了进一步确定菌株Q-7和G-04的种属,参考菌株Q-7和G-04 16S rRNA基因序列在Genbank数据库中的比较结果,利用MEGA 5.1软件和Neighbor-Joining法,以菌株Q-7和G-04的16S rRNA基因序列与Genbank数据库中所找到的蜡样芽胞杆菌属(Bacilluscereus)、地衣芽孢杆菌属(Bacilluslicheniformis)以及其他种的细菌的16S rRNA基因序列构建系统发育树,如图3所示。从构建的发育树看,菌株Q-7与Bacilluscereus、菌株G-04与Bacilluslicheniformis位于同一个分支上,这也证实了菌株Q-7与菌株G-04分别为蜡样芽胞杆菌(Bacilluscereus)、地衣芽孢杆菌(Bacilluslicheniformis)。综合形态学、生理生化特征实验、16S rRNA基因序列和系统发育树,可以确定菌株Q-7、菌株G-04分别为蜡样芽胞杆菌和地衣芽孢杆菌。
地衣芽孢杆菌和蜡样芽胞杆菌均属于常见的芽孢杆菌属,在重金属吸附、石油降解、植物病害防治、饲料加工、医药开发、环境污染治理等领域都有非常突出的应用价值,但有关其降解环境中拟除虫菊酯类农药的研究报道还不多见[26-31]。赖文[32]等从茶园土壤中分离得到一株地衣芽孢杆菌B-1,研究了其对氯氰菊酯的降解及其降解酶;曲杰[33]等报道了可降解氯氰菊酯的蜡样芽胞杆菌L12的降解能力和细胞疏水性;Zhang[34]等报道蜡样芽胞杆菌Y-1可促进培养基、污染土壤的溴氰菊酯的降解,并确定了最佳培养条件。但均未涉及对多种拟除虫菊酯类农药的降解能力分析。此次分离得到的地衣芽孢杆菌G-04和蜡样芽胞杆菌Q-7可有效降解多种拟除虫菊酯类农药,且耐药能力强,具有很好的开发应用潜能,是可应用于环境生物修复的降解菌资源。
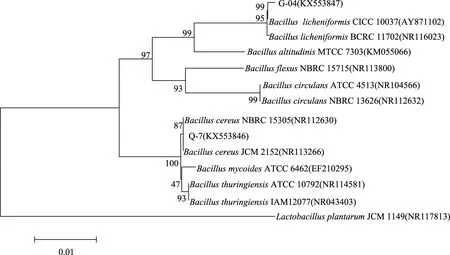
图3 菌株Q-7和G-04基于16S rRNA的菌株系统发育分析Fig.3 Phylogenetic tree of strain Q-7 and G-04 based on 16S rRNA sequence
2.3 菌株对拟除虫菊酯类农药的降解谱分析
以同时含高效氯氰菊酯、氰戊菊酯、氯菊酯及联苯菊酯且四种农药浓度均为50 mg/L的LB培养基(农药总浓度200 mg/L)作为降解体系,接种量5%(v/v)、pH7.0、温度30 ℃条件下培养72 h后,蜡样芽胞杆菌Q-7对高效氯氰菊酯、氰戊菊酯、氯菊酯、联苯菊酯的降解率分别为48.31%、64.31%、33.46%、26.52%,地衣芽孢杆菌G-04对四种农药的相应降解率为66.94%、45.04%、29.40%、26.40%,如图4所示。可见,蜡样芽胞杆菌Q-7和地衣芽孢杆菌G-04均可同时有效降解高效氯氢菊酯、氰戊菊酯、氯菊酯、联苯菊酯。其中,蜡样芽胞杆菌Q-7是氰戊菊酯优势降解菌,能高效降解氰戊菊酯和高效氯氰菊酯。地衣芽孢杆菌G-04是高效氯氰菊酯优势降解菌,可高效降解高效氯氰菊酯降解和氰戊菊酯。
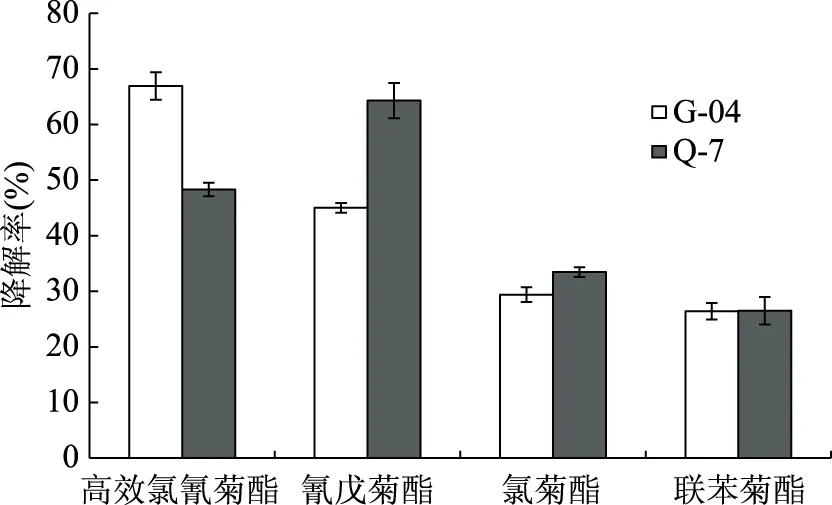
图4 菌株Q-7和菌株G-04对四种拟除虫菊酯类农药的降解率Fig.4 Degredation rate of four kinds of pyrethroid pesticides by Q-7 and G-04
同一降解菌株对四种拟除虫菊酯类农药之间的降解能力存在明显差异,原因在于:蜡样芽胞杆菌Q-7和地衣芽孢杆菌G-04的原始菌株所处土壤环境中农药种类杂多,残留量、分布不均,造成土壤微生物对不同农药耐受、降解能力的差异,且耕地农作物使用拟除虫菊酯类农药中高效氯氰菊酯和氰戊菊酯占比较大;其次不同农药本身结构差异性大,对环境理化条件、微生物等因素耐受能力差异明显,如高效氯氰菊酯醇部分的α位为氰基(-CN),而α位的氰基可减少底物和酶结合的空间位阻,降低酯键的稳定性,使其更易降解[35];菌株产拟除虫菊酯类农药降解酶对不同拟除虫菊酯类农药的降解性能差异大,即通过水解、氧化、还原等反应对不同农药有不同的降解作用。
2.4 菌株降解高效氯氰菊酯的降解过程分析
蜡样芽胞杆菌Q-7和地衣芽孢杆菌G-04在培养过程中,LB培养基由无色透明逐渐变浑浊,并出现大量的微生物絮状体。菌株Q-7、菌株G-04在此降解体系中的生长曲线及其对高效氯氰菊酯的降解曲线如图5、图6所示。
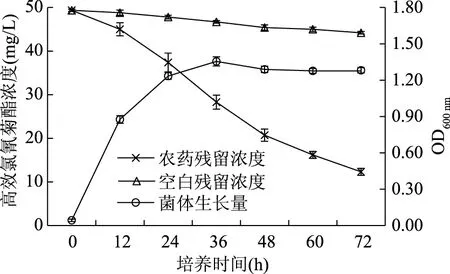
图5 菌株Q-7的生长曲线及其对高效氯氰菊酯的降解曲线Fig.5 Growth curve of strain Q-7 and biodegradation of beta-cypermethrin by the strain
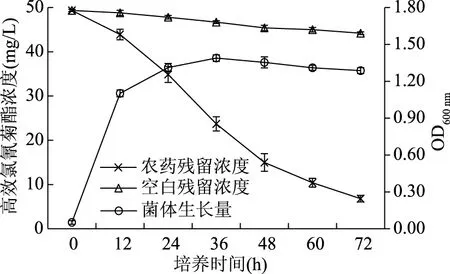
图6 菌株G-04的生长曲线及其对高效氯氰菊酯的降解曲线Fig.6 Growth curve of strain G-04 and biodegradation of beta-cypermethrin by the strain
由图5和图6可知,高效氯氰菊酯的降解与两菌株的生长基本同步,当菌株处于对数生长期(12~48 h)时,高效氯氰菊酯的降解速率较大。培养48 h后,菌株生长逐渐处于平稳期,高效氯氰菊酯的降解速率逐渐变小;经过72 h培养后,空白组高效氯氰菊酯浓度由最初的50 mg/L降至42.20 mg/L,地衣芽孢杆菌G-04将高效氯氰菊酯浓度降至6.81 mg/L,降解率达83.86%;蜡样芽胞杆菌Q-7将高效氯氰菊酯浓度降至12.32 mg/L,降解率达70.81%。说明两株菌均能高效降解高效氯氰菊酯,且两菌株生长量与其降解性能呈正相关。相对于四种拟除虫菊酯类农药混合体系,菌株Q-7和G-04对以高效氯氰菊酯为底物的单农药体系降解率分别提高了22.50%和16.92%,说明蜡样芽胞杆菌Q-7和地衣芽孢杆菌G-04在单农药、低浓度的降解体系中表现出更强的降解能力。
3 结论
从菜园耕作层土壤中分离纯化出可同时有效降解高效氯氰菊酯、氰戊菊酯、氯菊酯、联苯菊酯的菌株Q-7和菌株G-04,通过形态学观察、生理生化实验及16S rRNA序列分析,菌株Q-7鉴定为蜡样芽胞杆菌(Bacilluscereus),菌株G-04鉴定为地衣芽孢杆菌(Bacilluslicheniformis)。两菌株均具有拟除虫菊酯类农药降解的广谱性,其中蜡样芽胞杆菌Q-7和地衣芽孢杆菌G-04分别对氰戊菊酯、高效氯氰菊酯有较好的降解效果,两菌株均具备同时有效降解高效氯氰菊酯、氰戊菊酯、氯菊酯及联苯菊酯的能力。在只含高效氯氰菊酯的降解体系中,蜡样芽胞杆菌Q-7和地衣芽孢杆菌G-04的菌体生长量与降解作用呈正相关,对高效氯氰菊酯的降解能力优于混合拟除虫菊酯类农药降解体系。综上,分离得到的蜡样芽胞杆菌Q-7和地衣芽孢杆菌G-04具有较好的拟除虫菊酯类农药降解性能及应用潜能,为受该类农药污染的农耕地、水体等区域的生物修复提供了菌株资源。
[1]Tripathi G,Verma P.Fenvalerate-induced changes in a catfish,clarias batrachus:Metabolic enzymes,RNA and protein[J].Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology,2004,138(1):75-79.
[2]王兆守,李顺鹏.拟除虫菊酯类农药微生物降解研究进展[J].土壤,2005,37(6):577-580.
[3]González-Rodríguez R M,Rial-otero R,Cancho-grande B,et al.Occurrence offungicide and insecticide residues in trade samples of leafy vegetables[J].Food Chemistry,2008,107(3):1342-1347.
[4]Wolansky M J,Harrill J A.Neurobehavioral toxicology of pyrethroid insecticides in adult animals:A critical review[J]. Neurotoxicology and Teratology,2008,30(2):55-78.
[5]乔润香,彭星星,钟国华,等.拟除虫菊酯类农药微生物降解研究现状与方向[C]//成卓敏主编.植物保护与现代农业-中国植物保护学会2007年学术年会论文集.北京:中国农业科学技术出版社,2007:721-724.
[6]Singh B K,Walker A.Microbial degradation of organophosphorus compounds[J].FEMS Microbiology Reviews,2006,30(3):428-471.
[7]张琛,王圣惠,闫艳.高效氯氰菊酯降解菌CH7的分离鉴定及降解条件的优化[J].生物技术通报,2010(1):99-102.
[8]Zhang C,Jia L,Wang S H,et al.Biodegradation of beta-cypermethrin by twoSerratiaspp. with different cell surface hydrophobicity[J].Bioresource Technology,2010,101(10):3423-3429.
[9]Tallur P N,Megadi V B,Ninnekar H Z.Biodegradation of Cypermethrin byMicrococcussp. Strain CPN 1[J].Biodegradation,2008,19(1):77-82.
[10]Zhang W J,Rui W Y,Tu C,et al.Responses of soil microbial community structure and diversity to agricultural deintensification[J].Pedosphere,2005,15(4):440-447.
[11]Malony S E,Maule A,Smith A R W.Transformation of synthetic pyrethroid insecticides by a thermophilicBacillussp[J]. Arch Microbiol,1992,158:282-286.
[12]林淦.阴沟肠杆菌w10j15中拟除虫菊醋类杀虫剂降解酶的酶学性质研究[D].福州:福建农林大学,2004.
[13]虞云龙,宋凤鸣,郑重,等.一株广谱性农药降解菌的分离与鉴定[J].浙江大学学报:农业与生命科学版,1997,23(2):111-115.
[14]Tang J,Yao K,Liu S L,et al.Biodegradation of 3-phenoxybenzoic acid by a novelSphingomonassp. SC-1[J]. Fresenius Environmental Bulletin,2013,22(5a):1564-1572.
[15]唐洁,曾朝懿,张庆,等.氯氰菊酯降解菌的分离鉴定及其降解底物谱研究[J].食品科学,2014,35(11):160-163.
[16]Hashem F H,Mao E M.Isolation and identification of pyethroid insecticides-degrading bacteria from soil[J].Annals of Agricultural Science,1999,44(1):123-137.
[17]Chen S H,Hu Q B,Hu M Y,et al.Isolation and characterization of a fungus able to degrade pyrethroids and 3-phenoxybenzaldehyde[J].Bioresource Technology,2011,102(17):8110-8116.
[18]Grant R J,Daniell T J,Betts W B.Isolation and identification of synthetic pyrethroid-degrading bacteria[J].Journal of Applied Microbiology,2002,92(3):534-540.
[19]Guo P,Wang B Z,Hang B J,et al.Pyrethroid-degradingSphingobiumsp. JZ-2 and the purification and characterization of a novel pyrethroid hydrolase[J].International Biodeterioration & Biodegradation,2009,63:1107-1112.
[20]史颖,唐洁,姚开,等.氰戊菊酯降解菌的筛选与鉴定及其降解条件优化[J].食品工业科技,2016,37(2):217-222.
[21]布坎南R E,吉本斯N E.伯杰细菌鉴定手册[M].第8版.中国科学院微生物研究所《伯杰细菌鉴定手册》翻译组,译.北京:科学出版社,1984:729-732.
[22]赵裕栋,周俊,何璟.土壤微生物总DNA提取方法的优化[J].微生物学报,2012,52(9):1143-1150.
[23]倪桂萍,王延平,王华田,等.杨树人工林土壤细菌DNA的提取与扩增[J].山东大学学报,2013,48(5):23-28.
[24]叶光斌,罗慧波,杨晓东,等.基于免培养法研究泸州地区浓香型白酒窖泥原核微生物群落结构[J].食品科学,2013,34(17):176-181.
[25]王振雄,徐毅,周培瑾.嗜盐碱古生菌新种的系统分类学研究[J].微生物学报,2000,40(2):115-120.
[26]Banerjee A,Ghoshal A K.Biodegradation of phenol by calcium-alginate immobilized @@Bacilluscereusin a packed bed reactor and determination of the mass transfer correlation[J]. Journal of Environmental Chemical Engineering,2016,4(2):1523-1529.
[27]Cui H Y,Li W,Li C Z,et al.Intelligent release of cinnamon oil from engineered proteoliposome via stimulation ofBacilluscereusprotease[J].Food Control,2016,67:68-74.
[28]Chen Z,Pan X H,Chen H,et al.Biomineralization of Pb(II)into Pb-hydroxyapatite induced byBacillucereus12-2 isolated from Lead-Zinc mine tailings[J].Journal of Hazardous Materials,2016,301:531-537.
[29]Gobi N,Malaikozhundan B,Sekar V,et al.GFP taggedVibrioparahaemolyticusDahv2 infection and the protective effects of the probioticBacilluslicheniformisDahb1 on the growth,immune and antioxidant responses in Pangasius hypophthalmus[J].Fish & Shellfish Immunology,2016,52:230-238.
[30]Shanthi S,Jayaseelan B D,Velusamy P,et al.Biosynthesis of silver nanoparticles using a probioticBacilluslicheniformisDahb1 and their antibiofilm activity and toxicity effects in Ceriodaphnia cornuta[J].Microbial Pathogenesis,2016,93:70-77.
[31]EL-Sheshtawy H S,Aiad I,Osman M E,et al.Production of biosurfactant fromBacilluslicheniformisfor microbial enhanced oil recovery and inhibition the growth of sulfate reducing bacteria[J]. Egyptian Journal of Petroleum,2015,24(2):155-162.
[32]赖文,刘书亮,赵楠,等.氯氰菊酯高效降解菌的筛选鉴定及其降解特性[J].食品科学,2012,33(21):157-163.
[33]曲杰,王海胜,史延华,等.氯氰菊酯降解菌株L12的分离鉴定及降解特性[J].微生物学报,2011,51(4):510-517.
[34]Zhang H,Zhang Y M,Hou Z G,et al.Biodegradation potential of deltamethrin by theBacilluscereusstrain Y1 in both culture and contaminated soil[J].International Biodeterioration & Biodegradation,2016,106:53-59.
[35]周亚红.聚α-氰基丙烯酸乙酯和聚甲基丙烯酸乙酯的制备、表征及其密度泛函理论研究[D].南京:南京理工大学,2004.
Isolation and identification of two pyrethroid pesticides degradation strains and research of degradative capabilities
LIU Bo,TANG Jie*,CHEN Ting-ting,SHI Ying,ZENG Lin,ZENG Chao-yi
(College of Food and Biotechnology,Xihua University,Chengdu 610039,China)
Two strains named Q-7 and G-04 capable of a broad spectrum degrading of pyrethroid pesticides were isolated from the plowlandsoil by using enrichment culture,gradient method and the determination of pyrethroid pesticides degradation rate. Based on the morphology,physio-biochemical characteristics,and 16S rRNA sequence analysis,strain Q-7 was identified asBacilluscereus,strain G-04 was identified asBacilluslicheniformis.Two strains showed a strong ability of resistance to the pesticides for growing in liquid medium which containsβ-cypermethrin,fenvalerate,permethrin and bifenthrin with a total concentration of 640 mg/L.Two strains could degradeβ-cypermethrin,fenvalerate,permethrin and bifenthrin with the initial concentration of 50 mg/L simultaneously,the degradation efficiency ofβ-cypermethrin,fenvalerate,permethrin,bifenthrin by stain Q-7 and stain G-04 respectively reached 48.31%,64.31%,33.46%,26.52% and 66.94%,45.04%,29.40%,26.40% within 72 hours. The results showed that the strain Q-7 and strain G-04 possessed capability of broad spectrum degradation of pyrethroid pesticides,could be used as good repair of pyrethroid pesticide environmental pollution microorganism resources.
pyrethroid pesticide;Bacilluscereus;Bacilluslicheniformis;biodegradation
2016-07-20
刘波(1994-),男,硕士研究生,研究方向:食品安全,E-mail:lb2tt77@163.com。
*通讯作者:唐洁(1982-),女,博士,副教授,研究方向:食品安全,E-mail:tangjie1225@mail.xhu.edu.cn。
教育部春晖计划项目(Z2015122);四川省教育厅自然科学项目(114ZB0122);西华大学人才培养重点项目(z1310525);四川省食品生物技术重点实验室开放基金(szjj2014-011)。
TS201.3
A
:1002-0306(2017)04-0214-07
10.13386/j.issn1002-0306.2017.04.032
