超声波处理对牛血清白蛋白结构和乳化性的影响
2017-03-14刘丽娟
章 开,刘丽娟
(江西省肿瘤医院,江西南昌 330029)
超声波处理对牛血清白蛋白结构和乳化性的影响
章 开,刘丽娟*
(江西省肿瘤医院,江西南昌 330029)
采用圆二色谱(CD)、聚丙烯酰胺凝胶电泳(SDS-PAGE)、8-苯胺-1-萘磺酸(ANS)荧光探针及紫外(UV)光谱研究了不同超声强度和处理时间对牛血清白蛋白(BSA)结构和乳化性的影响。结果表明:超声波处理对BSA的一级结构无明显影响,但对其二级结构、三级结构有显著影响(p<0.05)。经过超声处理后,BSA中的α-螺旋明显降低、β-折叠含量明显增加、无规则卷曲总体上无显著变化(p>0.05),β-转角含量随功率的增加而增大、随超声时间的延长先增加后减小,内源性荧光强度、表面疏水性及乳化性均随超声处理强度和时间的延长呈先增加后降低的趋势,当超声功率为240 W/cm2、超声时间为10 min时,乳化活性(EAI)和乳化稳定性(ESI)达到最大。这表明,超声波处理是一种潜在改变BSA结构与乳化性的方法,同时也为超声处理在乳化蛋白时对蛋白的改性机理提供理论依据。
牛血清白蛋白,超声波,结构特性,乳化性
牛血清白蛋白(Bovine Serum Albumin,BSA)是牛血清中的一种球状心形蛋白,包含583个氨基酸残基,分子量为66.430 ku,等电点为4.7。BSA已经成为研究蛋白质理化性质、生物学功能、蛋白质与小分子相互作用以及相关小分子体内代谢等方面的理想蛋白模型[1-3]。
超声波是频率范围在104~1012Hz之间的弹性机械波,已被广泛应用于食品、化学、生物、医学等方面,如食品杀菌、食品干燥、食品保藏、天然产物的提取以及食品生物分子的改性等[4]。超声波具有集热效应、机械作用、剪切作用和空化作用为一体的特点,可以被食品吸收从而改变蛋白质的结构和功能性质[5],如超声波处理可以提高大豆蛋白的溶解性[6,7],改善花生分离蛋白的乳化性及改变其二级和三级结构[8]等。
近年来,超声波被广泛运用于研究蛋白质的理化性质。超声波处理增加BSA的粒径,起泡性,减少自由巯基的含量[9-11]。超声处理也会改变蛋白质中色氨酸(Trp)残基环境、蛋白质分子的构象[12],金属离子的干扰,也会导致其荧光强度的降低[13]。Stathopulos等指出超声波处理能够导致蛋白质中α-螺旋向β-折叠转化,特别是本身具有大量α-螺旋结构的蛋白质[14]。早期的研究报道指出,在2 ℃超声处理BSA中的α-螺旋含量将会增加;而将超声过程的温度控制在85 ℃时,α-螺旋含量则显著降低[15]。超声波也应用于其他蛋白性质的研究,如 Chen等采用超声结合酶解的方法对大豆蛋白进行处理提高了其乳化性[16],Li等研究了多频能量的超声波促进大米蛋白的水解作用[17],超声波还可促进蛋白质的糖基化反应从而改善蛋白质的功能性质[18-19]。本课题组前期采用氢氘交换质谱法研究了高强度控温超声处理BSA结构的变化,得到了超声处理后BSA内部结构的变化[20],也采用超声波预处理BSA,随后使其与己糖(果糖、葡萄糖、甘露糖)进行糖基化反应,实验结果表明糖基化程度有明显的提高[21]。
本文研究了BSA经过超声处理前后的结构及乳化性的变化,为进一步探讨超声处理在乳化蛋白时对蛋白的改性机理提供一定的实验基础,为充分利用BSA这一潜在资源提供一定参考。
1 材料与方法
1.1 材料与仪器
BSA(含量≥98%) 购于美国Sigma公司;8-苯胺-1-萘磺酸(ANS)、电泳Marker(14.4~97.4 ku)、三(羟甲基)氨基甲烷(Tris)、十二烷基磺酸钠(SDS)、β-巯基乙醇、甘油、溴酚蓝等 购于索莱宝试剂有限公司;所有分离用有机溶剂 均为国产分析纯。
Q700智能型超声波破碎仪 美国Misonix公司;电泳仪、凝胶成像仪 美国BIO-RAD公司;F-7000荧光光谱仪、U-3200紫外光谱仪 日本日立公司;Bio-Logic MOS 450 CD圆二色谱仪 法国Bio-Logic公司。
1.2 实验方法
1.2.1 BSA处理 用50 mmol/L,pH7.4的磷酸盐缓冲液(phosphate buffer saline,PBS)配制BSA溶液10 mg/mL,使BSA完全溶解。采用超声波破碎仪(探头尺寸1/8”=3 mm)、工作频率为20 kHz,超声脉冲工作时间5 s,间歇时间5 s。按以下方法进行超声强度和时间设计:取15 mL BSA溶液装入25 mL烧杯中,超声强度分别为0、60、90、120、180、240、300 W/cm2、在冰浴中处理5 min;取15 mL BSA溶液装入25 mL烧杯中,超声强度为90 W/cm2,超声时间分别为0、1、3、5、10、20 min对BSA样品进行处理。超声处理结束后迅速冰浴冷却,然后将超声后的样品冷冻干燥,储藏在-20 ℃待用。
1.2.2 分子量分析 参照Zhang等[8]的方法,采用12%的分离胶,5%的浓缩胶,4×上样缓冲液(含β-巯基乙醇),上样量为10 μL,低分子质量Marker(14.4~97.4 ku)。实验初始电流为8 mA/板,进入分离胶后,调整为16 mA/板,分离后取出,用考马斯亮蓝G250染色30 min,然后于7%的冰乙酸中进行脱色,直至背景清晰。
1.2.3 圆二色谱分析 BSA的二级结构采用Bio-Logic MOS 450圆二色谱仪进行测定。用PBS(50 mmol/L、pH7.4)稀释不同超声条件处理的BSA至0.2 mg/mL。参照Lucia等[22]的方法,测定条件:光径0.1 cm样品池,扫描速度100 nm/min,扫描范围190~250 nm,带宽1.0 nm。每个样品测量三次,圆二色谱的测量值用椭圆率表示(θ;degree.cm2/dmol),最终结果通过圆二在线分析软件dichroweb进行分析(http://dichroweb.cryst.bbk.ac.uk/html/process.shtml)。
1.2.4 内源性荧光测定 用F-7000荧光光谱仪测定不同处理条件对BSA荧光强度的影响。参照Lucia等[22]的方法,测定条件:激发波长为280 nm,扫描发射波长范围为30~500 nm,激发和发射的狭缝宽度均为1 nm,扫描速度为1200 nm/min,电压为400 V。
1.2.5 表面疏水性测定 采用ANS荧光探针法测定不同超声处理条件下BSA表面疏水性的变化。将蛋白样品用PBS(50 mmol/L pH7.4)倍比稀释成1、0.5、0.1、0.05、0.02 mg/mL。取2 mL稀释后的蛋白样品与20 μL 8 mmol/L ANS溶液(50 mmol/L,pH7.4)混合后,测定其荧光强度。测定条件:激发波长为380 nm,发射波长为400~500 nm,扫描速度为1200 nm/min,激发和发射的狭缝宽度均为2.5 nm,电压为400 V。以蛋白浓度(mg/mL)为横坐标,荧光强度为纵坐标作图,采用线性回归分析进行曲线拟合,曲线的斜率即为蛋白样品的表面疏水性(H0)[20]。
1.2.6 乳化性测定 乳化性测定依据Jamdar等人的方法[23],并稍作改动。取大豆油10 mL与30 mL浓度为1 mg/mL 的BSA溶液混合,然后用分散机以转速10000 r/min分散2 min。分散结束后,立刻(0 min)从得到的溶液底部取50 μL乳浊液加至5 mL的0.1% SDS溶液中,混匀,在波长为500 nm处测定吸光值。10 min后,再从得到的溶液底部取50 μL乳浊液加至5 mL的0.1% SDS溶液中,混匀,测定吸光值。0 min时的吸光值为A0,10 min时的吸光值为A10,乳化性(EAI)和乳化稳定性(ESI)的计算公式如下:
式中:A0指乳化后迅速被稀释的乳化液的吸光度;m指蛋白质量浓度(g/mL);ΔA=A0-A10,A10指乳化液在静置10 min后的吸光度,Δt=10 min。
1.2.7 数据统计与分析 所有实验重复3次,所得实验数据采用Origin7.5软件作图,SPSS17.0软件进行显著性分析(p<0.05)。
2 结果与分析
2.1 分子量分析
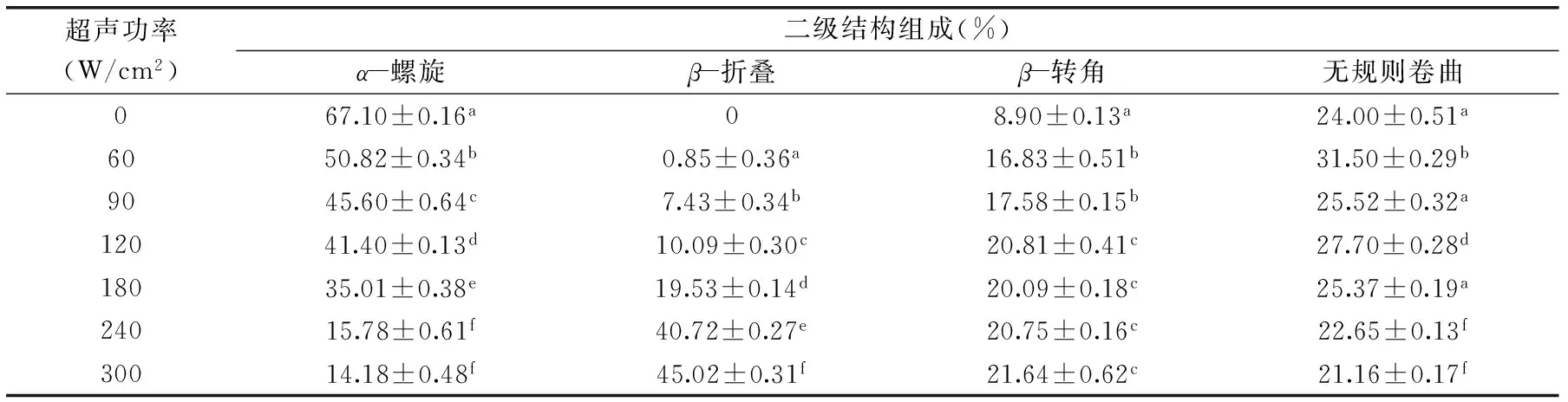
表1 超声强度对BSA二级结构各组分含量的影响(%)Table 1 Effect of ultrasound power on the content(%)of BSA secondary structure
注:实验结果以平均值±标准偏差表示(n=3),同列不同小写字母代表具有显著性差异(p<0.05),超声时间为5 min;表2同。
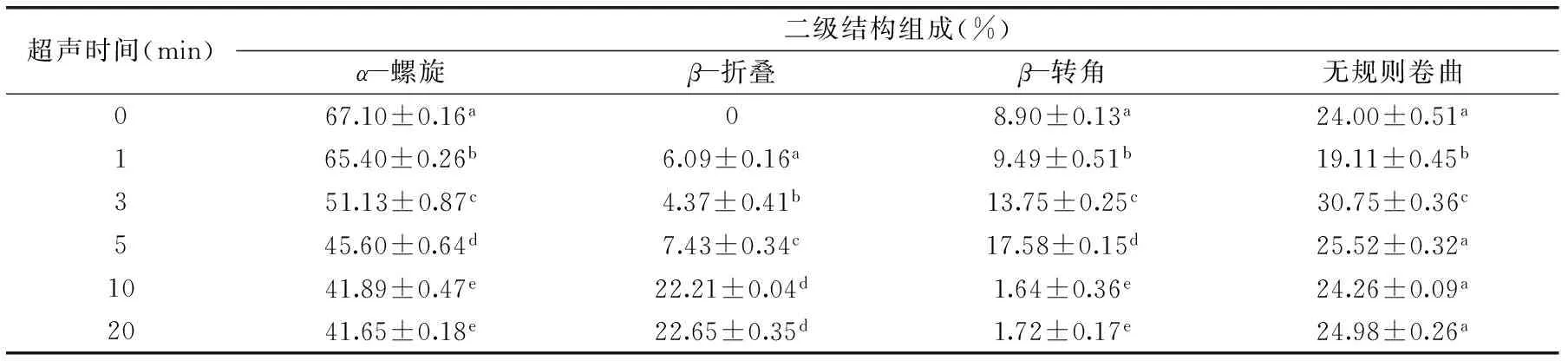
表2 超声时间对BSA二级结构各组分含量的影响(%)Table 2 Effect of ultrasound time on the content(%)of BSA secondary structure
注:超声功率为90 W/cm2。
图1为超声处理对BSA分子量的影响,BSA由583个氨基酸组成,分子量为66.43 ku。与未处理的BSA相比,经超声处理的样品电泳条带无明显变化,实验表明BSA分别在超声时间为5 min处理0~300 W/cm2,超声功率为90 W/cm2处理0~20 min的条件下,BSA的分子量不会发生明显改变。
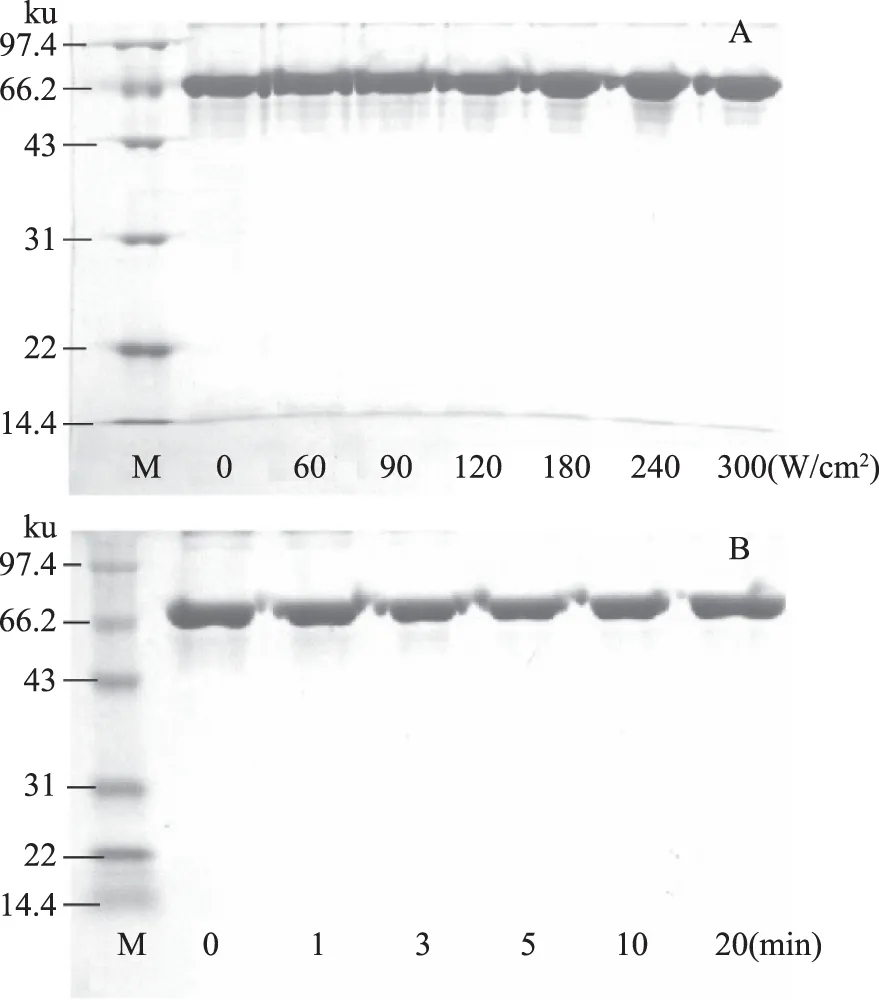
图1 超声处理对BSA分子量的影响Fig.1 The molecular weight of BSAin different ultrasound power
2.2 圆二色谱分析
Bio-Logic MOS 450圆二色谱仪可以用来测定BSA二级结构中各组分的含量,解析超声波对BSA二级结构的影响。由表1可知,超声波功率对BSA二级结构有较大影响,其中β-折叠、β-转角随处理强度的延长呈增加的趋势,而α-螺旋呈显著下降的趋势,含量从67.10%±0.16%下降到14.18%±0.48%。当超声功率为300 W/cm2、超声时间为5 min时,β-折叠含量到达45.02%±0.31%。随着超声波功率的增加,BSA的β-转角含量从8.90%±0.13%增加到21.64%±0.62%,无规则卷曲含量有先增加后减小的趋势,总体上无显著变化。
由表2可知,超声时间对BSA二级结构有较大的影响,其中α-螺旋呈显著下降的趋势,其含量从67.10%±0.16%下降到41.65%±0.18%;β-折叠随处理时间的延长呈增加的趋势,当超声功率为90 W/cm2、超声时间为20 min时β-折叠含量到达22.65%±0.35%;β-转角含量呈先增加后减小的趋势,超声时间10 min后其含量降低至1.64%±0.36%;无规则卷曲含量总体上无显著变化。这可能是由于超声波处理会破坏维持BSA高级结构的次级键(如氢键、静电相互作用、范德华力),从而导致结构展开,β-折叠含量增加。总体而言,经过超声处理后,α-螺旋明显降低,β-折叠含量明显增加,β-转角含量普遍先增加后减小,无规则卷曲总体上无显著变化,初步认为超声具有使α-螺旋向β-转角和β-折叠转化的趋势,这与Liu等研究的结果趋势一致[12]。
2.3 内源性荧光分析
内源荧光光谱是检测BSA三级结构的常用方法。BSA的内源荧光主要来源于色氨酸(Trp),而荧光基团苯丙氨酸(Phe)和酪氨酸(Tyr)具有很低的量子产率,同时受到周围氨基酸残基的完全猝灭作用,导致Phe和Tyr对荧光的贡献非常小[20],因此可以用Trp残基作为BSA的内源荧光探针来分析蛋白结构的变化。图2为不同条件超声波处理对BSA内源性荧光强度的影响。由图2(A)可知,超声时间为5 min时随着超声功率的增加,荧光强度呈先增大后降低的趋势,在超声功率为90 W/cm2荧光强度达到最大,说明此时超声功率使BSA中的Trp残基暴露于蛋白表面,致使其荧光强度增加。由图2(B)可知,超声功率为90 W/cm2时BSA的荧光强度随超声时间的延长,呈先增大后降低的趋势,超声时间3 min时BSA的荧光强度达到最大。这可能是由于BSA的电场作用使蛋白质的静电相互作用、氢键、疏水相互作用等发生变化,紧密的立体结构变得松散,BSA中的两个Trp残基(Trp134和Trp213残基)更多的暴露于极性环境中,从而荧光强度增加。而随着处理功率和时间继续延长,荧光强度呈降低的趋势,这可能是因为超声功率的增大和超声时间的延长使BSA重新通过非共价键作用发生了部分折叠,暴露在蛋白表面的Trp134和Trp213残基再次被掩埋到分子内部,致使BSA的内源性荧光强度降低。由图2可以看出BSA最大发射波长并没有发生明显的红移或蓝移,表明本实验的BSA处理仅使蛋白结构发生了部分的展开或者折叠,并没有使其结构发生较大的改变。
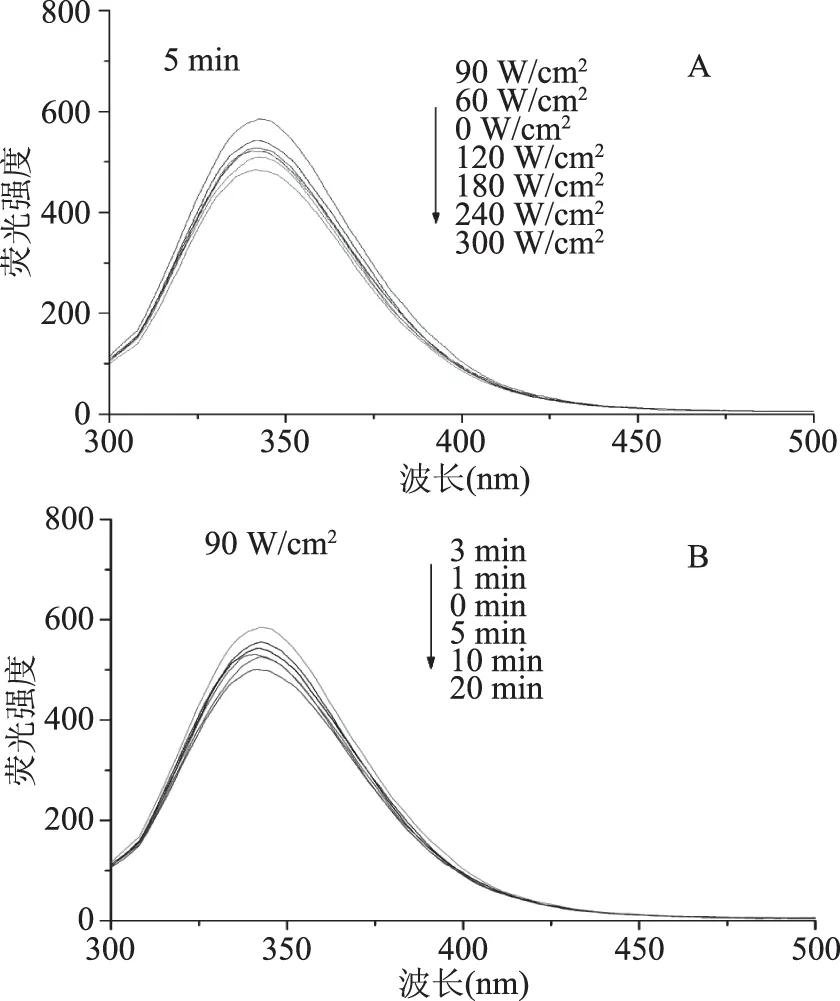
图2 超声波处理对BSA内源性荧光强度的影响Fig.2 The intrinsic fluorescence intensity(A.U)of BSA in different ultrasound power
2.4 表面疏水性分析
蛋白质的表面疏水性(H0)是蛋白质表面与极性水溶液环境接触的疏水基团数量的参数。如图3所示为未经超声处理的BSA以及超声处理后的BSA通过荧光发射光谱表现出来的表面疏水性。图3(A)所示,超声时间为5 min,不同超声功率对BSA表面疏水性分析的影响,与未超声的BSA相比,超声处理后BSA的H0显著增强。BSA的相对荧光强度随超声功率的增加先增加后减小,在超声功率为240 W/cm2、超声时间为5 min时H0达到最大;图3(B)为超声功率为90 W/cm2,不同超声时间对BSA H0值的影响,与未超声的BSA相比,超声处理后BSA的H0增强。随着超声时间的增加,H0先增加后减小,在超声功率90 W/cm2、超声时间为10 min时H0达到最大,但超声时间为3 min与5 min时,BSA的H0值无显著变化。实验表明:与未处理的BSA的H0相比,超声后的H0均增加,不同的超声波处理条件下,BSA的H0增加程度不同。H0值的显著增加很有可能是因为原来埋藏在BSA内部的疏水区域更多的暴露于蛋白质表面[8],也可能是蛋白质分子发生折叠或伸展有关,当蛋白折叠时,其表面疏水性降低;当蛋白伸展时,表面疏水性增加[24]。本实验结果表明随超声功率的增大、超声时间的延长,BSA的表面疏水性表现出先增强后有减弱的趋势。
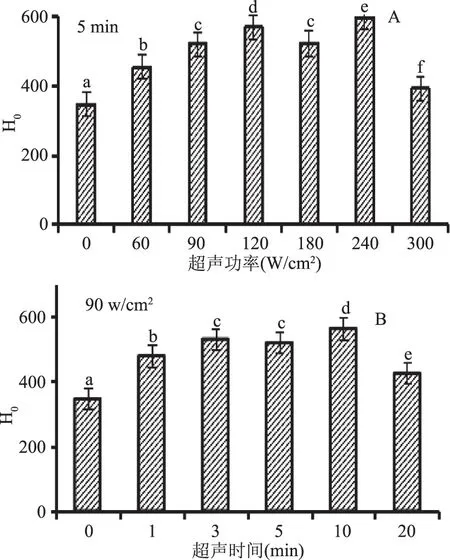
图3 超声波处理对BSA表面疏水性的影响Fig.3 The surface hydrophobicity of BSA in different ultrasound power
2.5 乳化性分析
乳化性表示单位质量蛋白质的界面稳定性,用以描述蛋白质溶液与油/水形成乳化液的界面性能。食品中蛋白质的乳化性一般通过乳化活性(EAI)和乳化稳定性(ESI)来评价。图4(A)为超声时间5 min,不同的超声功率对BSA溶液的乳化性和乳化稳定性的影响。结果表明,随超声功率的增加,EAI和ESI显著增加后又降低,当超声功率60~120 W/cm2时,ESI无显著变化,达到240 W/cm2时,EAI、ESI值达到最大。这可能是由于超声的作用使蛋白分子的空间结构被破坏,使蛋白分子部分展开,结构变得疏松,更多的分子聚集到油-水界面上,也可能是超声波产生的瞬时高温改变蛋白质的粒度、溶解性等[25],从而提高了蛋白的乳化性,但功率增大时乳化性能有所下降,这可能是因为超声强度过大,蛋白质变性增大,造成了蛋白质的聚集[7,16]。
图4(B)为超声功率90 W/cm2,不同的超声时间对BSA溶液的乳化性和乳化稳定性的影响,结果显示:随超声时间的延长,EAI、ESI值呈递增趋势,当超声时间为10 min时,EAI、ESI值达到最大,但总体变化不显著。这可能是在一定超声时间范围内,蛋白质结构变得疏松,可溶性蛋白含量增加,乳化活性和乳化稳定性从而增强,但当超声时间过长,蛋白质变性增大,不溶性蛋白质含量增多,乳化活力及乳化稳定性随之降低[26]。此外,蛋白质的乳化性与其表面疏水性存在着正相关的关系[8],当超声时间为5 min、超声强度逐渐增大至240 W/cm2和超声强度90 W/cm2、超声时间逐渐延长至10 min时,蛋白质的表面疏水性均达到最大,促使蛋白质分子与水形成油-水界面膜,但随着超声强度与时间的增加使得蛋白质表面疏水性降低,使蛋白质分子与水不易形成油-水界面膜,从而使得蛋白质乳化性能降低。结果表明:与未处理的BSA乳化性相比,超声后的乳化性均呈现增加的趋势,BSA随超声处理强度的增大、处理时间的延长,其EAI值和ESI值表现出先增强后减弱的趋势。
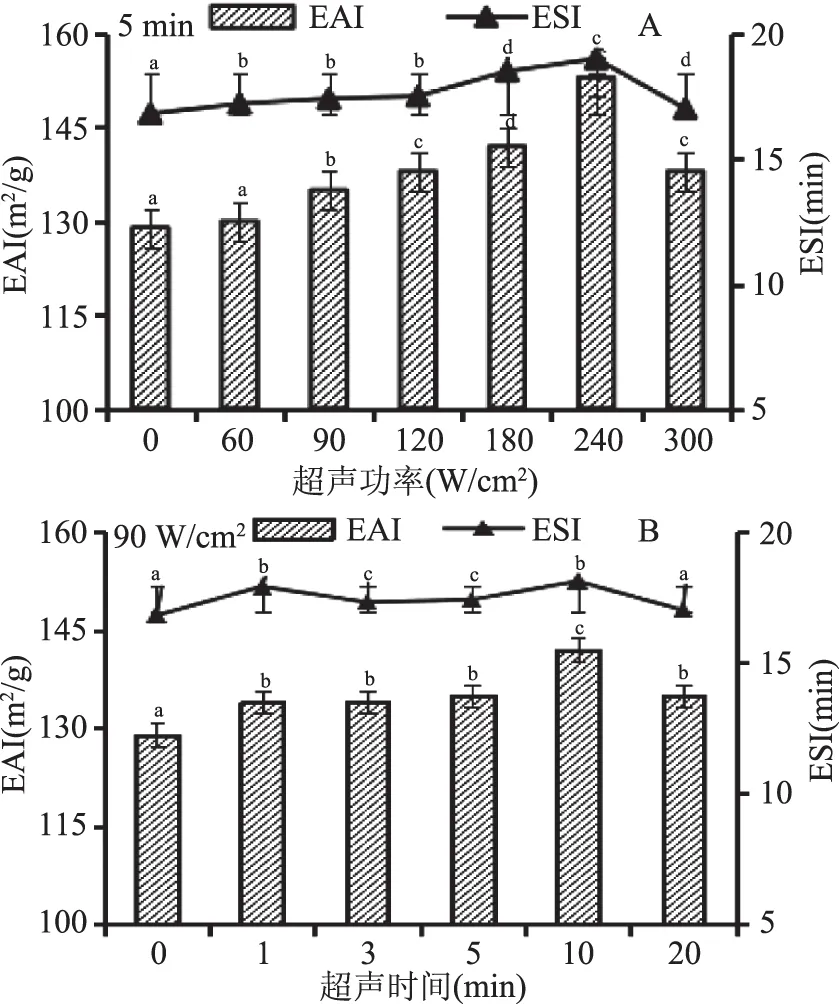
图4 超声波处理对BSA乳化性和乳化稳定性的影响Fig.4 The emulsifying properties(EAI and ESI)of BSA in different ultrasound power注:A为超声功率,B为超声时间。
3 结论
超声处理对BSA的一级结构无显著影响,而对其二、三级结构有显著影响。经超声处理后的BSA,α-螺旋含量显著降低,β-转角与β-折叠含量增加,说明超声作用可使分子内部氢键的排列取向发生改变,使多肽链中α-螺旋结构伸展而变成线性结构,而无规则卷曲则可能是因其柔性更大,受超声作用的影响不大,所以含量无显著变化。经超声处理后的BSA内源荧光强度、表面疏水性及乳化活性与未超声处理的BSA相比,均显著增加,其趋势先增加后减小,这些变化说明超声作用引起了蛋白分子构象的变化,可能是因为超声诱导蛋白质三级结构发生展开,从而引起原来埋藏在蛋白质内部的疏水基团更多地暴露于蛋白质表面;也可能是超声作用影响了蛋白质的二级结构,从而破坏其紧密结构,导致蛋白质的乳化性增加。结果表明:超声波为改性蛋白质的结构提供了一种有效的方法,超声波改变蛋白质的结构,从而改善蛋白质的乳化性。这为进一步探讨超声处理在乳化蛋白时对蛋白的改性机理提供一定的理论基础。
[1]Ojha B,Das G. The interaction of 5-(alkoxy)naphthalen-1-amine with bovine serum albumin and its effect on the conformation of protein[J]. The Journal of Physical Chemistry B,2010,114(11):3979-3986.
[2]Ni Y,Wang S,Kokot S. Spectrometric study of the interaction between Alpinetin and bovine serum albumin using chemometrics approaches[J]. Analytica Chimica Acta,2010,663(2):139-146.
[3]Zhang X,Li L,Xu Z,et al. Investigation of the interaction of naringin palmitate with bovine serum albumin:spectroscopic analysis and molecular docking[J]. Plos One,2013,8(3):e59106.
[4]Song X,Zhou C,Fu F,et al. Effect of high-pressure homogenization on particle size and film properties of soy protein isolate[J]. Industrial Crops and Products,2013,43:538-544.
[5]Jeantet R,Baron F,Nau F,et al. High intensity pulsed electric fields applied to egg white:effect on Salmonella enteritidis inactivation and protein denaturation[J]. Journal of Food Protection®,1999,62(12):1381-1386.
[6]Legay M,Gondrexon N,Le Person S,et al. Enhancement of heat transfer by ultrasound:review and recent advances[J]. International Journal of Chemical Engineering,2011.
[7]Hu H,Wu J,Li-Chan E C,et al. Effects of ultrasound on structural and physical properties of soy protein isolate(SPI)dispersions[J]. Food Hydrocolloids,2013,30(2):647-655.
[8]Zhang Q,Tu Z,Xiao H,et al. Influence of ultrasonic treatment on the structure and emulsifying properties of peanut protein isolate[J]. Food and Bioproducts Processing,2014,92(1):30-37.
[9]Povey M J,Moore J D,Braybrook J,et al. Investigation of bovine serum albumin denaturation using ultrasonic spectroscopy[J]. Food Hydrocolloids,2011,25(5):1233-1241.
[11]郭玲,刘爱国,胡志和,等. 牛血清白蛋白的乳化和起泡特性[J]. 食品科学,2010(19):137-140.
[12]刘斌,马海乐,李树君,等. 应用 FTIR 研究超声对牛血清白蛋白二级结构的影响[J]. 光谱学与光谱分析,2010(8):2072-2076.
[13]陈芳,陈妍,张彦峥,等. 牛血清白蛋白的荧光稳定性研究[J]. 应用化工,2011,40(9):1508-1511.
[14]Stathopulos P B,Scholz G A,Hwang Y M,et al. Sonication of proteins causes formation of aggregates that resemble amyloid[J]. Protein Science,2004,13(11):3017-3027.
[16]Chen L,Chen J,Ren J,et al. Effects of ultrasound pretreatment on the enzymatic hydrolysis of soy protein isolates and on the emulsifying properties of hydrolysates[J]. Journal of Agricultural and Food Chemistry,2011,59(6):2600-2609.
[17]Li S,Yang X,Zhang Y,et al. Effects of ultrasound and ultrasound assisted alkaline pretreatments on the enzymolysis and structural characteristics of rice protein[J]. Ultrasonics Sonochemistry,2016,31:20-28.
[18]De Castro M L,Priego-Capote F. Ultrasound-assisted crystallization(sonocrystallization)[J]. Ultrasonics Sonochemistry,2007,14(6):717-724.
[19]Villamiel M,Verdurmen R,Jong P D. Degassing of milk by high-intensity ultrasound[J]. Milchwissenschaft,2000,55(3):123-125.
[20]Zhang Q,Tu Z,Wang H,et al. Structural changes of ultrasonicated bovine serum albumin revealed by hydrogen-deuterium exchange and mass spectrometry[J]. Analytical and Bioanalytical Chemistry,2014,406(28):7243-7251.
[21]Zhang Q,Tu Z,Wang H,et al. Improved glycation after ultrasonic pretreatment revealed by high-performance liquid chromatography-linear Ion trap/orbitrap high-resolution mass spectrometry[J]. Journal of Agricultural and Food Chemistry,2014,62(12):2522-2530.
[22]de la Hoz L,Netto F M. Structural modifications ofβ-lactoglobulin subjected to gamma radiation[J]. International Dairy Journal,2008,18(12):1126-1132.
[23]Jamdar S N,Rajalakshmi V,Pednekar M D,et al. Influence of degree of hydrolysis on functional properties,antioxidant activity and ACE inhibitory activity of peanut protein hydrolysate[J]. Food Chemistry,2010,121(1):178-184.
[24]Wang X,Tang C,Li B,et al. Effects of high-pressure treatment on some physicochemical and functional properties of soy protein isolates[J]. Food Hydrocolloids,2008,22(4):560-567.
[25]Yu J,Ahmedna M,Goktepe I. Peanut protein concentrate:Production and functional properties as affected by processing[J]. Food Chemistry,2007,103(1):121-129.
[26]Jambrak A R,Lelas V,Mason T J,et al. Physical properties of ultrasound treated soy proteins[J]. Journal of Food Engineering,2009,93(4):386-393.
Effect of ultrasound treatment on structure and emulsibilities of bovine serum albumin
ZHANG Kai,LIU Li-juan*
(Tumor Hospital of Jiangxi Province,Nanchang 330029,China)
The effect of ultrasound treated power and time on the structure and emulsibilities of bovine serum albumin(BSA)was studied by CD spectra,SDS-PAGE,ANS fluorescence probe emission spectra and UV absorption spectra. The results showed that ultrasound treatment had no significant influence on primary structure of BSA. However,it had a significant effect on secondary structure,tertiary structure. The content ofα-helix were decreased. The content ofβ-sheet was increased. The content ofβ-turn firstly increased and then decreased with the increasing of ultrasound treatment,unordered had no significant change. Intrinsic fluorescence intensity,surface hydrophobicity and emulsibility were firstly increased and then decreased with the increasing of ultrasound treated power and time. The EAI and ESI of BSA reached the maximun when it was treated at 240 W/cm2for 10 min. It indicated that the ultrasound treatment would become a potential method for changing structure and emulsibilities of BSA. Meanwhile,when protein was emulsified by ultrasound treatment,it also provide a theoretical basis for the study of the mechanism of ultrasonic modification of protein.
bovine serum albumin;ultrasound;structure property;emulsibility
2016-07-20
章开(1991-),女,硕士研究生,研究方向:药品食品分析,E-mail:jun898989@foxmail.com。
*通讯作者:刘丽娟(1979-), 女,博士,副主任药师,研究方向:药品研发,E-mail:liu_lijuanpharm@163.com。
国家自然科学基金项目(81260337)。
TS201.2
A
:1002-0306(2017)04-0116-06
10.13386/j.issn1002-0306.2017.04.014
