内蒙古不同种源山杏杏仁中苦杏仁苷含量差异分析
2017-03-14段国珍白淑兰叶冬梅薛海峰平贵臣白玉娥
段国珍,白淑兰,叶冬梅,林 涛,薛海峰,平贵臣,白玉娥,*
(1.内蒙古农业大学林学院,内蒙古呼和浩特 010019;2.内蒙古农业大学理学院,内蒙古呼和浩特 010019)
内蒙古不同种源山杏杏仁中苦杏仁苷含量差异分析
段国珍1,白淑兰1,叶冬梅1,林 涛1,薛海峰1,平贵臣2,白玉娥1,*
(1.内蒙古农业大学林学院,内蒙古呼和浩特 010019;2.内蒙古农业大学理学院,内蒙古呼和浩特 010019)
采用高效液相色谱法(HPLC),对内蒙古7个种源山杏杏仁中苦杏仁苷的含量进行差异性分析。结果表明:不同种源山杏杏仁中苦杏仁苷的含量存在显著差异(p<0.05);7个种源苦杏仁苷平均含量为5.43%,平均含量范围为4.34%~6.25%;平均变异系数为0.07,扎鲁特旗种源的变异系数较其它种源大;苦杏仁苷含量与经纬度呈极显著负相关,相关系数分别为0.806、0.722,与海拔呈极显著正相关(0.896);聚类分析将7个种源划分为2类。该研究结果为内蒙古地区山杏的深加工以及利用提供理论依据。
内蒙古,种源,杏仁,苦杏仁苷,差异分析
山杏(PrunusarmeniacaL varansuMaxim),为蔷薇科(Rosaceae)植物,是一种重要生态经济型树种,主要分布于我国东北三省、晋冀鲁以及内蒙古等省市自治区[1]。山杏干燥的成熟种子通常称为杏仁[2]。杏仁除了正常食用外,还有较高的营养价值和药用功效,常见的杏仁中约含有49.6%脂肪与27.0%的蛋白质[3],以及约为2%~4.4%[4-7]的苦杏仁苷。其中苦杏仁苷是生氰苷的一种,广泛存在于山杏、桃、李子、苹果、山楂等植物种子中[8]。
目前苦杏仁苷已成为医药上常用的祛痰止咳剂、辅助性抗癌药物[9],并具有明确的生理、药理活性,如止咳平喘[10]、抗溃疡[11]、调节免疫[12]、抗炎[13]等作用。苦杏仁苷的提取主要有水提法和乙醇提取法,但通常采用乙醇回流提取,提取率较高,提取杂质较少[14]。苦杏仁苷的检测方法种类较多,如高效液相色谱法(HPLC)、薄层扫描法、紫外分光光度法、银量法、毛细管电泳色谱法等[15],其中HPLC法分离效率高,分析速度快,结果较准确,现已成为有机物定性定量分析研究的主要方法[16]。
内蒙古是我国北方山杏天然林的主要分布区,该地区地域辽阔,生态环境多样,山杏种质资源丰富[17],杏仁中苦杏仁苷的含量也高于其他地方[9],但目前对内蒙古地区山杏的研究大多为丰产、造林、优良单株的选择等,对杏仁的开发利用多停留在大众型小食品的开发上,精加工产品甚少,而苦杏仁苷的开发作为精加工的一个重要部分,具有很好的前景[18]。本文采用HPLC法[19]对内蒙古7个种源山杏杏仁中苦杏仁苷含量进行测定,并对其进行差异性分析,筛选山杏杏仁中苦杏仁苷含量较高的种源,并初步分析造成苦杏仁苷含量差异的原因,该研究可为内蒙古山杏仁的产业提供理论依据以及实践基础。
1 材料与方法
1.1 材料与仪器
山杏果实 样品于2015年7月采自内蒙古地区7个种源,每个种源选取5个群体,群体间距离不小于5 km2,每个群体随机采摘10株山杏并利用GPS定点,共采摘350株山杏单株,每株随机采摘500 g果实,去掉果肉编号将杏核带回实验室,置于4 ℃冰箱保存备用,内蒙古7个山杏种源生态环境因子见表1;苦杏仁苷标准品(批号:MUST-14092808) 中国科学院成都生物研究所;石油醚(沸程60~90 ℃) 分析纯,天津市光复科技发展有限公司;无水乙醇 分析纯,天津市富宇精细化工有限公司;甲醇(色谱纯) 天津康巢生物医药有限公司;水 为超纯水。
日立L-7420高效液相色谱仪 日立(中国)有限公司;SHZ-Ⅲ型循环水真空泵 上海亚荣生化仪器厂;UV-2800紫外分光光度计 北京普析通用仪器有限公司;DHG-9140A鼓风干燥箱 上海一恒科学仪器有限公司;KQ-500DE型医用数控超声波清洗仪 昆山市超声仪器有限公司;0.45 μm系微孔滤膜 上海密粒膜分离有限公司;CP124S电子分析天平 北京赛多利斯仪器系统有限公司。
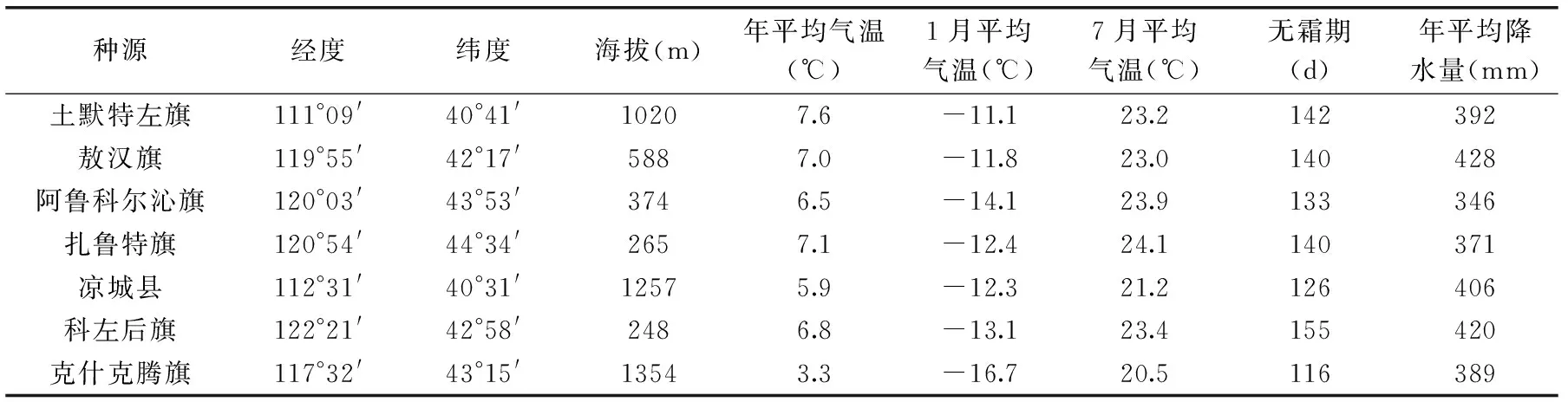
表1 内蒙古7个山杏种源生态环境因子Table 1 Ecological environment factors of 7 Apricot provenances
1.2 苦杏仁苷的提取与测定
1.2.1 苦杏仁苷的提取 每株山杏随机选择50颗杏核敲开取出杏仁,将杏仁用清水浸泡2 h,除杂,去皮,置于鼓风干燥箱中,80 ℃烘干2 h,灭酶,研磨过20目筛[20]。称取杏仁粉末2 g,置于30 mL石油醚中浸泡24 h,进行脱脂处理,将处理后的杏仁粉用100 mL 85%的乙醇于80 ℃下超声(40 kHz)40 min,用0.45 μm的微滤膜过滤,滤液保存备用。
1.2.2 苦杏仁苷的测定
1.2.2.1 色谱条件 色谱柱:E2414267(250 mm×4.6 mm,依利特SinoChrom ODS-BP反相键合色谱柱);流动相:甲醇∶水=20∶80(v/v);流速:1.0 mL/min;柱温:25 ℃;检测波长:210 nm(紫外分光光度计测标准溶液在210 nm处峰值最高);进样量:20 μL。
1.2.2.2 标准溶液的配制及测定 准确称取40 mg苦杏仁苷标准品移入10 mL容量瓶,超纯水溶解定容,得到的4 mg/mL标准溶液依次稀释配成浓度0.4、0.8、1.2、1.6、2 mg/mL的标准溶液,保存备用。将不同浓度的标准溶液与处理好的样品溶液分别依次进样三次,记录峰面积。
1.3 数据统计与分析方法
所有的数据统计及计算均使用Microsoft Excel 2013软件,使用IBM SPSS Statistics 19.0 进行方差分析和相关性分析,使用软件Origin Pro 8绘制高效液相色谱图,使用软件CANOCO 4.5进行冗余分析(redundancy analysis,RDA)。
2 结果与分析
2.1 标准曲线绘制
按照1.2.2所述色谱条件将不同浓度对照品溶液进样测定,将所得峰面积和浓度进行线性回归分析,回归方程为y=1×107x-15836(R2=0.9987),式中x为浓度,y为峰面积,苦杏仁苷浓度在0.4~2.0 mg/mL范围内,浓度与峰面积呈线性关系。
2.2 不同种源山杏杏仁中苦杏仁苷含量
2.2.1 不同种源山杏杏仁中苦杏仁苷HPLC色谱图 各样品所得峰面积取平均值,根据回归方程计算浓度,通过HPLC所测苦杏仁苷标准样品以及7个种源山杏杏仁苦杏仁苷含量的HPLC色谱图见图1~图8。
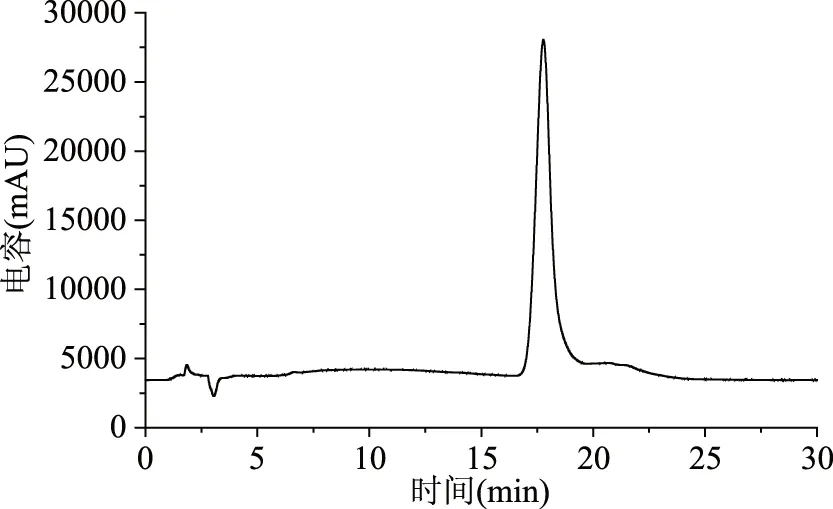
图1 苦杏仁苷标准样品HPLC色谱图Fig.1 The dimensional chromatogram of amygdalin standard samples
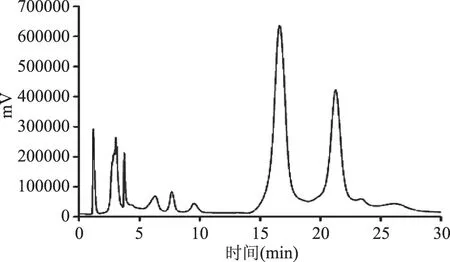
图2 土默特左旗种源苦杏仁苷HPLC色谱图Fig.2 The dimensional chromatogram in Tumotezuoqi
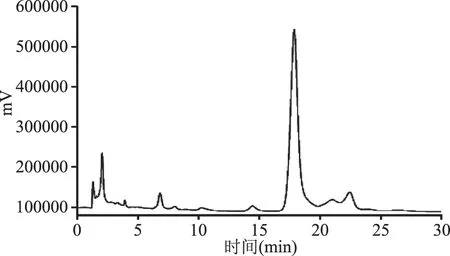
图3 克什克腾旗种源苦杏仁苷HPLC色谱图Fig.3 The dimensional chromatogram in Keshenketengqi
图4 凉城县种源苦杏仁苷HPLC色谱图Fig.4 The dimensional chromatogram in Liangcheng
图5 敖汉种源苦杏仁苷HPLC色谱图Fig.5 The dimensional chromatogram in AoHan
图6 阿鲁科尔沁旗种源苦杏仁苷HPLC色谱图Fig.6 The dimensional chromatogram in Alukeerqinqi
图7 科左后旗种源苦杏仁苷HPLC色谱图Fig.7 The dimensional chromatogram in Kezuohouqi
图8 扎鲁特旗种源苦杏仁苷HPLC色谱图Fig.8 The dimensional chromatogram in Zhaluteqi
2.2.2 苦杏仁苷含量的方差分析及变异分析 表2为7个种源共35个群体山杏杏仁中在高效液相色谱下所测含量,由表2可知,每个种源内山杏杏仁苦杏仁苷的含量较稳定,无特异群体。
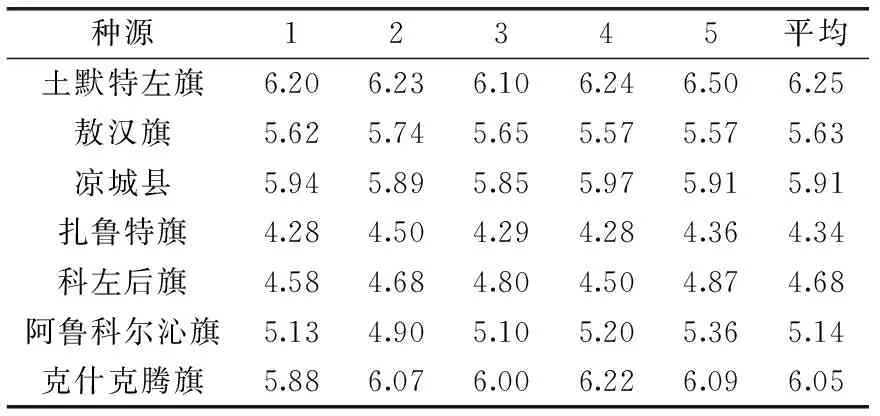
表2 不同种源5个群体山杏杏仁中苦杏仁苷含量Table 2 The amygdalin content of almond in 5 populations from different provenances
对内蒙古7个种源山杏杏仁中苦杏仁苷含量进行比较,由表3可知,在0.05的显著水平下内蒙古7个种源山杏杏仁中苦杏仁苷的含量在种源间存在显著差异。
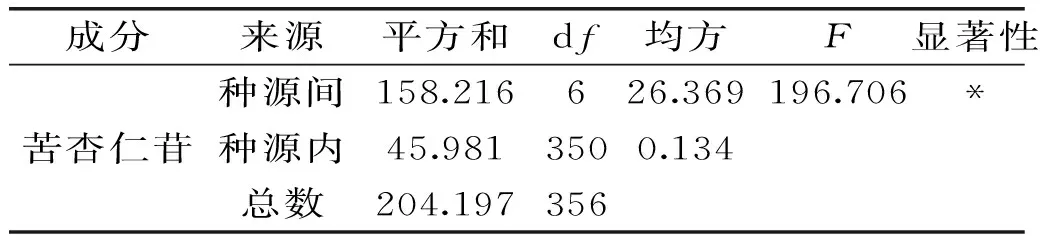
表3 内蒙古不同种源杏仁苦杏仁苷含量方差分析Table 3 Variance analysis of almond amygdalin content among provenance in Inner Mongolia
注:*代表在显著性水平为0.05上差异显著。
对7个种源山杏杏仁中苦杏仁苷的含量进行多重比较以及变异分析,由表4可知,内蒙古7个种源山杏杏仁中苦杏仁苷含量存在显著差异,平均含量为5.43%,范围为4.34%~6.25%;其中,土默特左旗种源杏仁中苦杏仁苷含量最大,为6.25%,扎鲁特旗种源苦杏仁苷含量最小,仅为4.34%,这与葛任新(5.19%)、董海荣[21](5.667%)所测结果相似。7个种源的种源间变异系数为0.07。扎鲁特旗种源杏仁中苦杏仁苷含量的变异系数最大为0.12,说明扎鲁特旗种源杏仁苦杏仁苷含量相较其它种源不稳定。苷作为不同植物的一种重要次生代谢物,影响含量因素较多,造成不同种源间苦杏仁苷含量存在差异的原因也有许多,Stoewsand猜测果核中氰化物含量可能受到品种和土壤含水量等因子的影响[22],即苦杏仁苷含量的差异可能是遗传与环境共同作用所造成的,Woodrow[23]等对两种土壤水分含量差异极大地区的桉树进行了研究,结果表明水分胁迫间接影响到了苷含量的多少,但主要影响因子还是物种差异。内蒙古地域辽阔,环境复杂,本项研究所选7个种源地分布地理跨度较大,环境条件多样,山杏为了适应其长期生长的复杂环境条件而形成特有的基因类型,种质的差异可能是造成不同种源苦杏仁中苦杏仁苷含量差异的主要因子。
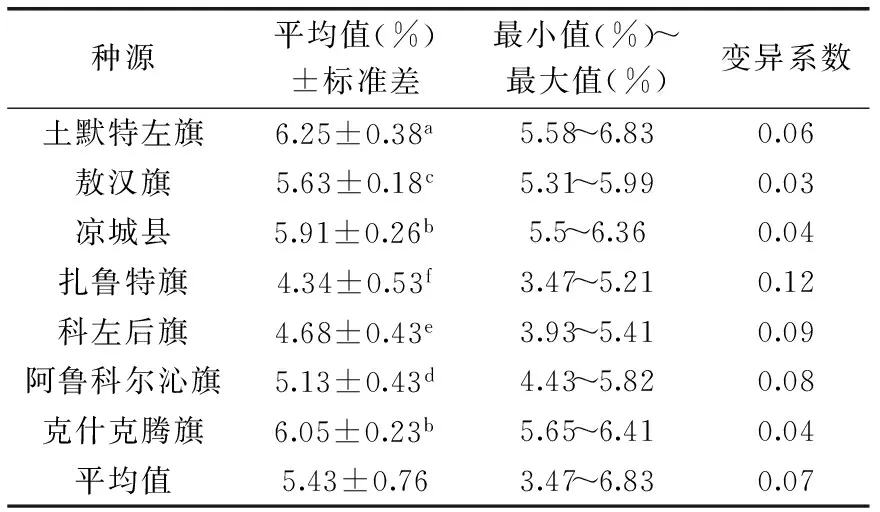
表4 苦杏仁苷含量比较Table 4 Comparison of the amygdalin content
注:小写字母为同一列Duncan grounping表示值,不同字母表示相互间差异显著,p<0.05。
2.3 苦杏仁苷含量与环境因子的相关分析
图9表示苦杏仁苷含量与环境因子的RDA分析,分析结果显示,苦杏仁苷含量与海拔、经度、纬度、7月平均气温具有显著相关性(p<0.05),其中,苦杏仁苷含量与海拔呈显著正相关(r=0.896),与经度、纬度、7月平均气温(r=0.806、0.722、0.673)呈显著负相关;苦杏仁苷含量与无霜期、年平均温度、1月平均温度以及年均降水量无明显相关。苦杏仁苷属于次生代谢产物,苏文华等[24]报道环境与次生代谢产物存在一定的关系,随着环境条件的恶化,植株生长状况减弱,次生代谢产物增加,但当环境严重恶化时,生长和次生代谢受阻,代谢产物降低。如文中土默特左旗种源山杏杏仁中苦杏仁苷含量最高,可能因为土默特左旗海拔较高,日照强而长,昼夜温差较大,土层较薄,环境相比其他种源恶劣,不利植物良好生长,次生代谢产物数量增加,进而苦杏仁苷含量要高于其它种源。
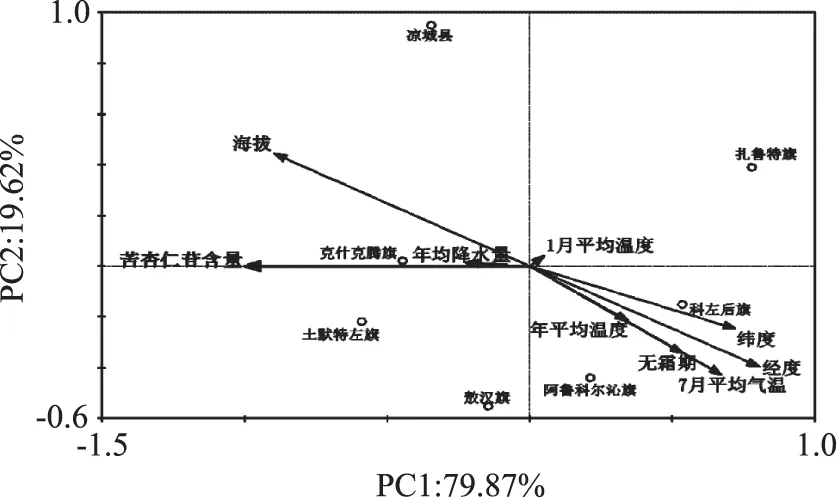
图9 苦杏仁苷含量与环境因子的相关分析Fig.9 The correlation analysis of the amygdalin content and the environment factors
2.4 聚类分析
将7个种源根据苦杏仁苷含量进行组间联接聚类,在平方Euclidean距离M=10的时候,可将7个种源划分为2类,第一类包括4个种源,该类山杏杏仁中的苦杏仁苷含量较高,地形多为山地,海拔较高;第二类包括3个种源,该类杏仁中的苦杏仁苷含量较低,属于内蒙古东部地区,海拔较低,多为沙地。
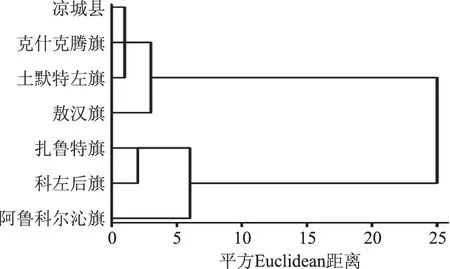
图10 苦杏仁苷含量聚类分析Fig.10 The cluster analysis of the amygdalin content
3 结论
分析测定了内蒙古7个种源苦杏仁中苦杏仁苷的含量,7个种源间苦杏仁苷含量差异显著,含量范围为4.34%~6.25%,土默特左旗种源山杏杏仁苦杏仁苷含量最高为6.25%;苦杏仁苷含量与海拔、经度、纬度以及7月平均温度有显著相关,即在内蒙古地区由西向东、地势逐渐降低,苦杏仁苷含量减少;聚类分析将7个种源分为两类,第一类包括4个种源,分别为凉城县、克什克腾旗、土默特左旗与敖汉旗,该类海拔较高,在内蒙古中西部,杏仁中苦杏仁苷含量较高;第二类包括3个种源,分别为扎鲁特旗、科左后旗、阿鲁科尔沁旗,该类杏仁中苦杏仁苷含量较低,属于内蒙古东部地区,海拔较低。不同种源山杏杏仁中苦杏仁苷含量的差异是遗传与环境共同作用所造成,所以深入研究遗传与环境对苦杏仁苷含量的作用机制是非常有价值的,可为内蒙古山杏杏仁的充分利用提供实践基础。
[1]李亚峰.对山杏等三个乡土灌木树种种源及单株的选择研究[D].呼和浩特:内蒙古农业大学,2006.
[2]殷振雄,张继,赵宝堂,等.响应面法优化超声波辅助提取苦杏仁渣中杏仁蛋白工艺[J].食品工业科技,2013,34(19):262-265.
[3]李科友,史清华,朱海兰,等.苦杏仁主要营养成分研究[J].西北农业学报,2003,12(2):119-121.
[5]丁东宁,谭廷华,刘俊儒,等.镇原苦杏仁化学成分的研究[J].西北药学杂志,1990,5(3):21.
[6]Font I,Kodad O,Socias i C R,et al.Evaluation of the Heritability of the Chemical Components of the Almond(Prunus amygdalus Batsch)Kernel[J].V International Symposium on Pistachios & Almonds,2011,912(2):465-467.
[7]赵文彬,刘金荣,黄韶光,等.新疆地产苦杏仁及油的营养成分研究[J].中国油脂,2002,27(2):31-33.
[8]邢国秀,李楠,杨美燕,等.天然苦杏仁苷的研究进展[J].中成药,2003,25(12):1007-1009.
[9]葛任新,李月娥,陈宗文.不同产地苦杏仁中苦杏仁苷含量比较研究[J].国际医药卫生导报,2011,17(22):2791-2795.
[10]周金黄,王筠默.中药药理学[M].上海:上海科学技术出版社,1986:219.
[11]蔡莹,李运曼,钟流.苦杏仁苷对实验性胃溃疡的作用[J].中国药科大学学报,2003,34(3):254-256.
[12]方伟蓉,李运曼,钟林霖.苦杏仁苷对佐剂性炎症影响的实验研究[J].中国临床药理学与治疗学,2004(3):289-293.
[13]罗德梅,葛金莲,朱震宏.苦杏仁苷对Ⅱ型胶原诱导性关节炎大鼠炎性细胞因子表达的影响[C].第十二次全国中西医结合实验医学专业委员会暨第七次湖南省中西医结合神经科专业委员会学术年会论文集,2015:7
[14]许宁侠.苦杏仁苷的研究进展[J].内蒙古中医药,2012,44(9):66-67.
[15]惠秋沙.杏仁中苦杏仁苷的提取及含量测定方法[J].医学信息旬刊,2011,24(8):223.
[16]沙明,曹爱明,姜丽,等.高效液相色谱法测定苦杏仁中苦杏仁苷的含量[J].药物分析杂志,1996,16(6):397-398.
[17]包文泉.内蒙古地区山杏重要性状遗传变异评价及优株选择[D].呼和浩特:内蒙古农业大学,2013.
[18]聂鲁,丁永萍,程春萍,等.苦杏仁苷的研究进展[J].阴山学刊:自然科学版,2012,26(4):27-30.
[19]Xingjun M,Zhong Z,Hailan Z,et al.Comparison of second-derivative spectrophotometry and HPLC for determination of amygdalin in wild apricot kernels[J].Scienceasia,2013,39(4):444-447.
[20]王涛.杨梅疏果核仁中苦杏仁苷的提取纯化及其功能活性评价[D].金华:浙江师范大学,2014.
[21]董海荣,王睿,赵卉,等.不同产地苦杏仁质量的化学模式识别研究[J].辽宁中医杂志,2009,36(12):2147-2149.
[22]苗兴军.山杏苦杏仁苷含量差异及苦杏仁油安全性评价[D].咸阳:西北农林科技大学,2014.
[23]Woodrow I E,Slocum D J,Gleadow R M.Influence of water stress on cyanogenic capacity in Eucalyptus cladocalyx[J]. Functional Plant Biology,2002,29(1):103-110.
[24]苏文华,张光飞,李秀华,等.植物药材次生代谢产物的积累与环境的关系[J].中草药,2005,36(9):1415-1418.
Analysis on differences of the bitter almond amygdalin content between different provenances in Inner Mongolia
DUAN Guo-zhen1,BAI Shu-lan1,YE Dong-mei1,LIN Tao1,XUE Hai-feng1,PING Gui-chen2,BAI Yu-e1,*
(1.Forestry College of Inner Mongolia Agricultural University,Hohhot 010019,China;2.College of Science Inner Mongolia Agricultural University,Hohhot 010019,China)
The amygdalin content in almond from seven provenances in Inner Mongolia were analyzed by high performance liquid chromatography(HPLC).The results showed that the amygdalin content of bitter almond from different provenances had significant differences(p<0.05). The average amygdalin content among provenances was 5.43%,content range for 4.34%~6.25%. The average coefficient of variation was 0.07. Jarud Banner had the higher coefficient of variation than other sources. Amygdalin content had significantly negative correlation with latitude and longitude(0.806,0.722),and significantly positive correlation with altitude(0.896). Cluster analysis divided seven provenances into 2 classes,clustering results were consistent with the correlation results. The results of the study provide a theoretical basis for the deep processing and medicinal value of apricot in Inner Mongolia.
Inner Mongolia;provenance;almond;amygdalin;analysis on differences
2016-08-09
段国珍(1990-),女,博士研究生,研究方向:林木生物技术,E-mail:18848110959@163.com。
*通讯作者:白玉娥(1968-),女,博士,教授,研究方向:林木生物技术,E-mail:bye666@163.com。
“十二五”农村领域国家科技计划(2013BAD14B02);内蒙古农业大学科技创新团队(NDPYTD2013-7);内蒙古自治区科技计划项目(201502053)。
TS255.6
A
:1002-0306(2017)04-0111-05
10.13386/j.issn1002-0306.2017.04.013
