大鼠肠道自发荧光微生物的分布
2017-03-13田树红王日超肖敏符健
田树红,王日超,肖敏,符健
(海南医学院海南省药物安全性评价研究中心,海口 571199)
大鼠肠道自发荧光微生物的分布
田树红,王日超,肖敏,符健*
(海南医学院海南省药物安全性评价研究中心,海口 571199)
目的 探讨不同发育阶段大鼠肠道自发荧光微生物在肠道内的分布。方法 采用Kinetics IVIS小动物活体成像系统的荧光检测技术对不同发育阶段SD大鼠肠道内自发荧光微生物在肠道内的分布位置进行检测和评估。先对体外培养的大肠杆菌标准菌株进行荧光检测,然后在同一检测条件下分别对大肠杆菌的分布位置进行检测。扩大荧光检测激发光波长范围,去除饲料和粪便等外来自发荧光物质的荧光背景,分别检测出生3、14 d和60 d的SD大鼠肠道内自发荧光微生物的分布。结果 大肠杆菌在485~535 nm激发波长范围内能发荧光。大肠杆菌在出生3 d的SD大鼠肠道系统中主要分布于胃,少量分布于回肠;在出生14 d的SD大鼠肠道系统中主要分布于胃和盲肠,少量分布于回肠;在出生60 d的SD大鼠肠道系统中主要分布于回肠内,少量分布于空肠、结肠和盲肠内。扩大荧光检测激发光波长范围后,自发荧光微生物在出生3 d的SD大鼠肠道系统中主要分布于回肠,其次是胃;在出生14 d的SD大鼠肠道系统中主要分布于胃,其次是盲肠,少量分布于回肠和空肠;在出生60 d的SD大鼠肠道系统中均有分布,主要分布于回肠和盲肠。结论 采用小动物活体成像系统荧光检测技术检测自发荧光肠道微生物,对研究肠道微生物在寄主不同发育阶段肠道内的分布有一定的帮助和指导作用,为肠道微生物与寄主和经胃肠道给药关系的研究提供一定的依据。
肠道菌群;自发荧光;大肠杆菌;SD大鼠;分布
动物的肠道内存在大量的肠道微生物即肠道菌群(gut microbiota),在人类的肠道内约有数十万亿个细菌[1]。肠道菌群对寄主体内的营养物质代谢[2]、自身发育、免疫及疾病[3,4]的产生等诸多方面都起着极其的重要作用。因此,肠道微生物成了近年来微生物研究的热点。目前,已经取得了许多进展。如机体代谢期间常见的肠道细菌相互作用的分子机制[5],饮食对个体肠道菌群环境改变起到更为重要作用[6],肠道中的特殊细菌或通过影响于机体外周血清素的产生进而引发一些外周血清素相关疾病(如肠易激综合征、心血管疾病及骨质疏松症等)[5],影响癌症免疫治疗效果[4],与葡萄糖耐受性和胰岛素敏感性的关系[7],不同菌群之间的竞争关系帮助维持了肠道生态系统的稳定[5]。此外,婴儿微生物菌群还会随不同时期饮食的不同而发生变化,并且随着时间的变化趋于稳定和成熟,越来越接近成人肠道微生物菌群[8]。然而,关于肠道系统不同发育阶段肠道菌群分布的研究还较少,基因组测序是目前菌群研究的常用方法[9],但这种方法需要耗费大量的时间和金钱,也并不适用于所有肠道菌群的研究。组织自发荧光普遍存在于动物各种身体组织,而且不同组织的荧光强度又不尽相同,微生物同样也会产生自发荧光。因此,通过屏蔽或去除不相关的荧光信号就可以检测到所需要菌群的自发荧光,从而判断自发荧光肠道菌群在肠道内的分布情况。本文采用Kinetics IVIS小动物活体成像系统的荧光检测技术,首次对不同发育阶段肠道系统内自发荧光肠道菌群的分布进行研究,为肠道菌群在寄主不同发育和生长阶段(即时间和空间的变化)中分布情况的研究提供思考。
1 材料与方法
1.1 材料
1.1.1 菌株及培养基成分
大肠杆菌标准菌株由海南省农垦医院友情提供,LB培养基(g/L):蛋白胨5,酵母粉10,氯化钠10,琼脂粉15。
1.1.2 实验动物来源及饲养环境
SPF级SD大鼠,60日龄,雌雄各6只,体重180~220 g,购于湖南斯莱克景达实验动物有限公司【SCXK(湘)2013-0004】。3 日龄和14 日龄SD大鼠由上述大鼠交配繁殖,雌雄各6只。实验地点为海南省药物安全性评价研究中心SPF级实验室【SYXK(琼)2012-0013】。实验动物饲料购于广东省医学实验动物中心。
1.1.3 主要仪器和试剂
Kinetics IVIS小动物活体成像系统(美国精诺真);VIP 3000型气体麻醉系统(Matrx);麻醉剂异氟烷(瑞沃德)。
1.2 方法
1.2.1 大肠杆菌标准菌株的自发荧光测定
将纯化在LB固体培养基上的大肠杆菌标准菌株放入Kinetics IVIS小动物活体成像系统内的样品放置处,选择激发波长范围为300~600 nm,然后拍照并检测大肠杆菌标准菌株的自发荧光情况。
1.2.2 出生3 d的SD大鼠肠道内自发荧光大肠杆菌的测定
用Matrx 的VIP 3000型气体麻醉系统对动物进行吸入式深度麻醉,麻醉剂为异氟烷。剖开腹腔,完整取出其胃肠道系统,放入小动物活体成像系统内的样品放置处,选择与大肠杆菌标准菌株相同的激发波长,然后拍照并检测动物肠道内大肠杆菌的自发荧光强度及其在胃肠道内的分布情况,荧光越强,菌数越多荧光越弱,菌数越少。
1.2.3 出生14 d的SD大鼠肠道内自发荧光大肠杆菌的测定
动物麻醉、取材和检测方法同“1.2.2”项。
1.2.4 出生60 d的SD大鼠肠道内自发荧光大肠杆菌的测定
除动物麻醉、取材和检测方法与“1.2.2”项相同外,由于动物饲料也会产生荧光,因此,结果分析时应去除饲料和粪便产生的荧光。
1.2.5 大鼠自发荧光肠道菌群的测定
将激发光波长范围设置为300~600 nm,将“1.2.2~1.2.4”项中检测肠道内自发荧光大肠杆菌的肠道系统再重新检测,去除自发荧光大肠杆菌、饲料、粪便及胃肠道组织等荧光背景,即为其他自发荧光的肠道菌群。
1.2.6 统计学分析

2 结果
2.1 大肠杆菌标准菌株的自发荧光检测结果
荧光检测结果表明,大肠杆菌标准菌株在激发光波长为485~535 nm时,能检测到较强荧光(图1B)。比较图1中A和B可见,荧光位置与大肠杆菌的位置能一一对应。因此,在特定激发波长时,用Kinetics IVIS小动物活体成像系统的荧光检测技术能检测到大肠杆菌的自发荧光。
2.2 哺乳期SD大鼠肠道内自发荧光大肠杆菌
分别将出生3 d和14 d的SD大鼠麻醉后完整取出胃肠道组织,包括胃、十二指肠、空肠、回肠、结肠、盲肠和直肠等。在与大肠杆菌同一检测条件下检测其胃肠组织内的自发荧光的强弱及分布(图 2)。结果表明,出生3 d的SD大鼠肠道内自发荧光均主要分布在胃,少量分布在回肠。出生14 d的SD大鼠肠道内自发荧光均主要分布在胃和盲肠,少量分布在回肠,其余部分未见明显荧光。而胃、肠和粪便(见图2中黄色箭头所指)在当前条件下并未检测到荧光。因此,可以推断出生3 d的SD大鼠肠道大肠杆菌主要分布于胃,少量分布于回肠;出生14 d的SD大鼠肠道大肠杆菌主要分布于胃和盲肠,少量分布于回肠。
2.3 出生60 d SD大鼠肠道内自发荧光大肠杆菌
将出生60 d的SD大鼠麻醉后完整取出胃肠道组织,在与大肠杆菌同一检测条件下检测其胃肠组织内的自发荧光的强弱及分布(图 3)。结果表明,出生60 d的SD大鼠肠道内自发荧光均主要分布在回肠,少量分布在空肠,然后是直肠、胃和盲肠。在这一检测条件下胃肠组织未能检查出荧光,但需要去除粪便和饲料所产生的荧光,从图3中可以看出,饲料和粪便未能检测到荧光。因此,可以推断出生60 d的SD大鼠肠道大肠杆菌主要分布于回肠,少量分布在空肠,然后是直肠、胃和盲肠。
2.4 SD大鼠胃肠道内其他自发荧光肠道菌群测定
去除胃肠组织、粪便、饲料和自发荧光大肠杆菌的荧光背景,当激发光的波长为420~485 nm时,发现在大鼠胃肠道内还存在其他的自发荧光肠道菌群(图4、图5和图6)。荧光强度越强,表明该区域的自发荧光肠道菌群数量越多。结果表明,出生3 d的SD大鼠,其他的自发荧光肠道菌群主要分布在回肠,其次是胃,而自身的自发荧光大肠杆菌则主要分布在胃,见图4;出生14 d的SD大鼠,其他的自发荧光肠道菌群主要分布在胃和盲肠,与自身的自发荧光大肠杆菌则主要分布类似,见图5;出生60 d的SD大鼠,其他的自发荧光肠道菌群主要分布与自身的自发荧光大肠杆菌则主要分布类似,而且分布更广,荧光强度也明显增强,见图6。
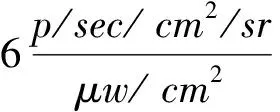
3 讨论
人类肠道菌群的研究已经变得非常活跃和重要,为了解人肠道中细菌的物种分布,2010年,由欧盟第七框架计划资助的子项目“MetaHIT”计划项目研究组收集了来自于欧洲人肠道菌群的124个样本,采用高通量的测序技术测序,估计人肠道中存在约1100种细菌,平均每个体内约含有160种优势菌种[10]。越来越多的研究表明,肠道菌群与人类多种疾病息息相关,而人类在治疗疾病时,许多药物对肠道菌群可能存在不同程度的影响。目前,利用肠道菌体自发荧光的特性来研究肠道菌群分布的报道较少。有研究用携带lux基因簇的质粒转化到大肠杆菌(Escherichiacoli)DH5α感受态细胞中,再将发光大肠杆菌注射到ICR小鼠(Musmusculus)盲肠内,24 h后检测小鼠肠道内微生物的荧光能持续发光16 h以上[11]。本文利用菌体自发荧光的现象,简单而且直观地分析了某些自发荧光菌群在SD大鼠肠道内的分布情况,希望能对肠道菌群分布的研究有所帮助。

注:A:大肠杆菌普通照片;B:大肠杆菌荧光照片。图1 大肠杆菌的自发荧光检测结果Note. A: Ordinary photo of E.coli;B: Auto-fluorescence photo of the same E.coli.Fig.1 Detection of autofluorescence of a standard E. colis train.

注:A:出生3 d SD大鼠胃肠道荧光照片;B:出生14 d SD大鼠胃肠道荧光照片。图2 哺乳期SD大鼠肠道内自发荧光大肠杆菌的分布Note. A: Auto-fluorescence photo of the gastrointestinal tract of SD rats at 3 days after birth. A: Auto-fluorescence photo of gastrointestinal tract of a SD rat at 14 days after birth.The yellow arrows indicate waste in the intestine.Fig.2 Distribution of auto-fluorescence of E.coli in the intestines of SD rats at lactation
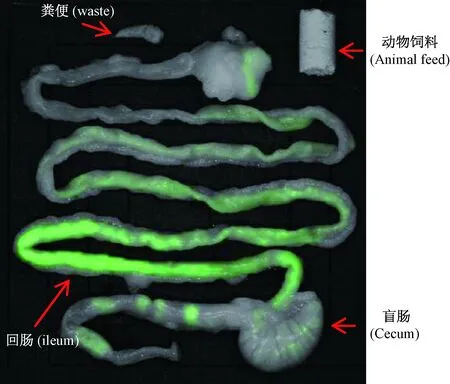
图3 出生60 d SD大鼠肠道内自发荧光大肠杆菌的分布Fig.3 Distribution of auto-fluorescent E.coli in the intestines of SD rats at 60 days after birth

图4 出生3 d SD大鼠肠道内除大肠杆菌以外的其他自发荧光肠道菌群的分布Fig.4 Distribution of auto-fluorescent gut microbiota in the gastrointestinal tract of SD rats at 3 days after birth. Besides E.coli, there were also some other autofluorescent bacterial flora in the intestinal tract.

图5 出生14 d SD大鼠肠道内除大肠杆菌以外的其他自发荧光肠道菌群的分布Fig.5 Distribution of auto-fluorescent microbiotain the gastrointestinal tract of SD rats at 14 days after birth. Besides E. coli, threr were also some other autofluorescent bacterial flora in the intestinal tract.
不同发育阶段的SD大鼠肠道菌群除了在分布上存在较大差异外,实验结果还表明,不同发育阶段的SD大鼠肠道菌群在数量上存在较大差异。出生14 d的SD大鼠肠道菌群自发荧光强度是出生3 d时的近10倍,出生60 d后肠道菌群自发荧光强度是出生3 d时的近1400倍。荧光强度的强弱与自发荧光菌体的数量成正相关,菌体越多,荧光强度越强。这些分别和数量上的差异这可能与食物和机体环境的变化有关。肠道菌群的变化对饮食的应答呈现明显的剂量依赖关系,饮食的微妙变化会引起肠道菌群成分结构的改变[6]。因此,在进行药物相关试验时,需要考虑药物对不同年龄阶段的受试对象肠道菌群的影响,因为肠道菌群的改变可能也使机体的某些功能异常[8]。虽然用小动物活体成像系统荧光检测技术能检测的某些自发荧光菌群的大致分布,但还有许多问题需要解决,比如还尚不清楚这些自发荧光的菌群种类,也不确定产生自发荧光的菌群占所有肠道菌群的比例,以及能检测到其自发荧光的菌体数量等。
[1] Andrew LK, Philip PA,Nicholas WG, et al. Human nutrition, the gut microbiome and the immune system[J]. Nature, 2012,474(7351):327-336.
[2] Atarashi K,Tanoue T,Ando M,et al. Th17 cell induction by adhesion of microbes to intestinal epithelial cells [J]. Cell, 2015, 163(2):367-380.
[3] Ayelet S,Leticia C,Nathaniel H, et al. CommensalBifidobacteriumpromotes antitumor immunity and facilitates anti-PD-L1 efficacy [J]. Science, 2015, 350:1084-1089.
[4] Marie V,Jonathan MP, Romain D, et al. Anticancer immunotherapy by CTLA-4 blockade relies on the gut microbiota [J]. Science, 2015, 350:1079-1083.
[5] Yano JM, Yu K, Donaldson GP,et al. Indigenous bacteria from the gut microbiota regulate host serotonin biosynthesis[J].Cell, 2015, 161:264-276.
[6] Rachel NC, Georg K.G, Jesus ML, et al. Diet dominates host genotype in shaping the murine gut microbiota[J].Cell Microbe, 2015, 17:3-5.
[7] Katharine Z.C, Jonas S, Kevin R.F. The ecology of the microbiome: Networks, competition, and stability[J]. Science, 2015, 350:663-666.
[8] Fredrik B, Josefine R,PengYQ, et al. Dynamics and stabilization of the human gut microbiome during the first year of life [J].Cell Microbe, 2015, 17:690-703.
[9] Nicolas SZ, Salvatore F, Claire C, et al. Microbiota depletion promotes browning of white adipose tissue and reduces obesity[J].Nature Med, 2015, 21:1497- 1501.
[10] Qin JJ,Li RQ, JeroenRR, et al. A human gut microbial gene catalogue established by metagenomic sequencing [J]. Nature, 2010, 464:59-67.
[11] 杨藩,王宁,徐西占,等. 转lux基因簇大肠杆菌在小鼠肠道内定植模型的建立[J]. 农业生物技术学报,2014,22(8): 925-932.
Distribution of autofluorescent microorganisms in the rat intestine
TIAN Shu-hong,WANG Ri-chao,XIAO Min,FU Jian*
(Hainan Research Center for Drug Safety Evaluation,Hainan Medical College, Haikou 571199, China)
Objective To study the distribution of intestinal autofluorescent microorganisms in the rat intestine at different developmental stages.Methods The distribution of intestinal autofluorescent microorganisms in rat intestine at various developmental stages was tested and evaluated using a small animals living imaging system. First, standardE.colistrain was tested by fluorescence detection in vitro. Then, the distribution ofE.coliunder the same test conditions was tested.The intestinal autofluorescent bacteria distribution was detected in the SD rats at 3 days,14 days and 60 days of age.After expanding the range of excitation wavelength fluorescence detection,removing the background of fluorescence feed and feces and other foreign autofluorescent substances. ResultsE.colican be excited in the range of 485-535 nm wavelength and to emit fluorescence.E.colimainly existed in the stomach and only a fewE.coliwere found in the ileum of 3-days old SD rat.. In the 14-days old rats,E.colimainly existed in the stomach and cecum, and only a fewE.coliwere found in the ileum. In the 60-days old SD rats,E.colimainly existed in the ileum, and only a fewE.coliwere found in the colon, cecum and jejunum. After the expansion of the excitation light wavelength range of fluorescence detection,E.coliwere observed mainly in the ileum, and only a fewE.coliwere found in the stomach in 3-days old SD rat.E.colimainly existed in the stomach, then the cecum and only a fewE.coliwere found in the ileum and jejunum in 14-days old SD rats.E.colicould be found in the whole intestinal system but mainly in the ileum and cecumin of the 60-days old rats. Conclusions Examining the intestinal autofluorescent microbes with the small animal in vivo imaging system can be helpful and make guidance to study the distribution of intestinal microbes in the host at different developmental stages, and to provide a basis for studying the relationship of intestinal microbes with its host and the gastrointestinal drug administration.
Gut microbiota;Autofluorescent microorganisms;E.coli;SD rat; Microbiota distribution
FU Jian, E-mail: Fujian.hnmc@163.com
田树红(1980-),男,助理研究员,硕士,研究方向:药理毒理学。E-mail:18089862900@163.com
符健(1960-),男,博士,教授,研究方向:药理毒理学。E-mail:Fujian.hnmc@163.com
Q95-33
A
1005-4847(2017) 01-0097-05
10.3969/j.issn.1005-4847.2017.01.018
2016-06-07