人子宫内膜异位症纤维化动物模型的建立
2017-02-28路攀米雪苗劲蔚
路攀++++++米雪++++++苗劲蔚++++++吴迪

[摘要] 目的 采用子宫内膜异位症患者的子宫内膜组织建立纤维化裸鼠模型。 方法 收集子宫内膜异位症患者的子宫内膜组织(增殖期及分泌期),使用开腹方法将所取子宫内膜组织种植入BALB/c裸鼠盆腹腔。观察裸鼠子宫内膜病灶生长以及裸鼠生存情况,分别于种植后的第7、14天开腹探查,观察异位病灶的位置、大小及与周围组织的关系,并取部分组织进行病理验证。 结果 人子宫内膜异位症裸鼠模型成功建立,裸鼠腹部表面可见隆起的结节,质韧,与周围组织粘连,活动度差,开腹探查可见异位病灶大部分位于腹壁及膀胱旁,病理证实异位病灶可见子宫内膜样腺体结构,周围有基质细胞及大量炎症细胞浸润,可见纤维组织沉积。 结论 子宫内膜异位症患者的子宫内膜种植于裸鼠盆腹腔内,可成功建立异体子宫内膜异位症纤维化裸鼠模型,为其发生、发展机制及其恶性生物学行为的研究提供平台。
[关键词] 子宫内膜异位症;不孕;盆腔疼痛;盆腔包块;动物模型
[中图分类号] R711.71 [文献标识码] A [文章编号] 1673-7210(2016)11(b)-0008-04
[Abstract] Objective To establish a fibrotic nude mouse model of human endometriosis by taking advantage of endometrial patients. Methods Stage proliferation and secretion of endometrial tissues in patients diagnosed as endometriosis were collected, thus a minilapamtomy was performed to transplant fresh human endometrial pieces into the peritoneum of BALB/c nude mice. The growth of endometrial disease lesion and survival situation in nude mice. The mice were killed at 7 and 14 d after transplantation to observe the location and size of the ectopic lesion and its relationship with the surrounding tissue. Part of the tissues were examined by histopathology. Results The human endometriosis model was successfully established, in which we could saw toughening lumps burged on the abdomen surface of nude mice, with the surrounding tissue adhesion, and mobility was poor. The most endometrial lesions located in nape and nexted to bladder were observed by through exploratory laparotomy. Pathology confirmed that endometrial glandular structure was surrounded by stromal cells and inflammatory cells infiltration, and it had fibrous tissue deposition in ectopic lesions. Conclusion A nude mouse model of endometriosis has been successfully established. It may provide an appropriate model for research of the mechanism of endometriosis.
[Key words] Endometriosis; Infertility; Pelvic pain; Pelvic cyst; Animal model
子宮内膜异位症(endometriosis,EMs)是指子宫内膜腺体和基质异位到宫腔以外的部分,以卵巢、子宫直肠陷凹、子宫骶韧带等部位最常见,是妇科一种慢性的、良性的、雌激素依赖性的疾病,主要影响6%~10%的育龄期女性[1],其病理学基础为异位的子宫内膜组织在雌激素的作用下周期性剥脱,这种异位内膜周期性出血被其周围组织包裹并发生纤维化,形成异位结节,占据正常卵巢组织并形成盆腔粘连[2],从而导致慢性盆腔疼痛、不孕、月经异常和痛经等一系列症状,其中盆腔疼痛率高达45%~82%[3],不孕率高达50%[4],严重影响广大女性的生活质量。
然而EMs产生的具体机制尚不明确。目前有关EMs的机制主要有以下6种学说:异位种植学说、体腔上皮化生学说、诱导学说、遗传因素、免疫与炎症因素、其他因素,但均不能完全解释EMs的发病、进展及预后问题,而且就目前诊治原则看来,手术及药物治疗虽有一定疗效,但是复发率仍然较高[5-6]。据文献统计,术后1年的复发率为8%~10%,术后2年的复发率约20% [7],术后5年复发率高达36%~57%[8]。而且手术治疗可造成有功能的卵巢组织减少,怀孕概率也明显降低[9];内分泌药物由于其严重的不良反应而不能长期使用。EMs导致盆腔组织纤维化,是造成女性盆腔疼痛、不孕的主要原因,因此成功构建出EMs的动物模型,将从分子层面揭示EMs纤维化的机制,为将来发现更有效的诊治方式提供很大帮助。
1 材料与方法
1.1 实验动物
选择BALB/c雌性裸鼠20只[合格证号:scxk(京)2014-0004],6~8周龄,体重17~21 g,由中国医学科学院肿瘤医院动物实验室提供无菌环境饲养(温度22~24℃,湿度:45%~70%,12 h白天,12 h黑夜),分5籠饲养(每4只裸鼠放入1笼中),采用SPF级条件饲养。本动物实验遵循北京市所制订的有关实验动物保护和使用指南,并经首都医科大学附属北京妇产医院(以下简称“我院”)实验动物伦理委员会批准。
1.2 标本来源
所用子宫内膜均来自就诊于首都医科大学附属北京妇产医院因EMs行卵巢囊肿剔除术的5名患者,平均年龄为(35±4)岁,无生育要求,术前6个月内未经任何激素治疗,且均月经周期规律,无子宫内膜相关疾病。行腹腔镜手术切除卵巢子宫内膜异位囊肿的同时,麻醉下采用诊刮的方式获得子宫内膜(即严格消毒外阴、阴道及宫颈口,减少污染,刮取子宫内膜1~2 g),刮出后立即放入含4 mL DMEM培养液无菌瓶中。同时留取部分内膜组织用福尔马林浸泡,所有病例术后病理提示为3名患者子宫内膜为增殖期,2名患者子宫内膜为分泌期。该研究方案经过我院伦理委员会批准,并根据伦理学要求,所有患者均签署相关知情同意书。
1.3 标本处理
子宫内膜组织离体后立即置入含4 mL DMEM培养液无菌瓶后,冰盒低温运输,快速送于实验室进行接种(接种时间应在离体后1 h内,否则影响接种成功率)。接种前标本用冷的0.1 mol/L的无菌磷酸盐缓冲液(PBS)洗去血块和黏液。冲洗至少三遍,然后于无菌培养皿内用无菌组织剪将冲洗好的子宫内膜组织剪成2 mm×3 mm~3 mm×3 mm碎块,每8~10小块为一组,分别置入PBS中,准备接种。
1.4 模型建立
裸鼠采用腹腔注射麻醉,质量分数为0.5%的戊巴比妥15~18 ml/kg。麻醉后固定,取下腹正中横切口长约1 cm,将上述处理的人子宫内膜碎块8~10块随机置入盆腹腔不同部位,采用无菌针缝合切口。每份子宫内膜种植4只裸鼠(经病理证实为增殖期的子宫内膜组织种植于12只裸鼠盆腹腔,编号为1~12;分泌期子宫内膜组织种植于8只裸鼠盆腹腔,编号为13~20),待裸鼠麻醉清醒后,置于温度22~26℃,相对湿度50%~60%、无菌净化屏障系统内饲养。当日起给予裸鼠雌激素(苯甲酸雌二醇30 μg/kg,1次/3 d,腿部肌内注射)。术后3 d,每日腹腔注射青霉素钠100 μL/(只·次)(内含200 000 U青霉素钠)预防感染。根据文献造模成功的标志:肉眼可见种植呈隆起透明的结节状、囊状,移植物被结缔组织覆盖,并有血管形成,病理提示为子宫内膜样组织,见内膜样基质和腺上皮结构[10]。
1.5 观察与取材
每日观察裸鼠活动情况及裸鼠腹部结节的变化,包括大小、位置、质地、与腹壁的关系及与周围组织的关系,并分别于种植后的第7、14天开腹探查,0.5%的戊巴比妥15~18 mL/kg麻醉下,采用下腹正中切口,大小约2 cm,打开裸鼠盆腹腔,观察盆腹腔内病灶的生长情况,包括位置、大小、数目及其与周围脏器的关系、颜色、周围血管生成情况,各自取材部分病灶标本,分别放入10%福尔马林溶液中浸泡,常规石蜡包埋,分别进行苏木精-伊红(HE)染色、免疫组化,显微镜下观察。
2 结果
2.1 种植成功率
经大体分析和病理分析,所有裸鼠模型均种植成功,即建模成功率为100%。
2.2 大体分析
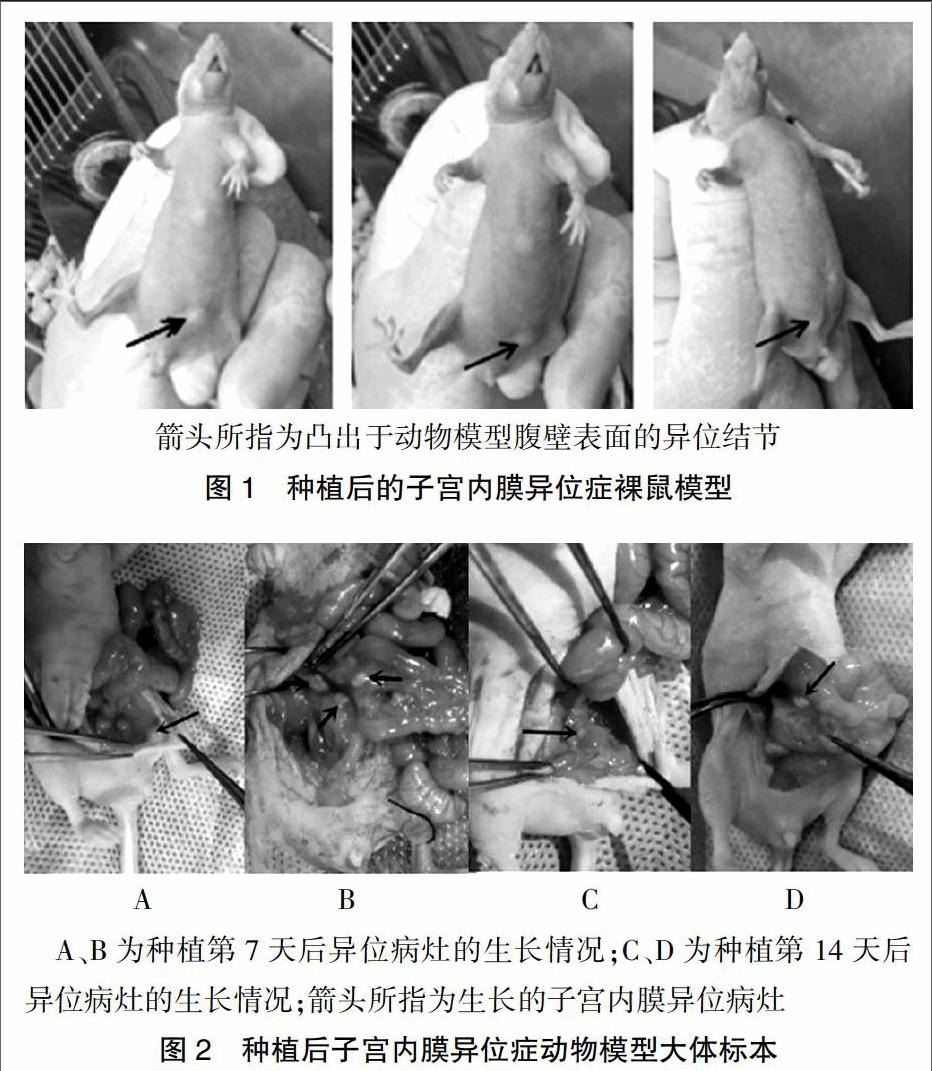
种植后约7 d,部分移植内膜可从裸鼠腹部肉眼可见,移植物有增大,可呈隆起的小包状的透明结节或囊肿(图1)。分别于种植后的第7、14天打开裸鼠的盆腹腔,观察病灶,发现病灶以腹壁生长为主(55%),切口处常见,另膀胱旁(45%)、肠管附近(15%)可见小块病灶。种植第7天可见移植内膜与裸鼠组织牢固黏附,形成异位结节,质韧,病灶边缘血管生成明显,裸鼠病灶与周围组织轻度粘连,尚能分离(图2)。种植第14天可见移植病灶变硬,与裸鼠组织连接致密,难以分离(图2)。
2.3 显微镜下分析
在光镜下可见子宫内膜样腺体增生,腺上皮细胞增生活跃,散在间质细胞,类似于子宫内膜样腺上皮及基质围绕囊泡生长;腺体细胞呈立方形或扁平状,腺体边缘较多炎性细胞(如淋巴细胞、巨噬细胞等)浸润(图3)。采用DAPI做荧光染料,在荧光显微镜下观察免疫组化的结果,可见EMs内膜组织中纤维化相关蛋白如CTGF、α-SMA、Collagen Ⅰ等表达明显增加(图4)。
3 讨论
EMs是一种常见的妇科良性疾病,发病率逐年上升,主要影响生育期女性[11-13]。就目前而言,导致EMs患者盆腔疼痛和不孕的发病机制比较复杂,涉及免疫、激素、基因和环境等因素[14],分子生物学专家认为纤维化是导致盆腔疼痛及不孕的关键。与其他疾病一样,对于EMs纤维化发生、发展的动态研究以及探索有效的诊断策略,动物模型是理想的研究对象。本实验采用裸鼠所建的人EMs模型中,病理显示原有组织的形态及生化特征,实验结果临床观察意义较大,可作为探索EMs纤维化的发病机制及有效诊治策略的理想模型。
构建EMs动物模型的动物选择,现主要采用的动物包括灵长类动物、大鼠、裸鼠等[10,14-15]。但是灵长类动物比较珍贵,且受到伦理学的限制而不能被用来科学研究[1];大鼠、兔子有自身的免疫功能,可以经过自体内膜移植,但是其内膜与人的内膜在种属及生化方面存在很大差异,因此此类动物所见模型存在诸多局限[16-17]。然而因为裸鼠属于免疫缺陷小鼠,不会发生异种异体移植免疫排斥反应,种植后成活率较高,模型构建成功率较大,可重复性好,因此裸鼠模型比较常用。而且实验中发现裸鼠模型中成功生成的子宫内膜异位病灶与人类的子宫内膜异位病灶相似度高,可观察性强,因此使用裸鼠是研究EMs的很好选择。
目前EMs裸鼠模型的构建方法主要有自体移植、皮下直接种植人类子宫内膜组织法、皮内注射EMs组织碎片法、腹腔内直接种植人类子宫内膜组织法、腹腔内注射EMs细胞系法等[18-20]。由于裸鼠本身的子宫体积较小,取裸鼠的子宫内膜需要娴熟的实验技能及精确剥离子宫内膜的方法,可操作性较差;而皮下種植不符合EMs的好发特点;子宫内膜细胞系价格昂贵,种植入腹腔内弥散性高易被吸收,而且用人的子宫内膜可以使具有物种特异性的药物被开发,从而利于人EMs的质量。我们此次构建EMs裸鼠模型即采用的是腹腔内直接种植人子宫内膜组织的方法,这样更加符合EMs在人体中的发病特点,结果建模成功率为100%,并经病理学金标准证实。
但是实验过程中发现,在腹腔种植子宫内膜病灶存在一定的局限性:①不容易观察,由于种植于腹腔,随小肠的蠕动,种植的病灶也会移动,以至在观察时不易定位。②不易测量,因为种植位置较深,虽然有部分的病灶会突出皮肤表面,可观察到明显的结节状组织块,但是其向腹腔内延伸的大小不能明确,要测量其大小则需开腹,而裸鼠本身就免疫能力低下,容易感染,因此多次开腹可能影响裸鼠的存活能力,并增加感染机会;另外有部分种植的病灶明显突向腹腔,表面无法观察,不能确定模型种植是否成功,必须开腹探查。③给药的问题,对于皮下或腹腔给药无明显不足,但是若病灶给药则会出现问题,原因是对裸鼠表面结节块不明显的裸鼠,难以定位种植的病灶。
内膜组织来源的选择各有不同,采用正常的增殖期内膜者,认为增殖期的内膜种植成功率较高;采用正常的分泌期内膜者认为分泌期内膜种植更符合经血逆流学说[21]。而本实验中所采取的内膜组织既有增殖期内膜又有分泌期内膜,最终都种植成功,裸鼠体健且裸鼠表面均可见结节状组织块,质韧,并通过病理切片证实为子宫内膜组织。因此,在动物模型的建立过程中,所采取的内膜并无特殊要求。
从本次实验过程及结果来看,模型的建立比较成功,且最后经病理证实为子宫内膜组织,同时我们发现种植的子宫内膜异位病灶与周围组织明显粘连,免疫组化证明与纤维化关系密切,因此该动物模型可以用来研究纤维化在人EMs发生、发展及恶性生物学行为中的作用具有很大的临床价值。
另外,因为上述提到腹腔种植的问题,认为裸鼠皮下种植效果可能更好:①好观察,种植于皮下时,结节块明显,容易测量;②存活率高,种植于皮下避免了多次开腹,会减少出血量及缩短手术时间,降低感染率;③给药方便,可以皮下给药、腹腔给药,必要时也可以病灶给药。但是因为就临床研究看来,EMs患者的异位病灶多位于盆腹腔,裸鼠皮下种植的结果与腹腔内种植的结果及临床研究是否一致有待研究。
另外,临床所见EMs以卵巢居多,那在建立EMs动物模型时是否可以将病灶直接种植在裸鼠卵巢上呢?这样是不是更加符合人EMs的发病情况呢?这一系列的问题有待进一步研究证实。
[参考文献]
[1] Nyholt DR,Low SK,Anderson CA,et al. Genomewide association meta-analysis identifies new endometriosis risk loci [J]. Nature Genetics,2012,44(12):1355-1359.
[2] De Ziegler D,Borghese B,Chapron C. Endometriosis and infertility:pathophysiology and management[J]. Lancet,2010,376(9742):730-738.
[3] Mishra VV,Gaddagi RA,Aggarwal R,et al. Prevalence;characteristics and management of endometriosis amongst infertile women:a one year retrospective study [J]. Clin Diagn Res,2015,9(6):QC01- QC03.
[4] De la Hera-Lazaro CM,Munoz-González JL,Perez RO,et al. Radical surgery for endometriosis:analysis of quality of life and surgical procedure [J]. Clin Med Insights Womens Health,2016,9:7-11.
[5] Hoo WL,Stavroulis A,Pateman K,et al. Does ovarian suspension following laparoscopic surgery for endometriosis reduce postoperative adhesions? An RCT [J]. Hum Reprod,2014,29(4):670-676.
[6] Young VJ,Ahmad SF,Brown JK,et al. Peritoneal VEGF-A expression is regulated by TGF-β1 through an ID1 pathway in women with endometriosis [J]. Sci Rep,2015,5:16859.
[7] Guo SW. Recurrence of endometriosis and its control [J]. Hum Reprod Update,2009,15(4):441-464.
[8] Moscarini M,Milazzo GN,Assorgi C,et al. Ovarian stripping versus cystectomy:recurrence of endometriosis and pregnancy rate [J]. Arch Gynecol Obstet,2014,290(1):163-167.
[9] Park H,Kim CH,Kim EY,et al. Effect of second-line surgery on in vitro fertilization outcome in infertile women with ovarian endometrioma recurrence after primary conservative surgery for moderate to severe endometriosis [J]. Obstet Gynecol Sci,2015,58(6):481-486.
[10] Sillem M,Hahn U,Coddington CC,et al. Ectopic growth of endometrium depends on its structural integrity and proteolytic activity in the cynomolgus monkey(Macaca fascicularis)model of endometriosis [J]. Fertil Steril,1996,66(3):468-473.
[11] 邓姗,郎景和.左炔诺孕酮宫内缓释系统的临床功用及相关基础研究[J].国外医学:妇产科学分册,2004,5(10):285-288.
[12] 章永平.腹腔镜治疗208例子宫内膜异位症患者的效果观察[J].中国当代医药,2016,23(2):68-70.
[13] 吴红娟,刘广珍,孔敏莉.子宫内膜异位症保守性手术联合药物巩固后复发者应用左炔诺孕酮宫内缓释系统的疗效观察[J].中国当代医药,2016,23(10):105-106.
[14] Erten OU,Ensari TA,Dilbaz B,et al. Vitamin C is effective for the prevention and regression of endometriotic implants in an experimentally induced ratmodel of endometriosis. Taiwan [J]. Obstet Gynecol,2016,55(2):251-257.
[15] Ding Y,Zhang M,Lang J,et al. In vivo study of endometriosis in mice by photoacoustic microscopy [J]. J Biophotonics,2015,8(1-2):94-101.
[16] Bailey MT,Coe CL. Endometriosis is associated with an altered profile of intestinal microflora in female rhesus monkeys [J]. Hum Reprod,2002,17(7):1704-1708.
[17] Berkley KJ,Dmitrieva N,Curtis KS,et al. Innervation of ectopic endometrium in a rat model of endometriosis [J]. Proc Natl Acad Sci USA,2004,101(30):11094-11098.
[18] Goktolga U,Cavkaytar S,Altinbas SK,et al. Effect of the non-specific matrix metalloproteinase inhibitor Doxycycline on endometriotic implants in an experimental rat mode [J]. Exp Ther Med,2015,9(5):1813-1818.
[19] Matsuzaki S,Darcha C. Involvement of the Wnt/β-catenin signaling pathway in the cellular and molecular mechanisms of fibrosis in endometriosis [J]. PLoS One,2013,8(10):e76808.
[20] Tamura K,Takashima H,Fumoto K,et al. Possible role of α1-antitrypsin in endometriosis -like grafts from a mouse model of endometriosis [J]. Reprod Sci,2015,22(9):1088-1097.
[21] 王丹波,張淑兰,牛慧彦,等.人EMs裸鼠模型组织形态学变化及血管内皮生长因子和基质金属蛋白酶9基因表达的研究[J].中华妇产科杂志,2004,39(11):759-762.
