HER2阳性胃癌的治疗研究进展
2017-02-21俞悦周爱萍曾益新
俞悦周爱萍曾益新
·专家论坛·
HER2阳性胃癌的治疗研究进展
俞悦①周爱萍①曾益新②

曾益新教授,医学博士,中国科学院院士,国务院医改专家咨询委员会委员,北京医院院长、中国科协常委,中国抗癌协会副理事长,中华医学会全科医学分会主任委员,华南肿瘤学国家重点实验室主任,国际欧亚科学院院士,发展中国家科学院院士。曾任中山大学肿瘤防治中心主任,北京协和医学院院长等。主要从事恶性肿瘤发病机理及生物治疗研究,多次取得相关研究领域的重要成果,曾获国家自然科学二等奖、何梁何利基金科学与技术进步奖和中国青年科学家奖等奖项。2010年获得瑞典卡罗琳斯卡医学院成立200周年纪念庆典颁发的第一枚大银质奖章。
抗人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)的靶向治疗显著延长了HER2阳性晚期胃癌患者的生存期,抑制HER2通路已成为HER2阳性晚期胃癌一线治疗的基础策略。ToGA研究中的曲妥珠单抗联合5-Fu/卡培他滨及顺铂的化疗方案是HER2阳性晚期胃癌一线化疗的标准方案。后ToGA时代,曲妥珠单抗联合其它的多个化疗方案不仅在晚期胃癌的二线治疗和转化性治疗中有突出的疗效,而且在局部进展期胃癌的新辅助治疗中有望发挥更大的作用。目前胃癌抗HER2治疗的研究方向是开发新的抗HER2药物,以及与其它信号通路的靶向药物联合。动态的基因检测有助于明确抗HER2治疗耐药的分子生物学机制,目前的临床研究在克服耐药性方面已取得进展。本文就HER2阳性晚期胃癌治疗方面的最新进展及今后的研究方向进行综述,以期指导临床实践。
HER2 晚期胃癌 曲妥珠单抗 靶向治疗
随着基因测序技术的发展,胃癌的精准治疗时代已经到来。传统的Lauren分型及WHO分型缺乏对治疗预后的预测,基因亚型也许可以更好地指导治疗。肿瘤基因组图谱研究网络发布的原发胃癌全基因测序结果根据不同的分子标志物将胃癌分为4个亚型(EBV型、MSI型、GS型及CIN型)[1]。新的分子分型有望成为筛选目标患者、判断预后及寻找潜在治疗靶点的重要依据。
在目前众多临床研究的分子靶点中,抗人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)是临床意义最明确、应用最广泛的一个。HER2是人表皮生长因子受体(human epidermal growth factor receptor,EGFR)家族蛋白的一员,作为酪氨酸激酶受体在调节细胞增殖、分化和生存等众多行为过程中发挥重要作用[2]。胃癌中HER2阳性率约为12%~20%[3]。曲妥珠单抗是针对HER2受体细胞膜外部分的单克隆抗体,通过与HER2细胞膜外Ⅳ区结合,阻断下游磷脂酰肌醇(phosphatidylinositol 3-kinase)PI3K/AKT和Ras/MEK肿瘤细胞信号传导从而发挥抗肿瘤作用[4-5]。在随机、前瞻性Ⅲ期多中心的临床研究(ToGA研究)中,首次对比了人源化HER2单克隆抗体曲妥珠单抗联合5-Fu+顺铂的治疗方案与单纯化疗组在初治HER2阳性胃癌中的疗效。结果显示联合曲妥珠治疗组的肿瘤应答率、疾病进展时间、应答持续时间及中位无进展生存期(progression-free survival,PFS)、总生存期(overall survival,OS)均显著长于对照组[6]。ToGA研究奠定了曲妥珠单抗在HER2阳性胃癌一线治疗中的基础地位。近年来,众多研究对曲妥珠单抗在适应证以外的应用及其它抗HER2靶向药物的临床疗效进行了深入探讨。本文就目前HER2阳性胃癌治疗的最新进展进行综述,以明确今后研究方向,从而指导临床实践。
1 曲妥珠单抗的后ToGA时代
1.1 一线治疗
目前,多项研究证实曲妥珠单抗联合5-Fu/卡培他滨+顺铂以外的多个化疗方案均有突出的疗效。HerMES研究是一项探讨曲妥珠在临床胃癌治疗中应用的研究[7]。该研究对383例接受一线曲妥珠单抗治疗的HER2阳性晚期胃癌患者进行了中期生存分析,结果显示仅有28.7%的患者接受了5-Fu/卡培他滨+顺铂的化疗方案。尽管50.7%的患者接受了其它方案化疗(如5-Fu+顺铂+亚叶酸钙占14%、5-Fu+奥沙利铂+亚叶酸钙占13%、5-Fu+奥沙利铂+多西他赛占10%、卡培他滨单抗占6%、曲妥珠单抗单药占3%,其中不含铂方案占48%),全部患者中位PFS仍达到了7.73个月,与ToGA研究的6.7个月相似,且曲妥珠单抗治疗期间患者总体健康状态[EORTC QLQ-30(生存质量)]和角色功能评分均保持稳定。
S-1+顺铂是亚洲地区局部进展期胃癌的标准治疗方案之一,在探讨曲妥珠单抗联合SP方案一线治疗疗效的HERBIS-1研究中,全部56例患者的中位总生存期(median overall survival,mOS)、PFS、疾病进展时间分别为16.0、7.8、5.7个月,展示了曲妥珠联合SP方案在HER2阳性转移性胃癌治疗中良好的抗肿瘤活性和应用前景[8]。此研究结果得到了Chua等[9]研究的证实。同样有效的联合方案还有曲妥珠联合XELOX(奥沙利铂+卡培他滨)。CGOG1001研究中,51例HER2阳性胃癌患者接受了曲妥珠单抗联合XELOX方案化疗,有效率达到66.7%、中位PFS和mOS分别为9.2个月,19.5个月[10]。
曲妥珠单抗联合不同化疗药物的一线治疗方案使HER2阳性胃癌的客观缓解率(objective response rate,ORR)提高至60%以上,OS达到16.0~20个月。不同方案联合应用的安全性及有效性不仅夯实了曲妥珠单抗在HER2阳性转移性胃癌中的基础治疗地位,而且拓宽了临床应用的范围。目前曲妥珠单抗一线联合治疗的研究汇总见表1。
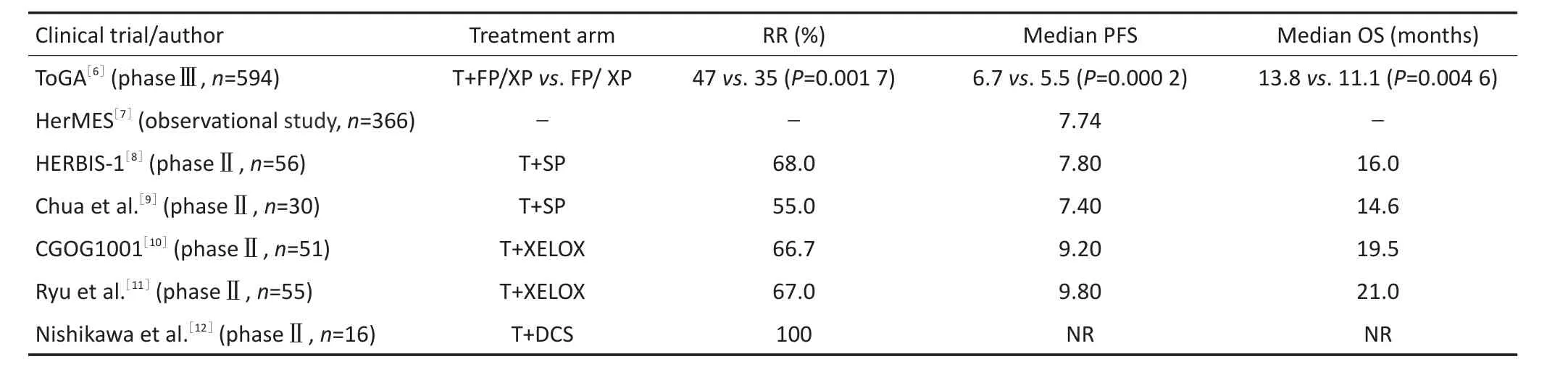
表1 曲妥珠单抗一线治疗HER2阳性晚期胃癌患者的主要临床研究Table 1Pivotal clinical trials for HER2-positive advanced gastric cancer,including trastuzumab as first-line treatment
1.2 二线治疗
曲妥珠在一线治疗中的良好疗效使研究者更加关注其在二线治疗中的表现。紫杉类是晚期胃癌5-Fu类化疗失败后可选用的二线方案之一。在HER2阳性胃癌二线靶向治疗的研究中,紫杉醇是常用的联用化疗药。Dai等[13]回顾性分析表明,既往未接受过曲妥珠单抗治疗的5-Fu治疗失败的患者二线应用曲妥珠单抗加紫杉类的方案治疗有效,PFS和OS分别可达6.8个月及16.0个月。这一结果得到了多中心Ⅱ期临床试验JFMC45-1102研究的验证[12]。该研究中,46例5-Fu治疗失败的HER2阳性晚期或复发胃癌患者接受了曲妥珠单抗+紫杉醇的二线方案治疗,获得了5.1个月的中位PFS及16.8个月的OS。曲妥珠单抗+紫杉醇的联合方案可以成为既往未接受曲妥珠单抗治疗、氟尿嘧啶类治疗失败后的HER2阳性患者的治疗选择。
1.3 跨线治疗
Li等[14]的多中心前瞻性观察研究进一步探讨了一线曲妥珠单抗治疗进展后二线继续应用曲妥珠单抗治疗可能带来的获益。研究中59例一线曲妥珠单抗治疗失败后的患者被分为曲妥珠单抗+化疗联合治疗组和单纯化疗组,结果显示联合组的PFS较单纯化疗组显著延长(3.1个月vs.2.0个月,P=0.008)。提示曲妥珠单抗一线治疗失败后继续应用曲妥珠单抗仍可获益。
1.4 转化及新辅助化疗
对于HER2阳性的局部进展期胃癌,多项研究显示曲妥珠单抗联合化疗是高度有效的新辅助治疗方案。2014年美国肿瘤临床学会(ASCO)年会上报道的HER-FLOT研究是探讨曲妥珠单抗联合FLOT围手术期治疗HER2阳性局部进展胃食管腺癌治疗疗效的Ⅱ期临床试验。研究结果显示,4个周期曲妥珠单抗联合FLOT新辅助化疗方案达到主要研究终点[手术标本病理完全缓解率(pathologic complete remission,pCR)],在52例评价标本中pCR率为23%。另一项发表于2015年ASCO年会的多中心Ⅱ期临床研究-NEOHX试验探讨了曲妥珠单抗+卡培他滨/奥沙利铂围手术期治疗HER2阳性可切除GC/EGJ腺癌的疗效。最终3个周期XELOX-T新辅助化疗方案18个月的主要研究终点为71%,达到预期分析决断点(70%)。围手术期XELOX+T方案治疗HER2阳性可切除GC/EGJ腺癌可行,疗效确切,ORR和pCR率分别为39%和8%。
对于不可手术切除的HER2阳性转移性胃癌,曲妥珠单抗联合3药的化疗方案结果较好。Mitsui等[15]选用了DCS(多西他赛+顺铂+替吉奥)加曲妥珠单抗的联合方案探讨HER2靶向治疗在HER2阳性胃癌转化治疗中的有效性。该研究纳入的16例HER2阳性不可切除转移性胃癌患者中,远处淋巴结转移患者11例(68.8%)、肝转移7例(43.8%)、腹膜转移4例(25%)、肺转移2例(12.5%)、骨转移和卵巢转移各1例(6.3%),其中9例(56.3%)患者存在>2处的转移灶。16例患者分别获得了高达100%应答率和56.3%的手术转化率。未手术患者的mOS为18.6个月,转化手术的mOS未达到。高应答率和手术转化率提示HER2靶向治疗在HER2阳性胃癌转化治疗中的重要作用,使DCS-T成为未来HER2阳性不可切除胃癌转化治疗或新辅助化疗的可能治疗策略,目前相关的Ⅲ期临床研究正在进行中。
2 抗HER2治疗的新药
除了曲妥珠单抗外,目前临床上应用及在研的HER2靶向药还包括帕妥珠单抗和抗体-药物偶联物等,它们分别通过结合HER2的不同部位发挥抗肿瘤作用。帕妥珠单抗及抗体-药物偶联物T-DM1在HER2阳性乳腺癌中的疗效已被肯定[16-18],两类药物在HER2阳性胃癌中的临床研究正在进行中。
2.1 帕妥珠单抗
与曲妥珠相似,帕妥珠单抗是一种人源化HER2单克隆抗体。帕妥珠单抗结合于HER2受体胞外Ⅱ区,抑制HER2同源或异源二聚体形成,继而阻止下游信号传导[19]。目前曲妥珠联合帕妥珠+多西他赛的治疗方案已成为HER2阳性晚期乳腺癌一线治疗的优选方案。在胃癌中,探讨不同剂量帕妥珠单抗联合曲妥珠单抗加化疗安全性的JOSHUA研究已证明了双靶向治疗的耐受性和安全性良好,并为Ⅲ期临床研究提供了帕妥珠的参考剂量(840/840 mmHg)[20]。正在进行中的随机对照JACOB试验将对帕妥珠联合曲妥珠治疗的有效性和安全性做更深一层的探讨和解答[21]。
2.2 抗体-药物偶联物
抗体-药物偶联物(antibody-drug conjugate,ADC),是由靶向特定位点的单克隆抗体和细胞毒药物通过化学键连接而成。曲妥珠单抗的抗体-药物偶联物与细胞表面HER2受体结合后通过内吞作用进入细胞,发挥药物细胞毒作用,同时曲妥珠单抗发挥靶向和抗肿瘤作用[22]。T-DM1-曲妥珠单抗和美登素的抗体药物已成为目前HER2阳性晚期乳腺癌二线治疗的优选药物。然而在胃癌中,探讨TDM1联合紫杉类对比单纯紫杉类化疗在HER2阳性晚期胃癌二线治疗有效性和安全性的Ⅲ期临床试验GATSBY研究未能获得阳性结果(2016年ASCO年会报道)。
目前,一种新的抗HER2抗体和拓扑异构酶I抑制剂的抗体药物复合物DS-8201a的临床前研究已完成[23]。在体内外药理学试验和动物模型中,DS-8201a表现出良好的抗肿瘤活性和耐受性。甚至在HER2高表达但T-DM1耐受的患者肿瘤移植物(patient-derived xenograft,PDX)模型中,DS-8201a亦能发挥有效作用。DS-8201a可能成为T-DM1耐药HER2阳性肿瘤治疗的有效选择。
3 抗HER2治疗新思路
血管内皮生成因子(vascular endothelial growth factor,VEGF)在胃癌组织中普遍高表达(免疫组织化学法)[24],VEGF和其受体是目前胃癌靶向治疗的另一个重要靶点。尽管抗血管生成药物在一线治疗中未能获得显著的生存获益[25],但在二线治疗方中,多个研究表明VEGFR2的单克隆抗体雷莫卢单抗联合化疗的治疗方案能显著延长HER2阳性患者的OS[26-27]。抗血管生成治疗是目前晚期胃癌二线治疗的基础治疗之一。
临床和临床前研究提示贝伐珠单抗在部分肿瘤治疗中可以克服曲妥珠单抗耐药[28-30]。多个临床研究探讨了两者联用在HER2阳性晚期胃癌中的安全性和有效性。2015年ASCO年会上报道的Ⅱ期MEGCA研究,采用了卡培他滨+奥沙利铂+贝伐珠单抗+曲妥珠单抗的治疗方案。结果显示,纳入的35例患者中位PFS为13.9个月,中位OS为21.7个月。Meulendijks等[31]的Ⅱ期临床研究探讨了3药方案联合双靶向治疗的有效性。纳入的25例患者一线治疗接受贝伐+曲妥珠单抗+DOC(多西他赛+顺铂+卡培他滨)的联合方案,PFS和OS分别为10.8个月和17.9个月。上述研究表明双靶点双靶向联合传统2药及3药的化疗方案在HER2阳性胃癌治疗中的疗效和安全性良好,贝伐珠单抗和曲妥珠单抗联合有协同效应。
上述联合抗血管生成药物的临床研究结果为抗HER2治疗提供了新的思路,未来应考虑在HER2阳性转移性胃食管癌中开展相应的随机对照Ⅲ期研究。
4 抗HER2治疗失败后的策略
尽管抗HER2治疗疗效显著,但大多数应用曲妥珠单抗的胃癌患者最终产生获得性耐药[32]。研究表明,HER2家族的其它受体如HER3的表达增强和HER2-HER3高水平异源二聚体化[33],Met和HER2通路之间的交互作用[34],HER2下游通路PI3K/AKT/ mTOR异常激活[35]均是获得性耐药的可能原因。2015年ASCO年会上报道的研究中对24例曲妥珠单抗治疗前及治疗进展后的HER2阳性胃癌患者进行二次取材,二代测序的结果显示曲妥珠耐药后的肿瘤组织存在多个新出现的基因变异,且不同患者进展后的突变基因不同。42%和21%的患者分别有CDK和PI3K/AKT/mTOR信号通路的激活,PTEN和MET的突变发生率均为4%,EGFR扩增率为8%,HER3、HER4扩增的患者均占4%。再次证实了HER2获得性耐药是多基因、多通路共同参与的复杂过程,同时也说明动态基因检测的必要性,应根据基因检测结果对不同患者实行个体化治疗。
阿法替尼是强效的EGFR、HER2、HER4的不可逆阻断剂。2014年ASCO年会报道的Ⅱ期临床研究中,19例曲妥珠单抗失败的晚期胃癌患者,接受阿法替尼40 mg/日,2例获得部分缓解,6例疾病稳定,疾病控制率为42.1%。结果提示,阿法替尼在治疗曲妥珠单抗难治性的HER2转移性胃食管癌中存在一定的临床疗效,值得进一步深入研究。
5 结语
基因分子分型的研究表明传统病理学中看似相同或相似的胃癌实际上是异质性极强的疾病。无论一线还是二线治疗,曲妥珠单抗联合不同的化疗方案均显示了突出的疗效,在局部进展期胃癌新辅助和晚期胃癌的转化性治疗中,有望发挥更为重要的作用。曲妥珠单抗与其他靶点药物联用的协同增效作用是进一步增强HER2治疗疗效的新思路。多次活检和动态基因检测提供了克服HER2瘤内异质性及不同抗HER2治疗获得性耐药机制的解决方法。新药和新研究必将使HER2这一精准医疗代表性分子标志物的潜在临床效用发挥到极致,未来HER2阳性晚期胃癌治疗选择将更加多样化,不同患者的治疗将更加精准化、个体化。
[1]Cancer Genome Atlas Research N.Comprehensive molecular characterization of gastric adenocarcinoma[J].Nature,2014,513(7517): 202-209.
[2]AkiyamaT,SudoC,OgawaraH,et al.Theproduct of thehumanc-erbB-2 gene:a 185-kilodalton glycoprotein with tyrosine kinase activity[J]. Science,1986,232(4758):1644-1646.
[3]Van Cutsem E,Bang YJ,Feng-Yi F,et al.HER2 screening data from ToGA:targeting HER2 in gastric and gastroesophageal junction cancer[J].Gastric cancer,2015,18(3):476-484.
[4]Hsieh AC,Moasser MM.Targeting HER proteins in cancer therapy and the role of the non-target HER3[J].Br J Cancer,2007,97(4):453-457.
[5]Okines A,Cunningham D,Chau I.Targeting the human EGFR family in esophagogastric cancer[J].Nat Rev Clin Oncol,2011,8(8):492-503.
[6]Bang YJ,Van Cutsem E,Feyereislova A,et al.Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer(ToGA):a phase 3,open-label,randomised controlled trial[J].Lancet,2010,376(9742):687-697.
[7]Al-Batran SE,Kroening H,Hannig CV,et al.Trastuzumab in combination with different first-line chemotherapies for treatment of HER2-positivemetastatic gastric or gastro-oesophageal junction cancer:Updated findings from the German non-interventional study HerMES[J].Eur J Cancer,2015,51:S444.
[8]Kurokawa Y,Sugimoto N,Miwa H,et al.Phase II study of trastuzumab in combination with S-1 plus cisplatin in HER2-positive gastric cancer (HERBIS-1)[J].Br J Cancer,2014,110(5):1163-1168.
[9]Chua C,Tan IB,Yamada Y,et al.Phase II study of trastuzumab in combination with S-1 and cisplatin in the first-line treatment of human epidermal growth factor receptor HER2-positive advanced gastric cancer[J].Cancer Chemother Pharmacol,2015,76(2):397-408.
[10]Gong J,Liu T,Fan Q,et al.Optimal regimen of trastuzumab in combination with oxaliplatin/capecitabine in first-line treatment of HER2-positive advanced gastric cancer(CGOG1001):a multicenter,phase II trial[J].BMC cancer,2016,16:68.
[11]Ryu MH,Yoo C,Kim JG,et al.Multicenter phaseⅡstudy of trastuzumab in combination with capecitabine and oxaliplatin for advanced gastric cancer[J].Eur J Cancer,2015,51(4):482-488.
[12]Nishikawa K,Takahashi T,Takaishi H,et al.Phase II study of the effectiveness and safety of trastuzumab and paclitaxel for taxane-and trastuzumab-naïve patients with HER2-positive,previously treated, advanced,or recurrent gastric cancer(JFMC45-1102)[J].Int J Cancer, 2017,140(1):188-196.
[13]Dai GH,Shi Y,Chen L,et al.Trastuzumab combined with docetaxelbased regimens in previously treated metastatic gastric cancer patients with HER2 over-expression[J].Hepatogastroenterology,2012, 59(120):2439-2444.
[14]Li Q,Jiang H,Li H,et al.Efficacy of trastuzumab beyond progression in HER2 positive advanced gastric cancer:a multicenter prospective observational cohort study[J].Oncotarget,2016,7(31):50656-50665. [15]Mitsui Y,Sato Y,Miyamoto H,et al.Trastuzumab in combination with docetaxel/cisplatin/S-1(DCS)for patients with HER2-positive metastatic gastric cancer:feasibility and preliminary efficacy[J].Cancer Chemother Pharmacol,2015,76(2):375-382.
[16]Baselga J,Cortes J,Kim SB,et al.Pertuzumab plus trastuzumab plus docetaxel for metastatic breast cancer[J].N Engl J Med,2012,366(2): 109-119.
[17]Swain SM,Baselga J,Kim SB,et al.Pertuzumab,trastuzumab,and docetaxel in HER2-positive metastatic breast cancer[J].N Engl J Med, 2015,372(8):724-734.
[18]Verma S,Miles D,Gianni L,et al.Trastuzumab emtansine for HER2-positive advanced breast cancer[J].N Engl J Med,2012,367(19):1783-1791.
[19]Franklin MC,Carey KD,Vajdos FF,et al.Insights into ErbB signaling from the structure of the ErbB2-pertuzumab complex[J].Cancer cell,2004, 5(4):317-328.
[20]Kang YK,Rha SY,Tassone P,et al.A phase IIa dose-finding and safety study of first-line pertuzumab in combination with trastuzumab, capecitabine and cisplatin in patients with HER2-positive advanced gastric cancer[J].Br J Cancer,2014,111(4):660-666.
[21]Oh DY,Bang YJ.Pertuzumab in gastrointestinal cancer[J].Expert Opin Biol Ther,2016,16(2):243-253.
[22]LoRusso PM,Weiss D,Guardino E,et al.Trastuzumab emtansine:a unique antibody-drug conjugate in development for human epidermal growth factor receptor 2-positive cancer[J].Clin Cancer Res,2011,17 (20):6437-6447.
[23]Ogitani Y,Aida T,Hagihara K,et al.DS-8201a,a novel HER2-targeting ADC with a novel DNA topoisomerase I inhibitor,demonstrates a promising anti-tumor efficacy with differentiation from T-DM1[J].Clin Cancer Res,2016,22(20):5097-5108.
[24]Grigore D,Simionescu CE,Stepan A,et al.Assessment of CD105,alpha-SMA and VEGF expression in gastric carcinomas[J].Rom J Morphol Embryol,2013,54(3 Suppl):701-707.
[25]Van Cutsem E,de Haas S,Kang YK,et al.Bevacizumab in combination with chemotherapy as first-line therapy in advanced gastric cancer:a biomarker evaluation from the AVAGAST randomized phase III trial[J]. J Clin Oncol,2012,30(17):2119-2127.
[26]Fuchs CS,Tomasek J,Yong CJ,et al.Ramucirumab monotherapy for previously treated advanced gastric or gastro-oesophageal junction adenocarcinoma(REGARD):an international,randomised,multicentre,placebo-controlled,phase 3 trial[J].Lancet,2014,383(9911): 31-39.
[27]Wilke H,Muro K,Van Cutsem E,et al.Ramucirumab plus paclitaxel versus placebo plus paclitaxel in patients with previously treated advanced gastric or gastro-oesophageal junction adenocarcinoma (RAINBOW):a double-blind,randomised phase 3 trial[J].Lancet Oncol, 2014,15(11):1224-1235.
[28]Singh R,Kim WJ,Kim PH,et al.Combined blockade of HER2 and VEGF exerts greater growth inhibition of HER2-overexpressing gastric cancer xenograftsthanindividual blockade[J].ExpMol Med,2013,45(11):e52. [29]Le XF,Mao W,Lu C,et al.Specific blockade of VEGF and HER2 pathways results in greater growth inhibition of breast cancer xenografts that overexpress HER2[J].Cell Cycle,2008,7(23):3747-3758.
[30]Sun Y,Dey N,Brammer M,et al.Bevacizumab confers additional advantage to the combination of trastuzumab plus pertuzumab in trastuzumabrefractory breast cancer model[J].Cancer Chemother Pharmacol,2013,72(4):733-745.
[31]Meulendijks D,Beerepoot LV,Boot H,et al.Trastuzumab and bevacizumab combined with docetaxel,oxaliplatin and capecitabine as firstline treatment of advanced HER2-positive gastric cancer:a multicenter phaseⅡstudy[J].Invest New Drugs,2016,34(1):119-128.
[32]Shimoyama S.Unraveling trastuzumab and lapatinib inefficiency in gastriccancer:Futuresteps(Review)[J].Mol ClinOncol,2014,2(2):175-181.
[33]Martin HL,Smith L,Tomlinson DC.Multidrug-resistant breast cancer: current perspectives[J].Breast Cancer(Dove Med Press),2014,6:1-13. [34]Lai AZ,Abella JV,Park M.Crosstalk in Met receptor oncogenesis[J]. Trends Cell Biol,2009,19(10):542-551.
[35]Matsuoka T,Yashiro M.The Role of PI3K/Akt/mTOR Signaling in Gastric Carcinoma[J].Cancers,2014,6(3):1441-1463.
(2016-10-07收稿)
(2017-01-13修回)
(编辑:武斌校对:郑莉)
Advances in the treatment for HER2-positive advanced gastric cancer
Yue YU1,Aiping ZHOU1,Yixin ZENG2
1Department of Medical Oncology,National Cancer Center/Cancer Hospital,Chinese Academy of Medical Sciences&Peking Union Medical College,Beijing 100021,China;2Beijing Hospital,Beijing 100000,China
Yixin ZENG;E-mail:zengyx@sysucc.org.cn
The addition of HER2-targeted therapy has markedly improved the survival and prognosis of patients with advanced gastric cancer.Inhibiting the HER2 signaling pathway has become the backbone treatment for advanced HER2-positive gastric cancer in the first-line setting.TOGA trial established trastuzumab in combination with cisplatin and 5-flurouracil as the standard first-line treatment.In the post-TOGA era,combinations of trastuzumab with other chemotherapy agents were proven to be effective as both the second-line treatment and the conversion treatment.Such combinations are promising in the neoadjuvant treatment for locally advanced gastric cancer.Research focuses on the development of novel anti-HER2 agents in combination with agents targeting against other signal pathways.Real-time monitoring of the gene expression profile is the key to discovering the mechanism of trastuzumab resistance.The preliminary results of existing clinical trials have shown potential to overcome resistance to trastuzumab.In this review, we summarized the treatment advancement for HER2 positive gastric cancer and the direction for future development,thereby providing guidance on clinical practice.
HER2,advanced gastric cancer,trastuzumab,targeted therapy

10.3969/j.issn.1000-8179.2017.02.148
①北京协和医学院,中国医学科学院,肿瘤医院肿瘤内科(北京市100021);②北京医院
曾益新zengyx@sysucc.org.cn
俞悦专业方向为肿瘤内科临床与基础研究。
E-mail:yuyueyykk123@163.com
