胃癌中DNA甲基化对miR-200c 141表达影响的研究
2017-02-21周欣亮张璁王玉栋赵连梅桑梅香单保恩
周欣亮张璁王玉栋赵连梅桑梅香单保恩③
·基础研究·
胃癌中DNA甲基化对miR-200c 141表达影响的研究
周欣亮①张璁②王玉栋①赵连梅②桑梅香②单保恩②③
目的:探讨胃癌组织中miR-200c/141CpG岛的甲基化水平与miR-200c/141表达水平和临床病理特征的相关性。方法:运用实时定量PCR(qRT-PCR)和BS-MSP方法检测胃癌组织和癌旁组织中miR-200c/141CpG岛的表达与其基因甲基化水平。统计学分析miR-200c/141CpG岛的甲基化水平与miR-200c/141水平和临床病理特征的关系。结果:miR-200c/141CpG岛的甲基化水平在胃癌组织中显著升高,miR-200c和miR-141的水平显著降低,miR-200c/141CpG岛的甲基化水平与miR-200c和miR-141的水平呈负相关。结论:胃癌组织中升高的miR-200c/141CpG岛的甲基化水平诱导miR-200c和miR-141表达降低。
胃癌 甲基化 miR-200c miR-141 临床病理特征
miRNAs是一类进化上高度保守的小分子非编码RNA,长度为21~25 nt[1-2]。研究发现,在乳腺癌中表达下调的miR-200c和miR-141能够增加乳腺癌细胞的侵袭转移能力[3]。近年来,对miRNAs识别和表达的高通量数据分析与生物信息学方法迅猛发展,其靶基因预测数据库更新迅速。但是,对miRNAs自身表达的调控机制研究尚不明确。近期的研究发现,DNA甲基化调节miR-200c/141簇在一些肿瘤和正常细胞中的表达发挥重要的作用[4]。但miR-200c和miR-141在胃癌中表达的调控机制尚不清晰。本实验通过实时定量PCR(qRT-PCR)方法和BS-MSP方法检测胃癌组织和癌旁组织中miR-200c/ 141上游CpG岛甲基化水平和miR-200c/141的表达情况,并分析甲基化水平与miR-200c和miR-141表达水平的关系,以期阐明miR-200c/141在胃癌中表达的调控机制。
1 材料与方法
1.1 材料
1.1.1 临床资料收集河北医科大学第四医院2012年5月至2013年1月胃癌根治性手术切除标本64例。患者术前未行任何放疗及新辅助治疗。每例标本采集肿瘤组织(非坏死部分)和癌旁组织(距肿瘤组织>5 cm),取出后立即放入冻存管于液氮保存。所有标本均经病理学诊断为胃癌。收集患者、性别、年龄、手术记录、病理号码、病理报告等临床资料。共64例(1例数据丢失)患者中男性54例、女性9例,年龄40~78岁,平均(56.6±8.93)岁。按临床病理资料进行分析,包括浸润深度(T1、T2、T3和T4)、淋巴结转移(N0、N1、N2、N3a、N3b)、远处转移(M0、M1)、肿瘤TNM分期(Ⅰa、Ⅰb、Ⅱa、Ⅱb、Ⅲa、Ⅲb、Ⅲc和Ⅳ)、病理组织学分级(高-中分化和低分化)和脉管瘤栓(阴性/阳性),其中TNM分期依照第7版《AJCC癌症分期手册》进行。
1.1.2 主要试剂Trizol试剂、PureLink®Genomic DNA Mini Kit、实验相关引物均购自美国Invitrogen公司;逆转录试剂盒、GoTaq®qPCR Master Mix、GoTaq®Hot Start Green Master Mix均购自美国Fementas公司;EpiTect Fast DNA Bisulfite Kit、EpiTect PCR Control DNA Set均购自美国Qiagen公司;地西他滨(5-aza-2′-deoxycytidine)购自美国Sigma-Aldrich公司;所有无RNaes相关耗材均购自美国AXYGEN公司。
1.2 方法
1.2.1 CpG岛的预测在线应用MethPrimer Program和CpG Island Searcher预测miR-200c/141上游CpG岛,在其上游有1个CpG岛存在,位于7072547到7072693,长度为146 bp(图1)。
1.2.2 组织中DNA的提取及DNA甲基化修饰(亚硫酸盐处理)根据美国Invitrogen公司PureLink®Genomic DNA Mini Kit操作手册提取组织中DNA。根据美国Qiagen公司EpiTect Fast DNA Bisulfite Kit操作手册提取DNA进行甲基化修饰。
1.2.3 PCR扩增根据GoTaq®Hot Start Green Master Mix操作手册,以亚硫酸氢盐处理后的DNA为模板,进行PCR反应。miR-200c/141-M(miR-200c/141甲基化引物)上游引物为:5′-GTAAATCGGTGTGTGTCGCGGG TCG-3′;下游引物为:5′-CAAACCCTCCGAAACCCCT CGACCG-3′。miR-200c/141-UM(miR-200c/141非甲基化引物)上游引物为:5′-GTAAATTGGTGTGTGTTGTG GGTTG-3′;下游引物为:5′-CAAACCCTCCAAAACCCC TCAACCA-3′。miR-200c/141-M的热循环条件:95℃5 min预变性,95℃20 s,65℃30 s,72℃20 s,30个循环,最后72℃延伸6min。miR-200c/141-UM的热循环条件:95℃5min预变性,95℃20 s,61℃30 s,72℃20 s,30个循环,最后72℃延伸6 min。各标本均设有空白对照。将PCR扩增产物于2.0%琼脂糖凝胶中电泳,采用Gel-Proanalysis3.1软件进行扫描观察结果。测定目的基因光密度值(optical density,OD)。甲基化率=甲基化产物OD/(甲基化产物OD+非甲基化产物OD)×100%。
1.2.4 实时荧光定量PCRTRIZOL法提取组织或细胞总RNA,检测其RNA浓度、纯度和完整性,应用Fementas公司的反转录试剂盒将miRNA或mRNA反转录为cDNA。参照GoTaq®qPCR Master Mix说明书推荐配制反应溶液,将PCR反应溶液置于ABI 7500仪器Real-time PCR仪上进行PCR反应。相关引物序列见表1。循环设置为两步法。数据采用RQ=2-△△Ct表示相对定量结果,以U6作为内参,每个组织样本重复3次。所用特异引物如下:hsa-miR-200c-RT:GTCGTATCCAGTGCGT GTCGTGGAGTCGGCAATTGCACTGGATACGATCCATC;hsa-miR-200c-Forward:GGCCTAATACTGCCGGGTAA T;hsa-miR-141-RT:GTCGTATCCAGTGCGTGTCGTGG AGTCGGCAATTGCACTGGATACGACCATCT;hsa-miR-141-Forward:CCCGGGTAACACTGTCTGGTAA;hsa-U6-RT:CGCTTCACGAATTTGCGTGTCAT;U6-Forward:GCTTCGGCAGCACATATACTAAAAT;Universal Primer:CAGTGCGTGTCGTGGAGT。
1.3 统计学分析
采用SPSS13.0软件进行统计学分析,癌组织与癌旁组织中miR-200c/141CpG岛的甲基化水平及miRNAs的水平用中位数和四分位数表示,分析其表达差异采用Wilcoxon符号秩检验;分析miR-200c/ 141CpG岛的甲基化水平与临床病理参数的相关性时,两组比较用Wilcoxon秩和检验,三组及以上组间差异采用Kruskal-Wallis检验。分析miR-200c/ 141CpG岛的甲基化水平与miR-200c/141的表达水平的相关性时,采用Spearman检验。以P<0.05为差异具有统计学意义。
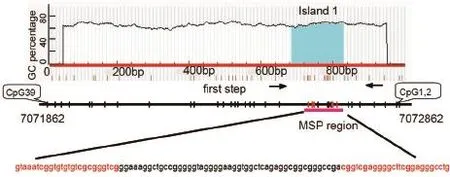
图1 miR-200c/141CpG岛在DNA中所处的位置Figure 1Locations of the hypermethylated fragment of miR-200c/141.One CpG island located at 500 bp upstream of the miR-200c/141 genomic sequence
2 结果
2.1 miR-200c和miR-141在胃癌组织中的表达水平
64例胃癌标本中(1例数据丢失),分别有50例(78.13%)和48例(76.19%)标本存在miR-200c和miR-141的表达下调。与癌旁组织相比,miR-200c和miR-141在胃癌组织中的表达显著降低(P<0.001,P<0.001,图2)。
2.2 胃癌标本中miR-200c/141上游CpG岛的甲基化水平
64例胃癌标本中(1例数据丢失),miR-200c/141上游CpG岛的甲基化水平升高率为84.13%(53/63),相较于癌旁组织,miR-200c/141上游CpG岛的甲基化水平在胃癌组织中显著升高(P<0.001,图3)。

图2 miR-200c和miR-141在胃癌中的表达情况Figure 2Differential expression of miR-200c and miR-141 in gastric cancer specimens

图3 胃癌标本中miR-200c/141上游CpG岛的甲基化水平Figure 3Methylation status of miR-200c/141 CpG island was analyzed by bisulfite conversion-and methylation-specific PCR in gastric cancer tissue and adjacent tissue
2.3 miR-200c/141上游CpG岛的甲基化水平与胃癌患者临床病理特征的相关性。
64例胃癌患者中(1例数据丢失),miR-200c/141上游CpG岛的甲基化水平与患者性别、年龄、组织学分级、TNM分期、肿瘤侵袭深度、淋巴结转移情况、肿瘤远处转移情况及脉管瘤栓均无显著性相关(表1)。
2.4 miR-200c/141上游CpG岛的甲基化水平与miR-200c和miR-141表达的相关性。
miR-200c/141上游CpG岛的甲基化水平与miR-200c和miR-141的水平呈负相关(表2)。
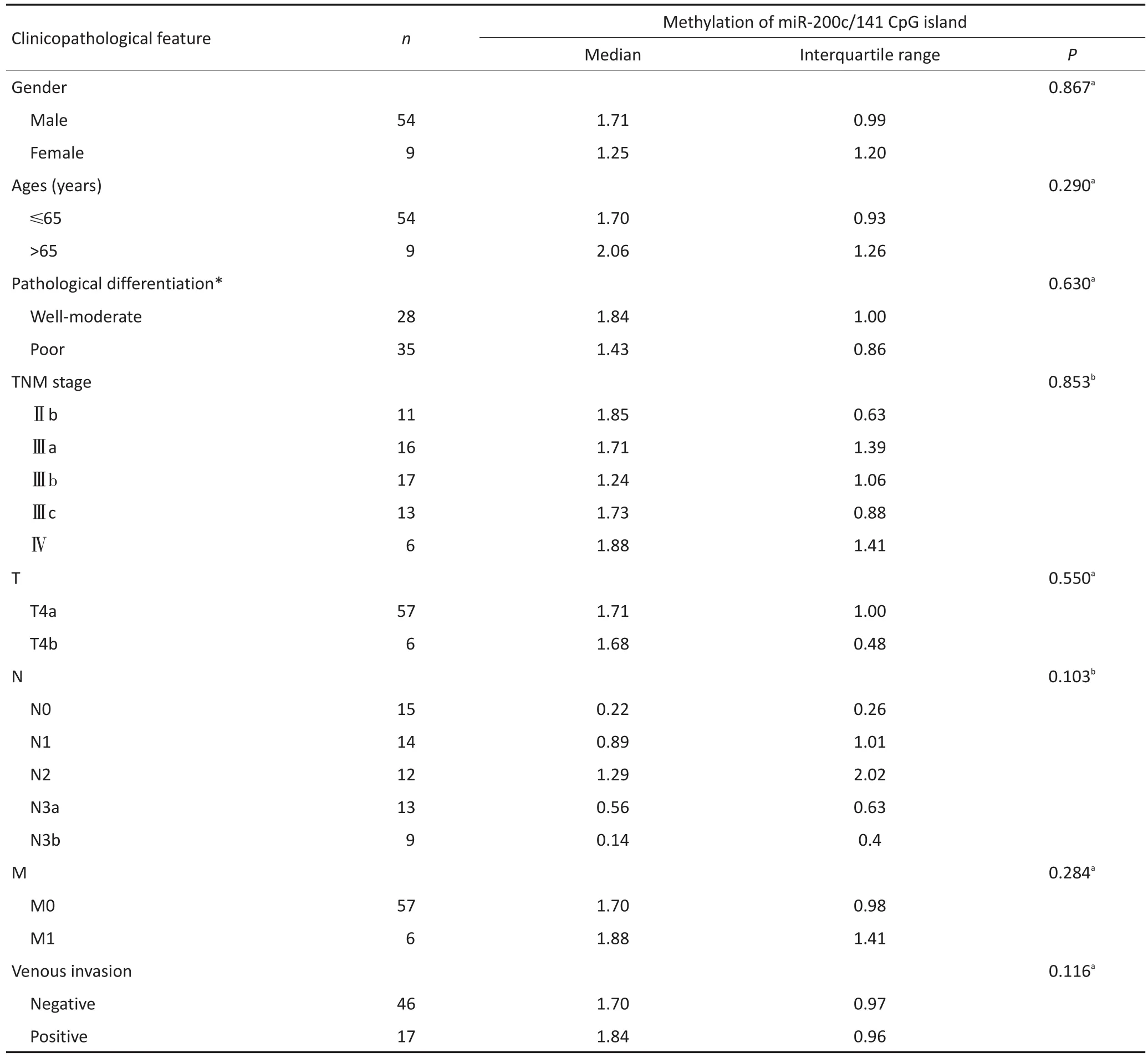
表1 胃癌中miR-200c/141CPG岛甲基化水平与胃癌患者临床病理特征的关系Table 1Correlations of the methylation status of miR-200c/141 CpG island in gastric cancer specimens with the clinicopathological feature

表2 miR-200c/141上游CpG岛的甲基化水平与miR-200c和miR-141表达的相关性Table 2Correlations of the expression levels of miR-200c and miR-141 in gastric cancer specimens with the expression level of TGF-β and CpG island cytosine methylation level of miR-200c/141
3 讨论
miR-200c和miR-141为miR-200家族的两个成员,成簇表达,转录为一个多顺反子的原始miRNA转录物miR-200c/141,位于人第12(12p13.31)常染色体上[5]。miR-200c和miR-141在多种恶性肿瘤中存在表达异常[6-10],近期研究表明,miR-200c和miR-141能够通过抑制ZEB1和ZEB2的表达促进乳腺癌细胞侵袭转移的发生,促进肿瘤的发展,发挥抑癌基因的作用[3]。miR-200c和miR-141可作为生物靶点进行抗肿瘤治疗。本研究发现,miR-200c和miR-141在胃癌组织中的表达显著降低。提示miR-200c和miR-141可能在胃癌的发生发展过程中发挥作用。miR-200c和miR-141在肿瘤中发挥的功能及其机制研究较多,但miR-200c和miR-141在胃癌中的表达调控机制尚不明确。
人类miRNAs基因多数位于易于发生点突变、染色体易位和染色体缺失的区域[11-12],miRNAs的表达可受到表观遗传学因素的影响,如DNA甲基化[13]。Wu等[14]研究发现miR-429启动子区CpG岛的高甲基化抑制其在肾透明细胞癌中的表达;Yang等[15]发现miR-129-2基因上游的高甲基化率抑制其在胶质瘤细胞中的表达。本研究发现,在胃癌组织中miR-200c/141转录起始位置附近存在一个CpG岛,miR-200c/141上游CpG岛的甲基化水平相较于癌旁组织显著升高,且miR-200c/ 141上游CpG岛的甲基化水平与miR-200c和miR-141的水平呈负相关。
BS-MSP是一种快速、实用的基因甲基化检测方法,灵敏度高、特异性强,能同时检测多个CpG位点的甲基化情况,对于深入研究肿瘤相关基因表达调控机制具有重要意义,可以较好地揭示启动子区CpG岛所包含的表观遗传学信息,以明确DNA甲基化模式在基因差异表达机制中的作用。既往研究中,BSMSP法仅能对肿瘤组织中CpG岛甲基化情况进行定性分析[16]。本研究中首次应用BS-MSP法对胃癌组织中miR-200c/141上游CpG岛的甲基化水平进行半定量分析,数据更精准、可靠,与在MSP的基础上研发的MethyLight技术相类似。
综上所述,胃癌组织中升高的miR-200c/141 CpG岛的甲基化水平能够使miR-200c和miR-141的表达降低。本研究运用BS-MSP法对CpG岛的甲基化进行半定量分析,其结果及实验方法的运用将有利于从分子水平揭示胃癌发生发展的病因,以期为胃癌的治疗提供可靠的生物靶点。
[1]Standart N,Jackson RJ.MicroRNAs repress translation of m7Gpppcapped target mRNAs in vitro by inhibiting initiation and promoting deadenylation[J].Genes Dev,2007,21(16):1975-1982.
[2]Nilsen TW.Mechanisms of microRNA-mediated gene regulation in animal cells[J].Trends Genet,2007,23(5):243-249.
[3]Damiano V,Brisotto G,Borgna S,et al.Epigenetic silencing of miR-200c in breast cancer is associated with aggressiveness and is modulated by ZEB1[J].Genes Chromosomes Cancer,2016.[Epub ahead of print].
[4]Vrba L,Jensen TJ,Garbe JC,et al.Role for DNA methylation in the regulation of miR-200c and miR-141 expression in normal and cancer cells[J].PLoS One,2010,5(1):e8697.
[5]Paterson EL,Kazenwadel J,Bert AG,et al.Down-regulation of the miRNA-200 family at the invasive front of colorectal cancers with degraded basement membrane indicates EMT is involved in cancer progression[J].Neoplasia,2013,15(2):180-191.
[6]Liu S,Tetzlaff MT,Wang T,et al.miR-200c/Bmi1 axis and epithelialmesenchymal transition contribute to acquired resistance to BRAF inhibitor treatment[J].Pigment Cell Melanoma Res,2015,28(4):431-441.
[7]Abedi N,Mohammadi-Yeganeh S,Koochaki A,et al.miR-141 as potential suppressor of β-catenin in breast cancer[J].Tumour Biol,2015, 36(12):9895-9901.
[8]Wu PP,Zhu HY,Sun XF,et al.MicroRNA-141 regulates the tumour suppressor DLC1 in colorectal cancer[J].Neoplasma,2015,62(5):705-712.
[9]Zhou H,Tang K,Xiao H,et al.A panel of eight-miRNA signature as a potential biomarker for predicting survival in bladder cancer[J].J Exp Clin Cancer Res,2015,34(1):53.
[10]Chen X,Wang X,Ruan A,et al.miR-141 is a key regulator of renal cell carcinoma proliferation and metastasis by controlling EphA2 expression[J].Clin Cancer Res,2014,20(10):2617-2630.
[11]Calin GA,Sevignani C,Dumitru CD,et al.Human microRNA genes are frequently located at fragile sites and genomic regions involved in cancers[J].Proc Natl Acad Sci U S A,2004,101(9):2999-3004.
[12]Makunin IV,Pheasant M,Simons C,et al.Orthologous microRNA genes are located in cancer-associated genomic regions in human and mouse[J].PLoS One,2007,2(11):ell33.
[13]Lujambio A,Esteller M.CpG island hypermethylation of tumor suppressor microRNAs in human cancer[J].Cell Cycle,2007,6(12):1455-1459.
[14]Wu A,Wu K,Li M,et al.Upregulation of microRNA-492 induced by epigenetic drug treatment inhibits the malignant phenotype of clear cell renal cell carcinoma in vitro[J].Mol Med Rep,2015,12(1): 1413-1420.
[15]Yang Y,Huang JQ,Zhang X,et al.MiR-129-2 functions as a tumor suppressor in glioma cells by targeting HMGB1 and is down-regulated by DNA methylation[J].Mol Cell Biochem,2015,404(1-2):229-239.
[16]Guo W,Zhu TN,Dong ZM,et al.Aberrant methylation and expression of growth arrest and DNA-damage-inducible 45G gene inesophageal squamous-cell carcinoma[J].TUMOR,2013,33(1):74-80.
(2016-09-23收稿)
(2017-01-12修回)
MiR-200c/141 methylation inhibits the expression of miR-200c and miR-141 in gastric cancer
Xinliang ZHOU1,Cong ZHANG2,Yudong WANG1,Lianmei ZHAO2,Meixiang SANG2,Baoen SHAN2,3
1Oncology Department,The Fourth Hospital of Hebei Medical University,Shijiazhuang 050011,China;2Research Center,The Fourth Hospital of Hebei Medical University,Shijiazhuang 050011,China;3Tumor Research Institute of Hebei,Shijiazhuang 050011,China
Baoen SHAN;E-mail:jsyyxyk2014@163.com
Objective:This work aims to detect the levels of miR-200c/141 methylation and miR-200c/141 in gastric cancer tissue and investigate the relationship between miR-200c/141 expression and clinical parameters.Methods:The methylation status of miR-200c/ 141 CpG island and miR-200c/141 in gastric cancer tissue specimens was evaluated by qRT-PCR or BS-MSP method.We analyzed the relationship among the methylation status of miR-200c/141 CpG island,expression level of miR-200c or miR-141,and clinical parameters.Results:The status of miR-200c/141 CpG island methylation in gastric cancer tissue was significantly higher compared with that in paracarcinoma tissue.MiR-200c and miR-141 were markedly decreased in gastric cancer tissue compared with those in adjacent tissue.MiR-200c/141 CpG island methylation was negatively related with the expression of miR-200c and miR-141 in gastric cancer specimens.Conclusion:The upregulation of miR-200c/141 CpG methylation inhibits miR-200c/141 expression in gastric cancer tissue.
gastric cancer,methylation,miR-200c,miR-141,clinicopathological feature

10.3969/j.issn.1000-8179.2017.02.119
①河北医科大学第四医院肿瘤内科(石家庄市050011);②科研中心;③河北省肿瘤研究所
单保恩baoenshan1962@126.com
周欣亮专业方向为肿瘤的精准治疗及非编码RNA在肿瘤中的作用机制等基础研究。
E-mail:zhouxlhappy@hotmail.com
