生防细菌对水稻的促生性及诱导抗性研究
2017-02-20张小芳魏兰芳史恭林姬广海
张小芳, 艾 瑛, 魏兰芳, 史恭林, 王 星, 李 凡, 姬广海*
1.云南农业大学, 农业生物多样性与病虫害控制教育部重点实验室, 昆明 650201; 2.云南省玉溪市通海县植保植检站, 云南 玉溪 652700; 3.云南农业大学, 农科基础实验教学中心, 昆明 650201
生防细菌对水稻的促生性及诱导抗性研究
张小芳1, 艾 瑛2, 魏兰芳3, 史恭林3, 王 星1, 李 凡1, 姬广海1*
1.云南农业大学, 农业生物多样性与病虫害控制教育部重点实验室, 昆明 650201; 2.云南省玉溪市通海县植保植检站, 云南 玉溪 652700; 3.云南农业大学, 农科基础实验教学中心, 昆明 650201
研究了4株生防菌对水稻白叶枯病的抑制作用和菌悬液浸种、浸芽、浇苗和包衣4种处理对水稻生长的促进作用,及对水稻体内过氧化物酶POD、多酚氧化酶PPO、苯丙氨酸解氨酶PAL 3种保护酶的诱导表达作用。结果表明,4个菌株均对水稻幼苗有促生及诱导抗病性的作用。其中,WY2菌株诱导水稻抗病性和对水稻的促生性都要优于其他3株菌株。水稻幼苗接种生防细菌24 h后再接种病原菌,生防细菌能促进植物体内保护酶PAL、POD、PPO活性的提高,进而诱导植物抗病性的提高。
生防细菌;促生性;诱导抗性;水稻细菌性条斑病
由各种病害造成的农作物损失严重,一般可达其总产量的30%~40%[1]。农业生产上,化学农药是防治植物病虫害的首选方式,但其长期的不合理使用造成了极大的负面影响,诸如化学农药的高毒高残留、病原菌与害虫产生抗药性、造成水体土壤等污染。随着人们对食品安全的日益关注与可持续控制病虫害发展的需要,生物防治受到了国内外植物保护工作者的重视。植物病害的生物防治主要包括:①利用拮抗菌对病原菌的拮抗作用来防治病害;②诱发植物自身的抗病性。作为植物病害生物防治因子深入研究的细菌类群很多,主要有:土壤杆菌属(Agrobacteriumspp.)、假单胞菌属(Pseudomonasspp.)、芽孢杆菌属(Bacillusspp.)、欧文氏菌属(Erwiniaspp.)、短杆菌属 (Curobacteriumspp.)、节杆菌属(Arthrobacterspp.)和溶杆菌属(Lysobacterspp.)等[2,3]。
目前,应用较多的生防细菌是芽孢杆菌。关于芽孢杆菌的生防促生机制,国内外学者进行了大量研究,普遍认为芽孢杆菌生防机制主要有营养和空间位点竞争、抗菌物质产生、溶菌作用和诱导植物抗病性等方面。林东等[4]发现枯草芽孢杆菌SO113对水稻白叶枯病菌具有强烈的抑菌作用。陈志谊等[5]报道BacillussubtilisB-916菌株对水稻纹枯病的防效达50%~81%,且该菌株与井岗霉素按一定比例混合可提高后者防治水稻纹枯病的效果。胡剑等[6]从枯草芽孢杆菌0BS-98中分离纯化抗真菌蛋白,发现它对苹果轮纹病、芦笋枯萎病具有很强的抑制作用。顾真荣等[7]评估显示枯草芽孢杆菌G3对菜豆和茄子苗期炭疽病、菌核病以及番茄叶霉病具有很好的防效。
溶杆菌1978年由Christensen和Cook命名[8]。溶杆菌属(Lysobacter)细菌属于黄单胞菌科(Xanthomonadaceae),该菌能够溶解一些病原细菌、真菌和线虫,产生抗生素、生物表面活性物质以及诱导寄主抗病性等,是一类具有极大生防潜力的生防菌。O′sullivan等[9]在1988年从溶杆菌属菌体细胞中分离得到的二盐基缩氨酸类抗生素lysobactin对革兰氏阳性细菌有较强的抑菌作用。1999年Md等[10]研究发现溶杆菌Lysobactersp. SB-K88能够产生一种对甜菜瘁倒病有明显拮抗作用的抗生素xanthobaccin A。2003年Larissa 等[11]从溶杆菌Lysobactersp. 3.1T8上分离出一种对黄瓜瘁倒病有较好防治效果的抗生素。2005年Kobayashi等[12]研究产酶溶杆菌C3时发现一种新的具有热稳定性的抗生素物质(HSAF),它通过调节神经酰胺酶的合成途径来改变菌丝的形态,从而达到控制病害的目的。
目前许多研究认为,诱导抗性有两种类型:一类是由病菌无毒菌株或无毒基因产物和一些化学因子诱导的系统性获得抗性(SAR),这类诱导抗性由诱导因子激发植物SAR基因表达,产生一系列防卫反应如合成病程相关蛋白(PR)等,并由水杨酸介导[13]。例如,Ongena等[14]系统研究了枯草芽孢杆菌对黄瓜(炭疽病)、烟草(霜霉病)、番茄(灰霉病) 和大豆(灰霉病)的诱导抗病性信号传导途径和防卫反应基因表达差异,并首次证明枯草芽孢杆菌产生的脂肽类抗生素surfactin和fengycin是诱导寄主植物产生防卫反应的激发子,它们与特定受体发生识别反应,从而激发植物依赖水杨酸( SA) 途径的防卫反应。另一类是由根际促生细菌(PGPR)引起的诱导系统抗性(ISR),通常PGPR诱导的ISR是由种子处理或土壤浇灌获得[15]。
生防细菌因其具有防病效果好、对人畜安全和对环境无污染等优点而受到重视。实验室前期从云南省不同地区分离到了多株芽孢杆菌和溶杆菌,并在魔芋软腐病、烟草青枯病、水稻条斑病和水稻白叶枯病病原菌进行了室内抑菌试验初试。本文拟选用实验室分离保存的3株芽孢杆菌和1株溶杆菌对水稻的促生性及诱导抗性进行研究,为进一步研究和应用提供理论依据。
1 材料和方法
1.1 试验时间、地点
本研究田间试验于2014年5月在云南农业大学校内温室进行,室内试验在农业生物多样性国家工程中心进行。
1.2 试验材料
供试生防菌株为解淀粉芽孢杆菌C3;甲基营养型芽孢杆菌R2-2[16];解淀粉芽孢杆菌WY2;抗生素溶杆菌YFY02(申请专利,已受理);水稻材料为感病品种IR24。材料均由云南农业大学生物多样性国家工程中心细菌实验室提供。
1.3 生防细菌处理对水稻生长的促进作用
1.3.1 菌液的制备及处理方法 所用菌株为C3、R2-2、WY2、YFY02。将其生防菌液在营养肉汁琼脂NA培养基(葡萄糖10 g,蛋白胨5 g,牛肉浸膏3 g,酵母浸膏1 g,琼脂粉17 g,用去离子水混合配制1 000 mL)上活化,28℃培养2 d。用移菌环挑取单菌落放于NA液体培养基中摇菌24~36 h。用分光光度计在600 nm下调OD值到0.5。将OD值为0.5的生防菌液按照100倍、200倍、500倍的浓度梯度稀释,并分别用作浸种、浸芽、浇苗、包衣处理。浸种处理48 h,每24 h更换处理液一次;浸芽在种子出芽后用处理液浸泡48 h,每24 h更换一次处理液;浇苗在两叶期进行;包衣处理使用羧甲基纤维素,羧甲基纤维素与稀释菌液按照1%的体积比混合在一起,羧甲基纤维素的浓度控制在0.2%。混合液置于装有种子的三角瓶中,在摇床中摇2~6 h,取出阴干,然后催芽播种。水稻材料采用感病品种IR24。清水为对照。每个处理3次重复,每个重复30粒种子。水稻播种30 d后,到幼苗两叶期时调查促生效果。
1.3.2 测定指标与方法 苗高和根长:每个处理分别取水稻苗10棵,测量各处理幼苗和根的长度,其中根以最长的一根为测量对象,以每一处理10棵幼苗的平均值作为苗高(cm)和根长(cm)。
根数:统计所有长度大于2 cm的根的条数,最后同样取每一处理的所有参试幼苗的平均值。
苗干重与根干重:将幼苗与根分开用吸水纸包好,自然风干后用0.001 g天平称重,其重量除以幼苗数即为干重(mg)。
1.4 生防细菌处理水稻诱导抗性研究
经C3、R2-2、WY2、13-6 4株生防菌液处理后的种子播种长至抽穗期。将水稻细菌性条斑病菌在NA培养基上活化,28℃培养2 d。用移菌环挑取少量菌株放于NA液体培养基中摇菌24~36 h。加入适量无菌水制成菌悬液,用喷雾器均匀的喷洒在水稻叶片上,每个处理接种相同量的菌液,待21 d后调查其诱导抗性效果。
1.5 生防细菌处理对水稻幼苗地上部3种酶活性的影响
水稻感病品种IR24置28℃恒温培养箱光照培养,生长至三叶期时分别用C3、R2-2、WY2、YFY02菌液处理,对照用清水。分别在处理的0、12 h、36 h、48 h、96 h时取叶片测定有关指标。
1.5.1 过氧化物酶(POD)活性测定[17]标准曲线的制作:取20 mL具塞试管6支,编号,按下表配制四邻甲氧基苯酚标准系列溶液,混匀后以1号管调零,于470 nm波长下测定吸光度,以标准液浓度为横坐标,吸光度为纵坐标绘制标准曲线。
POD的提取及活性测定:取待测水稻叶片适量,剪碎混匀于研钵中,加少量石英砂、碳酸钙和适量蒸馏水,冰浴研磨成匀浆,蒸馏水定量至50 mL,摇匀后离心,上清液即为待测酶液。POD活性测定参照孙红炜等[18]的方法。
POD活性测定[19]:取20 mL具塞试管3支,2支测定(3个重复),1支空白对照。各加入酶液1 mL,0.1%愈创木酚1 mL,蒸馏水6.9 mL,摇匀,加入0.18%双氧水1 mL(对照用蒸馏水),摇匀计时,25℃准确反应10 min,加5%偏磷酸0.2 mL终止反应。用标准曲线1号管调零,于分光光度计测定A470的吸光值。
过氧化物酶活力=(X-Y)×Vt/wF×Vs×t
式中:X:测定管四邻甲氧基苯酚的含量(μg)。Y:对照四邻甲氧基苯酚的含量(μg)。Vt:酶液总体积(mL)。wF:样品鲜重(g)。Vs:测定时取酶液的量(mL)。t:酶作用时间(min)。
1.5.2 多酚氧化酶(PPO)活性测定 每个处理叶片准确称取0.1 g,剪碎,加2 mL 0.1 mol/L 预冷的PBS磷酸缓冲液和少量石英砂于冰浴下研磨成匀浆,4℃下12 000 r/min离心20 min,将上清液移入另一容器中冰浴保存。反应系统中,以邻苯二酚为底物,反应成分包括0.02 mol/L邻苯二酚1.5 mL,pH 6.8的PBS缓冲液1.5 mL和1 mL酶液。反应液先于37℃放置2 min后,测定OD398的光密度值,10 min内每分钟记录一次光密度值,以不加酶液而加相同体积的缓冲液作为空白对照。以每分钟使OD398变化0.01的酶量为一个酶活力单位。
酶活力=△OD398×V/0.01×Vt×w×t
式中:0.01:酶活单位;V:提取酶液的总体积(mL);Vt:测定时酶液用量(mL);w:用于提酶的叶片重量(g);t:△OD398变化所用时间(min)。
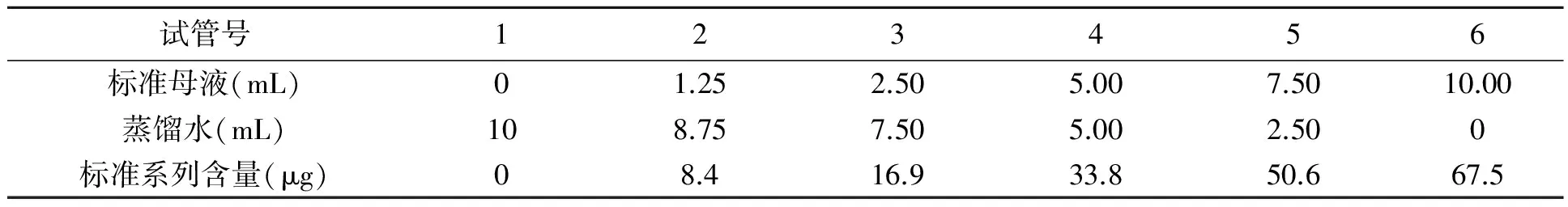
表1 标准曲线
1.5.3 苯丙氨酸解氨酶(PAL)活性测定 称取适量的水稻幼苗组织,先加1.5 mL预冷的提取液(即7 mmol/L巯基乙醇硼酸缓冲液)、过量的聚乙烯吡咯烷酮(但不能太多,否则不易研磨)、少量石英砂在冰浴下研磨成浆,再加3.5 mL预冷的提取液使其终体积为5 mL。于12 000 g/min 4℃离心15 min,用吸管吸取上清液,上清液即粗酶液。
酶活的测定:反应液包括:0.02 mol/L L-苯丙氨酸1 mL;0.1 mol/L硼酸缓冲液(pH 8.8)2 mL;0.1 mL粗酶液(对照以0.1 mL巯基乙醇缓冲液代替酶液)。反应液用涡旋混合器混匀后立即在290 nm处测起始OD值,并精确计时,每一样品重复两组。将测定后的各管于30℃水浴保温30 min,再于290 nm处测定各管的OD值。本实验以每30 min在波长290 nm处吸光率增加0.01所需酶量为1个单位。
苯丙氨酸解氨酶活力=30 min内吸光度的差值×V/a×w×0.01
式中:a:测定时的酶液用量(mL);V:酶液总体积(mL);w:样品重量(g)。
2 结果与分析
2.1 生防细菌处理对水稻生长的促生作用
生防菌株的处理对水稻的生长均具有促进的作用。4株菌株YFY02、C3、R2-2、WY2的促生作用见图1~4。YFY02的促生作用见图1,200倍包衣为最优处理(P<0.05),它对水稻幼苗的促生效果最为明显,株高、根长、根数、苗干重和根干重等5项指标均高于对照和其他处理。C3、R2-2、WY2菌株的处理中,500倍包衣均为最优处理,株高等5项指标均高于对照和其他处理(图1~4)。以上说明的是相同菌株之间促生效果。不同菌株之间的促生效果见表2,YFY02菌株处理之后,有根长和苗干重两个指标均高于其他菌株处理;C3则没有;R2-2菌株处理之后,有苗干重和根干重两个指标均高于其他菌株处理;WY2菌株处理之后,有株高、根数、苗干重3个指标均高于其他菌株处理。综合以上结果显示,WY2菌株包衣500倍的稀释液处理水稻种子为最优处理。
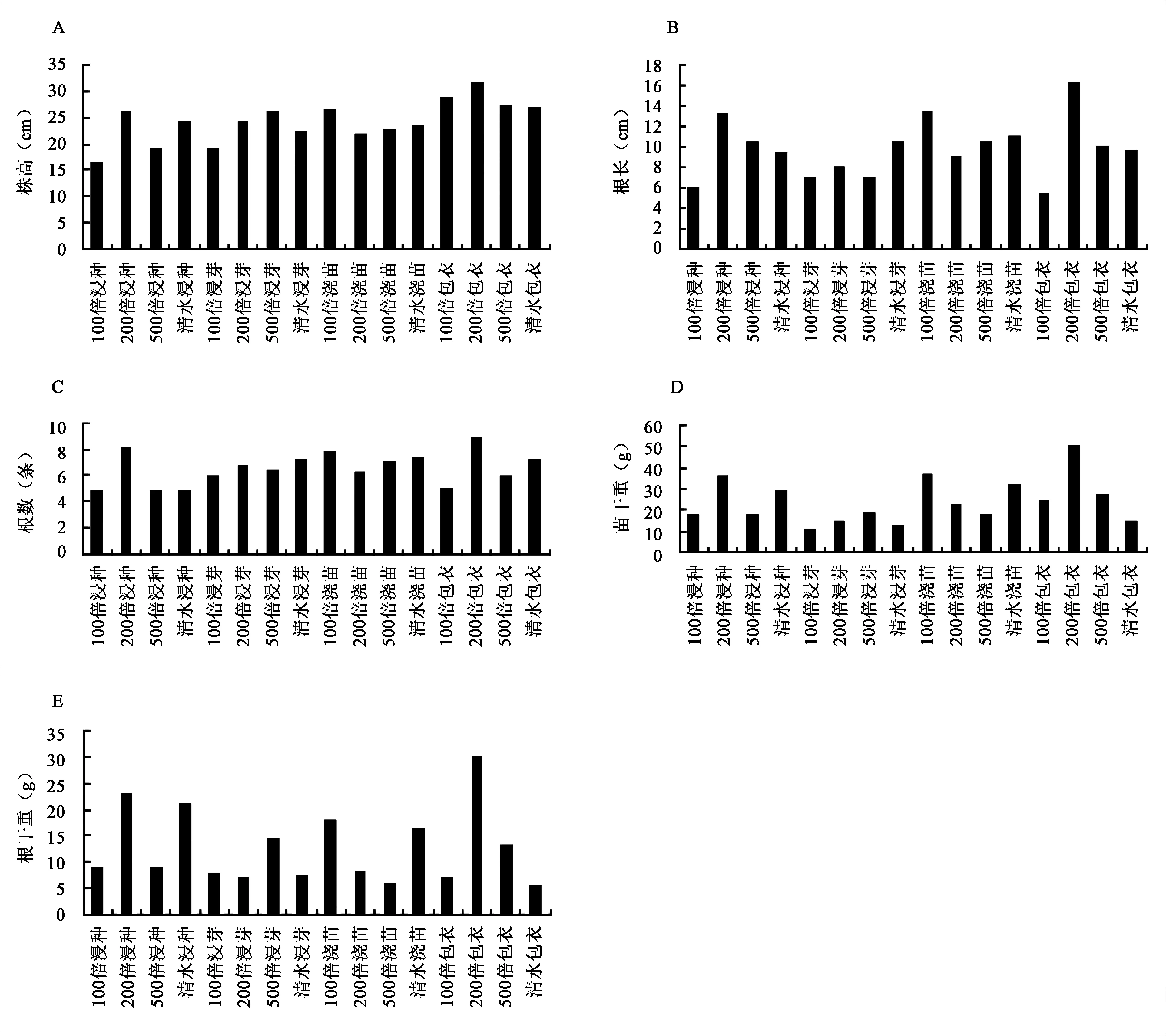
图1 生防细菌YFY02对水稻生长的促生作用Fig.1 The growth-promoting effect of biocontrol bacterium YFY02 on rice growth.
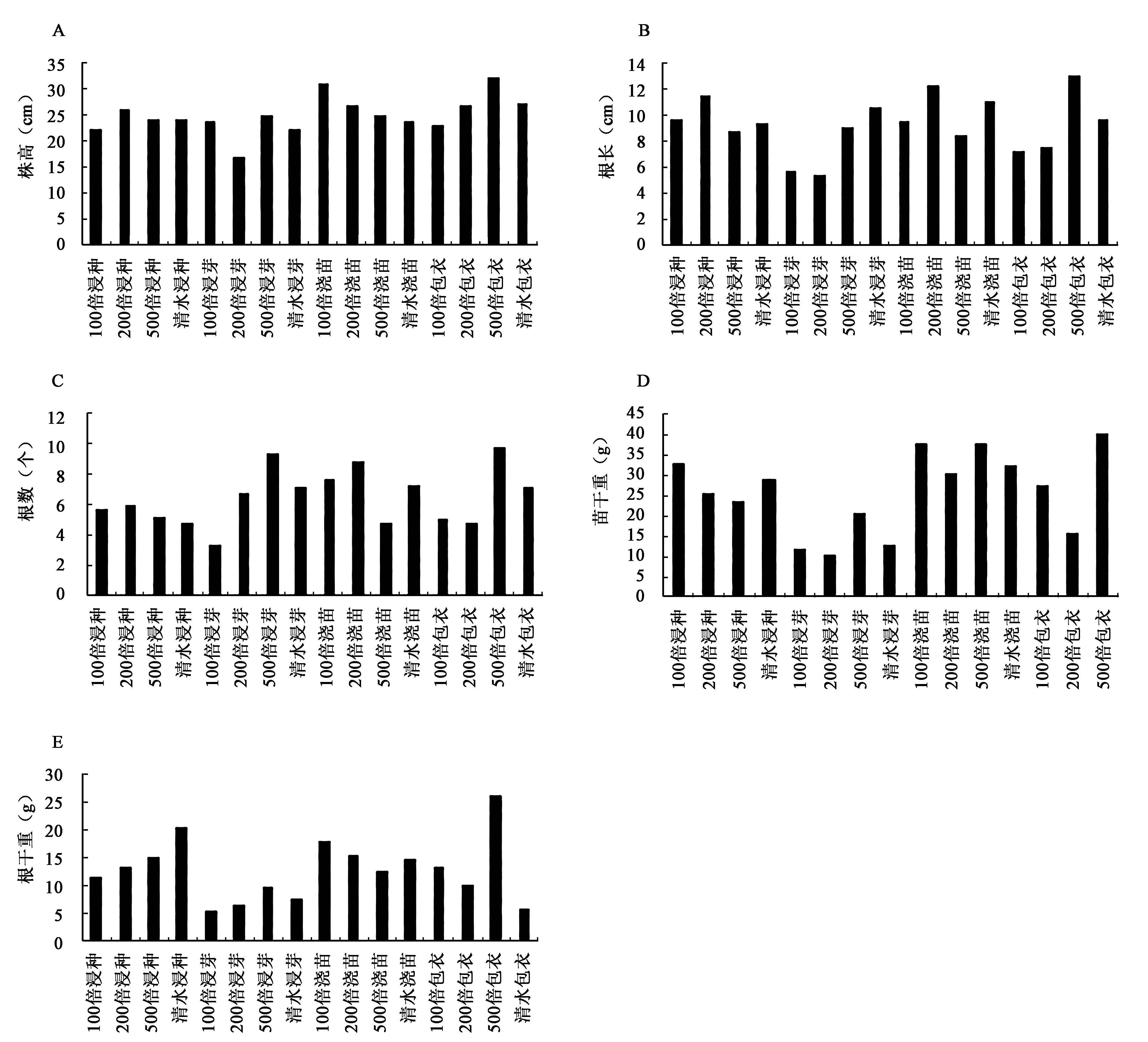
图2 生防细菌C3对水稻生长的促生作用Fig.2 The growth-promoting effect of biocontrol bacterium C3 on rice growth.
2.2 生防细菌诱导水稻抗病性分析
从图5可知,生防菌处理过的水稻苗再喷雾接种病原菌后,生防细菌对细菌性条斑病菌有明显的抑制作用,而只喷施细菌性条斑病菌菌液的水稻苗则发病比较严重。WY2菌株诱导水稻抗病性优于其他3个菌株。
2.3 生防细菌处理对水稻幼苗地上部3种酶活性的影响
2.3.1 接种生防菌后对植株POD的影响 由图6可以看出,接种4种生防菌后,水稻幼苗的POD活性明显增高,在接种后0、12 h、36 h、48 h、96 h的时间点上,POD值均以36 h时的POD值最大,36 h后,POD活性慢慢降低。4种生防菌诱导POD活性相比,以YEY02在接种36 h后,诱导POD活性最高。最低的为C3菌株诱导的POD活性。
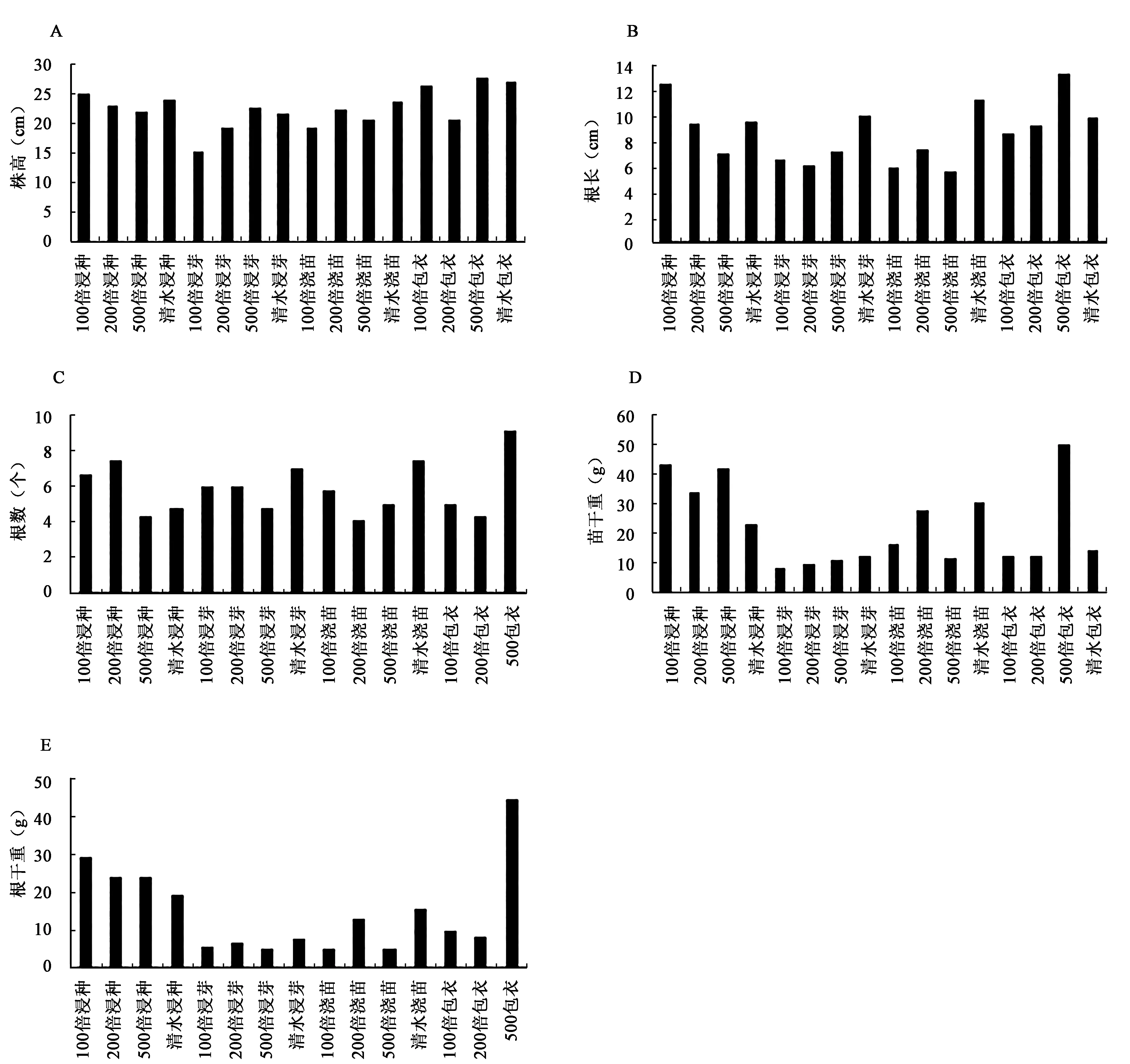
图3 生防细菌R2-2对水稻生长的促生作用Fig.3 The growth-promoting effect of biocontrol bacterium R2-2 on rice growth.
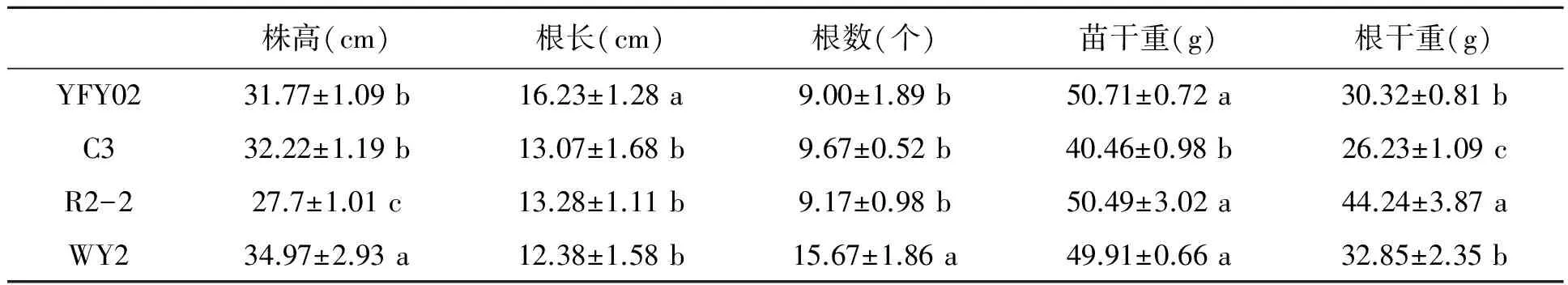
株高(cm)根长(cm)根数(个)苗干重(g)根干重(g)YFY0231.77±1.09b16.23±1.28a9.00±1.89b50.71±0.72a30.32±0.81bC332.22±1.19b13.07±1.68b9.67±0.52b40.46±0.98b26.23±1.09cR2-227.7±1.01c13.28±1.11b9.17±0.98b50.49±3.02a44.24±3.87aWY234.97±2.93a12.38±1.58b15.67±1.86a49.91±0.66a32.85±2.35b
注:同列数据后的不同字母表示差异显著(P<0.05).
2.3.2 接种生防菌后对植株PPO的影响 由图7得知,水稻幼苗接种生防菌后体内的PPO值明显比对照要高的多,并且分别接种4种生防菌的水稻幼苗体内的PPO值均在接种后36 h出现峰值,其中以YFY02生防菌株诱导的PPO值最高,R2-2生防菌株诱导的PPO值最低。
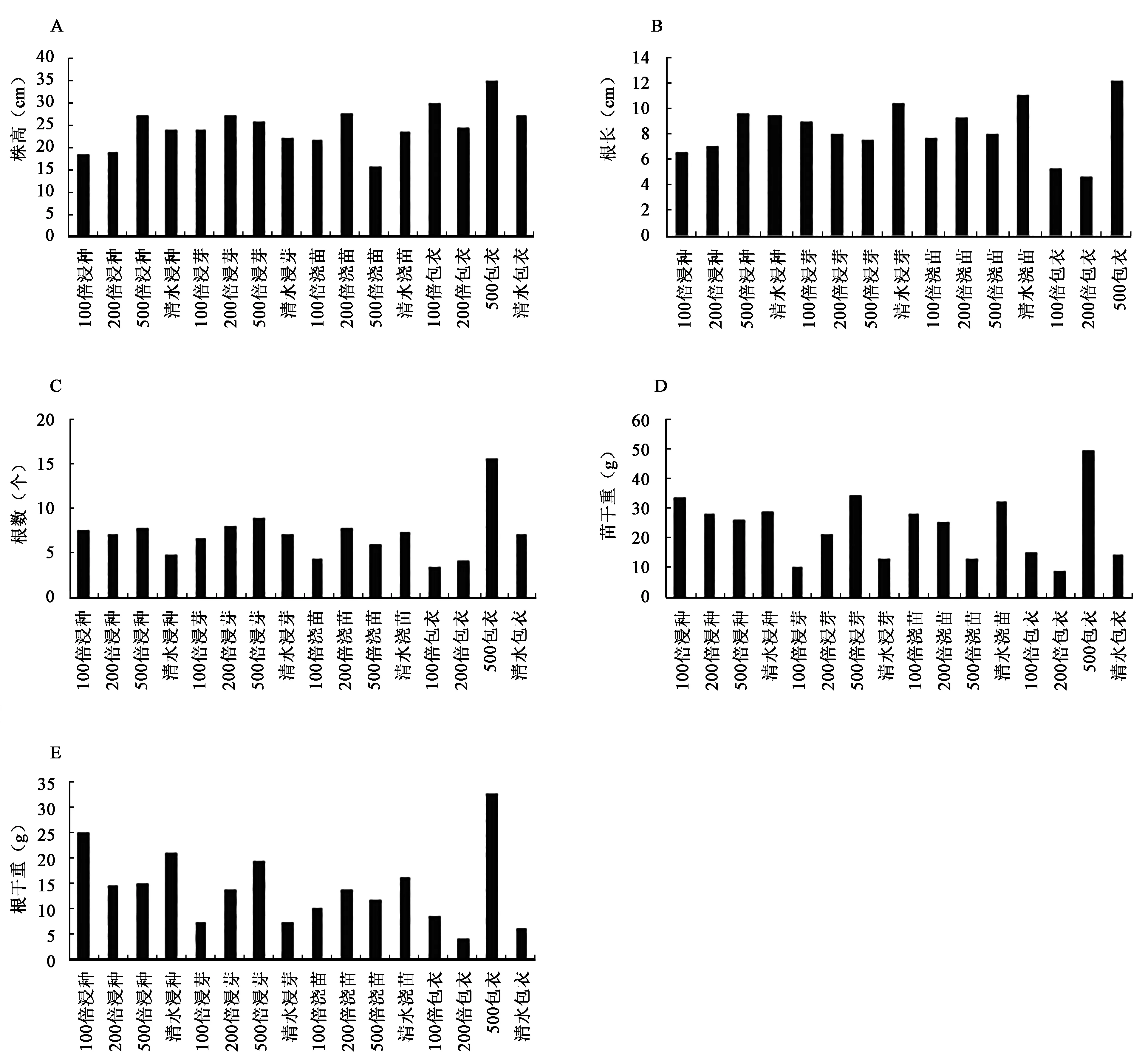
图4 生防细菌WY2对水稻生长的促生作用Fig.4 The growth-promoting effect of biocontrol bacterium WY2 on rice growth.
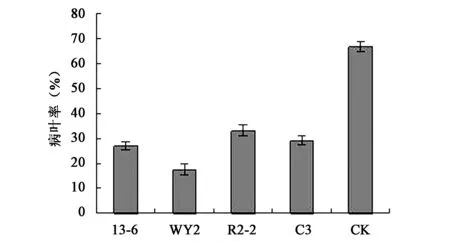
图5 水稻接种21 d后病叶率Fig.5 The percentage of diseased leaf of rice after inoculation for 21 days.
2.3.3 苯丙氨酸解氨酶 由图8可知,水稻幼苗分别接种4个生防菌株后,对其体内PAL的影响很大,接种生防菌株后,水稻幼苗体内的PAL值均在36 h时出现一个峰值,随着时间的推移,PAL值慢慢下降。其中以接种YFY02菌株的水稻幼苗在36 h的PAL峰值最高,其次是WY2和C3菌株诱导的36 h PAL峰值偏低,最低为R2-2诱导的36 h的PAL值。
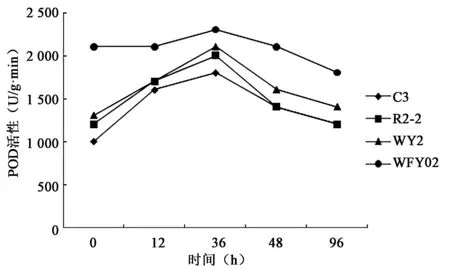
图6 4种菌株对水稻幼苗地上部POD活性的影响Fig.6 Activity of POD in up-ground part of rice seedling of 4 strains.
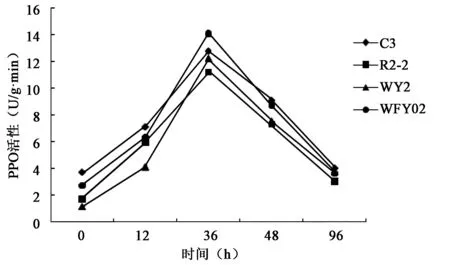
图7 4种菌株处理对水稻幼苗地上部PPO活性的影响Fig.7 Activity of PPO in up-ground part of rice seedling of 4 strains.
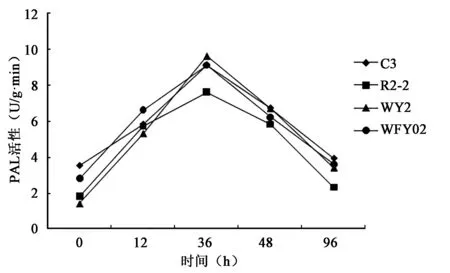
图8 4种菌株处理对水稻幼苗地上部PAL活性的影响Fig.8 Activity of PAL in up-ground part of rice seedling of 4 strains.
3 讨论
3.1 生防细菌处理对水稻生长的促生作用
4种生防细菌对水稻的促生性和诱导性,生防细菌的促生性试验结果显示, YFY02的促生作用以200倍包衣为最优处理,它对水稻幼苗的促生效果最为明显,而C3、R2-2、WY2菌株的处理中则是500倍包衣均为最优处理。不同菌株之间的促生效果比较得出, WY2菌株包衣500倍的稀释液处理水稻种子为最优处理。可见,包衣处理能够达到较好的促生效果。包衣处理与其他3种处理所用的菌液相同,但较其他3种处理在种子外围多了一层保护膜,能够更好的起到促生与保护作用,使生防菌液不至于扩散到土壤中去。且由于水稻的特殊种植方式,农药型种衣剂很容易引起药害和环境污染,造成人畜中毒。而采用生防种衣剂就能够很好的解决这一问题。另外,由表3中可以明显看出,在C3菌株浸芽处理中,稀释倍数越低,促生效果越弱,100倍稀释液处理没有500倍稀释液处理后的促生效果好,500倍稀释液和100倍稀释液都是同一细胞培养液的不同稀释倍数,他们之间的差别在于细胞浓度和培养基成分浓度不一样,浸芽处理采用的是菌液48 h浸芽,因此导致100倍稀释液促生效果没有500倍稀释液好是由于菌液细胞浓度较大、与萌发的水稻种子争夺氧气等生长因子所致。综上所述,采用WY2菌株包衣500倍的稀释液处理水稻种子可以有效的提高水稻种子的促生性。
3.2 接种生防细菌对水稻幼苗抗性相关酶活性的影响
病原菌侵染植株后,潜伏期短、发病快,难以控制。有相关研究已经报道,接种细菌性条斑病菌后,水稻病株的植物防御酶活性均有升高,同时,接种生防细菌的水稻幼苗处理表现了一定的抗病能力。20世纪60年代初,人们发现感染病原菌的植物PAL活性有所增强,随后在不同的植物与病原物互作中发现这一现象,伴随着 PAL活性升高有木质素的积累[20]及酚类物质[21]和植保素的合成,因此,认为PAL与植物抗病性有着密切的关系。接种后PPO和POD活性也均有不同程度的增高。
本实验采用4株生防细菌对水稻幼苗进行处理,水稻幼苗在接种细菌性条斑病菌前24 h,先接种生防细菌,结果发现,接种生防细菌的处理,水稻幼苗体内的PAL、POD、PPO相关抗性酶的活性明显增高,这个结果说明生防细菌一定程度上诱导了水稻幼苗抗性酶活性的增高。并且明显高于对照组的酶活力。水稻幼苗接种生防菌后,分别在0 h、12 h、36 h、48 h、96 h时取样,测定PAL、POD、PPO的酶活力值,发现在5个时间段的酶活力值先上升后下降的趋势,而且峰值均出现在36 h处,随后慢慢下降。这说明只接种病原菌也能引起植物体内保护酶活性的增高,这可以理解为植物本身的正常反应,但是既接种生防菌又接种病原菌的处理酶活力值增高,也说明了生防菌株一定程度上能够诱导植物体内的酶活力增高,同时产生抗病的作用。实验结果与Chithrashree[22]的结论基本一致。
综上所述,水稻幼苗接种生防细菌24 h后再接种病原菌,生防细菌能促进植物体内保护酶PAL、POD、PPO活性的增高,进而诱导植物抗病性的增高。
[1] 李德葆,朱伟光,陈伟良,等.拮抗蛋白在植物病害防治中的应用前景[A].见:荆玉祥,匡廷云,李德葆.植物分子生物学成就与前景[M] .北京:科学出版社,1995, 289-294.
[2] 程 亮,游春平,肖爱萍,等. 拮抗细菌的研究进展[J]. 江西农业大学学报, 2003, 25(5): 732-737.
[3] 姬广海.溶杆菌属及其在植物病害防治中的研究进展[J].云南农业大学学报,2011,26(1):124-130.
[4] 林 东,徐 庆,刘艺舟,等.枯草芽孢杆菌S0113分泌蛋白的抑菌作用及抗菌蛋白的分离纯化[J].农业生物技术学报,2001,01:77-80.
[5] 陈志谊,许志刚,高泰东,等.水稻纹枯病拮抗细菌的评价与利用[J].中国水稻科学,2000,14(2):98-102.
[6] 胡 剑,赵永歧,王岳五,等.枯草杆菌Bs-98分泌的抗真菌蛋白的分离纯化及其部分性质的研究[J]. 微生物学通报,1997,24(1):3-6.
[7] 顾真荣,马承铸,韩长安,等.枯草芽孢杆菌G3防治植病盆栽试验[J].上海农业学报,2002,18(1):77-80.
[8] Christensen P, Cook F D.Lysobacter, a new genus of non-fruiting, gliding bacteria with s high baseratio[J]. Int. J. Syst. Bacteriol., 1978,28:367-393.
[9] O′sullivan J, Mccullough J E, Tymiak A A,etal.. Lysobactin, a novel antibacterial agent produced byLysobactersp. I. Taxonomy, isolation and partial characterization[J]. J. Antibiotics,1998,41(12):1740-1744.
[10] Md T I, Yasuyuki H. Possible role ofXanthobaccinsproduced byStenotrophomonassp. strain SB-K88 in suppression of sugar beet damping-off disease[J].Appl. Environ. Microbiol.,1999,65(10):4334-4339.
[11] Folman L B, Postma J, van Veen J A. Characterization ofLysobacterenzymogenes(Christensen and Cook,1978)strain 3.1 T8. A powerful antagonist of fungal disease of cucumber[J].Microbiol. Res.,2003,158:107-115.
[12] Kobayashi D Y, Yuen G Y. The potential ofLysobacterspp. as bacterial biocontrol agents for plant diseases [J]. Nutr. Nat. Resour., 2007,2(7):11-14.
[13] 陈志谊,刘永峰,刘邮洲,等.植物病害生防芽孢杆菌研究进展[J]. 江苏农业学报,2012,05:999-1006.
[14] Ongena M, Jourdan E, Adam A,etal.. Surfactin and fengycin lipopeptides ofBacillussubtilisas elicitors ofinduced systemic resistance in plants [J].Environ. Microbiol., 2007, 9(4):1084-1090.
[15] Choudhary D K,Prakash A,Johri B N. Induced systemic resistance(ISR) in plants: Mechanism of action[J]. Indian J. Microbiol., 2007,47(4):289-297.
[16] 姬广海,魏兰芳,张丽辉,等. 一种甲基营养型芽孢杆菌及其应用[P].中国:2012102414426.
[17] 高增贵,陈 捷,刘军华,等.拮抗内生细菌 B20-006菌株对玉米主要防御酶系的影响[J].植物病理学报,2007,37( 1) : 102-104.
[18] 孙红炜,路兴波,杨崇良,等.不同抗性玉米品种接种甘蔗花叶病毒(SCMV) 后4种防御酶活性变化研究[J].植物病理学报,2006,36(2):181-184.
[19] 马桂珍,暴增海,刘云鹤,等.粘帚霉生防菌株发酵液对大豆幼苗中几种防御酶活性的影响[J].吉林农业大学学报,2007,29(3) :267-270.
[20] Maule A J, Ride J P. Ammonia-lyase and O-methyl transferase activities related to lignification in wheat leaves infected with Batrylis[J].Phytochemistry,1976,15:1661-1664.
[21] Glazener J A. Accumation of phenolic compounds in cells and formation of lignin-like polymer s in cell walls of young tomato fruits after inoculation withBotrytiscinerea[J]. Physiol. Plant Pathol., 1982,20: 11-25.
[22] Chithrashree A C, Udayashankar S, Chandra Nayaka M S. Plant growth-promoting rhizobacteria mediate induced systemic resistance in rice against bacterial leaf blight caused byXanthomonasoryzaepv.oryzae[J]. Biol. Control, 2011,59:114-122.
Studies on Promoting Ability and Induced Resistance of Biocontrol Bacteria in Rice
ZHANG Xiaofang1, AI Ying2, WEI Lanfang3, SHI Gonglin3,WANG Xing1, LI Fan1, JI Guanghai1*
1.KeyLaboratoryofAgricultureBiodiversityforPlantDiseaseManagement,theMinistryofEducation,YunnanAgriculturalUniversity,Kunming650201,China; 2.College of Resource and Environment Science, Yunnan Agricultural University, Yunnan Yuxi 652700, China; 3.Agricultural Foundation Experiment Teaching Center, Yunnan Agricultural University, Kunming 650201, China
FourbiocontrolbacteriastrainswereevaluatedforinhibitionabilityinriceagainstXanthomonas oryzaepv. oryzicola(Xooc).Promotingabilityoffourtreatmentsincludingseedssoaking,shootssoaking,seedingsirrigationandseedpelletingwithbiocontrolbacteriawasstudied.Atthesametime,theinductionofthreeprotectingenzymessuchasperoxidase,polyphenoloxidaseandphenylalnineammonialyasewerestudiedbyapplicationofbiocontrolbacteria.Theresultsshowedthatthefourstrainshadthegrowthpromotingeffectandinducedresistanceofriceseedlings.AndtheinducedresistanceandthegrowthpromotionofthestrainWY2wasbetterthanotherstrains.BiocontrolbacteriacouldenhancetheactivitiesofplantsprotectiveenzymesasPAL,PODandPPO,andinduceplantdiseaseresistancewheninoculatingXocpathogens24hoursafterinoculationofbiocontrolbacteriainriceseedlings.
biocontrol bacteria; promotion; induced resistance; rice bacterial streak
2016-05-31; 接受日期:2016-08-02
国家自然科学基金项目(31360002;31460458);云南高校科技创新团队支持计划[云教科(2014)22号];农业部公益性行业专项(201303015);云南省重点新产品计划(2014BB005)资助。
张小芳,硕士研究生,主要从事植物细菌病害的研究。E-mail:384952241@qq.com。*通信作者:姬广海,教授,主要从事植物细菌病害研究。E-mail:550356818@qq.com
10.3969/j.issn.2095-2341.2017.01.08
