羽毛降解菌的分离鉴定及角蛋白酶基因克隆
2017-02-20陈晓堂侯衍英张显忠李艳玲郭东会史仁玖
陈晓堂, 刘 超, 侯衍英, 张显忠, 李艳玲, 郭东会, 史仁玖
泰山医学院, 山东省中药生物技术重点实验室, 山东 泰安 271016
羽毛降解菌的分离鉴定及角蛋白酶基因克隆
陈晓堂, 刘 超, 侯衍英, 张显忠, 李艳玲, 郭东会, 史仁玖*
泰山医学院, 山东省中药生物技术重点实验室, 山东 泰安 271016
为了从废弃羽毛堆积土壤中分离筛选具有高效降解羽毛角蛋白的细菌,采用形态学观察、生化测定和16S rDNA序列分析鉴定菌株,测定蛋白水解研究酶活性及酶特性,鉴定该菌为假单胞菌属的嗜麦芽窄食单胞菌,降解羽毛的最适发酵培养温度为30℃,最适pH 7.0,最适接种量1%,最适发酵时间48 h,羽毛含量在0.25~0.5 g/50mL时产酶酶活性最高且较稳定,适合降解羽毛和头发。嗜麦芽窄食单胞菌角蛋白酶的作用温度和pH宽泛、稳定性好,具有良好的开发价值和应用前景。
嗜麦芽窄食单胞菌;角蛋白酶;羽毛降解;基因克隆
近几年,我国家禽养殖业迅猛发展,羽毛占肉鸡体重的5%~7%,年产量一百多万吨,羽毛中粗蛋白含量高达80%,氨基酸达70%,具有很高的开发利用价值[1]。羽毛的主要成分是角蛋白质,是一类结构稳定、不溶于水的硬性蛋白。目前,羽毛处理通常采用高温高压、强酸强碱和挤压膨化等物理化学方法,工艺复杂、耗能多,易引起环境污染[2,3]。因此,如何高效、环保、低成本降解角蛋白是当前面临的一个重要的资源和环保问题。角蛋白酶是微生物诱导产生,破坏角蛋白二硫键并使其进一步降解,是降解角蛋白的关键酶,反应条件温和、环保,筛选角蛋白降解菌及研究角蛋白酶是目前角蛋白降解的主要研究方向[4]。
目前,研究人员已分离到30多株能降解羽毛的微生物,包括细菌、真菌和放线菌[4,5],但是多数羽毛降解菌降解羽毛效率不高,羽毛需要高温高压等处理,因此筛选能高效降解并且直接作用羽毛的微生物菌株具有重要意义。本研究从养鸡场堆积腐烂羽毛的土壤中筛选分离了一株降解羽毛的菌株,通过菌株形态特征观察、生理生化实验测定和16S rDNA 分子鉴定法对该菌株进行鉴定,探讨其对羽毛的降解特性,并克隆了角蛋白酶基因序列,以期为进一步研究角蛋白酶功能及应用奠定理论基础。
1 材料和方法
1.1 实验材料
济宁养鸡场内废弃羽毛堆积处采土样。家禽市场收集的鸡羽毛,自来水洗净,纯水洗涤3次,60℃烘干至恒重。
LB培养基(g/L):蛋白胨10 g,酵母浸提膏5 g,NaCl 10 g,pH 7.0;富集培养基(g/L):碎羽毛7.5 g,酵母浸提膏1 g,K2HPO41 g,MgCl20.1 g,pH 7.0;初筛培养基(g/L):酪蛋白10 g,K2HPO41.4 g,KH2PO40.7 g,NaCl 0.5 g,MgSO40.1 g,琼脂20 g,pH 7.0; 牛肉膏蛋白胨培养基 (g/L):牛肉膏3 g,蛋白胨10 g,NaCl 5 g,pH 7.2;羽毛培养基(g/L):整根羽毛10 g,K2HPO41.4 g,KH2PO40.7 g,NaCl 0.5 g,MgSO40.1g,pH 7.0。
1.2 羽毛降解菌株的分离及筛选
①富集:5 g土样加入20 mL ddH2O,震荡静止后取上清5 mL于200 mL富集培养基,30℃ 120 r/min培养48 h;②初筛:取100 μL上清液稀释涂布于初筛培养基,37℃培养,72 h后观察,挑选透明圈较大的单菌落多次划线纯化,接斜面培养基保存备用;③复筛:菌株接种到牛肉膏蛋白胨培养基,37℃ 180 r/min,24 h。5%的接种量转接至羽毛发酵培养基,37℃培养48 h,观察羽毛降解情况。发酵液离心,上清液测定角蛋白酶活性和蛋白含量。
1.3 菌种鉴定方法
显微镜观察,革兰氏染色,生理生化试验参考细菌系统鉴定手册[4]。
16S rDNA鉴定,挑取单菌于10 mL 液体培养基,30℃ 200 r/min培养24 h。提取DNA作为PCR扩增模板,引物为细菌16S rDNA PCR,通用引物:27F: 5′-CGGCTACCTTGTTACGACT-3′,1502F:5′-GAGTTTGATCCTGGCTCAG-3′。1%的琼脂糖电泳,回收DNA,连接到载体pMD18-T,转化,华大基因公司测序,BLAST和DNAMAN软件比对分析。
1.4 角蛋白酶活的测定方法
参照蔡成岗[4]测定角蛋白酶酶活方法,略有改动:4 mL发酵液,5 000 r/min离心10 min,取1 mL上清液,加2 mL 50 mmol/L Tris-HCl缓冲液,10 mg的酪蛋白,50℃ 180 r/min反应1 h,加2 mL 10%的三氯乙酸终止反应,5 000 r/min离心10 min,上清液280 nm处测其吸光度。空白组在加入酪蛋白前先加2 mL 10%的三氯乙酸提前终止其反应。1 酶活单位定义为:实验组对空白组每增加0.01吸光度所需要的酶量。
1.5 培养条件对产酶活性的影响
1.5.1 不同接种量对产酶活性的影响 菌种接于牛肉膏蛋白胨培养基,培养24 h后,选择1%、2%、5%、8%、10%的接种量分别接种于50 mL羽毛培养基中,鸡毛含量0.5 g/瓶,初始pH 7.0,37℃ 180 r/min,培养48 h。然后5 000 r/min 4℃离心10 min,取上清液,测定酶活性。
1.5.2 不同蛋白底物对产酶活性的影响 分别称取0.5 g鸡毛、头发、脱脂牛奶和酪蛋白作为底物配制50 mL培养基,取24 h种龄的菌液1 mL接种,初始pH 7.0,37℃ 180 r/min,发酵培养48 h,测定酶活性。
1.5.3 不同羽毛含量对产酶活性的影响 称取0.05 g、0.25 g、0.5 g、0.75 g、1 g鸡毛分别配制50 mL培养基,接种1 mL 24 h种龄的菌液,初始pH 7.0,37℃ 180 r/min,发酵48 h,测定酶活性。
1.5.4 不同初始pH对产酶活性的影响 分别调节50 mL培养基初始pH为6.5、7.0、7.5、8.0、8.5,鸡毛含量0.5 g/瓶,接种1 mL 24 h种龄的菌液,37℃ 180 r/min,发酵培养48 h,测定酶活性。
1.5.5 不同培养温度对产酶活性的影响 培养温度分别为18℃、23℃、28℃、30℃、33℃、37℃、40℃,鸡毛含量0.5 g/瓶,接种1 mL 24 h种龄的菌液,初始pH 7.0,180 r/min,发酵培养48 h,测定酶活性。
1.5.6 不同发酵培养时间对产酶活性的影响
鸡毛含量0.5 g/瓶,初始pH 7.0,接种1 mL 24 h种龄的菌液, 37℃ 180 r/min,分别培养24 h、48 h、72 h、96 h、120 h,测定酶活性。
1.6 角蛋白酶基因克隆
根据细菌DNA保守序列设计引物:P1:5′-GAACGAACATTTCATCTTGCT-3′,P2:5′-GGTCTGAGGAACAGCGTG-3′,CTAB法提取嗜麦芽窄食单胞菌DNA作模板,PCR扩增基因序列:94℃,4 min;94℃ 75 s,52℃ 1 min,72℃ 2 min,32循环;72℃ 10 min。1%琼脂糖电泳回收,连接到pMD18-T载体,转化,华大基因公司测序,BLAST和DNAMAN软件比对分析。
2 结果与分析
2.1 高效降解羽毛菌株的分离
挑选出透明圈较大的单菌落进行复筛,发酵培养48 h后挑选羽毛降解情况较好的6支菌株(图1),菌株B降解羽毛速度最快且酶活性最高,羽毛发酵液中的降解蛋白质量最高,表明菌株B降解羽毛角蛋白的能力最强(图1),且差异显著(P<0.05),因此选用菌株B进行下一步的研究。

图1 6支菌株发酵液中酶活性和蛋白含量的比较Fig.1 Comparison of enzyme activity and protein content in the fermentation broth of 6 strain.
2.2 菌种鉴定
菌株B革兰氏染色呈阴性,菌落形态为圆形、白色、凸起,表面湿润、粘稠、有光泽,边缘无缺刻,颜色一致(图2,彩图见图版三)。生化反应见表1,初步鉴定为嗜麦芽窄食单胞菌(Stenotrophomonasmaltophilia)。
对该菌的16S rDNA序列进行测序,核苷酸序列为1 405 bp,BLAST软件比对分析,与Stenotrophomonasmaltophilia的相似性为99%,MEGA 6.0构建以16S rDNA全序列为基础的系统发育树 (图3) 与假单胞菌属细菌聚成一族,与StenotrophomonasmaltophiliaCRR1-48相似性最高,结果表明该菌株为嗜麦芽窄食单胞菌,命名为StenotrophomonasmaltophiliaTSMC-99。
2.3 发酵培养条件对产酶活性的影响
2.3.1 接种量对产酶活性的影响 图4表明嗜麦芽窄食单胞菌1%接种量产酶活性最高,随着接种量的升高产酶活性下降并趋于稳定,实验结果差异显著(P<0.05)。这说明接种量影响菌的生长,进一步影响细菌产酶的活性。
2.3.2 蛋白底物对产酶活性的影响 图5表明羽毛为底物发酵培养的产酶活性最高,该酶是诱导酶,羽毛作为唯一的碳源和氮源时诱导产生角蛋白酶的活性最高。底物为头发时产酶活性仅次于羽毛,而当蛋白底物为酪蛋白和脱脂牛奶时产酶活性明显降低,表明该细菌所产角蛋白酶适合降解羽毛和头发,不同发酵底物差异显著(P<0.05)。
2.3.3 羽毛含量对产酶活性的影响 由图6可知羽毛含量在0.25~0.5 g/50mL时产酶酶活性最高且较稳定,高于或低于这个区间范围产酶活性均显著降低,表明不同羽毛含量对酶活性影响差异显著(P<0.05)。

图2 菌株B形态图Fig.2 Colony morphology of strain B.(彩图见图版三)

项目结果葡萄糖O/F试验+/+动力试验+氧化酶酶试验-赖氨酸脱羧酶+DNA酶试验+七叶苷试验+明胶液化试验+葡萄糖试验+乳糖试验+麦芽糖试验+蔗糖试验+葡萄糖酸盐试验-

图3 菌株TSMC-99的系统发育树Fig.3 Phylogenetic tree of strain TSMC-99.

图4 接种量对产酶活性的影响Fig.4 Effect of inoculation size on enzyme activity.注:不同小写字母代表差异显著(P<0.05)。

图5 不同蛋白底物对产酶活性的影响Fig.5 Effects of different protein substrates on the activity of enzyme production.注:不同小写字母代表差异显著(P<0.05)。

图6 不同羽毛含量对产酶活性的影响Fig.6 Effect of feather content on the activity of enzyme production.注:不同小写字母代表差异显著(P<0.05)。
2.3.4 初始pH对产酶活性的影响 图7表明该菌在碱性发酵培养条件下具有较高产酶活性,在初始pH为7.0时产酶活性最高,但不同pH组别之间酶活性没有显著差异(P>0.05)。
2.3.5 培养温度对产酶活性的影响 如图8,在室温条件下该菌产酶活性较高,在30℃时产酶活性最高(图8),不同温度培养的酶活性差异显著(P<0.05);23~37℃之间没有显著差异(P>0.05),说明该菌为嗜温型产酶菌株。很多菌降解羽毛都需要较高的温度,这为工业化处理带来困难,常温条件高酶活性的菌株更适合大规模处理羽毛。

图7 不同初始pH对产酶活性的影响Fig.7 Effect of different initial pH on the activity of enzyme production.注:不同小写字母代表差异显著(P<0.05)。
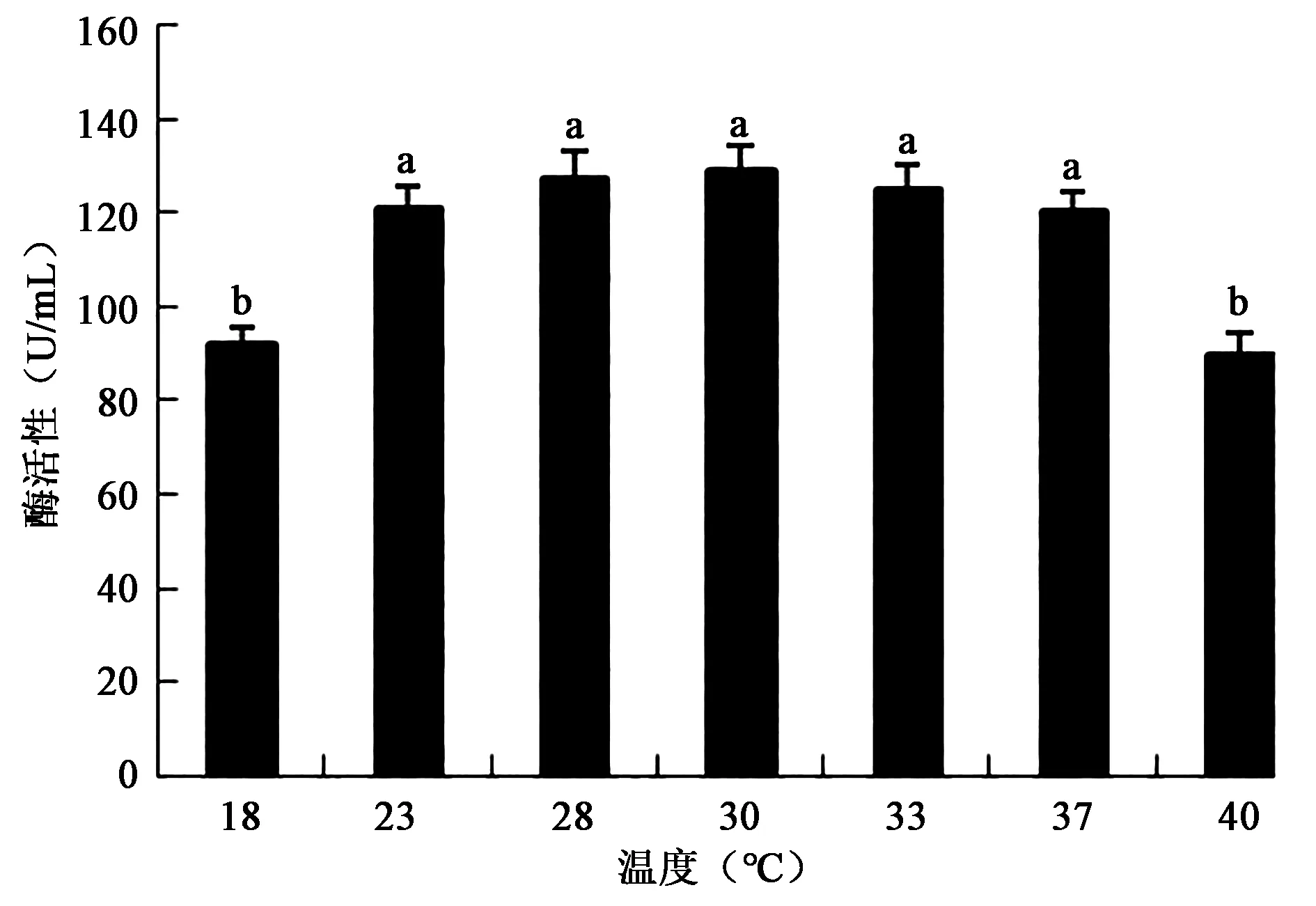
图8 不同培养温度对产酶活性的影响Fig.8 Effects of different culture temperatures on the activity of enzyme.注:不同小写字母代表差异显著(P<0.05)。
2.3.6 发酵培养时间对产酶活性的影响 发酵48 h,菌产酶活性最高,发酵培养基中的鸡羽毛全部被降解。随着时间的增加,酶活逐渐降低(图9),不同培养培养时间的酶活性差异显著(P<0.05)。
2.4 角蛋白酶基因克隆
PCR 扩增获得2 000 bp左右大小的基因片段(图10),测序获得2 157 bp序列,ORF Finder分析其中包含1个1 743 bp的开放阅读框,起始密码ATG,终止密码TGA。
基于角蛋白酶基因核酸序列构建系统进化树(图11),基因序列与GenBank中来源嗜麦芽窄食单胞菌的角蛋白酶、膜外蛋白酶、类枯草杆菌蛋白酶、丝氨酸蛋白酶基因同源性高达93%、93%、89%、91%,该基因序列分析与菌种鉴定具有一致性,表明酶可能是一个胞外分泌酶,功能与角蛋白酶相似,确定该基因为角蛋白酶基因。
角蛋白酶核酸序列翻译获得1个570氨基酸的蛋白质序列,NCBI Blast分析,推测角蛋白酶包含3个超家族结构(图12):肽酶抑制剂超家族(Inhibitor_I9 superfamily)、肽酶(Peptidases-S8-S53superfamily)超家族和前肽C-末端超家族结构(PPC superfamily),推测蛋白功能可能与这3个家族相关。
3 讨论
大量废弃羽毛不合理处置会污染环境,生物降解是最合理的处理方式,角蛋白酶是生物降解羽毛的关键酶,目前羽毛角蛋白降解菌的研究主要集中在细菌、真菌和放线菌[6]。筛选的角蛋白降解细菌以芽胞杆菌为主, 如BacilluspseudofirmusAL-89[7]、B.licheniformisPWD-1[8]和Bacillussp. FK 46[9]。
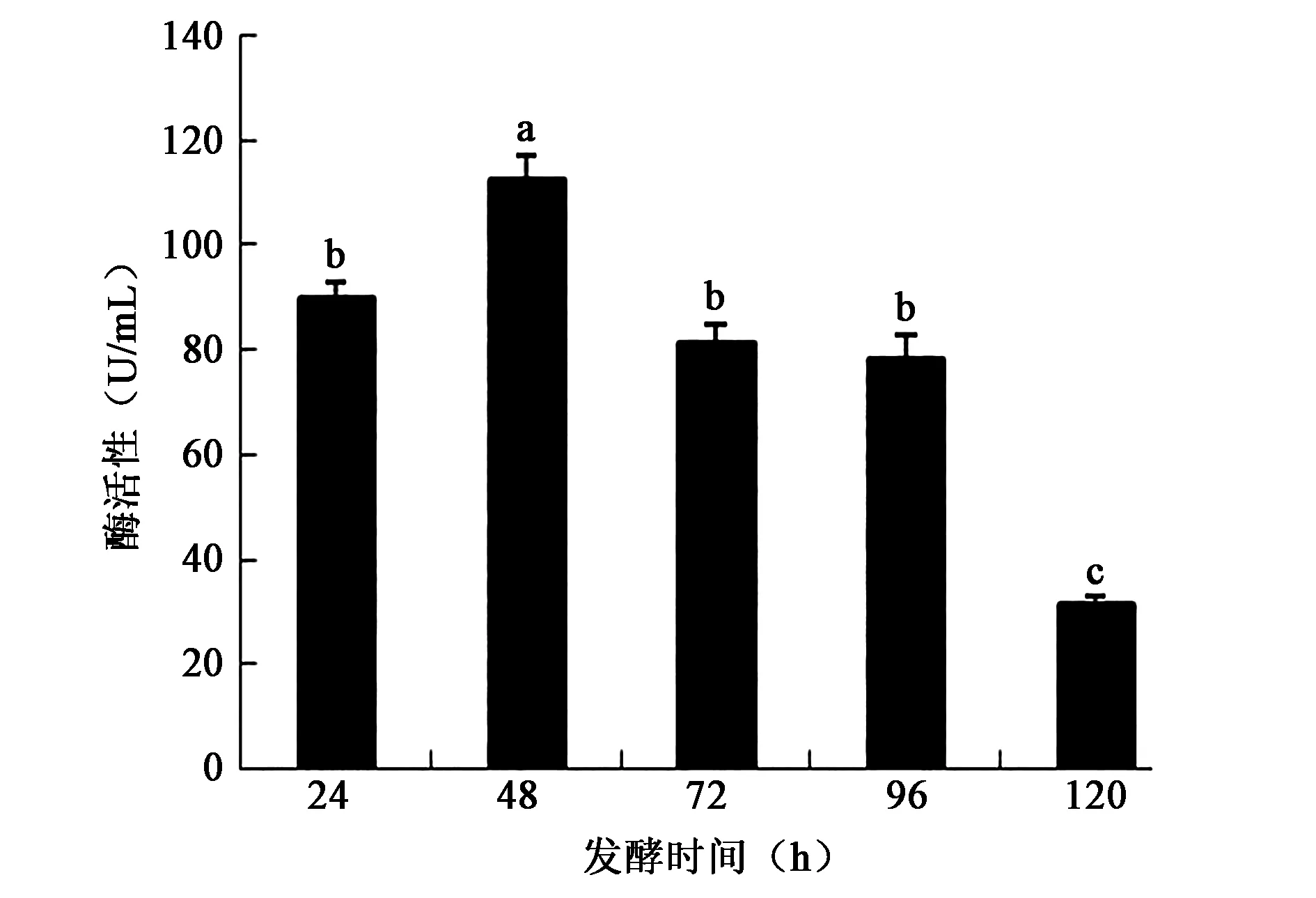
图9 不同发酵培养时间对产酶活性的影响Fig.9 Effect of different fermentation time on enzyme activity.注:不同小写字母代表差异显著(P<0.05)。

图10 PCR扩增角蛋白酶基因基因电泳图Fig.10 Amplification of KerF gene.M:DL5 000; G:角蛋白酶基因

图11 基因同源性的系统进化树Fig.11 Phylogenetic tree of keratinase gene.

图12 嗜麦芽窄食单胞菌角蛋白酶结构域Fig.12 The domain of the keratinase gene from Stenotrophomonas maltophilia.
本研究从养鸡场废弃羽毛的土壤中分离到1株高效降解羽毛的细菌,经过形态学观察、生理生化特征研究和16S rDNA序列比对结果分析, 鉴定为嗜麦芽窄食假单胞菌,命名Microbacteriumsp. TSMC-99。嗜麦芽窄食假单胞菌是广泛存在于自然环境中的好氧、革兰氏阴性原核微生物,具有条件致病性,目前对S.maltophilia的生物学研究主要集中在其耐抗生素机制和分解有毒物质、修复环境等功能[10]。
基于16S rDNA构建系统发育树分析同源性,表明TSMC-99与假单胞菌属细菌聚成一族。发酵条件对菌株所产酶有着不同影响,接种量、底物种类和含量、发酵pH、温度和时间对酶活性有着不同的影响,最佳发酵接种量小、温度低、pH[7~9]近中性的特性有利于工业化生产。筛选菌株酶活性达137.95U,与已筛选得到的菌株[7~9,11]相比,其他菌株酶活性多数集中在30~90 U,酶活性及降解能力较强,具有良好的开发和应用价值。
克隆得到该菌的角蛋白酶基因全长,与其他角蛋白酶基因最高相似度达93%[12~14],表明本研究获得的角蛋白酶基因具有不同的起源和催化能力,基因序列的差异也许和该菌的催化条件有密切关系,如平和的反应条件,初始pH为7.0、30℃时产酶活性最高等。基因全长的获得为下一步构建角蛋白酶高产工程菌做好了准备,为工业化生产奠定了基础。
[1] Cedrola S M L, de Melo A C N, Mazotto A M,etal.. Keratinases and sulfide fromBacillussubtilisSLC to recycle feather waste[J].World J. Microbiol. Biotechnol.,2012,28(3):1259-1269.
[2] Ghasemi Y, Shahbazi M, Rasoul A S,etal.. Identification and characterization of feather-degrading bacteria from keratin-rich wastes [J]. Ann. Microbiol.,2012,62(2):737-744.
[3] Evgenia V T, Adriana G, Georgi N. Ecologically safe method for improved feather wastes biodegradation[J].Int. Biodeter. Biodegrad.,2009,63(8):1008-1012.
[4] 蔡成岗.角蛋白酶生产菌株选育,发酵与分离纯化研究[D]. 杭州:浙江大学,博士学位论文,2007.
[5] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[6] 刘 婕.羽毛降解菌的筛选.鉴定及产酶条件优化[D].南宁:广西大学,硕士学位论文,2013.
[7] Gessesse A, Hatti-Kaul R, Gashe B A,etal.. Novel alkaline proteases from alkaliphilic bacteria grown on chicken feather [J].Enzyme Microb. Technol., 2003,32(5):519-524.
[8] Lin X, Lee C G, Casale E S,etal.. Purification and characterization of a keratinase from a feather-degradingBacilluslicheniformisstrain [J]. Appl. Environ. Microbiol.,1992,58(10):3271-3275.
[9] Suntornsuk W, Suntornsuk L. Feather degradation byBacillussp.FK 46 in submerged cultivation [J]. Bioresour. Technol., 2003,86(3):239-243.
[10] Juhasz A L,Stanley G A,Britz M L.Microbial degradation and detoxification of high molecular weight polycyclic aromatic hydrocarbons byStenotrophomonasmaltophiliastrain VUN 10003[J].Lett. Appl. Microbiol.,2000,30:396-401.
[11] 杨兴旺,李术娜,李红亚等.高效产角蛋白酶芽孢菌株JDBM-1的筛选及鉴定[J].内蒙古大学学报,2014,45(4):391-397.
[12] 刘晓迪,顾振红,朱红惠,等.一株羽毛降解菌产酶特性的初步研究[J].生物技术进展,2012,2(6):423-427.
[13] 王继勇,何 敏,陈 聪,等.羽毛降解菌的筛选及其产酶特性[J].武汉大学学报,2015, 61(2):183-186.
[14] 邹晓凤,岳寿松,宋爱荣,等.嗜麦芽窄食单胞菌角蛋白酶基因(KerF)的克隆及其在大肠杆菌中的表达[J].农业生物技术学报,2011,19(2):363-368.
Isolation and Characterization of a Feather-degrading Bacterium and Cloning of Keratinase Gene
CHEN Xiaotang, LIU Chao, HOU Yanying, ZHANG Xianzhong, LI Yanling, GUO Donghui, SHI Renjiu*
ShandongProvinceKeyLaboratoryofBio-technologyofTraditionalChineseMedicine,TaishanMedicalUniversity,ShandongTaian271016,China
This study was aimed to isolate and characterize feather-degrading bacteria from soil of discarded feathers. Morphological observation, biochemical analysis and 16S rDNA sequence analysis were used for identifying bacteria, and the enzyme activity and enzyme properties was studied by mensurating protein hydrolysis. The strain was identified as genusPseudomonas,Stenotrophomonasmaltophilia. The optimal pH and temperature for growth were 7.0 and 30℃, optimal inoculum size is 1%, optimal fermentation time is 48 h. The enzyme activity was highest and stable when the feather content was 0.25~0.5 g/50mL. The keratinase gene was cloned which included complete sequence of 2 157 bp and a 1 734 bp open reading frame encoded 580 amino acids fromStenotrophomonasmaltophilia. Keratinase ofStenotrophomonasmaltophiliahas the potential for the application of feather keratin sources for the functional temperature and pH is broad and stable.
Stenotrophomonasmaltophilia; keratinase; feather-degrading; gene cloning
2016-07-31; 接受日期:2016-10-10
山东省中医药科技发展计划项目(2015-247)资助。
陈晓堂,硕士研究生,研究方向为微生物药物。E-mail:376416460@qq.com。*通信作者:史仁玖,教授,研究方向为微生物与生化药学。E-mail:rjshi@tsmc.edu.cn
10.3969/j.issn.2095-2341.2017.01.10
