大肠埃希菌TG1电穿孔法转化条件优化研究
2017-02-20蒋华波夏梓元张琼阁王超群郑骄阳
蒋华波, 夏梓元, 张琼阁, 王超群, 郑骄阳, 陆 斌*
1.第二军医大学药学院, 生化药学教研室, 上海 200433; 2.上海市长征医院内分泌科, 上海 200003
大肠埃希菌TG1电穿孔法转化条件优化研究
蒋华波1, 夏梓元1, 张琼阁2, 王超群2, 郑骄阳2, 陆 斌1*
1.第二军医大学药学院, 生化药学教研室, 上海 200433; 2.上海市长征医院内分泌科, 上海 200003
为了确立稳定的高效率电转化方案,提高构建文库的库容,分别对细菌培养温度、生长状态、电场强度、感受态细胞浓度和体积、外源基因的质量、甘油/甘露醇缓冲液体积等条件进行优化,分析了各因素对转化效率的影响。结果显示:细菌培养温度为16℃,细菌生长的OD600值为0.5,密度梯度离心洗涤法,感受态细胞浓度高于1×1011/mL,并设定电场强度14.25 kV/cm时进行电穿孔,转化效率最高,可达到9×109CFU/μg DNA。研究获得的电转化优化条件为高库容文库的构建提供了一个重要的途径。
大肠埃希菌TG1;电穿孔转化;转化效率
基因文库(genomie library)是将某一基因组片段化,并全部克隆后得到的重组子群体,构建高度丰富的基因文库大大增加了后续筛选的有效性及靶向性。该技术因具有易于体外筛选、获得目的片段后方便进行进一步研究而广泛应用于多个领域。在文库构建中,电穿孔技术由于具有极高的转化效率而处于至关重要的地位。随着电穿孔技术的不断成熟,其在核酸疫苗的传递[1,2]、外源基因的转染[3]、利用非热效应杀伤肿瘤细胞[4]、治疗性蛋白和生长因子基因的导入、组织再生[5]以及基因敲除[6]等各个应用领域中显示着独特的优势并有着广泛的应用。文库筛选的成功与否在一定程度上取决于库容的大小及多样性,而电穿孔效率的高低和稳定性是其重要的限制因素。
电转化法的主要原理是通过瞬时电压使细胞膜被极化,从而在细胞膜内外产生局部电位差。当超过阈值电位时,细胞膜可形成短暂开放的分子通道,使外源性物质快速进入细胞内。在一定范围的脉冲持续时间和电场强度下,细胞的瞬时通透性是可逆的。获得稳定、高效的电转化效率是构建基因文库的关键步骤,而电转化效率又受到多种因素的影响,包括培养基种类、培养温度、电转化条件等[7~9]。虽然有很多文献报道能达到1010的转化效率[10~12],但在实际操作中较难实现。本研究对可能影响电转化效率的多个因素进行研究和优化,结果表明通过感受态的制备和电转化条件的优化,电转化效率最高达到9×109。本研究优化的电转化方案将为构建高库容的文库提供重要保证。
1 材料和方法
1.1 材料与仪器
1.2 TG1感受态细胞的制备
取E.coli菌株TG1于无抗性的LB琼脂平板上划线,于37℃恒温培养箱培养过夜。次日挑取单个克隆于5 mL无抗性的LB液体培养基中,置37℃摇床中培养12~16 h至OD600值约为8时,取2 mL菌液加入200 mL的LB培养基中,在恒温摇床中恒温(10℃、16℃、25℃、37℃)摇菌16~24 h,摇床转速为250 r/min。当OD600值为0.3~0.8时,停止摇菌,冰浴20 min后用高速离心机2 000 g 4℃离心10 min后,弃去上清,用超纯水吹匀后缓慢加入并分层于甘油/甘露醇缓冲液(1.5%甘露醇,20%甘油)中,用水平离心机1 000 g 4℃离心10 min后,重复一次上述洗涤步骤,弃上清液,收集感受态细胞用于后续实验。
1.3 电转化
取感受态细胞,加入适量质粒后置于冰上1 min,立即加入4℃预冷的0.2 cm电穿孔杯中,在预设条件下进行电击。电击完成后立即加入1 mL 37℃预热的SOC培养基,于37℃摇床中培养1 h,取适量菌液经倍比稀释后吸取100 μL铺板于氨苄抗性的LB琼脂平板中,37℃恒温培养箱放置过夜,次日计算克隆数。
2 结果与分析
2.1 细菌培养温度对转化效率的影响
电转化效率很大程度上取决于细菌的生长状态。尽管培养温度对细菌的生存能力无明显差异[13],但是是影响细胞活力、细胞膜状态的最重要因素之一。适宜的生长环境能保障细胞的最佳活力,因此首先对细胞适宜生长温度的条件进行摸索。如图1、图2所示,在37℃培养条件下,细菌很快(2~3 h)达到目标OD值,转化效率也较为稳定,在25℃培养组,转化效率最差。在16℃培养条件下,培养时间较长(约17~24 h),但转化效率优于其他实验组(图1)。在10℃培养条件下,生长时间过长(>36 h),转化效率远低于16℃培养组。

图1 温度对转化效率的影响Fig.1 Effect of temperature on electrotransformation efficiency.

图2 不同温度下细菌OD600值的变化对比Fig.2 Comparion of change on OD600 value under different temperture.
《组织学》是研究机体微细结构及其相关功能的科学。得利于显微镜的出现,这门科学将解剖学中的宏观(主要指系统和器官水平)结构推向了微观(主要指组织和细胞水平)。
2.2 生长状态对转化效率的影响
细菌的生长状态会很大程度上影响到电转化效率。采用16℃和37℃的培养条件下处于不同OD600值的细菌,进行感受态细菌的制备并分析其在电转化效率上的差异。结果如图3所示,在16℃和37℃条件下,当细胞生长状态处于中期时转化效率均较高。但是,在37℃条件下能维持较高转化效率的OD600值范围较窄,约0.4~0.5时最佳;在16℃条件下OD600值为0.4~0.7转化效率均能达到较高水平。

图3 生长状态对转化效率的影响Fig.3 Effects of growth state on electrotransformation efficiency.
2.3 电场强度对转化效率的影响
细菌对电场强度有一定的敏感性,当电场强度达到一定阈值时,才能有效击穿细胞,使核酸进入细胞内;而电场强度过高则会使大量细胞死亡。通过对大肠埃希菌TG1的电转化最适场强的研究,发现在16℃生长环境中且在一定细胞浓度下,最适场强在14 k~14.5 kV/cm之间(图4)。
2.4 感受态细胞浓度对转化效率的影响
感受态细胞浓度也是影响电转化效率的因素之一。通过一定的条件下对感受态细胞的最适浓度进行研究,发现细胞浓度与电转化效率成正相关,1.2×1011~1.5×1011/mL浓度时可达较高的电转化效率(图5)。
2.5 感受态细胞体积对电转化效率的影响
在文库建立过程中电穿孔工作量巨大,如果每次均以小体积感受态细胞进行电穿孔,达到一定的库容需要增加电穿孔的次数。通过增加感受态细胞的体积,比较其电转化效率的差异。结果发现,在大体积(>200 μL)感受态细胞的电转化效率略低于200 μL转化组,提示建库过程中可以通过增加感受态细胞的体积来减少电穿孔的次数(图6)。
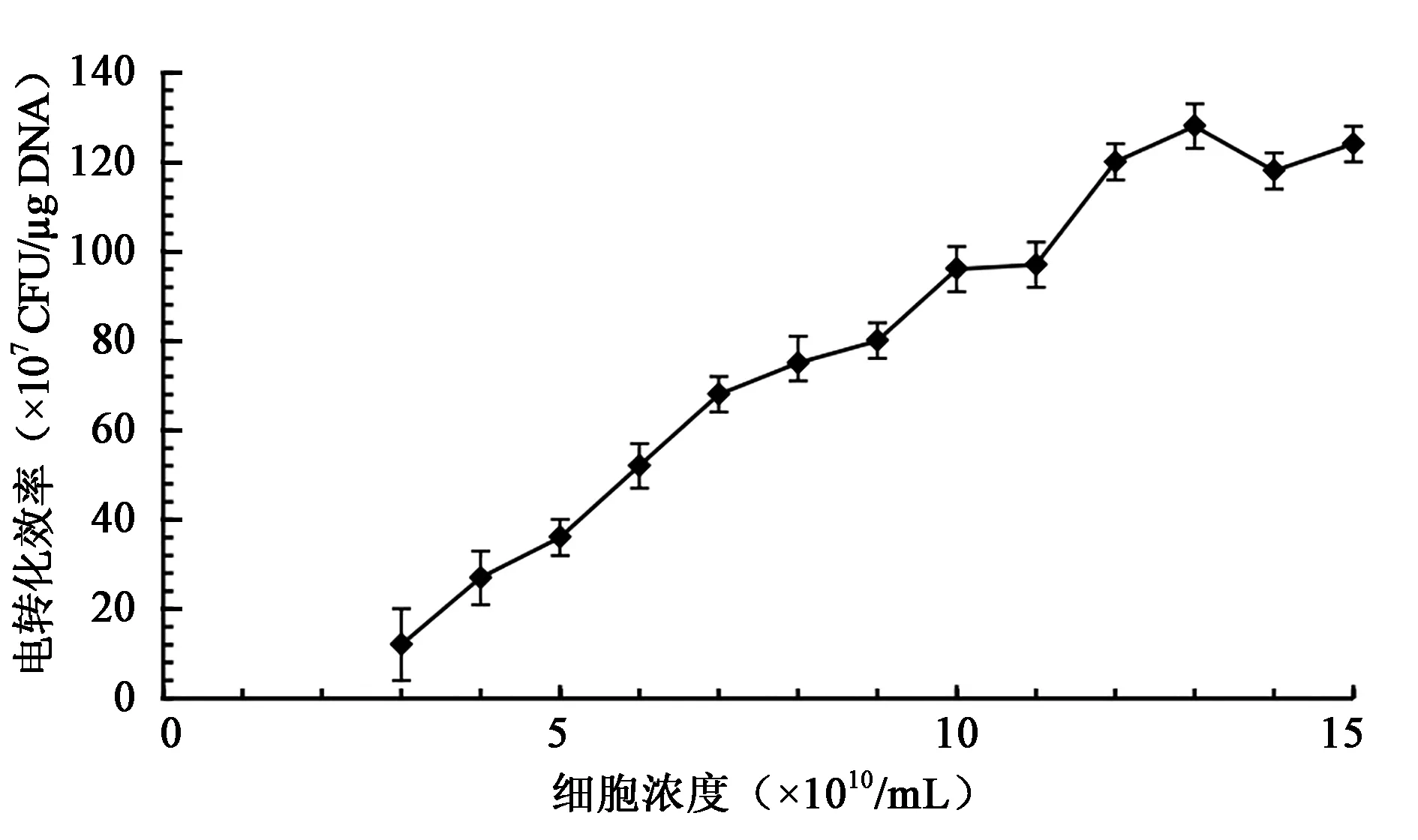
图5 感受态细胞浓度对转化效率的影响Fig.5 Effects of competent cell concentration on electrotransformation efficiency.
2.6 外源基因的质量对转化效率的影响
在电穿孔实验中,外源基因通过粘附作用聚集在细胞膜表面,在电击条件下细胞膜孔道短暂的开放使外源基因快速进入细胞内[14]。通过比较外源基因的不同数量对感受态细胞电转化效率的影响,发现在相同感受态细胞体积下,不同数量的外源基因对电转化效率无显著差异(图7)。
2.7 甘油甘露醇混合液对转化效率的影响
在感受态细胞的制备过程中,洗涤细胞的目的是尽量去除离子成分,以免在电穿孔过程中击穿感受态细胞导致死亡。利用甘油/甘露醇作为重悬感受态细胞的缓冲液,可能通过平衡细胞内的高渗透压,使细胞保持充盈状态[15]。本研究比较了不同体积的甘油/甘露醇缓冲液对电转化效率的影响,发现当加入20 mL甘油/甘露醇缓冲液后,电转化效率为甘油组的9倍(图8),提示甘露醇在电穿孔感受态细胞的洗涤过程中通过发挥保护作用,显著提高了电转化效率。

图6 感受态细胞体积对电转化效率的影响Fig.6 Effects of competent cell volume on electrotransformation efficiency.
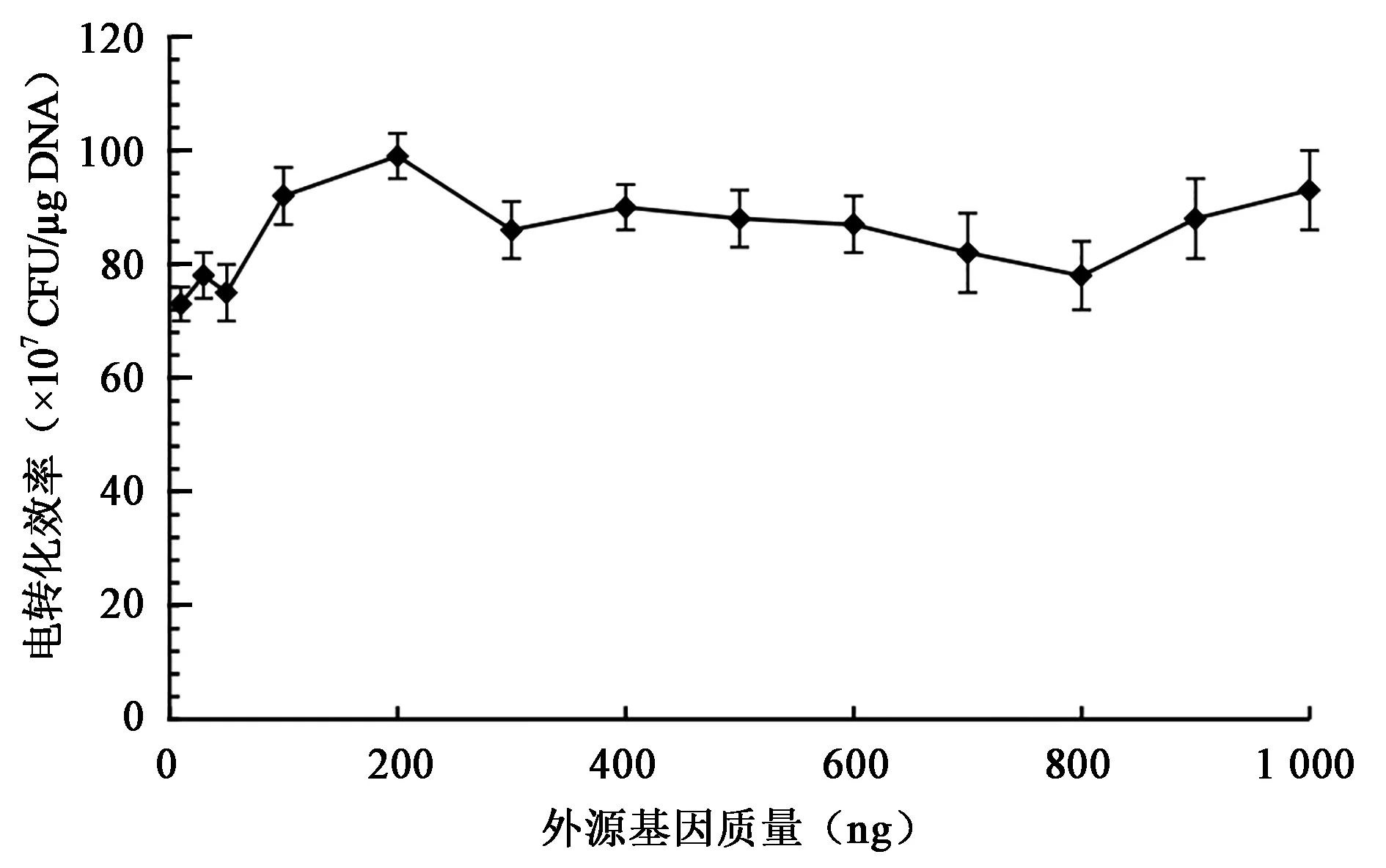
图7 外源基因质量对转化效率的影响Fig.7 Effects of quality of exogenous gene on electrotransformation efficiency.

图8 缓冲液对转化效率的影响Fig.8 Effects of buffer solution on electrotransformation efficiency.
根据目前研究报道发现,不同菌株电转化条件不同,而同一菌株不同实验室在相同操作流程得到的转化效率也不统一,因此对上述影响因素进行条件摸索之后得到最高转化效率为9×109CFU/μg DNA,最佳条件为在16℃温度下生长至OD600值为0.5时,通过密度梯度离心用20 mL甘油/甘露醇缓冲液进行洗涤,感受态细胞浓度为1.5×1011/mL,并设定电场强度14.25 kV/cm。
3 讨论
电穿孔方法作为一种高效的转化方法,目前广泛应用于外源基因转染等多个领域[3~6]。但在实际操作中,电穿孔的转化效率受到操作人员、电转化条件等多个因素的影响存在很大的差异,如细胞培养温度、生长状态、外源基因浓度、洗涤缓冲液成分、仪器、场强等,因此有必要对电转化条件的优化进行探索。本研究发现,大肠埃希菌TG1在37℃条件生长时,对数生长期在OD600值为0.4~0.5之间有较高的电转化效率,而在16℃低温环境下,OD600值为0.4~0.7之间有较高的电转化效率。本研究还发现外源基因的数量和感受态细胞的体积对转化效率并无较大影响,而感受态细胞的浓度越高,电转化效率越高,一般需要在1×1011/mL以上时才能保证较高的转化效率。因此可以通过一定程度上增加外源基因的数量、感受态细胞的浓度和体积,获得较高的电转化效率,减少电转化次数。在电转化条件上,场强在14 k~14.5 kV/cm时转化效率较高。最后,本研究通过调整洗涤缓冲液及其体积,发现大体积的甘油/甘露醇缓冲液对细胞进行洗涤可大大提高电转化效率。优化后的电转化条件可使电转化效率稳定在3×109CFU/μg DNA以上,最高可达9×109CFU/μg DNA,为后续构建高容量文库打下坚实的基础。
另外在电穿孔方面还有很多报道可以提高电转化效率。比如有研究发现培养基中Mg2+的缺乏也能使转化效率提高[16],高渗透压培养基能提高感受态细胞在电穿后的存活率,对电转化效率也有较大影响。此外在细菌生长过程中加入海藻糖能增加细胞膜的结合能力以及增强膜流动性,在感受态细胞洗涤过程中缓冲液内加入HEPES优于EDTA[17],电击后立即于46℃热击6 min能提高转化效率[18]。由于电穿孔后细胞会形成孔道,并且在30 min内处于开放状态,使细胞内成分流出胞内,导致细胞死亡,因此在用于感受态细胞电击后复苏的SOC培养基中加入表面活化剂,可使细胞表面孔道关闭以避免细胞死亡,能大大增加转化效率[19, 20]。同时电击后的复苏时间也会影响电转化效率[21]。其他因素,如质粒的大小、质粒的结构、水和洗涤缓冲液的纯净度、离心条件等均能影响电转化效率[22~24]。基于本研究已优化的电转化条件,再部分叠加上述已报道的实验条件,可获得更高的电转化效率。
[1] Luxembourg A,Evans C F,Hannaman D. Electroporation-based DNA immunisation: translation to the clinic[J].Expert Opin. Biol. Ther.,2007,7(11):1647-1664.
[2] LeBlanc R,Vasquez Y,Hannaman D,etal.. Markedly enhanced immunogenicity of a Pfs25 DNA-based malaria transmission-blocking vaccine by in vivo electroporation[J].Vaccine,2008,26(2):185-192.
[3] Jose A,Robledo F,Lin Z,etal.. Transfection of the protozoan parasitePerkinsusmarinus[J].Mol. Biochem. Parasitol.,2008,157(1):44-53.
[4] Hester J,Scheffer M D,Marleen C A M,etal.. Irreversible electroporation for colorectal liver metastases[J].Tech. Vasc. Interv. Radiol.,2015,18(3):159-169.
[5] Tendeloo V F V,Ponsaerts P,Berneman,etal.. mRNA-based gene transfer as a tool for gene and cell therapy[J].Curr. Opin. Mol. Ther.,2007,9(5):423-431.
[6] Kumar A,Godwin J W,Gates P B,etal.. Molecular basis for the nerve dependence of limb regeneration in an adult vertebrate[J].Science,2007,318(5851):772-777.
[7] Cheong D E,Lee H I,So J S. Optimization of electrotransformation conditions forPropionibacteriumacnes[J].J. Microbiol. Methods,2008,72(1):38-41.
[8] Lofblom J,Kronqvist N,Uhlen M,etal.. Optimization of electroporation-mediated transformation:Staphylococcuscarnosusas model organism[J]. J. Appl. Microbiol.,2007,102(3):736-747.
[9] Chen D Q,Huang S S,Lu Y J. Efficient transformation of Legionella pneumophila by high-voltage electroporation[J].Microbiol. Res.,2006,161(3):246-251.
[10] Palomino M M,Allievi M C,Mariano P A,etal.. New method for electroporation ofLactobacillusspecies grown in high salt[J]. J. Microbiol. Methods,2010,83(2):164-167.
[11] Warren D J. Preparation of highly efficient electrocompetentEscherichiacoliusing glycerol/mannitol density step centrifugation[J].Anal. Biochem.,2011,413(2):206-207.
[12] Dower W J,Miller J F,Ragsdale C F. High efficiency transformation ofE.coliby high voltage electroporation[J].Nucl. Acids Res.,1988,16(13):6127-6145.

[14] Rittich B,Spanova A. Electrotransformation of bacteria by plasmid DNAs: statistical evaluation of a model quantitatively describing the relationship between the number of electrotransformants and DNA concentration[J].Bioclectrochem. Bioenerget., 1995,40(1996):233-238.
[15] Xue G P,Johnson J S,Dalrymple B P. High osmolarity improves the electro-transformation efficiency of the gram-positive bacteriaBacillussubtilisandBacilluslicheniformis[J].J. Microbiol. Methods,1999,34(6):183-191.
[16] Wang H,Griffiths M W. Mg2+-free buffer elevates transformation efficiency of Vibrio parahaemolyticus by electroporation[J]. Lett. App. Microbiol.,2008,48(32):349-354.
[17] Shi X Z,Karkut A,Mees M A,Chamankhah M,etal.. EnhancingEscherichiacolielectrotransformation competency by invoking physiological adaptations to stress and modifying membrane integrity[J].Anal. Biochem.,2003,320(1):152-155.
[18] Van Der Restet M E,Lange C,Molenaar D,etal.. A heat shock following electroporation induces highly efficient transformation ofCorynebacteriumglutamicumwith xenogeneic plasmid DNA[J].Appl. Microbiol. Biotechnol.,1999,52(1):541-545.
[19] Lee R C,River L P,Pan F S,etal.. Surfactant-induced sealing of electropermeabilized skeletal muscle membranes in vivo[J]. Proc. Nadl. Acad. Sci. USA,1992,89(1):4524-4528.
[20] Hannig J,Yu J,Beckett M,etal.. Poloxamine 1107 sealing of radiopermeabilized erythrocyte membranes[J].Int. J. Radiat. Biol.,1999,75(3):379-385.
[21] Ye X,Dong H L,Huang Y P. Highly efficient transformation ofStenotrophomonasmaltophiliaS21, an environmental isolate from soil, by electroporation[J].J. Microbiol. Methods,2014,107(1):92-97.
[22] Wyber J A,Andrews J,Gilbert P,etal.. Loss of salt-tolerance and transformation efficiency inEscherichiaCOD associated with sub-lethal injury by centrifugation[J].Lett. App. Microbiol.,1994,19(31):312-316.
[23] Chuang S E,Chen A L,Chao C C,etal.. Growth ofE.coliat low temperature dramatically increase the thransformation frequency by electroporation[J].Nucl. Acids Res.,1995,23(9):1641.
[24] Kim W J,Heo T R,So J S,etal.. Optimized transformation by electroporation ofLactococcuslactisIL1403[J].Biotechnol. Tech.,1996,10(8):553-558.
Optimization of Electroporation Conditions forEscherichiacoliStrain TG1
JIANG Huabo1, XIA Ziyuan1, ZHANG Qiongge2, WANG Chaoqun2, ZHENG Jiaoyang2, LU Bin1*
1.DepartmentofBiochemicalPharmacy,SchoolofPharmacy,SecondMilitaryMedicalUniversity,Shanghai200433,China; 2.DepartmentofEndocrinology,ChangzhengHospital,Shanghai200003,China
To build up a stable protocol of electroporation transformation method with high efficiency and improve storage capacity of genomie library, we investigated the factors affecting the transformation efficiency, including culture temperature, growth state, voltage, the density and volume of competent cells, the amount of the exogenous gene and the volume of glycerol/mannitol buffer solution, which may contribute to construct highly diverse library. Results showed that when cells growing under 16℃ and harvested in mid-exponential phase (OD600of 0.5), using glycerol/mannitol density gradient centrifugation techniques and adjusting the cell density up to 1×1011/mL, the electroporation voltage of 14.25 kV/cm, the highest transformation efficiency could reach to 9×109CFU/μg DNA. The results showed that the optimal conditions for electroporation transformation would provide an important access for high-complexity library construction.
EscherichiacoliTG1; electroporation; transformation efficiency
2016-11-12; 接受日期:2016-11-23
国家自然科学基金项目(81472283;81270890)资助。
蒋华波,硕士研究生,研究方向为抗肿瘤抗体的制备和功能研究。E-mail:huabojiang@hotmail.com。*通信作者:陆斌,副教授,硕士生导师,研究方向为肿瘤靶向抗体类药物的发现及功能研究。E-mail:binlu@smmu.edu.cn
10.3969/j.issn.2095-2341.2017.01.12
