以黄芪—山茱萸治疗糖尿病肾病为例探究药对研究的新策略
2017-02-16段煜裴科蔡皓范恺磊刘晓蔡宝昌
段煜+裴科+蔡皓+范恺磊+刘晓+蔡宝昌
[摘要]药对具有复方配伍的最基本特点,是复方配伍中的最小单元。近年来,药对研究一直备受广泛关注,它是中医药现代化过程中不可或缺的一部分。随着新药创制效率的降低,如何从传统的中药药对中挖掘新药也一直是药物研发的难点之一。该文综述了近年的国内外文献,总结并归纳了药对研究的现状及问题。以此为基础,创新性地提出了“精准药对”的概念。“精准药对”不同于以往作用广和药效不明确的药对或复方,而是基于某种特定的疾病而开发的新的小药对,它作用明确且成分相对清楚。此外,作者还提出了“药对-结合柱色谱分离和细胞相关的成分谱筛选-模糊靶标识别药理学-精准药对再评价”的新策略,并成功将其应用于黄芪-山茱萸治疗糖尿病肾病的精准药对开发中。这种新策略简单、易操作且适用范围广,可为药对的现代研究及新药的研发提供借鉴和思考。
[关键词]药对; 精准药对; 新药创制; 新策略
[Abstract]As the smallest unit of traditional Chinese medicinal formula compatibility, herb-pair has the basic characteristic of traditional Chinese medicinal formula compatibility. In recent years, herb-pair investigation has attracted much attention, which is an indispensable part of modernization of traditional Chinese medicine. With the decrease of the efficiency in the discovery of new drug, how to discover new drugs from traditional Chinese medicinal herb-pair has also been a bottleneck for the research and development of drug. The authors reviewed the domestic and foreign literatures in the latest years and summarized the current situations and the existing problems of herb-pair study. Based on these investigations, the authors innovatively proposed a novel concept of "precision herb-pair". Difference from traditional Chinese medicinal herb-pair or formulae with extensive roles and unclear efficacies, "precision herb-pair" belongs to a developed new mini herb-pair formula with an exact treatment and a relatively clear composition based on a certain specific disease. In addition, the authors also proposed a new strategy of "herb-pair - screen of multiple constituents based on column separation andin vitro cell viability - fuzzy target recognition pharmacology - re-evaluation of precision herb-pair", and successfully applied it to the development of a precision herb-pair from Astragali Radix-Corni Fructus in treatment of diabetic nephropathy. This proposed new strategy is simple, easy to carry out, and has a wide application, and can offer references and thoughts for the modern investigation of herb-pair and the research and development of new drug.
[Key words]herb-pair; precision herb-pair; discovery of new drug; new strategy
doi:10.4268/cjcmm20162106
“藥有个性之特长,方有合群之妙用”,复方配伍一直是中医临床用药的最大特色[1]。众所周知,药对具有复方配伍的最基本特点,其组成简单,是复方配伍中的最小单元。近年来,药对研究一直受到高度关注和重视。药对作为复方和单味药之间的桥梁,对其透彻的研究将有助于盘活中医药的整体理论和推动中医药现代化的进程。然而,目前药对的研究方式较为混乱,没有一个统一的思路或标准。许多药对的研究仍然停留在过去单味药或者复方的思路上。例如大部分药对的质量控制仍然停留在单味药的成分控制上,并没有深入挖掘药对的内在科学内涵,这显然是不科学的。近年来,西药“点对点”的新药创制效率正逐步呈现出下降的趋势[2],而随着药对的临床治疗效果逐渐受到广泛的认可,越来越多的人把创制新药的目光投向了药对。如何建立药对新的和更通用的研究模式,如何开展药对更好的评价方法,如何以药对为基础挖掘更好的新药,这些都是亟待解决的关键问题。
黄芪为豆科植物蒙古黄芪Astragalus membranaceus(Fisch.)的干燥根,始载于《神农本草经》,具有补气固表和益气活血等功效。山茱萸为山茱萸科植物山茱萸Cornus officinalisSieb. et Zucc.的干燥成熟果肉,具有补益肝肾和涩精固脱等功效。黄芪-山茱萸为中医学界近现代专家张锡纯临床常用药对,二药伍用,气阴双补,益气固涩之功增强,用于治疗糖尿病肾病的案例已明确记载于《张锡纯对药》中[3]。但该药对在临床使用中同样面临着许多问题,诸如配伍比例混乱,药味剂量不明确,治疗效果缺乏理论依据等,严重制约了黄芪-山茱萸的临床使用。
药对作为中医药学的一大特色,其在临床上的确切疗效已得到广泛共识。但其研究过程中面临的诸多问题也同样不容忽视。药对数量众多,收载范围广泛,如果点对点的采用单一穷尽的研究方式显然是不现实的。因此,找到一种药对研究的共性策略并将研究过程模式化的方法势在必行。如今西方精准医疗正逐步受到重视[4],而以往传统的药对总是“一对多”的治疗方式,相同的药对在临床上往往可用于治疗多种疾病,这显然违背了精准医疗的范畴。作者首次提出基于某种特定的疾病寻找某个“精准药对(precision herb-pair)”的概念用于新药的创制与开发。作者在归纳和总结了近年来药对使用中的常见策略的同时,创新性地提出了“药对-结合柱色谱分离和细胞相关的成分谱筛选-模糊靶标识别药理学-精准药对再评价”的研究思路,在一定程度上解决了药对研究包括新药创制与开发过程中的问题,并将此研究思路成功地应用到黄芪-山茱萸药对中,以期丰富药对的研究模式,推动药对研究的规范化和模式化,促进药对中新药的深度挖掘。
1 药对研究现状及问题
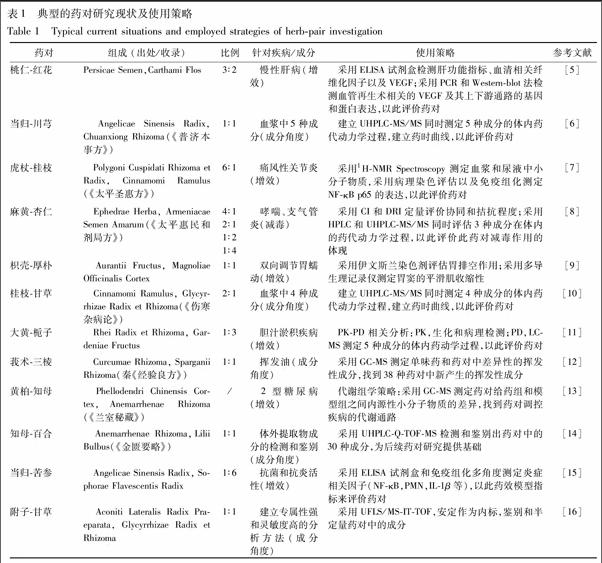
目前临床上有很多的经典案例都已证明药对具有较好的疗效。明确收载药对临床治疗功效的古籍众多,常见的有《太平圣惠方》、《普济局方》和《张锡纯对药》等。这些古籍或近现代专著提供了一个良好的研究基础,但由于其数量众多且复杂,同样也让研究者在研究过程中面临着巨大的挑战。该文选取了12种典型的药对,见表1,高度概括了目前药对研究过程中所运用的常见策略。这些研究方法在一定程度上解决了药对研究过程中遇到的问题。
1.1 药对研究现状具有的趋势和优势
1.1.1 先进分析仪器的使用正逐步得到普及
众所周知,许多单味中药本身的成分非常复杂,更不必说药对中成分研究的难度。药对中成分不仅数量众多,而且许多含量极低,过去过分依赖“高效液相色谱法”的做法已饱受诟病。令人欣喜的是当今药对中成分的分析手段正从过去的“色谱时代”逐渐过渡到现在的“质谱时代”。科研工作者目前已更加熟练于根据化合物的性质选择合适的仪器去开展分析研究工作。如分析范围更广和精度更佳的LC-MS的使用[17],针对挥发性成分的GC-MS的采用[18]以及专属性更强的NMR的运用等[7],在一定程度上解决了药对研究过程中“成分分析难”的问题。
1.1.2 系统生物学的运用正逐步引起重视
由于药对治疗疾病的机制十分复杂,近年来,越来越多的科研工作者尝试从组学的角度去阐释药对的功效物质基础[19]。基因组学、蛋白质组学、转录组学,特别是代谢组学等多元化组学研究手段正日益受到重视。有学者运用代谢组学的研究方式采用UHPLC-Q-TOF-MS测定了用当归-川芎药对治疗再生障碍性贫血大鼠前后血液和尿液中内源性小分子物质的差异,发现了13种差异性的小分子物质,揭示了当归-川芎造血功能的机制[20]。越来越多的经典案例将系统生物学的研究手段成功地运用到药对的研究中,在一定程度上将“中药药效的复杂问题”简单化和可视化。
1.1.3 分子生物学的介入正逐步受到青睐
分子生物学在西药研究过程中的运用成熟已久。药对过去一直因其“多成分和多靶点”治疗的复杂性而多采用整体的和行为学的简单药效评价模式。但令人欣慰的是当今药对的药效评价模式正从过去的“整体行为学时代”逐渐过渡到现在的“分子生物學时代”。科研工作者已逐步习惯从蛋白、基因和通路等方面深入地评价药对的药效机制。有学者揭示了知母-黄柏药对在治疗糖尿病肌肉萎缩中所具有的独特优势。而这种治疗过程可能与激活mTOR通路有关[21]。可以看出分子生物学研究手段的介入不仅丰富了药对治疗疾病的理论支撑,而且使药对治疗的特色更易被理解和信服。
1.1.4 体内过程的评价模式正逐步获得认可
药对的体外成分众多,很难想象如此众多的成分在体内经过众多转化后产物的复杂性。虽然体内过程十分复杂,但必须在现有的条件下去解决这个问题。众所周知,只有吸收进入血液中的成分(血中移行成分)才是中药在体内直接作用的物质,才有可能成为中药作用的物质基础。有学者采用UHPLC-Q-TOF-MS比较了麻黄-杏仁药对和单味药麻黄以及单味药杏仁在体内5种药代动力学过程的差异,揭示了药对配伍在成分进入体内的优势[22]。还有学者采用PK-PD相关分析的手段开展了体内成分的研究[11]。可以相信,伴随着体内过程评价方式的成熟,药对的研究和评价正逐步向着更加精细化的方向发展。
1.2 药对研究过程中面临的挑战和必须要解决的问题
1.2.1 “成分黑箱问题”仍普遍存在
在药对的研究过程中,虽然一直强调其成分的复杂性和研究的困难性,但这并不意味着药对中的指标性成分可以和单味药的指标性成分混为一谈。许多研究者在研究药对中成分的变化时仍主要关注单味药的指标性成分。例如,在研究A药和B药组成的药对时,很多研究者仍习惯于仅关注A药和B药在《中国药典》中的3~5个质控成分,这显然是不科学和不准确的。
1.2.2 药对中“有效成分”的概念仍不明确
药对中“有效成分”的概念十分重要,采用先进的分析仪器可使鉴别出的成分增多。但到底什么样的成分是“有效成分”。有些研究者仍将 “有效成分”等同于“变化了的成分”,这显然是不科学的。药对配伍中成分含量的增加或减少以及成分的消失或新成分的生成并不意味着其就一定是“有效成分”,“有效成分”的研究必須与药效相关。
1.2.3 “配伍比例”仍较为混乱
“配伍比例”是药对协同增效治疗疾病的关键所在。目前许多药对的研究并不十分重视“配伍比例”。许多研究者仍将药对的“配伍比例”等同于药对在其对应复方中的比例,这显然是不科学的。药对脱离了其在原来复方中的背景,其最佳的“配伍比例”有可能会发生相应的改变。一个合适的“配伍比例”也许能发挥药对更大的治疗作用。
1.2.4 “药效评价模式”仍十分单一
众所周知,药对治疗疾病的另一大优势是其多靶点的特征。但目前评价药效的方式仍十分孤立和单一,切不可将药对的药效评价模式等同于西药的药效评价模式。
1.2.5 “基于药对开发新药”的战略仍不够理想
任何医药研究的最终目的都是为了获得更好的可应用于临床治疗的药物。但目前药对的研究仍主要聚焦在基础研究,缺乏新药开发的策略。
1.2.6 过于分散的“研究途径”仍缺乏系统化
虽然药对研究目前备受关注,但研究仍过于分散。成千上万种药对采用零星的和不同的方式去研究,将会是一件非常耗时和耗力的工程,效果的好坏也很难定论。因此,必须找到药对研究的共性策略并将它规范化和模式化,使药对研究能更加有效地开展下去。
2 药对研究模式新策略
2.1 结合柱色谱分离和细胞相关的成分谱筛选
本课题组针对药对研究现状中的优势和问题,扬长避短,创新性地提出了结合柱色谱分离和细胞相关的成分谱筛选策略,并将其成功地运用到黄芪-山茱萸药对的研究中[23]。如今,与中药相关的临床产品一般是采用复方或从单味药中开发的活性成分(单体)用于疾病的治疗,虽然取得了一定的效果,但仍然存在着众多突出的问题,诸如疗效广泛,不易服用、储藏和携带等。特别是成分不明确所带来的“黑箱问题”一直困扰着中医药的创新和发展。本课题组通过近年的努力,试图寻找到更好的替代物去替代传统的复方,而精准药对即是最为器重的方式。如何获得精准药对。如何去证实这就是基于原复方挖掘出来的最好替代物。首先需要得到各种不同的结构类型相似的化合物群。这时候就需要采用柱色谱去进行分离。举个例子,如需得到黄酮类型化合物的集合,就可以考察聚酰胺和不同型号的大孔树脂以及洗脱条件来确定此种类型化合物集合的最佳工艺。以此类推,还可以得到其他多种结构类型相似的化合物群。根据得到的不同化合物群进行随机统计学组合得到一系列新的小药对复方。这时候特定的细胞相关的成分谱筛选就可以解决以下2个问题:①通过对细胞造模后加入不同组合的小药对复方细胞损伤改善情况的观察,从体外的角度揭示哪种新的小药对最佳;②找到有研究必要的、与疾病改善密切相关的成分。笔者所采用的成分谱筛选其实就是将成分群中的各种已知的若干成分的“峰信号”与“细胞中变化了的指标”进行相关。“峰信号”可以通过对各个成分峰面积的处理进行标准化,然后再与变化了的指标进行Pearson相关分析,以此得到的指标性成分可以很好地对精准药对的质量进行控制。现将研究过程中的相关思路归纳如下,以供其他药对研究工作者参考。
2.1.1 成分谱的深入挖掘是基础
“成分黑箱问题”仍普遍存在,既然不能片面地研究单味药的几个孤立的指标性成分,那就必须尽可能多地归纳出药对中现有的已知成分群。常见可供挖掘的数据库有PubMed, SciFinder, CNKI等。现将典型的黄芪-山茱萸成分群归纳如下。
2.1.1.1 多糖类成分群 葡聚糖和杂多糖是黄芪多糖的主要组成部分。Shimizu等[24]从蒙古黄芪中分离得到平均相对分子质量为76 kDa的黄芪多糖AMon-S。Xu等[25]通过黄芪水提液蛋白沉淀和离子交换色谱以及凝胶色谱分离得到相对分子质量分别为1 699.1,1 197.6 kDa的黄芪多糖Ⅰ和黄芪多糖Ⅱ。Yin等[26]通过双水相系统和高速逆流色谱纯化分离得到平均相对分子质量为1 095 kDa的多糖。
2.1.1.2 黄酮类成分群 黄芪中黄酮类物质的分类与其他植物有所不同,主要为异黄酮类。Zhang等[27]分离得到新的异黄酮类物质6″-O-乙酰基毛蕊异黄酮葡萄糖苷和6′-O-乙酰基-3-O-葡萄糖苷。Xiao等[28]通过高速逆流色谱分离得到5种黄酮类化合物,分别为毛蕊异黄酮葡萄糖苷、芒柄花苷、9,10-二甲氧基紫檀烷-3-O-葡萄糖苷、黄芪异黄烷苷和6″-O-乙酰基毛蕊异黄酮葡萄糖苷。Qi等[29]通过质谱碎片检测到黄芪中的黄芪异黄烷和芒柄花素等异黄酮类物质。
2.1.1.3 皂苷类成分群 黄芪中皂苷类成分群的结构均属于四环三萜类皂苷。Hirotani等[30]从黄芪中分离得到最基本也是现在最广泛熟知的黄芪皂苷Ⅰ、黄芪皂苷Ⅱ、黄芪皂苷Ⅲ和黄芪皂苷Ⅳ。Nalbantsoy等[31]分离并评估了黄芪皂苷Ⅶ和Mac B的活性。Zhang等[32]首次从黄芪中分离并鉴别出astroolesaponins A和astroolesaponins B等皂苷类物质。
2.1.1.4 环烯醚萜苷类成分群 山茱萸环烯醚萜苷类成分一直备受人们关注。Liang等[33]采用高速逆流色谱从山茱萸中分离得到3种环烯醚萜苷类成分,分别为马钱苷、莫诺苷和獐牙菜苷。Ma等[34]从山茱萸中分离得到2种新的环烯醚萜苷类物质,分别为logmalicids A和logmalicids B。Lin等[35]分离得到山茱萸新苷并检测了其抗糖尿病的活性。
2.1.2 体外模型的合理选择是前提
成分的选择必须与活性相关,脱离活性的成分研究是毫无意义的。成分谱的筛选亦如此。如何选择一个合适和精准的体外细胞模型是“结合柱色谱分离和细胞相关的成分谱筛选”能否成功的前提。以治疗糖尿病肾病为例,有报道称可通过抑制肾小球系膜细胞中的过度激活的NF-κB通路来改善糖尿病肾病的肾小球纖维化[36]。Zhou等[37]报道可通过激活FXR受体来抑制肾小球系膜细胞中的TGF-β/smad信号通路,从而减轻糖尿病肾病的进程。Huang等[38]报道可通过激活Sirt1-Nrf2-ARE通路来抵抗肾小球系膜细胞中的FN和TGF-β1的过渡表达,从而延缓糖尿病肾病的进程。肾小球系膜细胞的病变已成为糖尿病肾病发生和发展的中心环节,高糖诱导肾小球系膜细胞的增殖作为糖尿病肾病的体外模型已逐渐被人们认可。因此,选用该模型开展黄芪-山茱萸药对成分谱的筛选是合理的。
2.1.3 “精准药对”概念的提出是核心
任何医药研究的最终目的都是为了更好地服务于临床和为人类健康做出贡献。而以往药对的研究过于重视理论,却忽视了如何去寻找更好的药物。因此,在药对的研究过程中应更加注重新药的开发。笔者首次提出了“精准药对”的概念并将它成功地应用于黄芪-山茱萸药对的开发中[23]。“精准药对”不同于以往作用广和药效不明确的药对或复方,而是基于某种特定的疾病而开发的新的小药对,它作用明确且成分相对清楚。
2.1.4 统计学等交叉学科的运用是关键
药对研究是一项非常复杂的工作,成分谱的筛选更是极具挑战性。如果仅局限于医药研究中运用的仪器和方法是远远不够的,必须强调多学科的交叉和协同作用的发挥。鉴于成分谱的筛选可以看做是一种极其复杂的数据筛选过程,因此数据处理所运用的统计学相关学科就显得尤为重要,而其中的主成分分析(PCA)则是经常运用的一种数据处理方法。Brereton等[39]指出PLS-DA在复杂数据处理和分类过程中具有非常明显的作用,但必须要解决好过饱和的问题。Sah等[40]强调了响应面法在药物释放过程中参数优化所体现的重大作用。所以必须根据具体的情况选择合适的统计学工具,以避免数据处理过程中出现“假阳性”或“假阴性”结果。
2.2 模糊靶标识别药理学
该文提出的“精准药对”针对的是基于某种特定的疾病而开发的新的小药对,它作用明确且成分相对清楚,不同于以往作用广和药效不明确的药对或复方。那为何又提出“模糊靶标识别”呢?传统复方虽有很多显而易见的缺点,但“多成分和多靶点”的作用方式一直是其有别于西药“单一靶点”作用方式的独特优势。许多复杂疾病,如糖尿病和免疫系统疾病的发病过程均是受到多种靶标环节调控失衡的共同结果。笔者所提出的“精准药对”针对的是某种特定的疾病而非某种特定的靶点。因此,精准药对保留了原复方“多成分和多靶点”的优势。但同时,又面临着一个不可回避的问题,即:“精准药对”如何来评价?传统的药理评价模式针对的是单一靶点或孤立地看待几个靶点,采用这种模式对“精准药对”进行评价显然是不合适的。基于此,笔者提出了一个新的“模糊靶标识别”的药理评价模式。这种新的评价模式不仅适用于评价笔者所倡导的“精准药对”,同时也适用于评价其他传统天然产物治疗疾病的优劣。此时,又面临另一个新的问题,即:“模糊靶标”如何来选择。基于某种疾病,笔者选择了各种被公认的表型指标(这些指标均是已被证实与疾病密切相关的),在评价之前均把它们看成具有同等的重要性(因为此时并不知道对于精准药对来说,哪个指标更重要,所以说其模糊)。然后通过各种统计学方法来评价组合的精准药对和其他组合物的优劣,并同时识别出最重要的一个或几个表型指标。这些最重要的表型指标所相关的蛋白分子靶标此时可以进一步通过细胞实验来评价“精准药对”的优劣。笔者所提出的这种“模糊靶标识别”策略实质上是通过表型指标为桥梁,最终把最重要的、真正的蛋白分子靶标给识别出来。基于此,本课题组提出了模糊靶标识别药理学的策略,并将其成功地运用到黄芪-山茱萸药对的研究中[41]。现将研究过程中的相关思路归纳如下,以供其他药对研究工作者参考。
2.2.1 尽可能多的靶标识别是关键
2.2.1.1 “三多一少”靶标 “多饮、多食、多尿、体重减轻”所代表的“三多一少”特征是糖尿病肾病病人所面临的最基本的症状,这一认识已得到广泛的共识[42-43]。
2.2.1.2 “氧化应激”靶标 Miranda-Díaz等[44]指出氧化应激在患有早期慢性肾脏疾病的糖尿病肾病中发挥着重要的作用。氧化应激引起活性氧自由基的堆积,从而加重肾脏疾病的发展。Hou等[45]发现可通过激活线粒体上的四肽SS-31来改善糖尿病肾病中的氧化应激状态,从而缓解糖尿病肾病的发展进程。
2.2.1.3 “炎症”靶标 Xie等[46]发现黄连素可通过激活RhoA/ROCK信号通路来抑制糖尿病肾病发展过程中所过度激活的炎症状态。Uzun等[47]通过特定的专属性炎症因子发现糖尿病肾病中PTX-3的状态有着较大作用,从另一方面证实了炎症状态在糖尿病肾病的发展过程中发挥着关键的作用。
2.2.1.4 “足细胞损伤”靶标 Hyvnen等[48]指出CD2AP蛋白在足细胞损伤中发挥的作用可减轻糖尿病肾病的发展。Gluhovschi等[49]通过尿液中出现的足细胞等特征证实了足细胞的完整性与否决定了糖尿病肾病的严重程度,充分证实了足细胞是糖尿病肾病治疗的一个重要靶标。
2.2.1.5 “高血脂”靶標 Wang等[50]指出血脂紊乱是糖尿病肾病发生和发展过程中重要的危险因素,厄贝沙坦能通过改善血脂环境来调节糖尿病肾病的肾脏功能。Zhang等[51]通过小鼠注射游离脂肪酸发现FGF21能改善糖尿病肾病的高血脂环境。
2.2.1.6 “高血糖”靶标 糖尿病肾病发生过程中的高血糖能诱导肾小球系膜细胞的增殖,1,25-dihydroxyvitamin D3可通过激活DDIT4/TSC2/mTOR来改善这一状态[52]。Katsoulieris等[53]通过糖尿病肾病的肾小球相关细胞中胰岛素通路特征指标检测(IR,IRS-1等)发现了高血糖损伤在其中所起的关键作用。
2.2.2 “模糊识别”——距离法是核心
许多药对研究工作者在研究药对药效的过程中大多倾向于特定的靶点或者特定的作用方式,这有背于药对多靶点的作用效果。药对与西药特定的单一靶点的作用方式相比有着很大的不同。因为药对是在多个环节起着协同的疗效,所以在某些复杂疾病的新药开发方面有着它独特的优势。正是由于药对这种特有的作用方式,因此在药效研究过程中必须要挖掘其独特的研究思路。精准地进行活性筛选和功能定位的最关键步骤是PLS-DA距离法的引入。距离的长短可以体现出不同组合物对疾病调控的整体贡献。这种量化的方法可使复杂疾病的调控以数字和图形的方式形象地展示出来。基于此,本课题组创新性地建立了PLS-DA药效模型,将靶标距离法成功地应用于黄芪-山茱萸药对的研究中[42]。这一研究方式可供其他药对研究工作者参考。
3 结语与展望
3.1 精准药对再评价
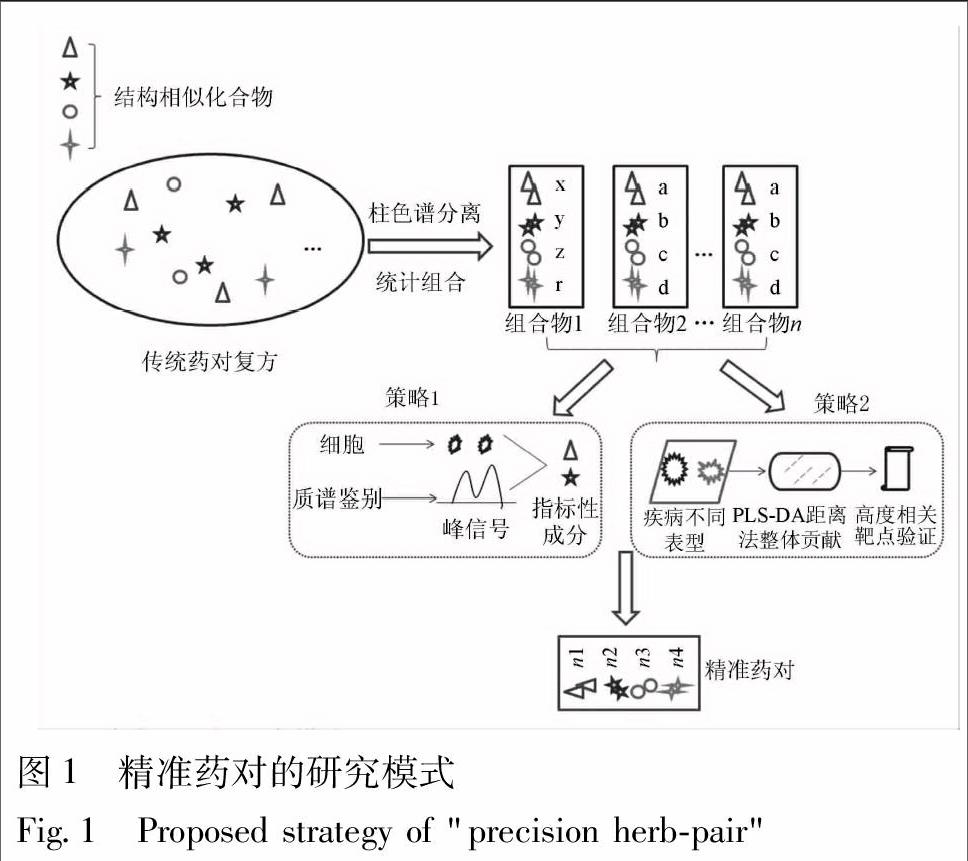
“精准药对”的提出是在传统医药研究思路上的一种创新和突破,本课题组提出的药对研究模式新策略的核心基础就是基于该“精准药对”的概念(精准药对的研究模式见图1)。通过大量的体内和体外实验,笔者已证实了从黄芪-山茱萸药对中开发出来的精准药对CG6(按照多糖-黄酮-皂苷-环烯醚萜苷精确配比2∶3∶1∶2组合的新的小药对复方)无论从成分上还是活性上均优于原来的药对[23,41]。精准药对CG6不仅具有明确和突出的药效,而且成分清晰易于控制。
3.2 展望
虽然提出的“精准药对”的概念已成功地应用于黄芪-山茱萸药对的研究,且所提出的“药对-结合柱色谱分离和细胞相关的成分谱筛选-模糊靶标识别药理学-精准药对再评价”策略已模式化并易于复制和应用于其他药对的研究中,但清楚地意识到一种新的策略要被广泛认可变成一种常规的思路还需要积累更多令人信服的证据。中医药的研究是一个非常复杂的过程,如果不对方法进行变革和创新,研究很难取得突破性的进展。本文提出的“精准药对”其实就是将“配伍艺术”和“精准药物”的思路进行高度的结合。这种“精准药对”具有许多无与伦比的优势,它易于大生产,质量可控且药效比传统复方更佳。还需强调的是,笔者所提出的“模糊靶标识别药理学”的策略不仅适用于精准药对的开发,同时也适用于传统中药或天然产物的再评价。相信通过笔者以及其他医药科研工作者的共同努力,“精准药对”的概念和产品或许会在将来大量的出现和应用于临床实践中,然而现在这谁又能说的清楚呢。
[参考文献]
[1]Wang S P, Hu Y Y, Tan W, et al. Compatibility art of traditional Chinese medicine: from the perspective of herb pairs[J]. J Ethnopharmacol, 2012, 143: 412.
[2]Jiang W Y. Therapeutic wisdom in traditional Chinese medicine: a perspective from modern medicine[J]. Trends Pharmacol Sci, 2005, 26: 558.
[3]刘健. 张锡纯对药[M]. 北京:人民军医出版社,2009.
[4]Prasad V, Gale R P. Precision medicine in acute myeloid leukemia: hope, hype or both?[J]. Leuk Res, 2016, 48: 73.
[5]Xi S Y, Yue L F, Shi M M, et al. The effects of Taoren-Honghua herb pair on pathological microvessel and angiogenesis-associated signaling pathway in mice model of CCl4-induced chronic liver disease[J]. Evid Based Complement Alternat Med, 2016, doi: 10.1155/2016/2974256.
[6]Ma W, Wang W H, Peng Y, et al. Ultra-high performance liquid chromatography with tandem mass spectrometry method for the simultaneous quantitation of five phthalides in rat plasma: application to a comparative pharmacokinetic study of Huo Luo Xiao Ling Dan and herb-pair extract[J]. J Sep Sci, 2016, 39: 2057.
[7]Han B, Huang H Z, Li Z, et al. Therapeutic effects of Chinese medicine herb pair, Huzhang and Guizhi, on monosodium urate crystal-induced gouty arthritis in rats revealed by anti-inflammatory assessments and NMR-based metabonomics[J]. Evid Based Complement Alternat Med, 2016, doi: 10.1155/2016/9398435.
[8]Song S, Ma Q H, Tang Q F, et al. Stereoselective metabolism of amygdalin-based study of detoxification of Semen Armeniacae Amarum in the Herba Ephedrae-Semen Armeniacae Amarum herb pair[J]. J Ethnopharmacol, 2016, 179: 356.
[9]Xiong X G, Peng W J, Chen L, et al. Traditional Chinese medicine Zhiqiao-Houpu herb-pair induce bidirectional effects on gastric motility in rats[J]. J Ethnopharmacol, 2015, 175: 444.
[10]Wang S N, Sun L J, Gu L Q, et al. The comparative pharmacokinetics of four bioactive ingredients after administration of Ramulus Cinnamomi Radix Glycyrrhizae herb pair extract, Ramulus Cinnamomi extract and Radix Glycyrrhizae extract[J]. Biomed Chromatogr, 2016, 30: 1270.
[11]Dong L C, Fan Y X, Yu Q, et al. Synergistic effects of rhubarb-gardenia herb pair in cholestatic rats at pharmacodynamic and pharmacokinetic levels[J]. J Ethnopharmacol, 2015, 175: 67.
[12]Xu G L, Geng D, Xie M, et al. Chemical composition, antioxidative and anticancer activities of the essential oil: Curcumae Rhizoma-Sparganii Rhizoma, a traditional herb pair[J]. Molecules, 2015, 20: 15781.
[13]Song L L, Liu H Y, Wang Y, et al. Application of GC/MS-based metabonomic profiling in studying the therapeutic effects of Huangbai-Zhimu herb-pair (HZ) extract on streptozotocin-induced type 2 diabetes in mice[J]. J Chromatogr B, 2015, 997: 96.
[14]Wang K R, Zhu Z Y, Yang L, et al. Detection, characterization and identification of major constituents in Zhimu-Baihe herb-pair extract by fast high-performance liquid chromatography and time-of-flight mass spectrometry through dynamic adjustment of fragmentor voltage[J]. Rapid Commun Mass Spectrom, 2011, 25: 9.
[15]Han C C, Guo J Y. Antibacterial and anti-inflammatory activity of traditional Chinese herb pairs,Angelica sinensis andSophora flavescens[J]. Inflammation, 2012, 35: 913.
[16]Yang Y, Yin X J, Guo H M, et al. Identification and comparative analysis of the major chemical constituents in the extracts of single fuzi herb and fuzi-gancao herb-pair by UFLC-IT-TOF/MS[J]. Chin J Nat Med, 2014, 12: 542.
[17]Liang Z T, Chen Y J, Xu L, et al. Localization of ginsenosides in the rhizome and root of Panax ginseng by laser microdissection and liquid chromatography-quadrupole/time of flight-mass spectrometry[J]. J Pharm Biomed Anal, 2015, 105: 121.
[18]Li X R, Lian Y Z, Guo F Q. Analysis of volatile oil in Rhizoma Ligustici Chuanxiong-Radix Paeoniae Rubra by gas chromatography-mass spectrometry and chemometric resolution[J]. Acta Pharmacol Sin, 2006, 27: 491.
[19]Cao H X, Zhang A H, Zhang H M, et al. The application of metabolomics in traditional Chinese medicine opens up a dialogue between Chinese and Western medicine[J]. Phytother Res, 2015, 29: 159.
[20]Li W X, Tang Y P, Guo J M, et al. Comparative metabolomics analysis on hematopoietic functions of herb pair Gui-Xiong by ultra-high-performance liquid chromatography coupled to quadrupole time-of-flight mass spectrometry and pattern recognition approach[J]. J Chromatogr A, 2014, 1346: 49.
[21]Zhang J B, Zhuang P W, Wang Y, et al. Reversal of muscle atrophy by Zhimu-Huangbai herb-pair via Akt/mTOR/FoxO3 signal pathway in streptozotocin-induced diabetic mice[J]. PLoS ONE, 2014, 9: e100918.
[22]Song S, Chen F L, Xing X F, et al. Concurrent quantification and comparative pharmacokinetic analysis of bioactive compounds in the Herba Ephedrae-Semen Armeniacae Amarum herb pair[J]. J Pharm Biomed Anal, 2015, 109: 67.
[23]Duan Y, Pei K, Cai H, et al. Bioactivity evaluation-based ultra high-performance liquid chromatography coupled with electrospray ionization tandem quadrupole-time-of-flight mass spectrometry and novel distinction of multi-subchemome compatibility recognition strategy with Astragali Radix-Fructus Corni herb-pair as a case study[J]. J Pharm Biomed Anal, 2016, 129: 514.
[24]Shimizu N, Tomoda M, Kanari M, et al. An acidic polysaccharide having activity on the reticuloendothelial system from the root ofAstragalus mongholicus[J]. Chem Pharm Bull, 1991, 39: 2969.
[25]Xu D J, Xia Q, Wang J J, et al. Molecular weight and monosaccharide composition ofAstragalus polysaccharides[J]. Molecules, 2008, 13: 2408.
[26]Yin J Y, Jiang Z H, Yu H, et al. A new application of an aqueous diphase solvent system in one-step preparation of polysaccharide from the crude water extract of Radix Astragali by high-speed counter-current chromatography[J]. J Chromatogr A, 2012, 1262: 92.
[27]Zhang L J, Liu H K, Hsiao P C, et al. New isoflavonoid glycosides and related constituents from Astragali Radix (Astragalus membranaceus) and their inhibitory activity on nitric oxide production[J]. J Agric Food Chem, 2011, 59: 1131.
[28]Xiao W H, Han L J, Shi B. Isolation and purification of flavonoid glucosides from Radix Astragali by high-speed counter-current chromatography[J]. J Chromatogr B, 2009, 877: 697.
[29]Qi L W, Cao J, Li P, et al. Qualitative and quantitative analysis of Radix Astragali products by fast high-performance liquid chromatography-diode array detection coupled with time-of-flight mass spectrometry through dynamic adjustment of fragmentor voltage[J]. J Chromatogr A, 2008, 1203: 27.
[30]Hirotani M, Zhou Y, Rui H, et al. Cycloartane triterpene glycosides from the hairy root cultures ofAstragalus membranaceus[J]. Phytochemistry, 1994, 37: 1403.
[31]Nalbantsoy A, Nesil T, YI lmaz-Dilsiz O, et al. Evaluation of the immunomodulatory properties in mice andin vitro anti-inflammatory activity of cycloartane type saponins fromAstragalus species[J]. J Ethnopharmacol, 2012, 139: 574.
[32]Zhang Y, Li X X, Ruan J Y, et al. Oleanane type saponins from the stems ofAstragalus membranaceus(Fisch.) Bge. var.mongholicus (Bge.) Hsiao.[J]. Fitoterapia, 2016, 109: 99.
[33]Liang J R, He J, Zhu S, et al. Preparative isolation and purification of iridoid glycosides from Fructus Corni by high-speed countercurrent chromatography[J]. J Liq Chromatogr Relat Technol, 2013, 36: 983.
[34]Ma W, Wang K J, Cheng C S, et al. Bioactive compounds fromCornus officinalis fruits and their effects on diabetic nephropathy[J]. J Ethnopharmacol, 2014, 153: 840.
[35]Lin M H, Liu H K, Huang W J, et al. Evaluation of the potential hypoglycemic and beta-cell protective constituents isolated from Corni Fructus to tackle insulin-dependent diabetes mellitus[J]. J Agric Food Chem, 2011, 59: 7743.
[36]Wang S G, Yang Z Y, Xiong F Q, et al. Betulinic acid ameliorates experimental diabetic-induced renal inflammation and fibrosis via inhibiting the activation of NF-κB signaling pathway[J]. Mol Cell Endocrinol, 2016, 434: 135.
[37]Zhou B S, Feng B, Qin Z X, et al. Activation of farnesoid X receptor downregulates visfatin and attenuates diabetic nephropathy[J]. Mol Cell Endocrinol, 2016, 419: 72.
[38]Huang K P, Chen C, Hao J, et al. Polydatin promotes Nrf2-ARE anti-oxidative pathway through activating Sirt1 to resist AGEs-induced upregulation of fibronetin and transforming growth factor-β1 in rat glomerular messangial cells[J]. Mol Cell Endocrinol, 2015, 399: 178.
[39]Brereton R G, Lloyd G R. Partial least squares discriminant analysis: taking the magic way[J]. Chemometrics, 2014, 28: 213.
[40]Sah A K, Suresh P K. Loteprednol etabonate nanoparticles: optimization via box-behnken design response surface methodology and physicochemical characterization[J]. Curr Drug Deliv, 2016, 13(8): 1.
[41]Duan Y, Pei K, Cai H, et al. Strategy of integrated evaluation on treatment of traditional Chinese medicine as interaction of system to system and establishment of novel fuzzy target contribution recognition with herb-pairs, a case study on Astragali Radix-Fructus Corni[J]. Mol Cell Endocrinol, 2016, 434: 219.
[42]Shera A S, Miyan Z, Basit A, et al. Trends of type 1 diabetes in Karachi, Pakistan[J]. Pediatr Diabetes, 2008, 9: 401.
[43]Liu K, Xu H Q, Lv G H, et al. Loganin attenuates diabetic nephropathy in C57BL/6J mice with diabetes induced by streptozotocin and fed with diets containing high level of advanced glycation end products[J]. Life Sci, 2015, 123: 78.
[44]Miranda-Díaz A G, Pazarín-Villaseor L, Yanowsky-Escatell F G, et al. Oxidative stress in diabetic nephropathy with early chronic kidney disease[J]. J Diabetes Res, 2016, 2016: 7047238.
[45]Hou Y J, Li S C, Wu M, et al. Mitochondria-targeted peptide SS-31 attenuates renal injury via an antioxidant effect in diabetic nephropathy[J]. Am J Physiol Renal Physiol, 2016, 310: F547.
[46]Xie X, Chang X T, Chen L, et al. Berberine ameliorates experimental diabetes-induced renal inflammation and fibronectin by inhibiting the activation of RhoA/ROCK signaling[J]. Mol Cell Endocrinol, 2013, 381: 56.
[47]Uzun S, Ozari M, Gursu M, et al. Changes in the inflammatory markers with advancing stages of diabetic nephropathy and the role of pentraxin-3[J]. Ren Fail, 2016,doi: 10.1080/0886022X.2016.1209031.
[48]Hyvnen M E, Saurus P, Wasik A, et al. Lipid phosphatase SHIP2 downregulates insulin signalling in podocytes[J]. Mol Cell Endocrinol, 2010, 328: 70.
[49]Gluhovschi C, Gluhovschi G, Petrica L, et al. Urinary biomarkers in the assessment of early diabetic nephropathy[J]. J Diabetes Res, 2016, doi: 10.1155/2016/4626125.
[50]Wang C Y, Min C Y, Rong X L, et al. Irbesartan can improve blood lipid and the kidney function of diabetic nephropathy[J]. Discov Med, 2015, 20: 67.
[51]Zhang C, Shao M L, Yang H, et al. Attenuation of hyperlipidemia-and diabetes-induced early-stage apoptosis and late-stage renal dysfunction via administration of fibroblast growth factor-21 is associated with suppression of renal inflammation[J]. PLoS ONE, 2013, 8: e82275.
[52]Wang H, Wang J M, Qu H, et al.In vitro andin vivo inhibition of mTOR by 1,25-dihydroxyvitamin D3 to improve early diabetic nephropathy via the DDIT4/TSC2/mTOR pathway[J]. Endocrine, 2016, doi: 10.1007/s12020-016-0999-1.
[53]Katsoulieris E N, Drossopoulou G I, Kotsopoulou E S, et al. High glucose impairs insulin signaling in the glomerulus: an in vitro andex vivo approach[J]. PLoS ONE, 2016, 11: e0158873.
[責任编辑 马超一]
