苍术化学成分和药理的研究进展
2017-02-16邓爱平李颖吴志涛刘谈康利平南铁
邓爱平+李颖+吴志涛+刘谈+康利平+南铁贵+詹志来+郭兰萍

[摘要]苍术中的化学成分主要有倍半萜及其苷类、烯炔类、三萜和甾体类、芳香苷类、苍术醇类等,药理活性研究表明苍术具有抑制胃酸分泌、促进肠胃运动及胃排空、降血糖、抗菌抗炎、心血管保护和神经系统作用等。该文对苍术的化学成分和药理活性进行了综述,以期为苍术的深入研究和开发利用提供依据。
[关键词]苍术; 化学成分; 药理作用; 研究进展
[Abstract]This article mainly summarises the results of the chemical compositions and its pharmacological activities of Atractylodes Radix. The chemistry components isolated from Atractylodes Radix are mainly sesquiterpenoids, enediynes, triterpenoids, aromatic glycosides, and etc. Pharmacological results showed that Atractylodes Radix has inhibition of gastric acid secretion, promoting gastrointestinal movement and gastric emptying, hpyerglycemic, antibacterial, anti-inflammatory, cardiovascular protection and nervous system activity, etc. This article hopefully to provide a reference for further research, development and utilization of Atractylodes Radix.
[Key words]Atractylodes lancea; chemical compositions; biological activities; advances
doi:10.4268/cjcmm20162104
苍术为菊科植物茅苍术Atractylodes lancea(Thunb.) DC.或北苍术A. chinensis (DC.) Koidz.的干燥根茎[1] 。除此以外地方习用品中尚有朝鲜苍术A. koreana(Nakai) Kitamura.和关苍术A. japonica Koidz.ex Kitam.[2]。苍术初以“术”载于《神农本草经》,被列为上品,味辛、苦,性温,具有燥湿健脾,祛风散寒,明目的功效。迄今为止,苍术中化学成分类型主要为倍半萜类、烯炔类、三萜及甾体类、芳香苷类等;药理活性研究表明这些成分具有保肝、抗菌、抗病毒、抗肿瘤、中枢抑制及促进胃肠道蠕动、抗溃疡、抑制胃酸分泌等作用[3-4]。苍术中挥发性成分已报道的有200多种,其结构主要通过气质联用技术结合数据库予以鉴定,关于这类成分已有较为详细的相关综述[5-6],故本文对挥发油类成分不做重点介绍。
1 化学成分
1.1 倍半萜及其苷类化合物
倍半萜(sesquiterpenes)是指分子中含15个碳原子的天然萜类化合物。倍半萜类化合物分布较广,在木兰目Magnoliales、芸香目Rutales、山茱萸目Cornales及菊目Asterales植物中最豐富。在植物体内常以醇、酮、内酯等等形式存在于挥发油中,是挥发油中高沸点部分的主要组成部分。多具有较强的香气和生物活性。
1.1.1 愈创木烷型倍半萜及其苷类
1.1.1.1 愈创木烷型倍半萜类 愈创木烷型倍半萜类化合物是较早从苍术属植物中提取分离鉴定出的化合物,属于由五元环与七元环骈合而成的芳香骨架类化合物——薁类的衍生物。Wang H X等[7]从苍术中得到如下几种愈创木烷型倍半萜类(1~5),并通过细胞毒性实验证实化合物(1,2,4)对P388和A549细胞无细胞毒活性,见图1,表1。
1.1.1.2 愈创木烷型倍半萜苷类 Junuchi Kitajima等[8-10]从苍术、关苍术等根茎中分得多种水溶性愈创木烷型倍半萜苷类,并对其化合物(6~16)结构进行了解析,其中化合物(12)首次从苍术的甲醇提取物中分离得到,化合物(7,13)首次从关苍术中分离得到,见图2,表2。
1.1.2 桉叶烷型倍半萜及其苷类
1.1.2.1 桉叶烷型倍半萜类 Wang H X 等[7]从苍术中分离并鉴定了化合物17~19,Duan J A等[12]对化合物20进行了结构解析,Katsuya等[13]采用圆二色谱法确定了化合物
21,23的绝对构型。
Yoichiro Nakai等[14]研究发现苍术中苍术酮(28)对患皮肤癌小鼠有抗肿瘤活性。Marion Resch等[15]发现化合物苍术酮具有5-脂肪氧化酶抑制活性。He Meng等[16]首次从苍术中分离得到白术内酯Ⅱ(30),并对其结构进行了解析。Kim Hyun-Kyung等[17]发现首次从白术中分离出白术内酯Ⅲ(31),并发现白术内酯Ⅲ和苍术酮均具有杀螨活性,见图3,表3。
1.1.2.2 桉叶烷型倍半萜苷类 Junuchi KitajimaI等[8-9]从苍术中分离出一系列桉叶烷型倍半萜苷类化合物,并对化合物(33~42)的化学结构进行了分析,其中化合物(33,34,36)首次从苍术的甲醇提取物中分离出,见图4,表4。
1.2 烯炔及其苷类化合物
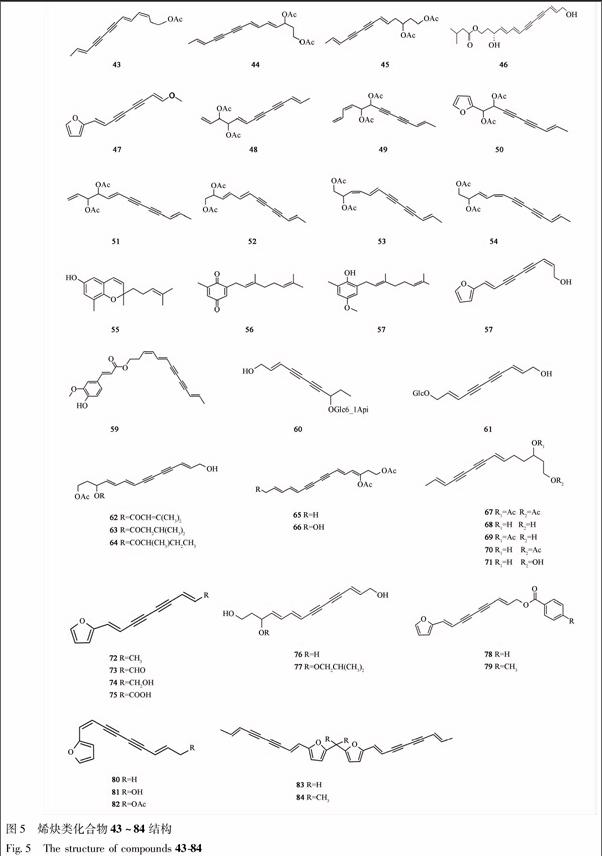
烯炔类化合物除同时具有不饱和三键和双键,有时还含有醇、酮、酸、酯或苯、呋喃等官能团,使三键和双键变得相对稳定,因而能用常规的植化技术进行提取、分离和检测鉴定[19]。Junichi Kitajima等[8,10]首次从苍术的水溶性成分中得到2种烯炔衍生苷(60, 61),并根据其质谱图和核磁共振波谱图分析确定了其骨架结构,见图5,表5。
1.3 三萜和甾体类化合物
苍术中的三萜皂苷类主要有四环三萜和五环三萜,四环三萜。Duan J A等[12]从茅苍术中分离得到6种三萜类化合物(85~90),并分析了其化学结构,见图6,表6。
1.4 芳香苷类化合物
有文献报道苯醇苷类成分具有抗菌、抗炎、抗病毒、保肝、强心、抗辐射、抗肿瘤、增强记忆、免疫调节等作用[27]。Junichi Kitajima等[9-10]从苍术中分离得到化合物(92~100),并对其结构进行了分析,见图7,表7。
1.5 其他类化合物
除上述化合物外,苍术还含有蛇床子素(101)、呋喃甲醛(106)、氨基酸(103,105)、香豆素衍生物(107)、单帖苷等其他水溶性化合物[9-12,15-16,28-29]。Jin-ao Duan等[13]首次从苍术中分离得到化合物(102),并通过细胞毒性实验证明其对HCT-116 和 MKN-45细胞具有细胞毒性见图8,表8。
2 苍术的药理活性
2.1 对消化系统的作用
中国古代医家认为苍术可用于湿阻中焦、脘腹胀满、泄泻等,现代研究则发现苍术有保护肠道、促进肠道运动的功效。苍术具有抗腹泻和抗炎作用。抗炎是苍术抗腹泻的机理[30]。苍术正丁醇提取液有广谱的抗溃疡作用(应激性大鼠溃疡模型),并能抑制蛋白酶活性和胃酸排除量[31]。苍术水煎剂对组织胺引起的胃酸分泌过多和黏膜病变为主要因素的溃疡有疗效[32]。Yu K W等[33]发现苍术提取物中的多糖类成分能有效调节肠道免疫系统。王金华等[34]研究发现β-桉叶醇在胃肠运动功能正常或低下时,能促进胃肠运动,又在脾虚泄泻或胃肠功能呈现亢进时,则显示出明显的抑制作用。苍术的乙醇提取物可以提高胃动激素和胃酸分泌素的水平,抑制生长素抑制素和促肾上腺皮质激素的释放,促进胃排空[3]。Yu Y等[35]研究发现苍术和麸炒苍术均具有抗胃溃疡的活性,麸炒苍术的抗胃溃疡活性强于苍术。并推断苍术抗胃溃疡活性可能与抗炎特性以及其可以抑制IL-8,IL-6和PGE2的合成,胃保护作用可能通过上调产生上表皮生长素和TFF2实现。
2.2 降血糖作用
茅苍术多糖对正常小鼠血糖有短暂的降低作用,对采用四氧嘧啶诱导的高血糖小鼠模型有良好的预防治疗作用[36]。Chohachi Konno等[37]从实验中研究出腹腔注射给药时,苍术多糖A,B,C对降低正常小鼠的血糖水平具有剂量依赖性,苍术多糖A可降低四氧嘧啶高血糖模型小鼠的血糖水平。苍术提取液可抑制小肠蔗糖酶对蔗糖的水解,可用于减少糖尿病患者对葡萄糖的吸收[38]。
2.3 對心血管系统作用
陈洪源等[39]测试出经过石油醚、乙酸乙酯、丙酮萃取后的苍术残渣对血管紧张素抑制酶有明显的抑制作用,进而起到降血压的作用。朱惠京等[40]研究发现关苍术的正丁醇提取物对大鼠心肌缺血及缺血再灌注所导致的心律失常有改善作用,且能降低大鼠心肌缺血及缺血再灌注后的血浆SOD活性,降低了心肌梗塞的范围。苍术酮是一种安全有效的抗高血压病药物,在治疗过程中的特点体现为:用药后不仅使血压逐步下降到正常水平,并且在停药后出现的血压稳定期与治疗时间成正比[41]。李鲁钦等[42]研究表明复方中(与独活联合使用时)苍术对痰湿引起的高血压有一定的治疗作用。
2.4 抗菌消炎作用
苍术中的挥发油具有明显的抗炎作用,其机制与抑制组织中的PGE2生成有关[43]。常温下保存时,随着保存时间的延长,苍术挥发油抗炎作用增强[44]。尹秀芝等[45]对苍术的萃取物进行了系统的多梯度体验外抑菌实验,结果显示苍术对15种真菌有不同程度的抑制作用,并且作用效果优于土槿皮、元柏等中药。王兴旺等[46]发现苍术提取液可以起到鸡大肠杆菌耐药质粒消除剂的作用。肖洋等[47]发现苍术提取液对铜绿假单胞菌R质粒体内外均有消除作用,且体内消除作用强于体外。苍术水提物具有抗念珠感染的活性,口服给药140 mg·kg-1·d-1可显著延长念珠菌感染小鼠的寿命[48]。Seung-Ⅱ Jeong等[18]发现化合物(68)具有抗耐甲氧西林金黄色葡萄球菌的生物活性。Chen Yanjun等[23]发现化合物(47,58,72~75,78,79,83~84)具有抗埃希氏大肠杆菌、金黄色葡萄球菌、枯草杆菌、白色念珠菌活性。 许立等研究发现[49]苍术胶囊有抗炎及免疫调节作用,能增加小鼠网状内皮系统的吞噬功能,增强小鼠迟发性超敏反应和血清溶血素含量,及免疫器官质量;能对杭二甲苯所致耳廓肿胀、抑制肉芽的增生。
2.5 保肝作用
北苍术水提液和挥发油成分均具有保肝作用,水提液作用较挥发油作用差,其中的多糖部位可能是苍术水提液发挥保肝作用的主要部位[50]。生苍术和麸炒苍术挥发油部位均具有保肝活性,麸炒苍术挥发油部位的保肝作用强于生苍术[51]。Hwang J M等[52]还发现苍术中的苍术酮还有保肝作用。
2.6 对神经系统作用
毛苍术挥发油对中枢神经系统有镇静作用[53]。有研究指出,β-桉叶醇和苍术醇是苍术的镇痛作用有效成分,并且β-桉叶醇还有降低骨骼肌乙酰胆碱受体敏感性的作用[54]。KIMura M等[55]经过实验发现β桉叶醇能阻断小鼠骨骼肌神经肌接头上的N受体离子通道,影响通道的打开和关闭,从而加速N受体脱敏。β-桉叶醇能够通过降低重复性刺激引起的乙酰胆碱的再生释放对抗新斯的明诱导的神经肌肉障碍,还能增强神经肌肉麻醉阻断作用[55-56]。
2.7 抗肿瘤活性
Tullayakorn P等[57]研究发现苍术醇提物对患胆管癌的仓鼠具有肿瘤抑制作用,并评价了苍术醇提物治疗胆管癌的安全性和有效性。苍术的甲醇提取物还具有抗皮肤癌活性[14]。Mahavorasirikul W等[58]发现北苍术的乙醇提取物对人的胆管癌细胞具有细胞毒性,其IC50=24.09 mg·L-1,此外还具有抗血管形成和抗细胞入侵的作用。
2.8 其他作用
研究发现苍术的丙酮提取物能够明显的延长氰化钾中毒小鼠的存活时间,表明苍术丙酮提取物有较强的抗缺氧能力,进一步研究表明苍术的抗缺氧主要活性成分为β-桉叶醇[59]。苍术酮是苍术所含的最多倍半萜类化合物,被发现有利尿作用[60]。Satoh K等[61]通过研究发现苍术通过抑制Na+, K+-ATO酶的活性,从而阻止水和Na+在肾脏的重吸收产生利尿作用。Marion Resch等[15]发现化合物(57)和(58)均具有5-脂肪氧化酶和环氧化酶活性。含有苍术的风湿康在类风湿治疗中具有清热除湿、祛风通络、活血止痛的功效。风湿康与甲氨喋呤联合使用时,对活动期的类风湿性关节炎有显著疗效 [62]。
3 结语和展望
目前对苍术中倍半萜及其苷类、烯炔类成分的报道较多,这两类成分在菊科植物中较为常见,烯炔类成分在红花中报道较多,这类成分是植物与昆虫长期协同进化形成的具有抵御昆虫侵食使用的重要次生代谢产物,而三萜和甾体类类成分在苍术中报道较少。现代研究证明苍术具有抗炎、降血糖、抗缺氧、抗菌、抗病毒、保肝、消化系统和神经系统作用等。苍术化学成分的研究已取得了一定成果,但对其各类主要成分的相应药理活性研究还不够深入,对其有效成分作用机制的研究更少。因此有必要对其进行深入的研究,为苍术的资源开发和临床应用提供依据。
[参考文献]
[1]中国药典.一部[S]. 2015: 161.
[2]谢宗万.中药品种理论与应用[M].北京: 人民卫生出版社,2008: 329.
[3]Kimura Y, Sumiyoshi M. Effects of anAtractylodes lancea rhizome extract and a volatile componentβ-eudesmol on gastrointestinal motility in mice[J]. J Ethnopharmacol, 2012, 141(1): 530.
[4]Koonrungsesomboon N, Na-Bangchang K, Karbwang J. Therapeutic potential and pharmacological activities ofAtractylodes lancea(Thunb.) DC[J]. Asian Pac J Trop Med, 2014, 7(6): 421.
[5]吳佳新. 茅苍术挥发油成分及药理活性综述[J].江苏农业科学,2016, 44(3):28.
[6]赵春颖,毛晓霞. 北苍术化学成分与药理作用研究进展[J]. 承德医学院学报,2010, 27(3): 309.
[7]Wang H X, Liu C M, Liu Q .Three types of sesquiterpenes from rhizomes ofAtractylodes lancea[J]. Phytochemistry, 2008, 69: 2088.
[8]Kitajima J, Kamoshita A, Ishikawa T. Glycosides ofAtractylodes lancea [J]. Chem Pharm Bull, 2003, 51(6): 673.
[9]Kitajima J, Kamoshita A, Ishikawa T. Glycosides ofAtractylodes japonica[J]. Chem Pharm Bull, 2003, 51(2): 152.
[10]Kitajima J, Kamoshita A, Ishikawa T. Glycosides ofAtractylodes ovata[J]. Chem Pharm Bull, 2003, 51(9): 1106.
[11]陈军. 茅苍术和白芷化学成分的研究[D]. 南京: 南京农业大学,2007.
[12]Duan J, Wang Y, Qian S H. A new cytotoxic prenylated dihydrobenzofuran derivative and other chemical constituents from the rhizomes ofAtractylodes lancea DC [J]. Arch Pharm Res, 2008, 31(8): 965.
[13]Katsuya E, Hiroshi H. Sesquiterpenoids, LIV: absolute configuration of eudesma-4(14), 7(11)-dien-10-one[J]. Bull Chem Soc Jpn, 1979, 52(8): 2439.
[14]Yu S, Yasukawa K, Takido M. Atractylodis Rhizoma extract and its component, atractylon, inhibit tumor promotion in mouse skin two-stage carcinogenesis[J]. Phytomedicine, 1994, 1(1): 55.
[15]Resch M, Steige A, Chen Z L. 5-Lipoxygenase and cyclooxygenase-1 inhibitory active compounds fromAtractylodes lancea[J]. J Nat Prod, 1998, 61(3): 347.
[16]Meng H, Li G, Dai R. Chemical constituents ofAtractylodes chinensis (DC). Koidz[J]. Biochem Syst Ecol, 2010, 38: 1220.
[17]Kim H K, Yun Y K, Ahn Y J. Toxicity of atractylon and atractylenolide Ⅲ identified inAtractylodes ovata rhizome toDermatophagoides farinaeandDermatophagoides pteronyssinus[J]. J Agric Food Chem, 2007, 55(15): 6027.
[18]Jeong S I, Kim S Y, Kim S J. Antibacterial activity of phytochemicals isolated fromAtractylodes japonica against methicillin-resistant staphylococcus aureus[J]. Molecules, 2010, 15: 7395.
[19]趙秀梅,胡人杰. 天然炔类化合物的研究现况[J]. 天津药学,2007,19(1): 60.
[20]赵晋, 邓金宝, 黎雄,等. 苍术聚炔类化学成分研究[J]. 中药新药与临床药理,2015, 26(4): 525.
[21]Kano Y, Komatsu K, Saito K. A new polyacetylene compound from Atractylodes Rhizome[J]. Chem Pharm Bull, 1989, 37(1): 193.
[22]Nakai Y, Sakakibara I, Hirakura K. A new acetylenic compound from the Rhizomes ofAtractylodes chinensis and its absolute configuration[J]. Chem Pharm Bull, 2005, 53(12): 1580.
[23]Chen Y, Wu Y, Wang H, et al. A new 9-nor-atractylodin fromAtractylodes lancea and the antibacterial activity of the atractylodin derivatives[J]. Fitoterapia, 2012, 83(1): 199.
[24]Resch M, Heilmann J, Steigel A, et al. Further phenols and polyacetylenes from the rhizomes ofAtractylodes lanceaand their anti-inflammatory activity[J]. Plant Med, 2001, 67(5): 437.
[25]Lehner M, Steige A, Bauer R. Diacetoxy substituted polyacetylenes fromAtractylodes lancea[J]. Phytochemistry, 1997, 46(6): 1023.
[26]Kano Y, Sakura T, Komatsu K. Polyacetylene compounds from Atractylodes Rhizome[J]. Chem Pharm Bull, 1990, 38(4): 1082.
[27]宋光西,马玲云,魏锋,等. 苯乙醇苷的分布及药理活性研究进展[J]. 亚太传统医药,2011, 7(4): 169.
[28]Hashimoto T, Noma Y, Kato S,et al. Biotransformation of hinesol isolated from the crude drugAtractylodes iancea byAspergillus niger andAspergillus cellulosae[J]. Chem Pharm Bull, 1999, 47(5): 716.
[29]李霞,王金辉.北苍术化学成分的研究Ⅰ[J]. 沈阳药科大学学报,2002, 19(3): 178.
[30]张明发,沈雅琴,朱自平,等.苍术抗腹泻和抗炎作用研究[J]. 中国药房,2000, 11(3): 109.
[31]朴世浩,朴惠善. 关苍术正丁醇萃取物的抗溃疡作用研究[J]. 中草药,1996, 27: 13.
[32]Kiso Y, Tohkin M, Hikino H. Antihepatotoxic principles of Atractylodes Rhizomes[J]. J Nat Prod, 1983, 46(5): 651.
[33]Yu Kwang-Won. Intestinal immune system modulating polysaccharides from rhizomes ofAtractylodes lancea[J]. Plant Med,1998, 64: 714.
[34]王金华,薛宝云,梁爱华,等. 苍术有效成分β-桉叶醇对小鼠小肠推进功能的影响[J]. 中药学杂志,2002, 37(4): 266.
[35]Yu Y, Jia T Z, Cai Q, et al. Comparison of the anti-ulcer activity between the crude and bran-processedAtractylodes lancea in the rat model of gastric ulcer induced by acetic acid[J]. J Ethnopharmacol, 2015, 160: 211.
[36]段国锋,欧阳臻,樊一桥,等. 茅苍术多糖防治小鼠高血糖的實验研究[J]. 中华中医药学刊,2008, 6: 1211.
[37]Chohachi Yutaka.Isolation and hypoglycemic activity of atractans A, B and C, glycans ofAtractylodes japonica rhizomes[J].Plant Med, 1985, 35(2): 102.
[38]刘晓雯,刘克武,江琰,等. 部分中药材及调味料对小肠蔗糖酶活性的影响[J]. 中国生化药物杂志,2003, 24(5): 229.
[39]陈洪源,明智强,李学刚,等. 苍术提取物对血管紧张素转化酶的抑制活性[J]. 重庆工商大学学报: 自然科学版,2008, 25(4): 420.
[40]朱惠京,红英,马玉莲,等. 关苍术正丁醇萃取物对大鼠心肌缺血及缺血再灌注损伤的保护作用[J]. 中国中医药科技,2000, 7(3): 173.
[41]董大京,刘兰祥,张健,等. 苍术酮对高血压的疗效[J]. 河北医学,1997, 3(4): 63.
[42]李鲁钦.基于数据挖掘的张徳英教授治疗高血压病经验研究[D].石家庄: 河北医科大学,2014.
[43]李宇馨,李瑞海.苍术挥发油抗炎活性研究[J].辽宁中医药大学学报,2013, 15(2): 71.
[44]邓时贵,胡学军,李伟英,等.(茅)苍术挥发油主要化学成分的稳定性及其抗炎作用的初步比较[J].辽宁中药杂志,2008, 35(11): 1733.
[45]尹秀芝,浦卓,王冰梅. 中药苍术抗真菌作用的研究及临床观察[J]. 北华大学学报,2000, 1(6): 492.
[46]王兴旺,胡勇,宋伟舟,等. 苍术对鸡大肠杆菌耐药质粒消除作用的研究[J]. 重庆工学院学报,2006, 20(2): 123.
[47]肖洋,张凌赢,华芳,等. 苍术提取液对铜绿假单胞菌R质粒体内外消除作用的实验研究[J]. 中国老年学杂志,2002, 22: 216.
[48]Inagaki N, Komatsu Y, Sasaki H, et al. Acidic polysaccharides from rhizomes ofAtractylodes lancea as protective principle in candida-infected mice[J]. Plant Med, 2001, 67(5): 428.
[49]许立,倪正,方泰惠,等.苍术胶囊抗炎免疫作用研究[J]. 陕西中医,2005, 26(7): 719.
[50]塔西斯,张洁,杭永付,等.北苍术炮制前后水提液和多糖部位保肝作用比较研究[J]. 现代中药研究与实践,2011, 25(3): 45.
[51]沙多依,杭永付,宋菲,等.北苍术炮制前后挥发油部位保肝作用比较研究[J]. 现代中药研究与实践,2010, 24(4): 41.
[52]Hwang J M, Tseng T H, Hsieh Y, et al. Inhibitory effect of atractylon on ter-butyl htdroperoxide induced DNA damage and hepatic toxicity in rat hepatocytes[J]. Arch Toxicol, 1996, 70(10): 640.
[53]山原条二,沢田徳之助,谿忠人,等. 生薬の生物活性成分に関する研究.朮の薬理学的品质评価[J]. 药学杂志,1977, 97(8): 873.
[54]周德文,周立勇. 术类的药理和药效[J]. 国外医药·植物药分册,1996, 11(3): 121.
[55]Kimara M, Nojima H, Muroi M, et al. Mechanism of the blocking action of beta-eudesmol on the nicotinic acetylcholine receptor channel in mouse skeletal muscles[J]. Neuropharmacology, 1991, 30(8): 853.
[56]Nojima H, Kimural,Kimura M. Blocking action of succinyl-choline with beta-eudesmol on acetylcholine-activated channel activity at endplates of single muscle cells of adult mice[J]. Brain Res, 1992, 575(2): 337.
[57]Plengsuriyakarn T, Matsuda N, Karbwang J, et al. Anticancer activity ofAtractylodes lancea (Thunb.) DC in a hamster model and application of PET-CT for early detection and monitoring progression of cholangiocarcinoma[J]. Asian Pac J Cancer P, 2015, 16(15): 6279.
[58]Mahavorasirikul W, Viyanant V, Chaijaroenkul W, et al. Cytotoxic activity of Thai medicinal plants against human cholangiocarcinoma, laryngeal and hepatocarcinoma cellsin vitro[J]. BMC Complement Altern Med, 2010, 10(1): 1.
[59]李育浩,山原條二. 苍术的抗缺氧作用及其活性成分[J]. 中药材,1991, 14(6): 41.
[60]刘国生,孙备,明亮,等. 苍术挥发油与水溶性成分的主要药理作用比较[J]. 安徽医科大学学报,2003, 38(2): 124.
[61]Satoh K, Yasuda J, Nagai F, et al. The effects of crude drugs using diuretic on horse kidny(Na+、KI+)adebosine triphos-phatase[J]. Yakugaku Zasshi, 1991, 11(2): 138.
[62]郑立辉.风湿康联合甲氨喋呤方案治疗类风湿关节炎(湿热痹阻证)的临床研究[D]. 广州: 南方医科大学, 2009.
[责任编辑 丁广治]
