脂肪营养对封闭循环水养殖道氏虹鳟生长、相关代谢酶及基因表达的影响
2017-02-09孙国祥赵宁宁王顺奎
张 静, 李 勇, 孙国祥, 赵宁宁, 马 骏, 王顺奎
脂肪营养对封闭循环水养殖道氏虹鳟生长、相关代谢酶及基因表达的影响
张 静1, 2, 3, 李 勇1, 2, 3, 孙国祥1, 2, 3, 赵宁宁1, 2, 3, 马 骏1, 2, 3, 王顺奎4
(1. 中国科学院 海洋研究所, 山东 青岛 266071; 2. 中国科学院大学, 北京 100049; 3. 中国科学院实验海洋生物学重点实验室, 山东 青岛 266071; 4. 山东东方海洋科技股份有限公司, 山东 烟台 264003)
为探讨饲料脂肪营养对封闭循环水养殖道氏虹鳟()生长、脂肪代谢及相关酶基因表达的影响, 作者采用单因素设计, 即4个脂肪水平——12%、15%、18%、21%(以Ⅰ、Ⅱ、Ⅲ、Ⅳ组表示), 共4个处理组, 每处理3重复, 每重复25尾鱼。试验鱼为初始体质量(333.25±20.71)g的道氏虹鳟幼鱼, 试验期77 d。结果表明, 与后3组相比, Ⅰ组试验鱼增质量率显著提高17.20%~33.17%, Ⅰ和Ⅱ组饲料系数显著低于Ⅲ和Ⅳ组6.20%~20.56%(<0.05); 脂肪合成酶类FAS活力随饲料脂肪水平升高而降低, 脂肪分解酶类LPL、HL及L-CPT Ⅰ活力变化特征与之相反(<0.05)。其中, Ⅰ组FAS活力显著高于Ⅲ、Ⅳ组7.5%、8.7%; L-CPT Ⅰ活力显著低于后3组13.08%~16.35%; Ⅳ组LPL活力显著或极显著高于前3组18.8%~44.7%(<0.05或<0.01); I组肝脏的mRNA表达量比后3组显著高48.29%~55.15%(<0.05);呈相反特征, Ⅳ组显著高于前3组36.72%~113.59%(<0.05或<0.01); Ⅰ组肌肉mRNA表达量显著高于Ⅳ组66.82%(<0.05);表达丰度随脂肪水平升高先下降后显著上升(<0.05)。该结果特征与肝脏中该两种酶活力变化具有同步性。研究发现, 随饲料脂肪水平变化, 肌肉mRNA表达量变化比肝脏更明显且规律性更强, 而肝脏mRNA表达量变化较肌肉更明显。本试验初步确定, 在封闭循环水养殖模式下, 330 g左右道氏虹鳟饲料蛋白水平在45%时, 脂肪水平以不超过12%为宜。
脂肪; 道氏虹鳟(); 生长; 脂肪代谢; 基因表达; 封闭循环水养殖
脂肪是鱼类维持生长、发育和正常生理机能所必需的营养物质。大量研究证实, 适宜脂肪水平会提高饲料蛋白利用率, 节约蛋白质。但饲料脂肪含量过高, 会造成脂肪代谢紊乱, 进而导致营养性脂肪肝[1]、内脏团脂肪过量沉积[2]等, 抑制生长。因此, 有关脂肪营养对鱼类生长、脂肪代谢及相关基因表达的效应, 值得深入研究。
道氏虹鳟()隶属鲑形目(Salmoniformes)鲑科(Salmonidae)大麻哈鱼属(), 属降海型虹鳟。目前该鱼工业化养殖中, 存在内脏团脂肪过量沉积、畸形率高等问题, 严重影响正常生长, 具体原因尚未探明。关于饲料脂肪水平对虹鳟生长、肝脏脂肪代谢影响的研究不全面且结果存在分歧[3-4, 5-7]。查阅文献可知, 虹鳟鱼脂肪需要量为8%~25%[8-9], 但其封闭循环水养殖中饲料脂肪需求的变化特点研究未见报道。
本试验研究在封闭循环水养殖模式下, 通过设计不同饲料脂肪水平, 探寻脂肪营养对道氏虹鳟生长、脂肪代谢及相关基因表达的效应, 为初步查明其脂肪代谢机制和健康养殖的营养调控提供科学依据和应用参考。
1 材料与方法
1.1 试验设计、饲料配制、饲养管理
目前国内外研究表明, 虹鳟脂肪需求介于8%~ 25%, 而实际生产中采食22%脂肪水平饲料的海水虹鳟, 出现了脂肪沉积过量等现象, 本试验结合前人研究以及生产实际, 采用单因素设计, 将优质鱼油作为单一脂肪源变量, 设置4个饲料脂肪水平(12%、15%、18%、21%), 分别以Ⅰ、Ⅱ、Ⅲ、Ⅳ组表示, 每处理组3重复。试验饲料为直径5 mm的膨化饲料, 由北京汉业科技有限公司专门加工, 试验饲料配方见表1。试验鱼由山东东方海洋科技股份有限公司提供, 来自同一批次、同一养殖池。
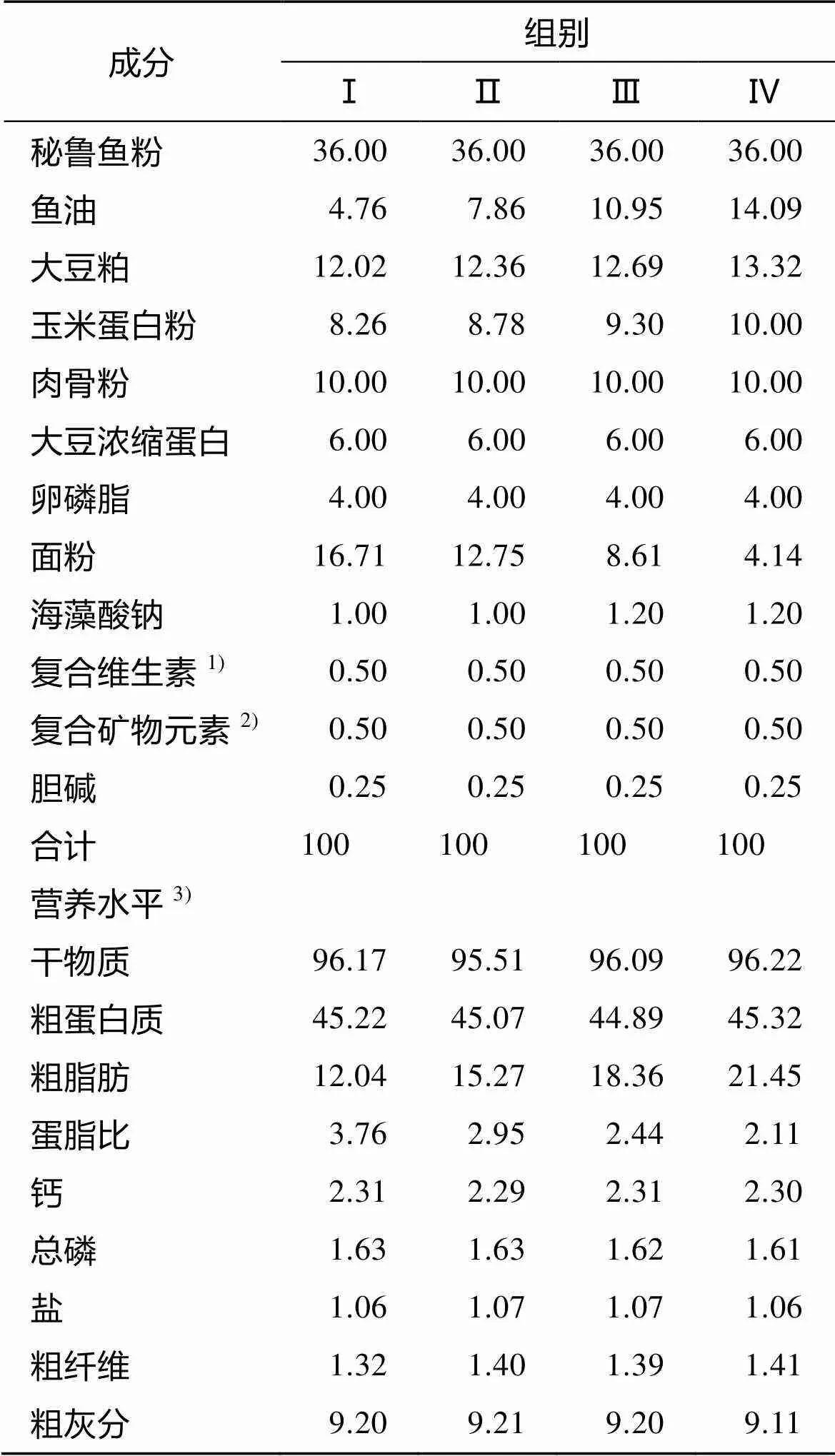
表1 试验饲料原料组成及营养水平(%干物质)
注: 表中数值除粗纤维外均为实测值; 1). 复合维生素为每千克饲料提供: VA 7 500 IU, VC 100 mg, VD32 000 IU, VK35 mg, VB17.5 mg, VB215 mg, VB67.5 mg, VB120.02 mg, VE 50 mg, 烟酸 6 mg, 泛酸钙 20 mg, 叶酸 1 mg, 生物素 0.12 mg, 肌醇 500 mg; 2). 复合矿物元素 (mg/kg饲料): Cu 3; Zn 72; Mn 13; Fe 50; I 0.15; Co 0.5; Mg 600; Se 0.23; P 6000; 3). 实测值
试验开始前禁食24 h, 挑选大小均匀(333.25± 20.71)g、健康、活力好的道氏虹鳟成鱼, 随机分配于12个直径0.95 m、高0.65 m的养殖桶内, 每桶25尾。试验在室内封闭循环水系统中进行, 日换水量约占总水量的10%, 每天36个循环, 驯养21 d, 正式试验77 d, 试验水温14℃±0.5℃, 溶氧(10±0.5)mg/L, 盐度30±0.5, 24 h光照。每天投喂4次(8: 00, 12: 00, 16: 00, 20: 00)至饱食, 每次投喂0.5 h后, 将残饵排出、收集、计质量, 从投喂量中扣除作为实际采食量。发现死鱼及时捞出称质量, 记录。
1.2 样品采集和指标测定方法
试验结束时, 禁食24 h, 翌日称体质量。用MS-222快速深度麻醉, 冰盘中解剖剥离肝胰脏和背肌, 取同一部位肝胰脏迅速分装入封口袋, –20℃保存待测, 另取适量肝胰脏和背肌剪碎放入冻存管, 迅速放入液氮罐, 取样完毕后保存于–80℃冰箱用于分子指标测定。饲料样品用四分法缩减至200 g, 分装入封口袋, 进行后续营养成分分析。
1.2.1 饲料营养成分测定
干物质采用失重法, 即105℃烘箱烘干至恒质量; 粗蛋白采用凯氏定氮法; 粗脂肪采用索氏抽提法; 粗灰分采用焚烧法; 钙采用高锰酸钾法; 总磷采用钼黄比色法。
1.2.2 生长指标测计
存活率(%)=100×(终末存活鱼数/初始鱼数)
增质量率(%)=100×[(终末体质量–初始体质量)/初始体质量]
特定生长率(%/d)=100×[(ln(终末体质量)–ln(初始体质量))/试验天数]
摄食量(g/尾)=(总投喂量–总残饵量)/尾数
饲料系数=(总投喂量–总残饵量)/(终末体质量–初始体质量)
1.2.3 脂肪代谢指标测定方法
使用南京建成生物工程研究所生产的Elisa试剂盒, 测定试验鱼肝胰脏中脂肪酸合成酶(FAS)、肝型脂肪酸结合蛋白(L-FABP)、肝型肉碱棕榈酰转移酶Ⅰ(L-CPTⅠ)、脂蛋白脂酶(LPL)、肝酯酶(HL)和总酯酶(TL)的活力。测定前进行样品预处理, 准确称取组织质量, 按质量体积比加入9倍的生理盐水制成10%的组织匀浆, 2 500 r/min, 离心10 min, 后通过预试验确定最终稀释倍数, 进行指标正式测定。
1.2.4 脂肪代谢关键酶mRNA相对表达量检测方法
1.2.4.1 总RNA的提取和反转录
取0.1 g肝胰脏和肌肉组织样品, 按照飞捷生物技术有限公司提供的RNAfast200试剂盒提取总RNA(总体系20 μL), 然后用1%的琼脂糖凝胶电泳检测RNA完整性(3条带, 分别是5sRNA、18sRNA、28sRNA), 并分别测定样品在260 nm和280 nm波长的吸光度值, 计算RNA样品的浓度和纯度。根据RNA浓度, 取2mg RNA按照PrimeScript™ RT reagent Kit with gDNA Eraser (Perfect Real Time) (TaKaRa)说明书进行反转录, –80℃保存。
1.2.4.2 实时荧光定量PCR
以道氏虹鳟(NM_001124235.1)作为内参基因, 使用ABI 7500 Fast实时荧光定量PCR仪以及7500 software v2.0.1(Applied Biosystems, 美国)测定肝胰脏和肌肉中、相对表达量。特异性引物序列见表2。首先通过溶解曲线和琼脂糖凝胶电泳检测引物特异性, 并利用浓度标准曲线确定合适的模板稀释倍数(4×)。然后进行样品测定, 每试验组9个样品(3×3), 每个样品重复测量3次, 以不加模板的PCR反应样品作为阴性对照。反应体系为20mL: 2mL模板cDNA、0.4mL特异性引物(上下游引物, 10mmol/L)、0.4mLROX、6.8mL无菌水、10mL SYBR® Premix Ex Taq™ II (Tli RNaseH Plus)(TaKaRa)。反应条件为:(95℃ 30 s; 95℃10 s, 61℃ 30 s, 40个循环),(95℃ 30 s; 95℃ 10 s, 56℃ 30 s, 40个循环)。最后, 以试验初始样品为对照组, 使用2–DDCt方法计算和的相对表达量。
1.3 数据统计及分析
试验数据用SPSS 22.0软件进行生物统计分析, 采用单因素方差分析和Duncan检验法进行多重比较。结果用“平均值±标准差(Mean±SE)”表示。

表2 本试验的引物设计
2 结果
2.1 生长性能
由表3可见, 终末体质量(FBW)、增质量率(WGR)和特定生长率(SGR)均随脂肪水平升高整体呈下降趋势。其中, Ⅰ组FBW、WGR分别显著高于后3组6.81%~7.83%、17.20%~33.17%(<0.05); SGR显著高于Ⅲ、Ⅳ组28.91%、29.54%(<0.05), 与Ⅱ组差异不显著(>0.05)。
摄食量随脂肪水平升高先下降后上升, Ⅰ组显著高于Ⅱ、Ⅲ组19.40%、14.62%(<0.05), 与Ⅳ组无显著差异(>0.05)。饲料系数随脂肪水平升高先上升后下降。Ⅰ、Ⅱ组显著低于Ⅲ、Ⅳ组6.20%~20.56% (<0.05)。
各组存活率无显著性差异, 均在93%以上(> 0.05)。
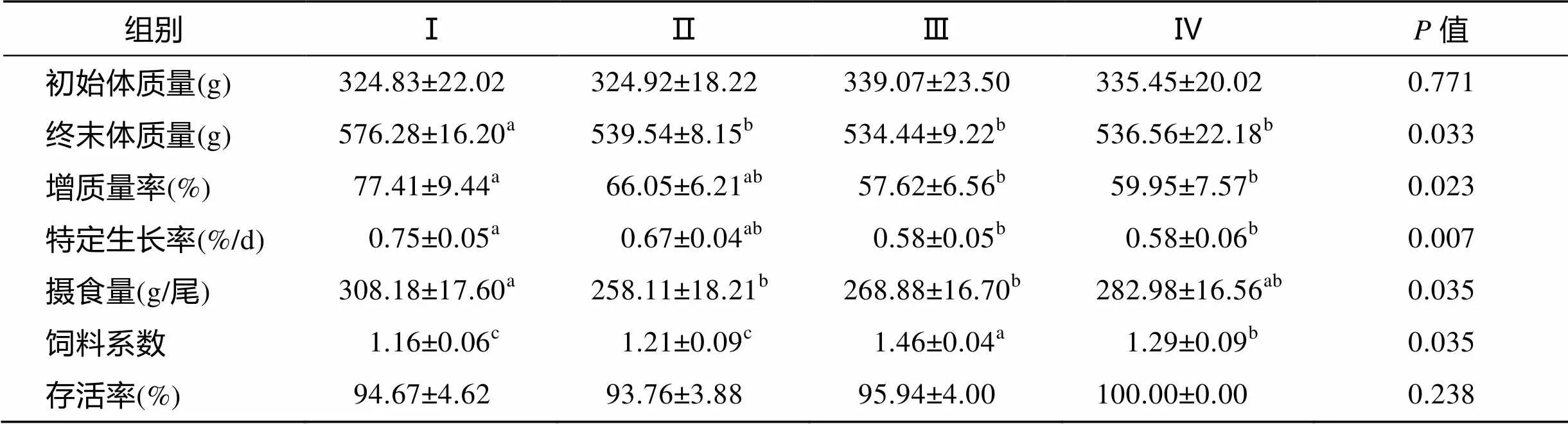
表3 饲料不同脂肪水平对道氏虹鳟生长性能的影响
注: 表中同一行上标无字母、或相同字母表示差异不显著(>0.05), 相邻字母表示差异显著(<0.05), 相隔字母表示差异极显著(< 0.01), 表3、表4同
2.2 脂肪代谢指标
由表4可知, 脂肪酸合成代谢中, FAS活力随饲料脂肪水平增加而下降, Ⅰ组显著高于Ⅲ、Ⅳ组7.5%、8.7%(<0.05); Ⅱ组L-FABP活力显著高于其他3组9.1%~13.1%(<0.05)。
脂肪分解相关酶中, LPL活力随脂肪水平升高先下降后上升。Ⅳ组显著高于Ⅰ、Ⅲ组36.3%、18.8% (<0.05), 极显著高于Ⅱ组44.7%(<0.01)。HL活力随脂肪水平升高而升高。Ⅲ、Ⅳ组显著高于Ⅰ、Ⅱ组(<0.05)。TL与HL有相同变化特征。
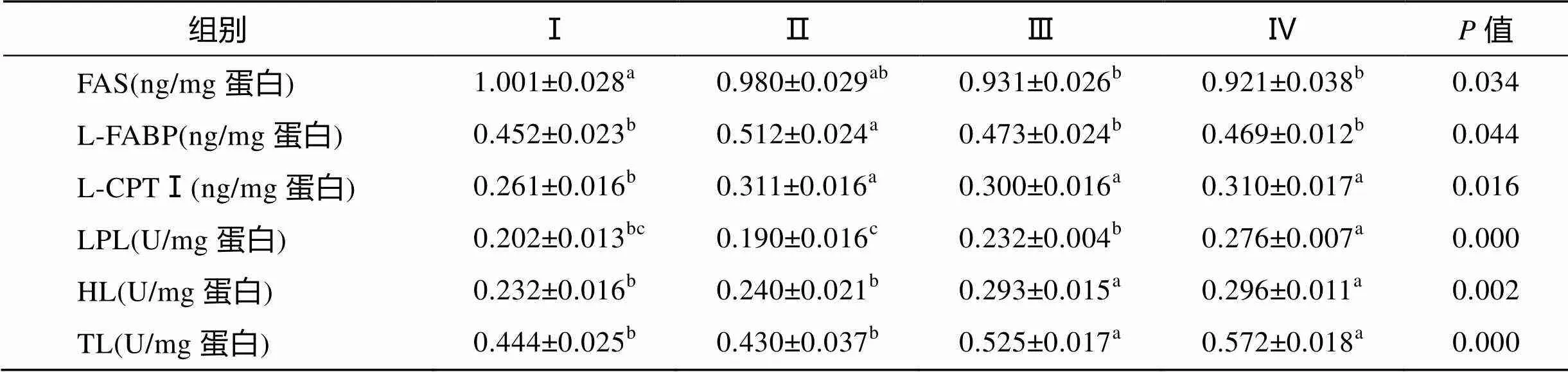
表4 饲料脂肪水平对肝脏脂肪代谢指标的影响
β-氧化相关代谢酶L-CPTⅠ活力随脂肪水平升高先上升后趋稳, 后3组显著高于Ⅰ组15.1%~19.5% (<0.05)。
2.3 脂肪代谢基因mRNA水平
由表5和图1可知, 在肝脏中,表达量随脂肪水平升高先下降后趋稳,表达量逐渐上升。其中, Ⅰ组显著高于其他3组48.29%~55.15% (< 0.05); Ⅳ组显著或极显著高于前3组36.72%~ 113.59%(<0.05或<0.01)。
在肌肉中,表达量变化较为缓慢, Ⅰ组显著高于Ⅳ组66.82%(<0.05)。表达量先下降后上升, Ⅱ组最低, Ⅲ、Ⅳ组显著高于Ⅱ组86.03%、72.66%(<0.05)。
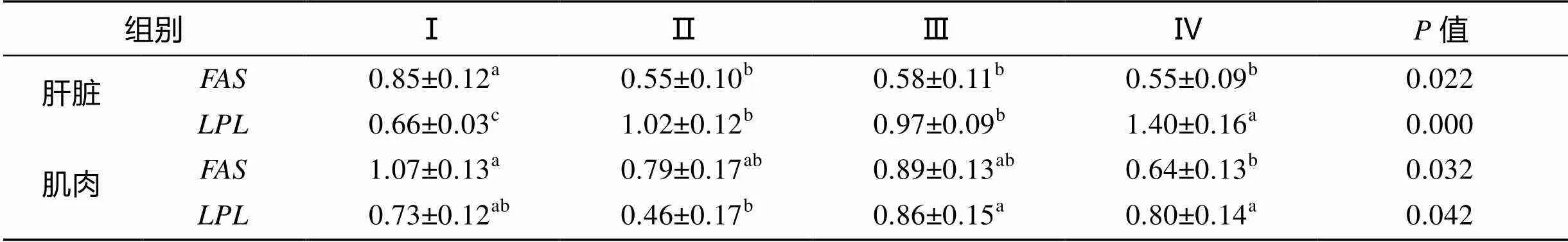
表5 脂肪营养对道氏虹鳟脂肪代谢基因mRNA表达量的影响
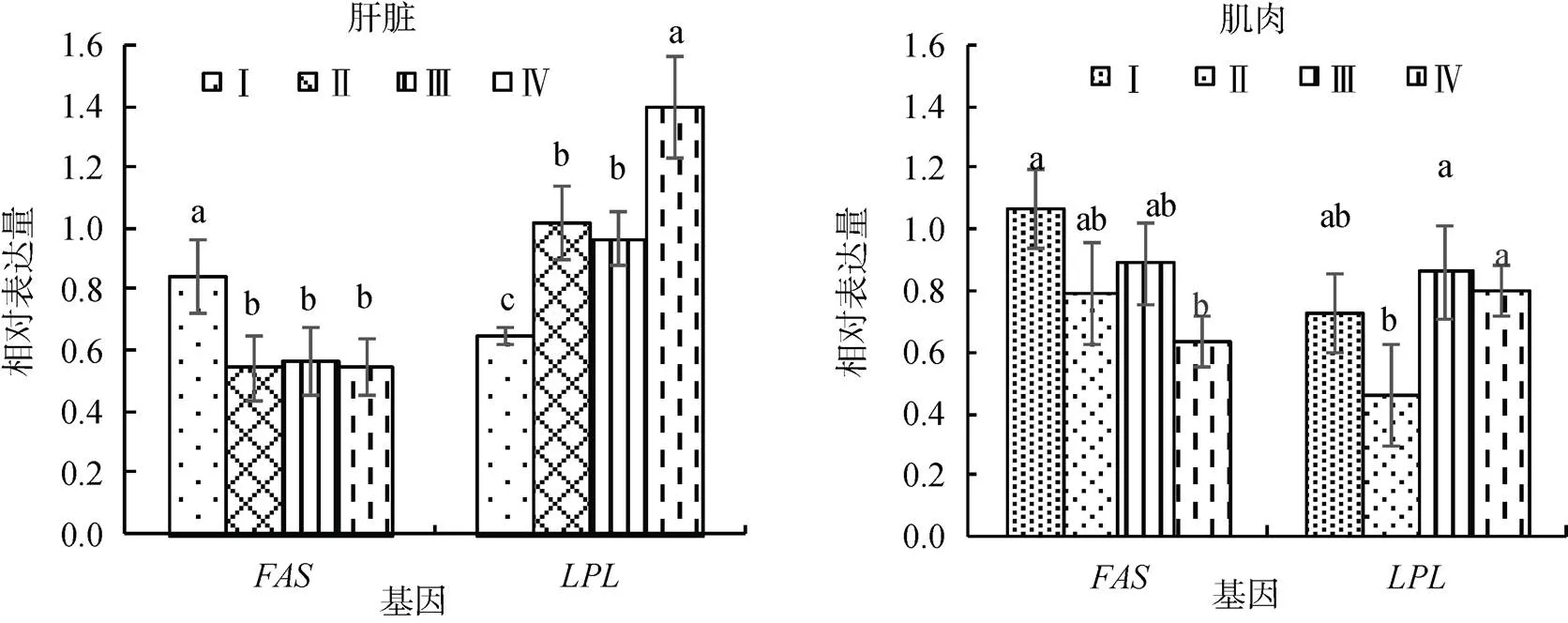
图1 脂肪营养对肝脏和肌肉脂肪代谢基因表达的影响
数据柱形标注不同小写字母表示差异显著(<0.05)
Column values with different small letters indicate significant difference (< 0.05)
3 讨论
3.1 脂肪营养对生长性能的影响
在本试验条件下, 饲料12%脂肪水平组的增质量率显著高于其他3组, 饲料系数对应显著最低, 说明该脂肪水平组饲料适合工业化养殖条件下试验鱼的生长和饲料利用, 即虹鳟成鱼无需过高脂肪水平即可满足其生长需求。分析原因, 一方面从能量利用角度看, 本试验中、高脂肪水平饲料所提供的有效能, 可能超过了试验鱼的生长需求, 并不能为生长增益, 反而会增加代谢负担、阻滞生长和饲料利用; 另一方面, 与流水和网箱养殖相比, 工业化循环水养殖流速、水温稳定, 活动范围和游泳阻力较小, 从而减少了维持所需能量, 较低脂肪水平即可满足试验鱼生长需求。杨清华等[8]曾报道, 淡水养殖虹鳟成鱼脂肪需要量为8.0%~10.6%; Bureau等[3]的试验表明, 在蛋白水平为47%时, 10%、16%、18%脂肪水平组虹鳟鱼的生长无显著差异, 且10%水平组饲料利用率显著高于其他两组; 饲料脂肪水平超过鱼类需求会显著降低饲料利用率[11-12]。上述研究与本试验结果基本一致。但也有学者发现, 流水养殖虹鳟脂肪需求量约为15%~25%[13-15], 这可能是由养殖模式不同造成的。本试验结果与前人研究中较低脂肪水平结果相一致, 说明在工业化循环水养殖模式和饲料蛋白质含量45%的前提下, 道氏虹鳟并不需要过高脂肪营养即可满足生长需求, 其饲料脂肪水平以不超过12%为宜。
同时, 合适蛋脂比既能为鱼类提供适宜能量, 又能最大程度地利用蛋白质。蛋脂比过低, 蛋白质不能满足鱼类的生长需求或脂肪过量导致脂肪代谢异常, 生长受抑制[16]。本试验中, 12%脂肪水平组蛋脂比为3.76, 试验鱼生长性能最佳, 说明该蛋脂比适宜, 这与前人得出的虹鳟鱼适宜蛋脂比3.8相近[17]。
3.2 脂肪营养对肝脏脂肪代谢的影响
本试验中, 试验鱼肝脏FAS活力随脂肪水平升高而降低, 12%脂肪水平组显著高于18%和21%组。说明饲料脂肪营养增加对道氏虹鳟FAS活力有抑制作用, 这与前人在虹鳟、吉富罗非鱼()以及白甲鱼()上的研究结果[2, 18-19]相一致。剖析原因, FAS是内源性脂肪酸合成的关键酶, 能够催化丙二酰辅酶A、乙酰辅酶A和还原型辅酶Ⅱ体内合成长链饱和软脂酸盐[18], 促进脂肪生成。低脂肪组试验鱼FAS活力最高, 有利于增加脂肪及脂肪酸合成满足机体需要, 使饲料脂肪营养充分利用, 超过中、高脂肪组的利用效率; 而中、高脂肪组外源性脂肪的供给充足或过量, 因而通过降低试验鱼FAS活力来减少内源性脂肪的合成, 以维持机体脂肪代谢的平衡。
肝脏LPL、HL和TL的活力测析表明, 三者活力随饲料脂肪水平升高而增加, 18%和21%脂肪水平组显著或极显著高于12%和15%组。这与前人研究所得高脂饲料能提高鱼类肝脏中两种酶活力[20-22]的结果基本一致。这可能是由于饲料脂肪水平升高, 肝脏中需代谢的甘油三酯(TG)和游离脂肪酸(FFA)增加, 肝脏一方面通过提高LPL和HL活力, 降解乳糜微粒与极低密度脂蛋白中的TG为FFA, 通过血液转运至其他组织, 促进脂质合成或氧化供能; 另一方面利用HL加速摄取高密度脂蛋白中的CHO, 促进肝脏对TG、FFA以及CHO的代谢[23-25]。
本试验L-CPT Ⅰ活力随脂肪水平升高先显著上升后趋于平稳, 拐点出现在15%脂肪组。这说明饲料脂肪水平在一定范围内升高可提高该酶活力, 脂肪水平过高无益于其活力增加。这一变化特征与Li等[26]所发现的饲料脂肪水平对草鱼()L-CPT Ⅰ基因表达影响的特征相似, 即脂肪营养对该酶基因表达和活力的调控可能具有同步性。分析原因, 饲料低脂肪水平时, 细胞内长链酯酰辅酶A(LCACoAs)含量较低, 此时丙二酰辅酶A(MCoA)抑制L-CPT1活力[27]; 随脂肪水平增加, LCACoAs含量增加, 竞争性结合L-CPT Ⅰ, 减弱了MCoA的抑制作用, 故L-CPT Ⅰ活力升高, 促进脂肪酸β氧化; 脂肪水平继续增加, 细胞内长链脂肪酸转运效率下降(由下文L-FABP活力测析结果可知), 降低LCACoAs对MCoA的竞争性相互作用, 故L-CPT Ⅰ活力不再升高。
除脂肪及脂肪酸的合成、分解代谢外, 脂肪转运在脂肪代谢中发挥重要作用。本试验结果显示, 15%脂肪水平组L-FABP活力显著最高, 其余3组无显著差异。说明饲料脂肪水平为15%时, 肝脏脂肪酸转运效率最高, 高于或低于此脂肪水平转运效率下降。这可能是由于L-FABP参与细胞内长链脂肪酸的转运及TG合成[28], 故在中低脂肪时, 与FAS协同促进脂质形成, 提高饲料脂肪利用率。
可见, 饲料脂肪水平显著影响肝脏脂肪合成、转运和分解酶活力。试验鱼通过脂肪对五种酶活力的调控, 促进脂肪代谢, 满足机体需要。本试验12%脂肪组试验鱼通过增加肝脏脂肪合成(提高FAS活力)和减少分解(降低LPL、HL、L-CPT Ⅰ活力)的自我调控方式, 提高了饲料脂肪利用率, 从而不仅保证鱼体脂肪正常需要, 而且促进生长, 从脂肪代谢层面解释了低脂肪组试验鱼生长性能显著优于其他3组的机制所在。
3.3 脂肪营养对肝脏和肌肉相关代谢酶基因表达的影响
作为脂肪代谢的两个关键酶,和mRNA在鱼类表达量方面的研究, 目前主要集中于对其表达影响因素(生理阶段、激素、营养、环境条件等)的探寻上[5, 29]。其中, 饲料脂肪水平作为一种营养调控因子, 对两种酶基因表达有一定影响[20, 30-31], 目前尚未见有关于脂肪水平对道氏虹鳟肝脏和肌肉两种酶mRNA表达量影响的研究。
本试验肝脏mRNA表达量在低脂肪组最高, 显著高于其他3组, 而高脂肪组表达量显著或极显著高于前3组。该结果特征与其代谢酶活力变化具有同步性。与饲料脂肪水平对吉富罗非鱼[18]肝脏、团头鲂()[32]和瓦氏黄颡鱼()[23]基因表达的研究结果基本一致。究其原因, 一方面, 饲料脂肪水平升高导致的不饱和脂肪酸含量增加会抑制的表达; 另一方面在肝脏中存在营养诱导性表达, 高脂是其表达的诱导因子之一[33]。通过对两种酶基因表达丰度的调控, 协调脂肪的分解与合成, 充分利用饲料脂肪营养。在低脂肪组, 试验鱼通过促进转录、降低表达水平协调脂肪代谢, 满足机体的脂肪酸需求, 从转录水平上解释了低脂肪组活力显著最高、活力显著最低, 从而导致该组增质量率和饲料系数最优的试验结果。由于高脂肪饲料提供了足够脂肪, 故试验鱼维持低表达即可满足需求; 而表达丰度提高有助于清除多余的TG, 避免脂肪肝。
肌肉是脂肪沉积的主要部位之一, 脂肪沉积多寡对肉质品质影响显著。本试验中, 12%脂肪组肌肉mRNA表达量显著高于21%组, 后两组显著高于15%脂肪组。这一结果说明饲料低脂肪水平时, 鱼体主要通过提高表达水平合成较多脂肪酸, 储存于肌肉, 可能有利于试验鱼的肉质改善; 而表达丰度的提高有利于为肌肉组织供能。本试验低脂肪组主要通过表达量的增加促进肌肉脂肪沉积, 可能有利于改善肉质品质。
由图1可知, 肝脏和肌肉中两种酶基因mRNA表达量随饲料脂肪水平变化的特征不同。具体表现为, 肌肉mRNA表达量随脂肪水平变化比肝脏更明显且规律性更强, 而肝脏mRNA表达量变化较肌肉显著。从根本上来说, 是肝脏与肌肉两组织对饲料脂肪营养干预的分子生物学应答程度不同。分析原因在于虹鳟作为主要三文鱼之一, 其肌肉脂肪沉积至关重要, 故基因表达对饲料脂肪水平变化反应较肝脏更为敏感而强劲,基因表达相对弱化; 而肝脏仍处于正常表达状态。此可谓三文鱼肌肉脂肪分子营养调控的特征或机理显现。
4 小结
本研究从脂肪生理代谢及其分子营养层面初步揭示了12%脂肪组生长性能显著高的可能机制所在, 即饲料脂肪水平实则作用于机体脂肪代谢酶基因的表达, 然后调控其代谢酶活力变化, 进而影响脂肪生理代谢效应, 最终表现为生长性能的优劣。本研究初步确定, 在封闭循环水养殖模式下, 330 g左右道氏虹鳟无需过高脂肪供给即可实现健康生长, 在饲料蛋白质水平为45%时, 其饲料脂肪水平以不超过12%为宜。
[1] 冯健, 刘永坚, 刘栋辉, 等. 红姑鱼日粮脂肪水平和脂肪酸比例与脂肪肝病关系研究[J]. 海洋科学, 2004, 28(6): 28-31. Feng Jian, Liu Yongjian, Liu Donghui, et al. Relationship between dietary lipid levels and proportion of lipid acids on fatty liver disease in juvenile[J]. Marine Sciences, 2004, 28(6): 28-31.
[2] Gelineau A, Corraze G, Boujard T, et al. Relation between dietary lipid level and voluntary feed intake, growth, nutrient gain, lipid deposition and hepatic lipogenesis in rainbow trout[J].Reproduction Nutrition Development, 2001, 41(6): 487-503.
[3] Bureau D P, Hua K, Harris A M. The effect of dietary lipid and long-chain n-3 PUFA levels on growth, energy utilization, carcass quality, and immune function of rainbow trout,[J]. Journal of the World Aquaculture Society, 2008, 39(1): 1-21.
[4] Chaiyapechara S, Liu K K M, Barrows F T, et al. Proximate composition, lipid oxidation, and sensory characteristics of fillets from rainbow troutfed diets containing 10% to 30% lipid[J]. Journal of the World Aquaculture Society, 2003, 34(3): 266-277.
[5] Albalat A, Sanchez-gurmaches J, Gutierrez J, et al. Regulation of lipoprotein lipase activity in rainbow trout () tissues[J]. General and Comparative Endocrinology, 2006, 146(3): 226-235.
[6] Ducasse-cabanot S, Zambonino-infante J, Richard N, et al. Reduced lipid intake leads to changes in digestive enzymes in the intestine but has minor effect on key enzymes of hepatic intermediary metabolism in rainbow trout ()[J]. Animal, 2007, 1(9): 1272-1282.
[7] Panserat S, Perrin A, Kaushik S. High dietary lipids induce liver glucose-6-phosphatase expression in rainbow trout ()[J]. Journal of Nutrition, 2002, 132(2): 137-141.
[8] 杨清华, 赵福利, 何贤臣.鲑鳟鱼类对蛋白质、脂肪和碳水化合物的营养需求[J].黑龙江水产, 2006(2): 32-38. Yang Qinghua, Zhao Fuli, He Xianchen. Requirements on protein, lipid and carbohydrate of trout[J]. Heilongjiang Fisheries, 2006(2): 32-38.
[9] 李志华, 王军霞, 谢松. 虹鳟营养需求的研究进展[J].水产科学, 2004, 2: 39-44. Li Zhihua, Wang Junxia, Xie Song. Nutritional requirements in rainbow trout () [J]. Fisheries Science, 2004, 2: 39-44.
[10] Skiba C S, Geurden I, Panserat S, et al. Dietary methionine imbalance alters the transcriptional regulation of genes involved in glucose, lipid and amino acid metabolismin the liver of rainbow trout ()[J]. Aquaculture, 2016, 454: 56-65.
[11] Peres H, Oliva T A. Effect of dietary lipid level on growth performance and feed utilization by European sea bass juveniles ()[J]. Aquaculture, 1999, 179(1–4): 325-334.
[12] Rahim A, Abbas G, Waryani B, et al. Influence of varying dietary lipid levels on growth, feed conversion and chemical composition of meat and liver of the juvenile Blackfin Sea bream,(Forsskal 1775)[J]. Pakistan Journal of Zoology, 2015, 47(5): 1467-1473.
[13] Eya J C, Yossa R, Ashame M F, et al.Effects of dietary lipid levels on growth, feed utilization and mitochondrial function in low- and high-feed efficient families of rainbow trout ()[J]. Aquaculture, 2013, 416: 119-128.
[14] 龙勇, 陈永胜, 罗莉, 等. 虹鳟营养需求的研究[J]. 北京水产, 2004, 3: 16-18. Long Yong, Chen Yongsheng, Luo Li, et al. The nutritional requirementof rainbow trout [J].Journal of Beijing Fisheries, 2004, 3: 16-18.
[15] 袁春营, 崔青曼. 虹鳟营养需求研究进展[J]. 中国饲料, 2003, 17: 21-22. Yuan Chunying, Cui Qingman. Research progress on nutritional requirement of rainbow trout[J]. China Feed, 2003, 17: 21-22.
[16] 宋林, 樊启学, 胡培培, 等. 饲料蛋能比对翘嘴鲌幼鱼生长性能、肠道和肝胰脏消化酶活力的影响[J]. 动物营养学报, 2013, 25(7): 1480-1487. Song Lin, Fan Qixue, Hu Peipei, et al. Effects of dietary protein to energy ratio on growth performance and digestive enzyme activities of juvenile topmouth culter,[J]. Chinese Journal of Animal Nutrition, 2013, 25(7): 1480-1487.
[17] 徐奇友, 李建兴, 许红, 等.低温条件下脂肪和蛋白质水平对虹鳟()生长性能和体成分的影响[C]//2007年中国水产学会学术年会暨水产微生态调控技术论坛. 桂林: 中国水产学会, 2007. Xu Qiyou, Li Jianxing, Xu Hong, et al. Effects of lipid and protein levels on growth performance and body composition of rainbow trout ()[C]// Academic Annual Conference Hold by China Society of Fisheries in 2007. Guilin: China Society of Fisheries, 2007.
[18] 王爱民. 饲料脂肪水平对吉富罗非鱼生长及脂肪代谢调节的研究[D]. 南京: 南京农业大学, 2011: 89-97.Wang Aimin. Effects of dietary lipid levels on growth and fat metabolism of GIFT strain of nile tilapia ()[D]. Nanjing: Nanjing Agricultural University, 2011: 89-97.
[19] 向枭, 周兴华, 陈建, 等. 饲料脂肪水平对白甲鱼幼鱼形体指数、脂肪沉积和脂肪代谢酶活力的影响[J]. 水产学报, 2013, 39(9): 1349-1358. Xiang Xiao, Zhou Xinghua, Chen Jian, et al. Effect of dietary lipid level on body index, lipid deposition and lipid metabolic enzyme activities of juvenile[J]Journal of Fisheries of China, 2013, 39(9): 1349-1358.
[20] 王爱民, 杨文平, 於叶兵, 等. 不同脂肪含量饲料对吉富罗非鱼鱼种生长性能、脂蛋白脂酶活力及其基因表达的影响[J]. 华中农业大学学报, 2014, 33(2): 96- 102. Wang Aimin, Yang Wenping, Yu Yebing, et al. Effects of dietary lipid levels on growth performance, activity and gene expression of lipoprotein lipase in GIFT tilapia () juvenile[J]. Journal of Huazhong Agricultural University, 2014, 33(2): 96-102.
[21] 宋理平, 冒树泉, 马国红, 等. 饲料脂肪水平对许氏平鲉脂肪沉积、血液生化指标及脂肪代谢酶活力的影响[J]. 水产学报, 2014, 38(11): 1879-1888. Song Liping, Mao Shuquan, Ma Guohong, et al. Effects of dietary lipid level on lipid deposition, blood biochemistry indices and lipid metabolic enzyme activities of[J]. Journal of Fisheries of China, 2014, 38(11): 1879-1888.
[22] 岳彦峰, 彭士明, 施兆鸿, 等. 饲料脂肪水平对褐菖鲉生长、肠道消化酶及主要脂代谢酶活力的影响[J]. 南方水产科学, 2012, 8(6): 50-56. Yue Yanfeng, Peng Shiming, Shi Zhaohong, et al. Effects of dietary lipid levels on growth, intestinal digestive enzyme and main lipid metabolic enzyme activities of[J]. South China Fisheries Science, 2012, 8(6): 50-56.
[23] 郑珂珂, 朱晓鸣, 韩冬, 等. 饲料脂肪水平对瓦氏黄颡鱼生长及脂蛋白脂酶基因表达的影响[J]. 水生生物学报, 2010, 34(4): 815-821. Zheng Keke, Zhu Xiaoming, Han Dong, et al. Effects of dietary lipid level on growth and lipoprotein lipase gene expression in[J]. Aata Hydrobillogica Sinica, 2010, 34(4): 815-821.
[24] 张晓刚. 肝脂酶与脂蛋白代谢[J]. 国外医学(临床生物化学与检验学分册), 2002, 23(1): 48-49. Zhang Xiaogang. Hepatic lipase and lipoprotein metabolism[J]. Foreign Medical Sciences (section of Clinical Biochemistry and Laboratory Medicine), 2002, 23(1): 48-49.
[25] 徐俊楠. 肝脏脂蛋白酯酶LPL的代谢调节功能与机制研究[D]. 上海: 第二军医大学, 2013: 1-7. Xu Junnan. Studies on the role of lipoprotein lipase in lipid metabolism and mechanism[D]. Shanghai: Second Military Medical University, 2013: 1-7.
[26] Li A X, Yuan X C, Liang X F, et al. Adaptations of lipid metabolism and food intake in response to low and high fat diets in juvenile grass carp ()[J]. Aquaculture, 2016, 457: 43-49.
[27] 张芳林. 肉碱棕榈酰转移酶-Ⅰ的研究进展[J]. 国外医学(内分泌学分册), 2002, 22(3): 166-169.Zhang Fanglin. Research progress of carnitine palmitoyl transferase-Ⅰ[J]. Foreign Medical Sciences (Section of Endocrinology), 2002, 22(3): 166-169.
[28] Jh V, Htb V. Fatty-acid-binding protein and itsrelation to fatty-acid oxidation[J]. Molecular and Cellular Biochemistry, 1993(1-2): 101-106.
[29] 颜新春, 汪以真, 许梓荣. 动物脂肪酸合成酶(FAS)基因表达的调控[J]. 动物营养学报, 2002, 14(2): 1-4. Yan Xinchun, Wang Yizhen, Xu Zirong. Regulation of fatty acid synthase (FAS) gene expression in animals[J]. Chinese Journal of Animal Nutrition, 2002, 14(2): 1-4.
[30] Tian J, Wu F, Yang C G, et al. Dietary lipid levels impact lipoprotein lipase, hormone-sensitive lipase, and fatty acid synthetase gene expression in three tissues of adult GIFT strain of Nile tilapia,[J]. Fish Physiology and Biochemistry, 2015, 41(1): 1-18.
[31] Zheng K K, Zhu X, Han D, et al. Effects of dietary lipid levels on growth, survival and lipid metabolism during early ontogeny oflarvae[J]. Aquaculture, 2010, 299(1-4): 121-127.
[32] Li X F, Jiang G Z, Qian Y, et al. Molecular characterization of lipoprotein lipase from blunt snout breamand the regulation of its activity and expression by dietary lipid levels[J]. Aquaculture, 2013, 416: 23-32.
[33] 岳颖, 刘国华, 郑爱娟, 等. 生长动物脂肪代谢关键酶基因表达调控[J]. 动物营养学报, 2012, 24(2): 232- 238. Yue Ying, Liu Guohua, Zheng Aijuan, et al. Modulating the expression of genes regulating key enzymes for lipid metabolism in growing animals[J]. Chinese Journal of Animal Nutrition, 2012, 24(2): 232-238.
(本文编辑: 谭雪静)
Effects of lipid levels on growth, fatty acid enzymatic activity, and gene expression of rainbow trout () in a recirculating aquaculture system
ZHANG Jing1, 2, 3, LI Yong1, 2, 3, SUN Guo-xiang1, 2, 3, ZHAO Ning-ning1, 2, 3, MA Jun1, 2, 3, WANG Shun-kui4
(1. Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China; 2. University of Chinese Academy of Sciences, Beijing 100049, China; 3. Key Laboratory of Experimental Marine Biology, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China; 4. Shandong Oriental Ocean Sci-Tech Co., Ltd, Yantai 264003, China)
The aim of this trial was to evaluate the effects of dietary lipid levels on growth performance, fat metabolism, and gene mRNA expression of rainbow trout () in a recirculating aquaculture system (RAS). Four isonitrogenous diets containing 45% crude protein with increasing dietary lipid levels of 12%, 15%, 18%, and 21% (denoted as groups Ⅰ, Ⅱ, Ⅲ, and Ⅳ) were fed to satiety to triplicate groups of 25 fishes (weighing 333.25 ± 20.71 g) for 77 days. Results are described as follows: First, the growth performance of fish fed group Ⅰ diet was optimal due to the highest weight gain (77.41%) and the lowest feed conversion rate (1.16) (< 0.05 or< 0.01); Second, fatty acid synthetase (FAS) activity was decreased with increasing dietary fat content, whereas the activities of lipolytic enzymes were increased. The FAS activity of fish fed group Ⅰ diet was significantly higher than those fed groups Ⅲ and Ⅳ diets by 7.5% and 8.7%, respectively. The L-CPT I activity of fish fed group Ⅰ diet was lower than that of fish fed other diet groups by 13.08%–16.35% (< 0.05). Meanwhile, the LPL activity of fish fed group Ⅳ diet was significantly highest (< 0.05). This result implies that fishes fed group Ⅰ diet improved their fat utilization rate by increasing fat synthesis and decreasing lipolysis to ensure the body’s normal requirement for lipids and promote growth; Third, FAS mRNA expression in fish fed group Ⅰ diet was higher than that of fish fed other diet groups by 48.29%–55.15% (< 0.05), whereas the changes in LPL showed an opposite pattern (< 0.05 or< 0.01). In the muscle, the FAS mRNA expression in fish fed group Ⅰ diet was higher than that of fish fed group Ⅳ diet by 66.82% (< 0.05), and the expression of LPL was initially decreased and then increased with increasing dietary lipid levels. The preliminary finding was that FAS and LPL gene expression in the liver changed faster than that in the muscle with the increase in fat levels. Determined primarily, the Donaldsons rainbow trout (weighing about 330 g) could achieve healthy growth without excessive fat supply, and its fat nutrition requirement is no more than 12% in RAS when the dietary protein level is 45%.
lipid;; growth; fat metabolism; gene expression; recirculating aquaculture system
Mar. 3, 2017
S963.7
A
1000-3096(2017)10-0024-09
10.11759//hykx20170303003
2017-03-03;
2017-03-22
“十二五”国家科技支撑计划项目(2011BAD13B07); 中国科学院院地合作项目(Y12530101L)
[National “Twelfth Five-Year” Plan for Science & Technology Support, No.2011BAD13B07; Cooperation Projects of Chinese Academy of Sciences and Local Government, No.Y12530101L]
张静(1990-), 女, 山东泰安人, 硕士研究生, 主要从事水产动物营养与饲料科学研究, 电话: 15550283365, E-mail: 15550283365@ 163.com; 李勇, 通信作者, 研究员, E-mail: liyong@qdio.ac.cn
