敌百虫对两种赤潮微藻生长的毒性效应研究
2017-02-09王朝晖钟文聪廖姿蓉
王朝晖, 钟文聪, 廖姿蓉
敌百虫对两种赤潮微藻生长的毒性效应研究
王朝晖, 钟文聪, 廖姿蓉
(暨南大学生命科学技术学院, 水体富营养化与赤潮防治广东普通高校重点实验室, 广东 广州 510632)
敌百虫是使用最为广泛的有机磷农药之一, 在水产养殖中主要用于防治甲壳类寄生虫。本文研究了72 h的急性暴露以及25 d的亚慢性暴露下, 敌百虫对两种赤潮微藻海洋卡盾藻和锥状斯氏藻生长的影响, 以了解敌百虫对海洋微藻的毒性及海洋初级生产力的影响。在急性暴露下, 高质量浓度敌百虫能明显抑制两种藻细胞的生长, 而低质量浓度则对藻细胞的生长影响不明显, 敌百虫对海洋卡盾藻和锥状斯氏藻生长的72 h EC50分别为32.1 mg/L和22.1 mg/L。在亚慢性暴露下, 两种藻细胞对敌百虫的敏感性相近, 高质量浓度组(>25 mg/L)的藻细胞在暴露的第7~9天就全部死亡; <1 mg/L的低质量浓度组, 藻细胞的生长状况与对照组相近; 5 mg/L和10 mg/L质量浓度组在暴露初期对藻细胞生长具有抑制作用, 但在暴露后期则明显刺激了藻细胞的生长。本研究说明水环境背景质量浓度下的敌百虫不会抑制浮游植物的生长, 但施药一段时间后, 可刺激藻细胞的生长, 从而增加了引发赤潮的风险。
敌百虫; 海洋卡盾藻; 锥状斯氏藻; 毒性; 生长抑制; 微藻
有机磷农药是一类重要的有机合成农药, 也是目前应用最为广泛的广谱高效农药之一。但是有机磷农药对其他非靶动物毒性也较高[1], 如对鱼类半致死质量浓度(LC50)通常在mg/L水平[1-2], 而对水生甲壳类的毒性则更高, 为μg/L水平[1]。而且有机磷农药为环境雌激素类, 可导致鱼类和其他水生生物生长发育异常[3]。有机磷农药可以通过地表径流进入水生态系统, 对水生生物造成一定生态风险[4]; 近岸海域也常常能检测出有机磷农药[5], 我国沿海因有机磷农药污染所造成的养殖生物死亡事件时有发生, 给水产养殖业造成较大危害[6]。
敌百虫是最为常见的有机磷农药之一, 在水产养殖中主要用于杀死甲壳类寄生虫、水生昆虫以及寄生蠕虫等[7]。敌百虫对水生动物的毒性较高, 对水生甲壳类LC50一般在μg/L水平, 对鱼类96h LC50值一般大于10 mg/L[8]。而敌百虫对藻类的毒性较低, 半效应质量浓度(EC50)一般高于100 mg/L[1, 9]。敌百虫等农药可以通过食物链富集, 进入高营养级生物如浮游动物、鱼类等, 从而对人类健康产生潜在危害[10]。目前有关敌百虫对海洋微藻的毒性研究报道较少, 本课题组研究了敌百虫对海洋硅藻中肋骨条藻()生长的影响, 发现其对敌百虫的敏感性略高于淡水绿藻, 72h EC50为84.8 mg/L[11]。本文以我国海域常见浮游植物海洋卡盾藻()和锥状斯氏藻()为研究对象, 研究了敌百虫对两种藻细胞生长的急性和亚慢性毒性, 以评估敌百虫对海洋初级生产力的潜在影响, 为海洋生态系统保护提供科学依据。
1 材料与方法
1.1 试验藻种及培养
海洋卡盾藻隶属于针胞藻纲(Raphidophyceae) 卡盾藻属(Biecheler)。为单细胞藻类, 细胞黄褐色到褐色, 无细胞壁。细胞长约30~50 μm, 宽约20~30 μm。海洋卡盾藻是世界上危害最为严重的有害赤潮原因种之一, 已在世界许多海区引发赤潮并造成养殖鱼类的大量死亡。
锥状斯氏藻隶属甲藻门(Pyrrophyta)斯氏藻属(Baleth & Loeblich), 细胞长为18~30 μm, 宽15~25 μm。细胞呈梨型, 上壳圆锥形有突起的顶端, 下壳半球形。锥状斯氏藻是一种世界广布性赤潮藻类, 其赤潮在世界各地海域时有发生, 在我国东南沿海广泛分布, 同时也是我国南海重要的赤潮生物。
海洋卡盾藻和锥状斯氏藻来自于暨南大学藻种室。实验前, 在对数生长期反复接种3~4次, 使藻细胞达到同步生长。培养采用f/2培养基[12], 用人工海水盐配制, 盐度为30, pH为7.9 ±0.1。所有实验容器和培养基均经过高压蒸汽灭菌(121℃, 30 min)。培养温度为20℃, 光照强度为6 000 lx, 光暗比为L︰D = 12 h︰12 h。
1.2 藻细胞密度测定
藻细胞密度利用细胞密度与叶绿素荧光的关系进行计算。将对数生长期的藻细胞培养液稀释成7个藻细胞密度梯度, 用叶绿素荧光仪(美国Turner Designs公司Trilogy实验室荧光仪)测定荧光值, 并计数藻细胞数量, 得到叶绿素荧光与藻细胞数量的线性关系。其中海洋卡盾藻:=4.9015–398.83,2= 0.9994; 锥状斯氏藻:=6.78–691,2=0.9998, 其中为细胞密度个/mL,为叶绿素荧光值。
1.3 急性暴露实验
根据预备实验结果, 设置6个敌百虫质量浓度组和1个对照组, 海洋卡盾藻暴露质量浓度为0、1、5、10、25、50、100 mg/L, 锥状斯氏藻暴露质量浓度为0、0.1、0.5、1、5、10、25 mg/L。
试验在250 mL的三角瓶中进行, 加入150 mL培养基, 添加敌百虫母液配制成设定质量浓度的试验液, 并加入到达同步生长的对数生长期藻细胞, 藻细胞初始密度为5 000 个/mL左右。每个质量浓度设置3个平行组, 每天手动摇藻3次, 培养基、培养条件同2.1。分别在0、6、12、24、48、72 h测定荧光值, 并根据细胞密度与叶绿素荧光关系换算成细胞密度。
1.4 亚慢性暴露实验
亚慢性暴露实验设置5个敌百虫质量浓度组和1个对照组, 海洋卡盾藻暴露质量浓度为0、1、5、10、25、50 mg/L, 锥状斯氏藻暴露质量浓度为0、0.1、0.5、1、5、10、25 mg/L, 实验周期为25 d, 藻细胞的初始密度为500 个/mL左右。实验前7 d每天测定叶绿素荧光值, 8~25 d隔2 d测定叶绿素荧光值。实验的其他设置和培养条件同1.3。
1.5 数据处理与分析
1.5.1 特定生长率的计算
特定生长率用以下公式进行计算:
(d–1) = (ln(N/0))/(2–1)
其中,N和0分别为2和1时的细胞数量。最大生长率(max)为特定生长率的最高值, 表示藻细胞在一定时间内的最大分裂能力。
1.5.2 半效应质量浓度EC50的计算
生长抑制百分率(EC)定义为抑制生长率的百分比:
EC (%) = (c–μ)/c×100
其中,c是对照组的特定生长率,μ是试验组的特定生长率。
EC50值采用抑制百分率的概率单位——质量浓度对数直线回归法进行计算, 并计算EC50的95%可信限范围。
1.5.3 统计与分析
所有实验结果均为3个实验组数据的平均值, 数据误差线为3组数据间标准差。实验结果采用统计软件SPSS 20.0进行显着性差异分析。
2 结果
2.1 急性暴露敌百虫对海洋卡盾藻和锥状斯氏藻生长的影响
图1A显示了在敌百虫急性暴露下, 海洋卡盾藻的生长状况。在72 h的急性暴露下, 100 mg/L质量浓度组藻细胞密度在12 h后明显降低, 而24 h后的细胞密度仅为初始密度的一半左右, 随后维持在此密度。其余各质量浓度组细胞密度在接种6 h后就开始迅速增加, 24h内均增加了一倍以上(图1A)。72 h暴露后, ≤10 mg/L的低质量浓度组的生长与对照组没有明显差别(0.05), 而≥25 mg/L的高质量浓度则能显著抑制海洋卡盾藻的生长(<0.05)。暴露质量浓度越高, 对藻细胞生长的抑制程度也越高。除100 mg/L质量浓度组的最大细胞密度出现在暴露后的12 h外, 其余各实验组的最大细胞密度均出现在实验结束的72 h(图1A)。1 mg/L质量浓度组的最大细胞密度略高于对照组(图2A), 为对照组的105%; 5 mg/L和10 mg/L两个质量浓度组与对照组相近(图2A), 这3个质量浓度组的最大细胞密度均与对照组无明显差别(>0.05)。≥25 mg/L的高质量浓度组的最大细胞密度明显低于对照组(<0.05), 仅为对照组83%、65%和27%。敌百虫对藻细胞的最大生长率(max)影响较小, 在1~25 mg/L暴露下,max未受到明显抑制, 其中5和10 mg/L两个实验组的max明显高于对照组(0.05), 50 mg/L质量浓度组的最大生长率受到明显抑制(<0.05)。由于在100 mg/L质量浓度组几乎无生长, 暴露12 h后细胞密度持续下降, 因此最大生长率为负值, 仅为-0.17/d, 说明100 mg/L的敌百虫能完全抑制海洋卡盾藻的生长, 导致藻细胞大量死亡。
从敌百虫对锥状斯氏藻的急性毒性来看(图1B), 暴露6 h后, 细胞密度就开始迅速增加, 24 h内各实验组细胞密度均增加了一倍以上, ≤1 mg/L的3个质量浓度组藻细胞生长与对照组无明显差别(0.05), 而≥5 mg/L的敌百虫则对藻细胞生长有明显抑制作用(<0.05或<0.01), 并且随着敌百虫质量浓度增加, 抑制作用增加。各实验组的最大细胞密度均出现在实验结束的72 h(图1B), ≤1 mg/L的低质量浓度组同样与对照组无明显差别(>0.05)(图2B)。0.1 mg/L质量浓度组的最大细胞密度甚至超过对照组, 为对照组的105%; 0.5 mg/L和1 mg/L质量浓度组的最大细胞密度与对照组相近, 5 mg/L和10 mg/L质量浓度组与对照组有明显差别(<0.05), 但能分别达到对照组的83%和65%; 而25 mg/L质量浓度组仅为对照组的52.8%。在实验设置的质量浓度范围内, 锥状斯氏藻在接种初期能迅速生长, 最大特定生长率达到0.78~ 1.06/d(图3B), 而且均出现在接种后的24 h。敌百虫对锥状斯氏藻的最大特定生长率影响较小, ≥10 mg/L高质量浓度组的最大生长率明显低于对照组(< 0.05), 其余各质量浓度组均与对照组无明显差别(> 0.05), 而0.5 mg/L和1 mg/L组的最大生长率还超过了对照组(图3B)。
利用概率单位——直线回归法计算, 得出敌百虫对海洋卡盾藻生长的72 h EC50为32.1 mg/L, 对锥状斯氏藻生长的72 h EC50为22.1 mg/L。

图1 72h急性暴露下敌百虫对海洋卡盾藻(A)和锥状斯氏藻(B)生长的影响
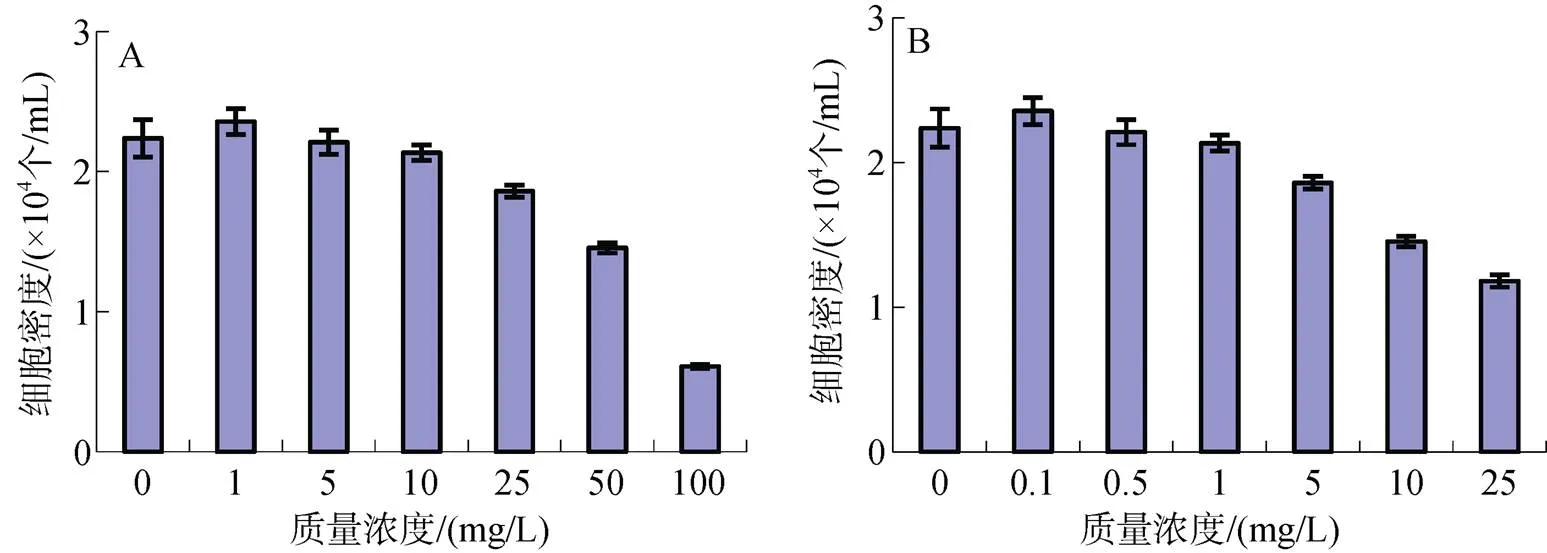
图2 敌百虫暴露72h后海洋卡盾藻(A)和锥状斯氏藻(B)的最大细胞密度
2.2 敌百虫对海洋微藻的亚慢性毒性
在25 d亚慢性试验中(图4A), ≤10 mg/L低质量浓度组的海洋卡盾藻和对照组藻细胞在第2天立即进入对数生长期, 而在敌百虫暴露下藻细胞的生长速度明显低于对照组(0.05)。在暴露前11 d, 1 mg/L质量浓度组藻细胞的生长趋势与对照组相近, 细胞密度略低于对照组; 11 d后对照组细胞密度迅速下降, 而1mg/L质量浓度组细胞密度经历了下降期后, 在第17~23天尚出现一段时间的缓慢增长的平台期, 随后细胞密度迅速下降。5 mg/L和10 mg/L两个质量浓度组藻细胞生长趋势相近, 细胞密度经过5~7 d的缓慢上升期后, 在第7~17天细胞密度快速上升, 至暴露的第15~17天达到细胞密度最高峰, 然后细胞密度快速下降。相对来说, 10 mg/L质量浓度组的藻细胞比5 mg/L质量浓度组生长时期略为推迟, 细胞密度较低, 稳定生长时间更长。从低质量浓度组的亚慢性暴露结果来看, ≤10 mg/L使海洋卡盾藻生长的迟滞期延长, 到达最大细胞密度的时间也相应延后。25 mg/L 和50 mg/L两个质量浓度组, 细胞密度在暴露初期略有增长, 但在暴露的第9~11 天细胞已经全部死亡, 无活体叶绿素荧光值。虽然在亚慢性暴露实验中, 藻细胞的初始密度仅为急性暴露的10%, 但最大细胞密度与急性暴露相近, 甚至略高于急性暴露, 为30 000个/mL左右。从最大细胞密度来看(图5A), 5 mg/L和10 mg/L质量浓度组均高于对照组, 分别为对照组的124%和115%; 1 mg/L质量浓度组略低于对照组, 为对照组的91%; 而25 mg/L和50 mg/L两个组, 仅在暴露初期细胞略有增长, 随后细胞密度急剧下降, 并全部死亡, 最大细胞密度仅与初始接种密度相近。
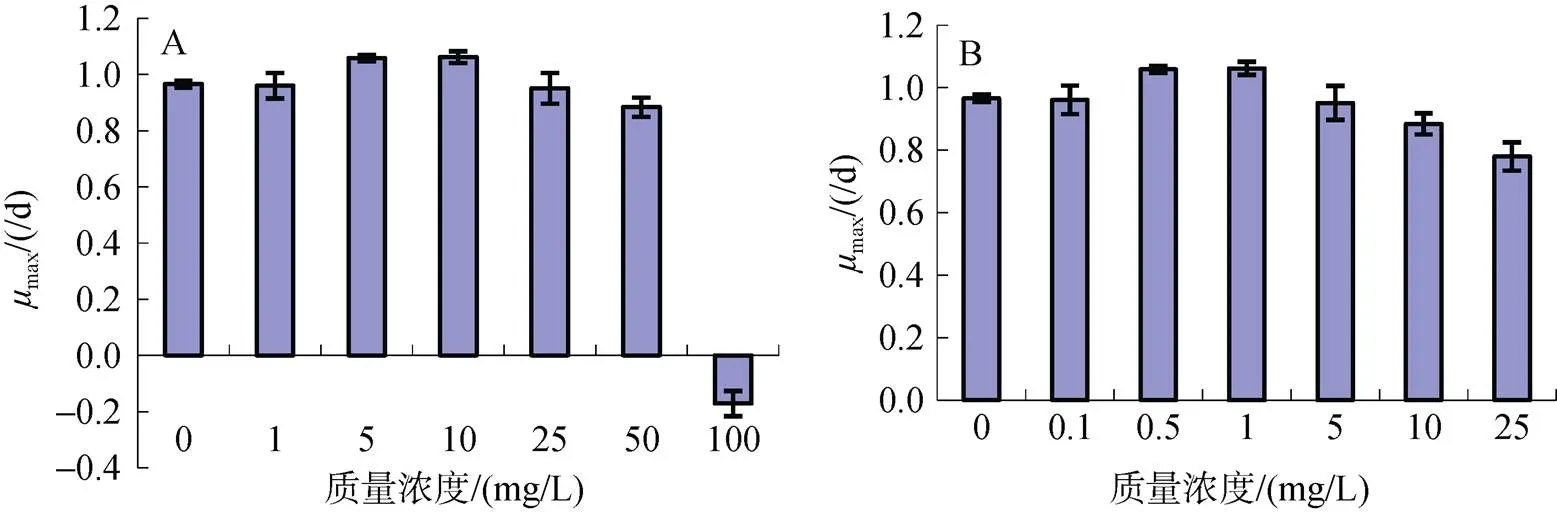
图3 敌百虫暴露72h后海洋卡盾藻(A)和锥状斯氏藻(B)的最大特定生长率
锥状斯氏藻在敌百虫的慢性暴露下(图4B), ≤1 mg/L的4个质量浓度组以及对照组在接种后第1~2 天即进入对数生长, 而且生长趋势与对照组相近, 虽然细胞密度均小于对照组, 但不存在明显差异(> 0.05)。5 mg/L 实验组藻细胞经历了6 d的迟滞期后, 第7 天细胞密度快速增长, 至第11 天细胞密度与对照组相近。10 mg/L质量浓度组的生长在前23 d的暴露中, 细胞密度明显低于对照组和低质量浓度组(<0.05或0.01), 但在第25天, 该实验组藻细胞仍保持一定生长速度。与海洋卡盾藻相似, 25 mg/L质量浓度组锥状斯氏藻细胞密度仅在第2天略有增长, 在暴露的第7天藻细胞全部死亡。所有实验组的最大细胞密度均小于对照组, 但是除25 mg/L质量浓度组外, 可以达到对照组的90%以上(图5B), 与对照组无明显差别。

图4 25 d亚慢性暴露下敌百虫对海洋卡盾藻(A)和锥状斯氏藻(B)生长的影响
3 讨论
本研究是使用一次性培养, 而且在较小的三角瓶中进行实验, 实验时间长达25 d。因此, 实验条件尚不能与自然海区的环境条件相吻合, 可能也会造成一定的瓶效应。本研究采用欧盟和美国国家环保署藻类生长抑制试验(Algal Growth Inhibition Test)标准方法, 实验结果可反映浮游藻类对敌百虫的敏感, 得到的EC50值可用于实验室之间浮游藻类对污染物敏感性的比较。

图5 敌百虫暴露25d后海洋卡盾藻(A)和锥状斯氏藻(B)的最大细胞密度
敌百虫对海洋微藻的毒性属于低毒等级[1, 9], 对浮游藻类的毒性明显低于甲壳类和鱼类[1]。本研究中敌百虫对海洋卡盾藻和锥状斯氏藻72h EC50分别为32.1和22.1 mg/L, 属于低毒级别。但是本研究中的两种海洋微藻对敌百虫的敏感性较其他藻类高, 如敌百虫对羊角月牙藻96h EC50为274.5 mg/L[2], 对斜生栅藻96h EC50为86.03 mg/L[13], 对杜氏盐藻10 d EC50为179 mg/L[9], 对中肋骨条藻72 h EC50为84.8 mg/L[11]。
在急性暴露实验中, 虽然高质量浓度敌百虫能明显抑制两种藻细胞的生长, 但仅在100mg/L质量浓度组的卡盾藻细胞密度低于初始细胞密度(图1)。在亚慢性暴露下, 25mg/L以上质量浓度组的海洋卡盾藻和锥状斯氏藻细胞在暴露的第7~9天就全部死亡(图4)。在急性暴露实验中, 藻细胞密度较高, 是亚慢性暴露的10倍, 虽然实验液中农药的质量浓度一样, 但是由于细胞密度的不同, 单位细胞承受农药的量有所差异, 因而对农药的抵抗能力也有所不同。此外, 在亚慢性暴露实验中, 在暴露的前4 d, 细胞密度也出现了一定程度的增长, 只是在暴露后的5~9 d细胞密度急剧下降, 最后全部死亡。由于敌百虫在碱性条件下容易水解成毒性更高的敌敌畏[14], 敌敌畏的产生可能对藻细胞造成更大的伤害。此外, 有研究报道在敌百虫暴露下, 杜氏盐藻细胞破裂, 内含物溶出, 而且细胞受损程度和比例随着质量浓度的增加以及暴露时间的延长增加[7], 同时敌百虫暴露也会使藻细胞蛋白质含量下降, 酶活性降低[14], 从而导致了藻细胞的死亡。
低质量浓度的敌百虫在72 h内对藻细胞的生长没有明显刺激作用; 而长时间的亚慢性暴露中后期, 中等质量浓度组(5 mg/L和10 mg/L)对藻细胞的生长具有明显促进作用, 但是敌百虫质量浓度越高, 藻细胞的迟滞生长期也越长。这是因为在暴露的初始阶段, 敌百虫对藻细胞具有一定毒害作用, 但是随着暴露时间的延长, 敌百虫及其水解产物敌敌畏发生了降解, 农药质量浓度降低, 藻细胞恢复生长。敌百虫在pH为7.7~8的海水中的半衰期为2.5~6.3 d, 降解产物主要为敌敌畏, 完全降解时间为10 d左右[15-16]; 而敌敌畏能水解成磷酸氢二甲酯和二氯乙醛, 在25℃水体中的半衰期为43.9 h[16]。敌百虫的降解产物磷酸氢二甲酯进一步水解成磷酸盐, 可作为微藻生长的营养盐, 从而促进了藻细胞生长。此外, 暴露后期藻细胞的超补偿生长也是中等质量浓度组藻细胞在暴露后期生长加速的重要原因。超补偿生长是藻类受到低剂量胁迫或者胁迫消除后的普遍现象, 研究表明铜绿微囊藻在光胁迫下能超补偿生长[17], 而中肋骨条藻在拟除虫菊酯农药的胁迫下也能进行超补偿生长[18]。但是≥25 mg/L的敌百虫超过了藻细胞的耐受极限, 在暴露初期就完全抑制藻细胞生长, 并导致藻细胞大量死亡(图4)。
敌百虫水溶性较强, 脂水分配系数为 0.43, 对生物的生物浓缩系数(BCF)也较低, 如对巴西巨脂鲤()的BCF值仅为0.41[15]。一般认为敌百虫较容易水解, 在中性与碱性条件下, 首先水解为敌敌畏和氯化氢, 敌敌畏再进一步水解为磷酸氢二甲酯和二氯乙醛[16]。因此, 实验液中敌百虫的质量浓度会随暴露时间的延长而下降, 本实验设置的质量浓度仅为初始暴露质量浓度, 不能反映藻细胞持续暴露的农药质量浓度。但是, 这种一次性、高质量浓度暴露与实际应用中的敌百虫施药状况相似, 而本研究中敌百虫暴露25 d后, 敌百虫对海洋卡盾藻毒性的降低以及藻细胞的超补偿生长也反映了一次性施药过后敌百虫对浮游植物的生态毒理学效应。
由于敌百虫等有机磷农药在环境中较易降解, 自然海水中有机磷农药含量较低。莱州湾敌百虫的含量在0.2~45.2 ng/L[19], 珠江口有机磷农药质量浓度为134.8~354.6 ng/L[20], 环境中敌百虫质量浓度远远低于其对藻类的毒性质量浓度。由此可见, 环境中敌百虫并不会对藻类的生长产生抑制作用。但是磷是藻类生长最重要的元素, 有机磷农药的施用, 能增加水体中磷含量, 导致海洋浮游植物结构的变化。一般来说, 水体中磷含量的增加, 更有利于有毒鞭毛藻类藻华发生[21]。此外, 由于浮游动物对有机磷农药的敏感性较高, 可能会由于浮游动物数量减少或者群落结构的改变, 从而对浮游植物数量和群落结构产生一定影响[22]。本研究中的亚慢性暴露与自然施药过程相近, 因此即使在一次性施药导致农药瞬间质量浓度较高的情况下, 藻细胞的生长仍能在施药后期恢复甚至出现超补偿现象。鉴于实验藻种均为重要的有毒有害赤潮藻类, 敌百虫等有机磷农药可能会刺激这些浮游植物的生长, 从而增加引发某些赤潮的风险。
[1] Coelho S, Oliveira R, Pereira S, et al. Assessing lethal and sub-lethal effects of trichlorfon on different trophic levels[J]. Aquatic Toxicology, 2011, 103: 191-198.
[2] Venturini F P, Moraes F D, Cortella L R X, et al. Metabolic effects of trichlorfon (Masoten (R)) on the neotropical freshwater fish pacu () [J]. Fish Physiology and Biochemistry, 2015, 41(1): 299-309.
[3] 王汝平, 王军, 孙长青, 等. 有机磷农药类雌/抗雄激素效应研究进展[J]. 海洋科学, 2014, 38(12): 128-135. Wang Rongping, Wang Jun, Sun Changqing, et al. Research progress of estrogenic/anti-androgenic activity induced by organophosphorus pesticides[J]. Marine Sciences, 2014, 38(12): 128-135.
[4] 雷昌文, 曹莹, 周腾耀, 等. 太湖水体中5种有机磷农药混合物生态风险评价[J]. 生态毒理学报, 2013, 8(6): 937-944.Lei Changwen, Cao Ying, Zhou Tengyao, et al. Ecological risk assessment of five organophosphorus pesticides mixture in Taihu Lake[J]. Asian Journal of Ecotoxicology, 2013, 8(6): 937-944.
[5] 白红妍, 韩彬, 孙丕喜, 等. 桑沟湾水体及沉积物中有机磷农残时空分布特征[J]. 海洋科学, 2013, 37(1): 54-61. Bai Hongyan, Han Bin, Sun Pixi, et al. Temporal and spatial distributions of Organophosphorus pesticides in the seawater and sediment of SanggouBay[J]. Marine Sciences, 2013, 37(1): 54-61.
[6] 唐学玺, 徐家英, 李永祺. 有机磷农药对海洋微藻致毒性的生物学研究Ⅳ. 对硫磷对4种海洋微藻的毒性效应[J]. 海洋环境科学, 1998, 17(1): 1-5, 10. Tang Xuexi, Xu Jiaying, Li Yongqi. Biological study on the toxicity of organophosphorus pesticide to microalgae Ⅵ. Toxicity effect of parathion on four kinds of marine micro algae[J]. Marine Environmental Science, 1998, 17(1): 1-5, 10.
[7] 黄国强, 李德尚, 董双林. 敌百虫对虾池生物的毒性[J].海洋科学, 2003, 27(10): 6-9.Huang Guoqiang, Li Deshang, Dong Shuanlin. Toxicity of dipterex on organisms in shrimp ponds[J]. Marine Sciences, 2003, 27(10): 6-9.
[8] 马瑜, 李勃, 张育辉. 敌百虫对中国林蛙蝌蚪生长发育的毒性效应[J]. 生态毒理学报, 2014, 9(3): 531- 537. Ma Yu, Li Bo, Zhang Yuhui. Toxicity effect of trichlorfon on the growth and development of tadpoles[J]. Asian Journal of Ecotoxicology, 2014, 9(3): 531-537.
[9] Chen H, Jiang J G. Toxic effects of chemical pesticides (trichlorfon and dimehypo) on[J]. Chemosphere, 2011, 84: 664-670.
[10] Jonsson C M, Paraiba L C, Mendoza M T, et al. Bioconcentration of the insecticide pyridaphenthion by the green algae[J]. Chemosphere, 2001, 43: 321-325.
[11] 梁菊芳, 王朝晖, 林朗聪. 敌百虫对中肋骨条藻生长的影响[J]. 生态科学, 2013, 32(2): 230-234.Liang Jufang, Wang Zhaohui, Lin Langcong. Effects of trichlorfon on the growth of marine microalga[J]. Ecologic Science, 2013, 32(2): 230- 234.
[12] Guillard R R L. Division rates[C]//Stein. Handbook of Phycological Methods. Cambridge, Cambridge University Press, 1973: 289-312.
[13] 刁树林. 藻类急性毒性监测中参比毒物的研究[J]. 环境科学与管理, 2007, 32(9): 138-141. Diao Shulin. The research of senate compares poison in the algae acute toxicity monitor[J]. Environmental Science and Management, 2007, 32(9): 138-141.
[14] Fathi A A. Some metabolic activities in the green algaas affected by the insecticide trichlorfon[J]. Protistology, 2003, 3(2): 92-98.
[15] Lopes R B, Paraiba L C, Ceccarelli P S, et al. Bioconcentration of trichlorfon insecticide in pacu ()[J]. Chemosphere, 2006, 64: 56-62.
[16] Samuelsen O B. Aeration rate, pH and temperature effects on the degradation of trichlorfon to DDVP and half-life lives of trichlorfon and DDVP in seawater[J]. Aquaculture, 1987, 66: 373-380.
[17] 毕相东, 张树林, 张鹏. 铜绿微囊藻在光限制胁迫下的超补偿生长响应[J]. 水生态学杂志, 2011, 32(1): 94-98.Bi Xiangdong, Zhang Shulin, Zhang Peng. Over-compensatory growth ofresponse to the dtress of light limitation[J]. Journal of Hydroecology, 2011, 32(1): 94-98.
[18] Wang Z H, Yang Y F, Yue W J, et al. The growth behavior of three marine phytoplankton species in the presence of commercial cypermethrin[J]. Ecotoxicology Environment Safety, 2010, 73: 1408-1414.
[19] 王凌, 黎先春, 殷月芬, 等. 莱州湾水体中有机磷农药的残留监测与风险影响评价[J]. 安全与环境学报, 2007, 7(3): 82-85. Wang Ling, Li Xianchun, Yin Yuefen, et al. Organophosphate pesticide residue monitoring and risk assessment in the sea-water from Laizhou Bay[J]. Journal of Safety and Environment, 2007, 7(3): 82-85.
[20] 吴妹英. 鳗鱼养殖常用药物对铜绿微囊藻繁殖的影响[J]. 福建水产, 2009, 12(4): 15-21. Wu Meiying. The effects of common pesticide in eel culture on the growth of[J]. Journal of Fujian Fisheries, 2009, 12(4): 15-21.
[21] Sharpley A, Wang X Y. Managing agricultural phosphorus for water quality: Lessons from the USA and China[J]. Journal of Environmental Sciences-China, 2014, 26(9): 1770-1782.
[22] Hanazato T, Kasai F. Effects of the organophosphorus insecticide fenthion on phyto-and zooplankton communities in experimental ponds[J]. Environment Pollution, 1995, 88: 293-298.
(本文编辑: 梁德海)
Toxic effects of trichlorfon on the growth of two microalgae,and
WANG Zhao-hui, ZHONG Wen-cong, LIAO Zi-rong
(College of Life Science and Technology, Key Laboratory of Eutrophication and Red Tide Prevention of Guangdong Higher Education Institutes, Jinan University, Guangzhou 510632, China)
Trichlorfon is an important organophosphate insecticide and has been widely used for treating various parasitic infestations in aquaculture. This study analyzed the effects of trichlorfon on the growth ofandthrough 72-h and 25-d growth tests. The aim was to estimate the toxic effects of trichlorfon on marine phytoplankton. Results showed that high concentrations of trichlorfon significantly inhibited the growth of both microalgae in the 72-h test. However, low concentrations had no significant influence on the growth of the microalgae. The 72-h EC50values of trichlorfon forandwere 32.1 and 22.1 mg/L,respectively. In the 25-d test, the algal cells were not able to survive at trichlorfon concentrations >25 mg/L after ~7- to 9-d exposure, while the growth under 1 mg/L was comparable with that of the control. At moderate concentrations (5 and 10 mg/L), the growth was enhanced during the late period of exposure in the 25-d test. These results suggest that background concentrations of trichlorfon in aquatic environments would not inhibit the growth of phytoplankton; however, the growth might be stimulated after a period of application, which might thus increase the risk of algal blooms.
trichlorfon;;; toxicity; growth inhibition; microalgae
Jan. 6, 2017
X55; Q81
A
1000-3096(2017)10-0102-07
10.11759/hykx20170426001
2017-01-06;
2017-06-12
国家自然科学基金项目 (41476132)
[National Natural Science Foundation of China, No. 41476132]
王朝晖(1968-), 女, 教授, 研究方向为海洋生态毒理学, 电话: 020-85225100; E-mail: twzh@jnu.edu.cn
