胆酸盐外排泵研究的最新进展
2017-02-08陈曼玉
赵 晶,陈曼玉,李 磊
(大连医科大学药学院,辽宁 大连 116044)
胆酸盐外排泵研究的最新进展
赵 晶,陈曼玉,李 磊
(大连医科大学药学院,辽宁 大连 116044)
胆酸盐外排泵是肝细胞分泌胆酸盐进入胆汁的主要转运体,其变异和功能抑制与许多胆汁淤积症和药致肝损伤有关。对这些疾病的分析总结加深了我们对胆酸盐外排泵(bile salt export pump,BSEP)生理和病理功能的认识,该文将对BSEP的结构、表达调控、底物及抑制剂,及其相关疾病进行简要综述,以期为临床相关疾病的治疗提供进一步的理论和实验依据。
胆酸盐外排泵;胆汁淤积;抑制剂;调控;胆汁酸; 调节因子
胆汁持续不断的分泌进入十二指肠对于脂类营养物质和脂溶性维生素的吸收具有重要作用。在肠道中,胆酸盐会被重新吸收经肝门静脉返回肝脏;然后通过肝细胞血管侧膜的牛磺胆酸盐转运多肽吸收进入肝细胞,而进入肝细胞的胆酸盐又会被肝细胞胆管侧膜的胆酸盐外排泵(bile salt export pump,BSEP)分泌进入胆管,并进入胆囊贮存;在食物的刺激下胆酸盐再次进入十二指肠,如此周而复始,不断循环。在这个循环过程中,BSEP介导的外排是胆酸盐分泌的限速步骤,对BSEP的抑制可导致胆酸盐在肝内蓄积达到中毒水平,从而导致胆汁淤积和药致肝损伤,并会间接影响人体血糖稳态[1],造成动脉粥样硬化[2],甚至引起癌变[3]。鉴于BSEP在维持体内胆酸盐平衡中的重要作用,欧洲医药管理局(European Medicines Agency,EMA)已将其列入研究药物相互作用的指南中。因此,对BSEP结构、表达调控的研究引起人们极大的关注。
1 BSEP的结构
BSEP的基因符号为ABCB11,属于ATP-结合盒(ATP binding cassette,ABC)转运家族中的一员。BSEP与P-糖蛋白家族具有49%~50%氨基酸序列同源性, ABCB11基因包含有28个外显子,定位于人染色体2q24位点。人BSEP由1 321个氨基酸组成,分子量为160 kDa[4]。BESP含有12个跨膜螺旋区域(Fig 1)。N-端和C-端均位于细胞质侧,序列分析显示在第1个细胞外环有4个N-端糖基化位点,在BSEP的稳定及功能上扮演着重要的角色。
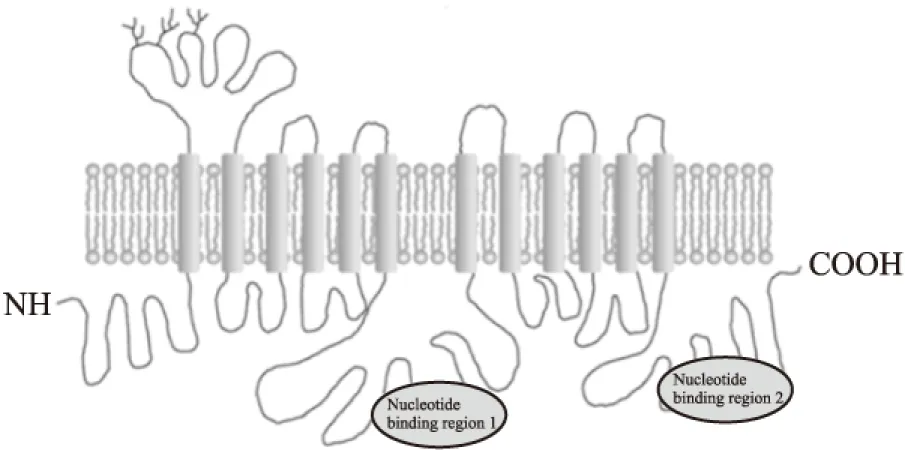
Fig 1 Schematic view of topological arrangement of BSEP
2 BSEP的表达与调控
BSEP主要分布于肝细胞胆管侧膜,尽管有报道在其它组织中检测到低水平的BSEP mRNA,但从未在蛋白水平上检测到。细胞内新合成的BSEP会经高尔基体中转运至近细胞膜顶侧的囊泡室(内涵体)中。在最终转运到顶侧膜之前,BSEP将在其中停留数小时。BSEP/Bsep(BSEP表示人体内蛋白,Bsep表示动物体内蛋白)在顶侧膜上的停留半衰期为4~6 d,其在顶侧膜和近顶侧囊泡室之间不断的往复循环[5]。实验证实,BSEP/Bsep的循环具有微管依赖性,对肌动蛋白抑制剂敏感。另外也有一些蛋白能够锚定在Bsep的作用位点上,对其产生影响,如肌球蛋白II的调控轻链(myosin Ⅱ regulatory light chain,MLC2)能够与Bsep的核苷结合区域相互作用,对其转运至浆膜侧具有重要作用。MLC2的抑制剂Blebbistatin可使MLC2处于非磷酸化形式,从而会降低BSEP在浆膜侧的表达水平[6]。
研究表明,在胆酸盐高负荷时,大鼠肝脏的分泌能力会迅速上调。因此,BSEP表达的增加是一种急性调节方式,可促使胆酸盐转运量迅速增加。这其中,磷脂酰肌醇-3激酶介导的磷酸肌醇脂磷酸化可能参与了BSEP转运活性的调节。另外,BSEP也存在转录及转录后调节机制。低渗和糖皮质激素可诱导BSEP mRNA表达水平的上调,而高渗作用则相反。细胞的低渗状态能够刺激胆酸的分泌可能跟Erk-1/2和p38 MAP激酶的激活有关。雌二醇-17β-葡糖苷酸,lithocholate,脂多糖等可导致Bsep内化返回进入顶侧膜附近的囊泡室[7-8]。
人类的BSEP表达水平存在着明显的个体差异,其表达水平受转录机制的高度调控[9]。BSEP/Bsep的主要调节器是法尼醇X受体(Farnesoid X receptor, FXR)。FXR/Fxr能够激活人和动物BSEP/Bsep的近端启动子。胆酸即是FXR的生理受体,能够调节自身对应转运体的转录。Fxr对于Bsep表达的关键作用可以通过Fxr基因敲除小鼠实验证明,给予此种小鼠胆酸盐不能诱导Bsep的表达。
BSEP除了受FXR调节外,许多其它转录因子也参与其中(Fig 2)。例如,BSEP启动子活性受肝细胞特异性受体LRH-1的诱导,在Lrh1基因敲除小鼠肝中Bsep的表达会降低;BSEP启动子也受核调节因子NRF2的调节,NRF2在氧化应激响应中有重要作用[10]。
3 底物与抑制剂
尽管与P-gp同属ABC转运家族,但BSEP对底物的选择性很高,仅有一小部分P-gp底物可被其转运。例如,BSEP并不外排P-gp底物长春新碱、正定霉素、紫杉醇、地高辛和罗丹明123,但转运普伐他汀、长春花碱等药物[11]。BSEP对人胆汁中的主要胆酸盐类物质如甘氨鹅脱氧胆酸钠,甘胆酸盐和牛磺鹅胆酸盐等具有很高的亲和性。BSEP主要负责单价胆酸盐的外排,多药耐药相关蛋白MRP2则主要负责二价胆酸、硫酸化或葡糖醛酸化胆酸盐的外排。另外,多药耐药蛋白MDR3负责将磷脂转运至肝细胞微管膜的外侧,而异质二聚体ABCG5/ABCG8转运体则负责将胆固醇外排出去,所有这些转运体促成了包含有胆酸、胆固醇和磷脂成分的混合胶束的形成,从而对胆酸盐可能对胆管细胞产生的“去垢危害”产生防护作用。
对BSEP的抑制将导致微管膜胆酸盐分泌的减少,从而造成胆汁阻塞形成肝损伤。药物诱导的肝损伤临床上很常见,严重的时候甚至不得不进行肝移植[12]。临床上药物导致肝损伤有30%的比例跟胆汁阻塞有关[13]。通过给予肝损伤患者BSEP抑制剂来评估BSEP在多大程度上起作用是非常困难的,因为有时药物的代谢产物会造成肝管上皮细胞的损伤。利用表达Bsep的Sf9体外细胞模型可以对药物对Bsep的抑制作用进行研究,并且其计算得到的Ki值与在大鼠微管膜上计算得到的Ki值具有可比较性。利用表达BSEP的昆虫细胞也证实了环孢素A、利福平、格列苯脲等对人BSEP有竞争抑制作用。Tab 1列举了不同抑制剂对Bsep的抑制情况。
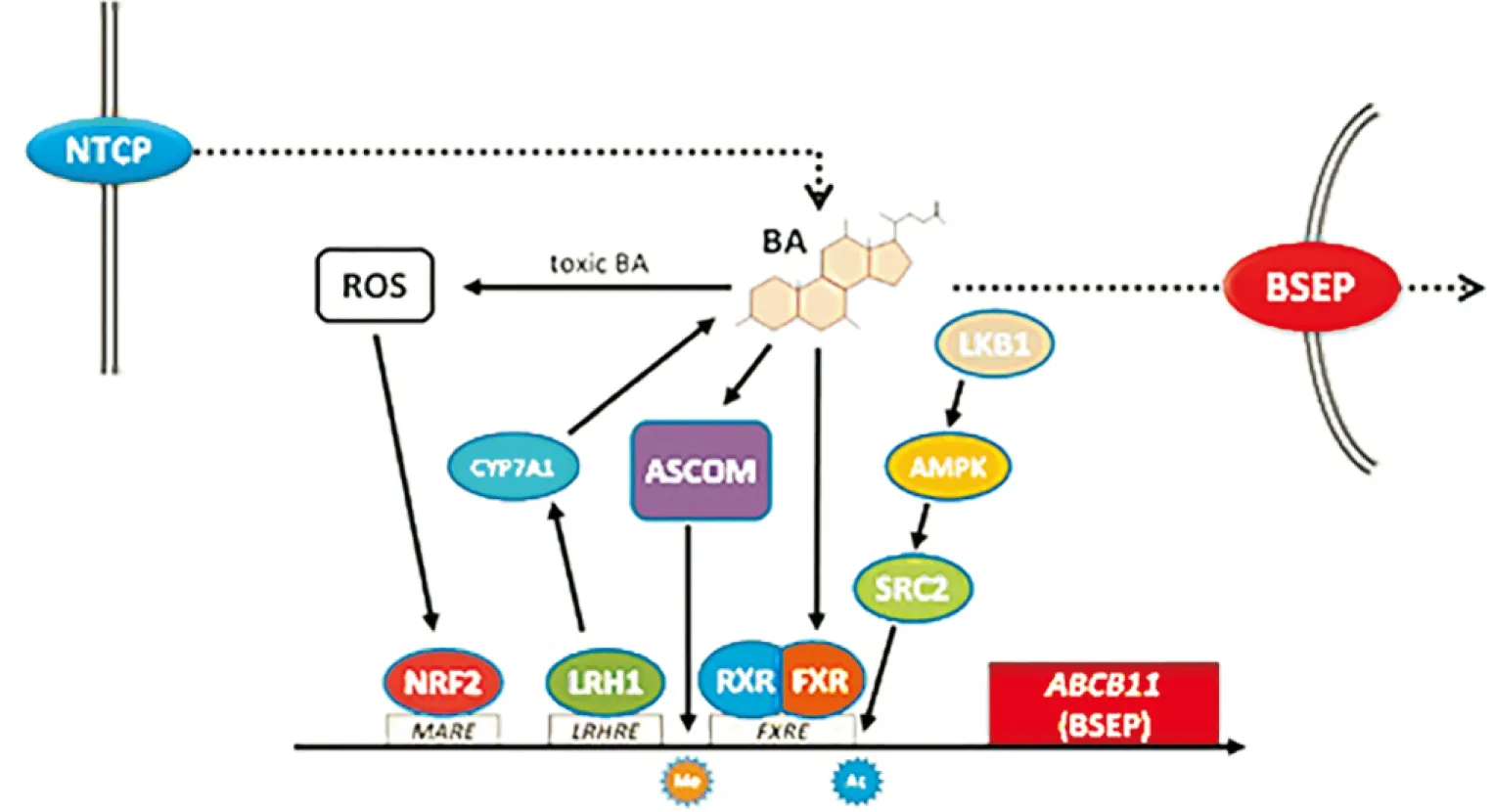
Fig 2 Regulation of bile salt export pump(BSEP) promoter
Bile acids(BA) are major regulators of BSEP expression through activation of the farnesoid X receptor(FXR). The activating complex ASCOM is recruited by BA/FXR for the methylation(Me) of histones within the BSEP promoter. The nuclear factor erythroid 2-related factor 2(NRF2) is activated by oxidative stress, binds to a Maf recognition element(MARE) and transactivates the BSEP promoter. The steroid receptor coactivator-2(SRC2) is activated by the liver kinase B1(LKB1) and the “energy sensor kinase” AMP activated protein kinase(AMPK) and activates gene expression via acetylation(Ac) of histones. Liver receptor homolog 1(LRH1) transactivates BSEP and CYP7A1, the rate-controlling enzyme of BA synthesis. Increased BSEP transcription eventually increases BSEP protein expression and removal of intracellular BA.(FXRE: FXR response element; LRHRE: LRH response element; NTCP: Na+-taurocholatecotransporting polypeptide; ROS: reactive oxygen species; RXR: Retinoid X receptor)
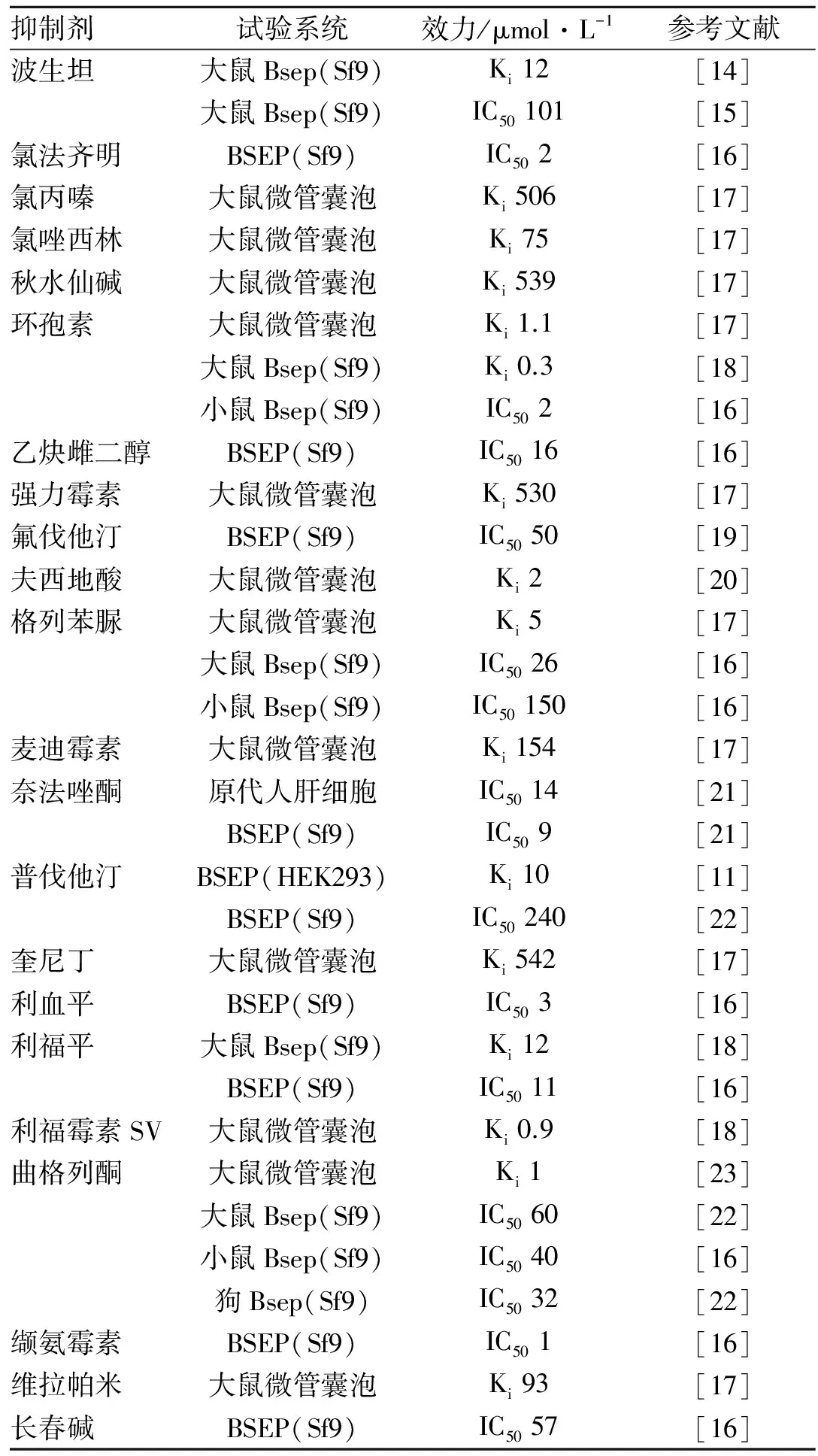
Tab 1 The inhibitor of Bsep in different expression system
4 BSEP相关疾病
4.1 胆汁酸对BSEP表达的调节 BSEP的变化与肝对药物消除、肝内胆汁酸水平、胆汁流量的变化、胆结石形成敏感性有关。BSEP缺乏可导致:① 血中胆汁酸升高;② 胆汁中磷脂成分增高,与胆汁酸上调mdr2有关;③ 胆汁酸羟化增加,水溶性增强,即胆汁酸通过孕烷受体X (pregenane X receptor,PXR)途径使四羟胆酸生成增加,羟基越多胆汁酸水溶性越大。后两种改变和机体的代偿有关。
研究发现BSEP启动子有一个高度保守的IR1序列,该序列是公认的FXR/ RXR的结合点。只有FXR和胆汁酸的结合,才能诱导BSEP启动子表达。FXR的胆汁酸结合区突变时,FXR不能激活BSEP启动子。FXR(-/-)鼠不能有效地调节胆汁酸合成和BSEP表达,其BSEP mRNA为正常鼠的70%,高胆酸喂食也不能诱导BSEP的表达。
在胆汁酸代谢调节中,FXR起着中心作用,FXR通过抑制CYP7A1和NTCP从而抑制胆汁酸合成及肝细胞对胆汁酸的摄取,FXR对BSEP的激活加速了胆汁酸分泌,避免了肝内胆汁酸堆积。FXR的激动剂或抑制剂将用于高脂血症和胆汁淤积的治疗[24]。
4.2 胆汁淤积与BSEP突变 ABCB11的突变会导致蛋白分子功能的缺失,干扰BSEP正确进入肝细胞胆小管膜,导致胆汁流量减少和胆酸盐在肝细胞中的聚集,从而造成肝损伤,至少3种临床肝脏疾病与此相关:II型良性复发性肝内胆汁淤积(benign recurrent intrahepatic cholestasis Ⅱ,BRIC2)、Ⅱ型进行性家族性肝内胆汁淤积(progressive familial intrahepatic cholestasis Ⅱ,PFIC2)和妊娠期肝内胆汁淤积(intrahepatic cholestasis of pregnancy,ICP)。PFIC2是一种染色体遗传病,表现为进行性胆汁分泌障碍,胆汁中胆酸含量降低,血胆固醇正常或降低。基因分析表明,PFIC2患者家族成员的ABCB11基因序列出现突变,引起其编码蛋白BSEP异常。到目前为止,发现了100多个错义(非同义)ABCB11基因的突变导致严重PFIC2。这些突变产生非功能性蛋白或导致没有蛋白质的产生,都与PFIC2相关。
由于许多ABCB11基因的突变影响BSEP的功能活性或表达,并且增强了药物诱导胆汁郁积的敏感性,因此从体外BSEP抑制结果预测胆汁郁积和药物诱导肝损伤非常困难[25-27]。应用免疫组化方法测定28例PFIC2病人的肝组织,发现其中16例病人肝细胞胆小管侧膜的BSEP表达为阴性,且均存在基因突变,病人胆汁中胆酸盐浓度小于正常的1%。应用熊脱氧胆酸进行治疗,不能恢复BSEP,且胆汁中不能检测到熊脱氧胆酸。与人类不同,小鼠BSEP基因突变后总胆汁酸盐含量降低4倍,血浆和肝脏胆汁酸盐则分别增高5.8倍和4倍。但其胆汁中可检测到人体罕见的四羟基胆汁酸,提示小鼠肝细胞胆小管侧膜可能存在替代转运途径,分泌四羟基胆汁酸来减轻对肝细胞的毒性。人体由于缺乏这种替代途径,导致病情进行性地加重。
有研究显示,BSEP的突变也可能参与胆固醇结石病的发生。Bsep突变小鼠肝脏分泌胆汁酸盐减少,而胆汁中胆固醇和磷脂的含量明显升高,这种改变可能达到易于成石的状态,使胆汁中胆固醇饱和度升高。
4.3 BSEP与肝癌的关系 胆汁分泌对于维持肝脏的正常生理代谢功能至关重要, 若胆汁形成或分泌出现问题, 将对肝脏造成炎症性的损伤,甚至产生致癌作用。Wang等[28]用基因敲除的小鼠来考察转运体与肝癌发生的关系,发现Bsep基因敲除小鼠肝癌的发病率极低,推测原因可能与Mdr1、Mrp3和Mrp4代偿性增多有关。BSEP功能缺陷可显著提高肝脏恶性肿瘤的发病率,有研究表明,15%的BSEP功能缺陷患者可发展为肝癌或胆管上皮癌[29-30]。
4.4 BSEP与药物诱导的肝损伤 药物诱导的肝损伤(drug-induced liver injury,DILI)在临床上很常见,严重的时候甚至不得不进行肝移植。由于BSEP是一个能量依赖性蛋白,负责胆汁酸从肝细胞的流出,可以认为当人服用同时使线粒体能量和BSEP功能活性损伤的药物时,能表现出比单一损伤更为严重的DILI的临床反应[28]。临床上药物导致肝损伤有30%的比例跟胆汁阻塞有关。例如,曲格列酮作为一种胰岛激素类药物因为其肝毒性而被撤出市场。有研究显示其肝毒性与胆汁淤积有关。曲格列酮和它的硫酸结合物(曲格列酮胆汁排泄的主要代谢物)竞争性抑制由BSEP介导的牛磺胆酸盐能量依赖性的转运。这种对胆盐泵出的抑制造成人肝中胆汁淤积,从而产生肝毒性。对大鼠进行实验,曲格列酮和其硫酸结合物均能抑制BSEP,Ki值分别为1.3和0.23 μmol·L-1。♂大鼠体内曲格列酮硫酸结合物的浓度比♀大鼠的浓度高(因为♂大鼠的磺酸转移酶活性较高),因而给予曲格列酮后♂大鼠将出现比♀大鼠更为严重的胆汁淤积。
5 总结与展望
BSEP在肝微管胆酸盐的分泌中起着决定性的作用,其病变和功能抑制与多种胆汁淤积症密切相关。BSEP转运体在正常的肝细胞中调节胆酸盐平衡,当BSEP活性受损后会造成胆汁淤积和药物诱导的肝毒性,这些充分表明体外评价BSEP与药物相互作用的重要性,因此对BSEP转运的评价方法成为研究的热点[28]。目前,很多公司已经将BSEP抑制剂合并入药物发现的筛选程序中,即用体外测定方法来评价药物或化学实体作为BSEP的底物或抑制剂的潜力。膜囊泡和基于肝细胞的BSEP测定是目前用于药物或药物候选物筛选的最主要的方法。相对于其它试验方法,BSEP膜囊泡测定相对容易实施,对于底物/抑制剂的测定和动力学分析也是确证有效的。采用这种方法可以研究由BSEP引起的药物相互作用,同时在药物发现过程中有利于大量化合物的的高通量筛选[28]。但是采用膜囊泡体系缺乏实验化合物的在体代谢,这有可能会影响BSEP抑制,因此当将测定结果外推到体内时有可能会造成误导。对BSEP结构功能、抑制剂及基因变异的详细研究方法可加深人们对胆汁形成机制的认识,开发出新的相关疾病治疗策略。
[1] Thomas C, Gioiello A, Noriega L, et al. TGR5-mediated bile acid sensing controls glucose homeostasis[J].CellMetab, 2009, 10(3): 167-77.
[2] Pols T. W, Nomura M, Harach T, et al. TGR5 activation inhibits atherosclerosis by reducing macrophage inflammation and lipid loading[J].CellMetab, 2011, 14(6): 747-57.
[3] Bernstein H, Bernstein C, Payne C M, Dvorak K. Bile acids as endogenous etiologic agents in gastrointestinal cancer[J].WorldJGastroenterol, 2009, 15(27): 3329-40.
[4] Kubitz R, Droge C, Stindt J, et al. The bile salt export pump(BSEP) in health and disease[J].CliniResHepatolGastroenterol, 2012, 36(6): 536-53.
[5] Lam P,Pearson C L,Soroka C J,et al.Levels of plasma membrane expression in progressive and benign mutations of the bile salt export pump(Bsep/Abcb11) correlate with severity of cholestatic diseases[J].AmJPhysiolCellPhysiol,2007,293(5):C1709-16.
[6] Chan W, Calderon G, Swift A L, et al. Myosin II regulatory light chain is required for trafficking of bile salt export protein to the apical membrane in Madin-Darby canine kidney cells[J].JBiolChem, 2005, 280(25): 23741-7.
[7] Fouassier L, Beaussier M, Schiffer E, et al. Hypoxia-induced changes in the expression of rat hepatobiliary transporter genes[J].AmJPhysiolGastrointestliverphysiol, 2007, 293(1): G25-35.
[8] Boaglio A C, Zucchetti A E, Sanchez Pozzi E J, et al. Phosphoinositide 3-kinase/protein kinase B signaling pathway is involved in estradiol 17beta-D-glucuronide-induced cholestasis: complementarity with classical protein kinase C[J].Hepatology(Baltimore,Md),2010,52(4):1465-76.
[9] Tirona R G. Molecular mechanisms of drug transporter regulation[J].HandbExpPharmacol,2011,201: 373-402.
[10]Weerachayaphorn J, Cai S Y, Soroka C J, Boyer J L. Nuclear factor erythroid 2-related factor 2 is a positive regulator of human bile salt export pump expression[J].Hepatology(Baltimore,Md), 2009, 50(5): 1588-96.
[11]Hirano M, Maeda K, Hayashi H, et al. Bile salt export pump(BSEP/ABCB11) can transport a nonbile acid substrate, pravastatin[J].JPharmacolExpTher, 2005, 314(2): 876-82.
[12]Bleibel W,Kim S,D′silva K,Lemtner E R.Drug-induced liver injury: review article[J].DigDisSci,2007,52(10):2463-71.
[13]Meier Y, Cavallaro M, Roos M, et al. Incidence of drug-induced liver injury in medical inpatients[J].EurJClinPharmacol, 2005, 61(2): 135-43.
[14]Fattinger K, Funk C, Pantze M, et al. The endothelin antagonist bosentan inhibits the canalicular bile salt export pump: a potential mechanism for hepatic adverse reactions[J].ClinPharmacolTher, 2001, 69(4): 223-31.
[15]Mano Y, Usui T, Kamimura H. Effects of bosentan, an endothelin receptor antagonist, on bile salt export pump and multidrug resistance-associated protein 2[J].BiopharmDrugDispos, 2007, 28(1): 13-8.
[16]Kis E, Ioja E, Nagy T, et al. Effect of membrane cholesterol on BSEP/Bsep activity: species specificity studies for substrates and inhibitors[J].DrugMetabDispos, 2009, 37(9): 1878-86.
[17]Horikawa M, Kato Y, Tyson C A, Sugiyama Y. Potential cholestatic activity of various therapeutic agents assessed by bile canalicular membrane vesicles isolated from rats and humans[J].DrugMetabPharmacokinet, 2003, 18(1): 16-22.
[18]Stieger B, Fattinger K, Madon J, et al. Drug-and estrogen-induced cholestasis through inhibition of the hepatocellular bile salt export pump(Bsep) of rat liver[J].Gastroenterology, 2000, 118(2): 422-30.
[19]Lang C, Meier Y, Stieger B, et al. Mutations and polymorphisms in the bile salt export pump and the multidrug resistance protein 3 associated with drug-induced liver injury[J].PharmacogenetGnomics, 2007, 17(1): 47-60.
[20]Bode K A, Donner M G, Leier I, Keppler D. Inhibition of transport across the hepatocyte canalicular membrane by the antibiotic fusidate[J].BiochemPharmacol, 2002, 64(1): 151-8.
[21]Kostrubsky S E, Strom S C, Kalgutkar A S, et al. Inhibition of hepatobiliary transport as a predictive method for clinical hepatotoxicity of nefazodone[J].ToxicolSci, 2006, 90(2): 451-9.
[22]Yabuuchi H, Tanaka K, Maeda M, et al. Cloning of the dog bile salt export pump(BSEP; ABCB11) and functional comparison with the human and rat proteins[J].BiopharmDrugDispos, 2008, 29(8): 441-8.
[23]Funk C, Ponelle C, Scheuermann G, Pantze M. Cholestatic potential of troglitazone as a possible factor contributing to troglitazone-induced hepatotoxicity:invivoandinvitrointeraction at the canalicular bile salt export pump(Bsep) in the rat[J].MolPharmacol, 2001, 59(3): 627-35.
[24]Alrefai W A, Gill R K. Bile acid transporters:structure, function, regulation and pathophysiological implications[J].PharmRes, 2007, 24(10): 1803-23.
[25]Maggiore G, Gonzales E, Sciveres M, et al. Relapsing features of bile salt export pump deficiency after liver transplantation in two patients with progressive familial intrahepatic cholestasis type 2[J].JHepatol, 2010, 53(5): 981-6.
[26]Evason K, Bove K E, Finegold M J, et al. Morphologic findings in progressive familial intrahepatic cholestasis 2(PFIC2): correlation with genetic and immunohistochemical studies[J].AmJSurgPathol, 2011, 35(5): 687-96.
[27]El-Guindi M A, Sira M M, Hussein M H, et al. Hepatic immunohistochemistry of bile transporters in progressive familial intrahepatic cholestasis[J].AnnHepatol, 2016, 15(2): 222-9.
[28]Wang R, Chen H L, Liu L, et al. Compensatory role of P-glycoproteins in knockout mice lacking the bile salt export pump[J].Hepatology, 2009, 50(3): 948-56.
[29]Pawlikowska L, Strautnieks S, Jankowska I, et al. Differences in presentation and progression between severe FIC1 and BSEP deficiencies[J].JHepatol, 2010, 53(1): 170-8.
[30]Strautnieks S S, Byrne J A, Pawlikowska L, et al. Severe bile salt export pump deficiency: 82 different ABCB11 mutations in 109 families[J].Gastroenterology, 2008, 134(4): 1203-14.
The research progress of bile acid efflux pump (BSEP)
ZHAO Jing, CHEN Man-yu, LI Lei
(CollegeofPharmacy,DalianMedicalUniversity,Dalian116044,China)
Bile acid efflux pump(BSEP) is the major transporter of bile salts secreted by liver cells into the bile, the variation and inhibition of which are connected with cholestasis and drug-induced liver injury. A deep understanding of the physiological and pathological function of BSEP IS achieved by analysis and summary of diseases. The paper briefly illustrates the structure, expression, regulation, substrates, inhibitors and diseases of BSEP, in order to provide further theoretical and experimental basis for the clinical treatment.
BSEP; cholestasis; inhibitor; regulation; bile acid; regulatory factor
时间:2016-12-27 16:13
http://www.cnki.net/kcms/detail/34.1086.R.20161227.1613.008.html
2016-08-21;
2016-11-08
国家自然科学基金资助项目(No 81202484)
赵 晶(1992-),女,硕士生,研究方向:药物传递系统,Tel: 0411-86110420, E-mail: zhaoj0109@163.com; 李 磊(1976-),女,博士,副教授,硕士生导师,研究方向:药物传递系统,通讯作者,Tel: 0411-86110420, E-mail:ll_wht@163.com
10.3969/j.issn.1001-1978.2017.01.004
A
1001-1978(2017)01-0018-05
R-05;R322.47;R394.2;R575;R735.7
