BCL6B对人结直肠癌LoVo细胞增殖和迁移的影响及机制
2017-01-19李爱芳李雪茹赵佳丽谢佳卿
谷 月, 李爱芳, 孙 晖, 李雪茹, 查 何, 赵佳丽, 谢佳卿, 周 兰
(重庆医科大学检验医学院,临床检验诊断学教育部重点实验室,重庆 400016)
BCL6B对人结直肠癌LoVo细胞增殖和迁移的影响及机制
谷 月, 李爱芳, 孙 晖, 李雪茹, 查 何, 赵佳丽, 谢佳卿, 周 兰△
(重庆医科大学检验医学院,临床检验诊断学教育部重点实验室,重庆 400016)
目的: 研究B细胞白血病/淋巴瘤6B(BCL6B)在人正常肠上皮细胞FHC及结直肠癌细胞LoVo中的表达水平及BCL6B对LoVo细胞增殖和迁移的影响,并探讨其相关分子机制。方法: 采用RT-PCR及Western blot检测FHC细胞和LoVo细胞中BCL6B的内源性表达;用脂质体法将重组质粒pcDNA3.1-BCL6B转入LoVo细胞,运用MTT、集落形成、细胞划痕及Transwell小室实验检测BCL6B对LoVo细胞增殖和迁移的影响,采用RT-PCR及Western blot检测细胞周期蛋白D1(cyclin D1)和基质金属蛋白酶9(MMP-9)的表达,Western blot检测蛋白激酶B(AKT)的磷酸化水平。结果: 与正常肠上皮细胞FHC相比,BCL6B在LoVo细胞中呈明显低表达;转染pcDNA3.1-BCL6B后的LoVo细胞内BCL6B水平显著增高。过表达BCL6B的实验组细胞72 h的增殖活性及划痕愈合力分别较对照组降低28.33%(P<0.01)和36.11%(P<0.05)。实验组细胞cyclin D1和MMP-9的mRNA水平分别降低39.90%(P<0.01)和77.36%(P<0.05),同时cyclin D1、MMP-9和磷酸化蛋白激酶B(p-AKT)的蛋白水平分别降低44.00%(P<0.05)、47.06%(P<0.01)和32.88%(P<0.05)。结论: BCL6B可抑制结直肠癌LoVo细胞的增殖和迁移,其机制可能涉及PI3K/AKT信号通路的抑制。
BCL6B; 结直肠癌; 细胞增殖; 细胞迁移; PI3K/AKT信号通路
结直肠癌作为消化道恶性肿瘤之一,其发病率和死亡率分别位居世界第3位和第4位[1]。在我国随着人口的老龄化及其它致癌因素的增加,结肠癌的发病率呈逐年上升趋势,形势十分严峻。现如今,外科手术和放化疗方案虽有进展,然而转移和复发仍是导致结直肠癌患者低生存率的主要因素。
研究表明,抑癌基因启动子区域的高甲基化所导致的表达下调或缺失在结肠癌的发生和发展中起重要作用。B细胞白血病/淋巴瘤6B(B-cell leukemia/lymphoma 6 member B,BCL6B)基因属于B细胞白血病/淋巴瘤6(B-cell leukemia/lymphoma 6,BCL6)超家族成员,其编码的蛋白与BCL6具高度同源性,发挥着与BCL6相似的转录抑制功能[2-4]。然而,目前关于BCL6B在肿瘤中的作用及机制的报道甚少。已有的研究提示,BCL6B因启动子区域高甲基化而导致的表达缺失存在于胃癌、肝癌及结直肠癌中,并且其启动子区甲基化程度与肿瘤的恶性程度及患者不良预后呈正相关关系[5-8]。在结直肠癌细胞系中,BCL6B因启动子区甲基化程度不一而呈现不同水平的表达;恢复结直肠癌细胞系中BCL6B的表达可激活P53信号通路而发挥肿瘤抑制作用[8]。
为进一步探讨BCL6B对肿瘤的作用及可能机制,本研究检测正常肠上皮细胞FHC及具有高转移潜能的结直肠癌细胞LoVo中BCL6B的表达水平,探讨BCL6B对结直肠癌细胞增殖及迁移侵袭的影响,并进一步探讨其相关分子机制。
材 料 和 方 法
1 细胞系和质粒
人正常肠上皮细胞FHC及人结直肠癌细胞LoVo购自美国模式培养物集存库(American type culture collection,ATCC);pcDNA3.1空载质粒和pcDNA3.1-BCL6B质粒由重庆医科大学附属第一医院表观遗传学实验室馈赠。
2 主要试剂和仪器
脂质体转染试剂Lipofectamine 2000购自Invitrogen;DMEM培养基、胎牛血清购自Gibco;TRIzol试剂购自Invitrogen;反转录试剂盒购自TaKaRa;引物由南京金斯瑞生物科技有限公司合成;蛋白质提取相关试剂购自上海碧云天生物技术研究所;兔抗人BCL6B、细胞周期蛋白D1(cyclin D1)、基质金属蛋白酶9(matrix metalloproteinase-9,MMP-9)、磷酸化蛋白激酶B(phosphorylated protein kinase B,p-AKT)和总蛋白激酶B(total protein kinase B,t-AKT)抗体均购自Santa Cruz;鼠抗人β-actin抗体购自Santa Cruz;山羊抗兔IgG/HRP标记购自Abgent;山羊抗鼠IgG/HRP 标记购自中杉金桥生物技术有限公司;MTT检测试剂购自凯基生物。
3 方法
3.1 细胞培养与质粒转染 用含10%胎牛血清的DMEM高糖培养基常规培养LoVo细胞。实验分为对照组(control组,转染空载体pcDNA3.1质粒)和实验组(pcDNA3.1-BCL6B组,转染pcDNA3.1-BCL6B重组质粒)。以每孔2×105个的密度接种LoVo细胞至6孔板中,置于37 ℃、5%CO2的条件下培养,待贴壁细胞融合度约为70%时进行转染。转染流程参照Lipofectamine 2000说明书,每孔转染质粒4 μg;于转染后24 h或48 h收集细胞进行后续实验。
3.2 RT-PCR 转染后48 h收集细胞,用TRIzol法提取细胞总RNA,取800 ng总RNA在10 μL反应体系中反转录生成cDNA。以cDNA为模板进行PCR反应,检测细胞中目的基因和内参照基因的转录水平。GAPDH的上游引物序列为5’-CAGCGACACCCACTCCTC-3’,下游引物序列为5’-TGAGGTCCACCACCCTGT-3’;BCL6B的上游引物序列为5’-AAGCCGTATAAGTGTGAGACG-3’,下游引物序列为5’-AGAATGTGGTAGTGCAC-3’;cyclin D1的上游引物序列为5’-CTGGCCATGAACTACCTGGA-3’,下游引物序列为5’-GTCACACTTGATCACTCTGG-3’;MMP-9的上游引物序列为5’-CCTGGAGCCTGAGAACCAATC-3’,下游引物序列为5’-CCACCCGAGTGTAACCATGGC-3’。PCR 反应条件为:95 ℃ 5 min; 94 ℃ 30 s, 63 ℃~54 ℃ 30 s,9个循环(每个循环依次降低1 ℃),72 ℃ 30 s; 94 ℃ 30 s, 55 ℃ 30 s, 72 ℃ 30 s, 20~26个循环;最后72 ℃ 10 min。产物经琼脂糖凝胶电泳,凝胶成像仪采集图像,Quantity One软件分析条带灰度值,计算目的基因与内参照的比值。
3.3 Western blot法 转染48 h后,收集细胞,按照蛋白提取试剂盒说明书提取细胞总蛋白,分光光度仪测定其浓度。蛋白质煮沸10 min充分变性,经10% SDS-聚丙烯酰胺凝胶电泳后,湿转法转移至聚偏二氟乙烯(polyvinylidene difluoride,PVDF)膜,5% BSA封闭2 h,Ⅰ抗分别为鼠抗人β-actin(1∶3 000稀释)、兔抗人BCL6B(1∶3 000稀释)、兔抗人cyclin D1(1∶1 000稀释)和兔抗人MMP-9(1∶1 000稀释),4 ℃孵育过夜,TBST洗膜后加Ⅱ抗(1∶5 000稀释),37 ℃孵育1 h,PVDF膜上滴加化学发光显色液,Gel Doc凝胶成像仪上观察结果,采集图像,Quantity One软件分析条带的灰度值,计算目的蛋白与内参照的比值。
3.4 MTT比色法 收集转染12 h后的细胞,调整细胞密度,分别接种于96孔板中,每组设5个复孔,每孔接种3×103个细胞,分别于接种后24 h、48 h、72 h和96 h时向每孔细胞中加500 mg/L MTT试剂10 μL,置于37 ℃、5% CO2培养箱中继续培养4 h后,弃去上清培养基,加入200 μL DMSO,避光振荡10 min,于光吸收酶标仪上检测492 nm处吸光度(A)值。将5个复孔的平均值设为该组的A值,实验重复3次。
3.5 平板集落形成实验 细胞接种及转染24 h后,分别取800个对照组和实验组细胞接种于6孔板中,每组设3个复孔,置于37 ℃、5% CO2细胞培养箱中培养2周左右,吸弃各孔培养基,PBS漂洗2次,每孔加500 μL甲醇溶液室温下固定15 min,弃去固定液,然后每孔加1 mL结晶紫染液,避光条件下染色20 min,自来水冲洗后晾干,计算集落数。使用酶联斑点图像自动分析仪扫描拍照;按照“集落形成率(%)=集落数/接种细胞数×100%”的公式,计算集落形成率。
3.6 细胞划痕愈合实验 收集转染后的各组细胞接种于6孔板中,于37 ℃、5% CO2条件下常规培养,待细胞融合度达到90%时,用10 μL无菌枪头在培养板中划线,用力均匀、勿倾斜;PBS轻轻洗涤细胞2次;每孔加入无血清培养基2 mL,分别于划痕后0 h、24 h、48 h和72 h拍照,获取各组细胞同一部位不同时点的划痕宽度,根据“划痕愈合率(%)=(0 h划痕宽度-X h划痕宽度)/0 h划痕宽度×100%”的公式,计算相应时点细胞划痕愈合率。
3.7 细胞侵袭实验 采用Transwell小室进行检测。基质胶与无血清培养基1∶5混合,各小室加32 μL稀释后的基质胶,置37 ℃培养箱5 h。将上室(Transwell小室)放入下室(24孔板)中,收集各组细胞,制成单细胞悬液,每个上室加300 μL完全培养基含1×105个肿瘤细胞,下室加700 μL含20%胎牛血清的DMEM培养基;每组设3个复孔。于37 ℃、5% CO2孵育24 h后,取出小室,PBS洗2次,用棉签拭去上室细胞及清除基质胶,4%多聚甲醛固定15 min,0.1%结晶紫染色20 min,PBS清洗,晾干后于倒置显微镜下计数穿膜细胞数。
4 统计学处理
采用SPSS 17.0软件进行统计学分析。实验数据以均数±标准差(mean±SD)表示。两组间比较采用Student’st检验。多组间均数比较采用单因素方差分析,进一步采用Bonferroni校正的t检验进行组内两两比较。以P<0.05为差异具有统计学意义。
结 果
1 BCL6B在正常肠上皮细胞FHC和结直肠癌细胞LoVo中的内源性表达及BCL6B重组质粒转染效率的检测
提取常规培养的FHC细胞和LoVo细胞的总RNA及总蛋白进行RT-PCR和Western blot实验,结果显示,FHC细胞和LoVo细胞BCL6B mRNA的校正灰度值依次为1.82±0.64和0.03±0.04,BCL6B蛋白的校正灰度值分别为1.36±0.20和0.02±0.03,即BCL6B在结直肠癌细胞LoVo中呈明显低表达状态,见图1A。重组质粒pcDNA3.1-BCL6B转染LoVo细胞48 h后,与转入空载体组相比,BCL6B的mRNA及蛋白水平分别增加至8.84倍(P<0.01)和6.57倍(P<0.05),说明转染效率较高,见图1B。
2 BCL6B对LoVo细胞增殖的影响
对照组在24 h、48 h、72 h和96 h的A值分别为0.27±0.02、0.42±0.03、0.62±0.04和0.81±0.07,实验组A值则分别为0.26±0.02、0.31±0.02、0.41±0.03和0.48±0.05,实验组各时点均低于对照组,其中72 h和96 h时的差异有统计学显著性(分别P<0.01和P<0.05),提示BCL6B抑制LoVo细胞的存活能力,见图2A。
实验组细胞集落形成率为(2.43±2.12)%,对照组为(19.64±3.21)%,实验组低于对照组,差异有统计学显著性(P<0.05),说明BCL6B抑制LoVo细胞的集落形成能力,见图2B。
3 BCL6B对LoVo细胞迁移和侵袭能力的影响
划痕实验结果显示,24 h时2组细胞迁移能力的差异无统计学显著性;48 h时实验组LoVo细胞的划痕愈合率为(28.21±4.06)%,显著低于对照组的(50.72±4.89)%,差异有统计学意义(P<0.01);72 h时,实验组细胞划痕愈合率为(52.01±5.11)%,显著低于对照组的(81.41±2.80)%,差异有统计学意义(P<0.05),见图3A。

Figure 1.The endogenous BCL6B expression in the FHC cells and LoVo cells (A), and the expression of BCL6B in the LoVo cells after transfected with pcDNA3.1-BCL6B for 48 h (B) detected by RT-PCR and Western blot. Mean±SD.n=3.##P<0.01vsFHC;*P<0.05,**P<0.01vscontrol group.
图1 BCL6B在FHC细胞和LoVo细胞中的内源性表达及LoVo细胞中BCL6B转染效率的检测
Transwell实验的结果显示,实验组和对照组LoVo细胞的穿膜细胞数分别为(48±24)个和(192±31)个,差异有统计学意义(P<0.05),见图3B。上述结果说明BCL6B能抑制LoVo细胞的迁移和侵袭能力。
4 BCL6B对LoVo细胞中cyclin D1和MMP-9 mRNA表达的影响
BCL6B重组质粒转染LoVo细胞48 h后行RT-PCR,结果如图4所示。对照组cyclin D1 mRNA校正灰度值为1.93±0.08,实验组为1.16±0.05,差异有统计学意义(P<0.01);对照组MMP-9 mRNA校正灰度值为0.89±0.12,实验组为0.27±0.07,差异有统计学意义(P<0.05),提示BCL6B下调这2种基因的转录。
5 BCL6B对LoVo细胞中cyclin D1、MMP-9、t-AKT和p-AKT蛋白水平的影响
BCL6B重组质粒转染LoVo细胞48 h后的Western blot实验检测结果见图5。对照组cyclin D1蛋白的校正灰度值为1.00±0.05,实验组为0.56±0.06,差异有统计学意义(P<0.05);对照组MMP-9蛋白的校正灰度值为0.89±0.05,实验组为0.45±0.04,差异有统计学意义(P<0.01);对照组t-AKT蛋白的校正灰度值为0.84±0.05,实验组为0.90±0.09,差异无统计学显著性;对照组p-AKT蛋白的校正灰度值为0.73±0.03,实验组为0.39±0.06,差异有统计学意义(P<0.05),提示BCL6B可下调肿瘤细胞中增殖和迁移相关蛋白的表达,且能抑制AKT的磷酸化。

Figure 2.The MTT assay (A) and colony formation assay (B) to measure the effect of BCL6B on the proliferation of the LoVo cells. Mean±SD.n=3.*P<0.05,**P<0.01vscontrol group.
图2 MTT实验和集落形成实验检测BCL6B对LoVo细胞增殖的影响
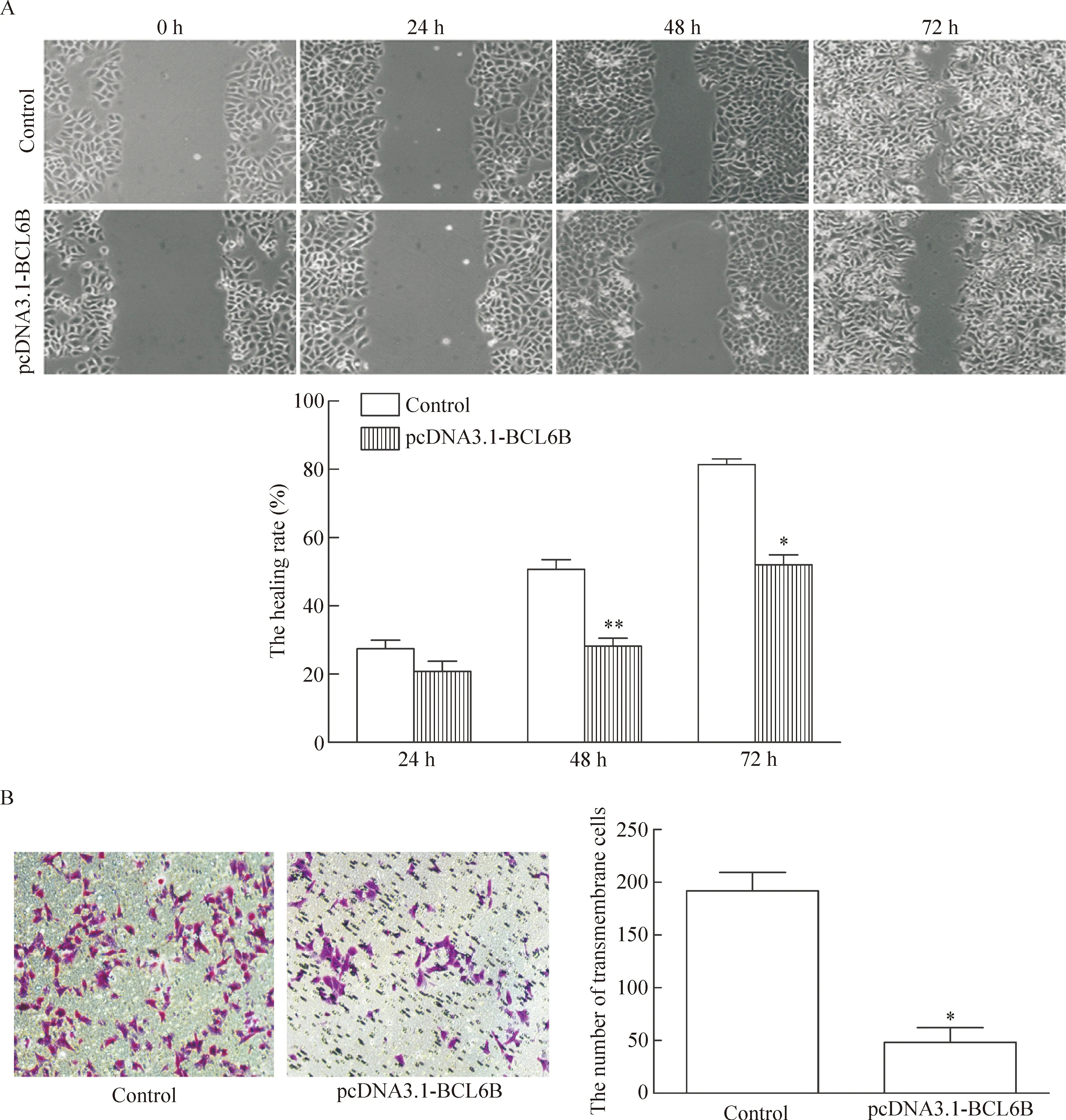
Figure 3.The effect of BCL6B on the migration (A, wound healing assay) and invasion (B, Transwell chamber experiment) of the LoVo cells. Mean±SD.n=3.*P<0.05,**P<0.01vscontrol group.
图3 细胞划痕和Transwell小室实验检测BCL6B对LoVo细胞迁移和侵袭的影响

Figure 4.The effect of BCL6B on the mRNA expression of cyclin D1 and MMP-9 in LoVo cells detected by RT-PCR. Mean±SD.n=3.*P<0.05,**P<0.01vscontrol group.
图4 RT-PCR检测BCL6B对LoVo细胞中cyclin D1和MMP-9 mRNA表达的影响
6 PI3K/AKT 信号通路对BCL6B引起的肿瘤相关蛋白表达变化的影响
将pcDNA3.1-BCL6B重组质粒及PI3K/AKT信号通路抑制剂LY294002共同处理LoVo细胞48 h后,Western blot实验结果显示cyclin D1、MMP-9和 p-AKT的蛋白水平明显低于未用抑制剂处理的对照组和单独用抑制剂处理组,差异有统计学意义(P<0.05),见图6。这一结果提示PI3K/AKT信号通路的抑制可能参与介导BCL6B对该细胞增殖和迁移的抑制。
讨 论
BCL6B基因又称作BAZF、ZBTB28及ZNF62,位于人17号染色体1区3带1亚带[2]。文献报道BCL6B广泛表达于人体正常组织,然而在很多肿瘤中存在不同位点的突变或缺失[9],提示BCL6B可能为抑癌基因。同时研究发现BCL6B启动子区域在肿瘤中普遍甲基化[10]。而目前关于BCL6B在肿瘤中的作用及机制的报道甚少。
本研究发现BCL6B在人正常肠上皮细胞FHC中高表达,在人结直肠癌细胞LoVo中呈明显低表达。且Western blot实验证实,瞬时转染重组质粒pcDNA3.1-BCL6B可使LoVo细胞内BCL6B成功过表达。本研究中,MTT和集落形成实验结果显示BCL6B能有效抑制LoVo细胞的增殖活性;细胞划痕及Transwell实验结果表明BCL6B能显著抑制癌细胞迁移和侵袭能力。这与2015年Hu等[8]报道的BCL6B对结直肠癌的抑制性作用是一致的。同时我们发现,BCL6B可下调 LoVo细胞中cyclin D1和MMP-9的mRNA和蛋白水平。Cyclin D1是细胞周期的重要调控者,可与细胞周期蛋白依赖性激酶4/6(cyclin-dependent kinases 4/6,CDK4/6)形成特异性的复合物,促进细胞周期由G1期进入S期[11-12]。MMP-9为基质金属蛋白酶家族重要成员之一,其主要功能是降解IV型胶原,在肿瘤细胞突破基底膜屏障发生浸润和远处转移过程中扮演重要角色[13-14]。进一步表明BCL6B抑癌功能的发挥可能与细胞周期阻滞和肿瘤细胞迁移侵袭能力减弱有关。
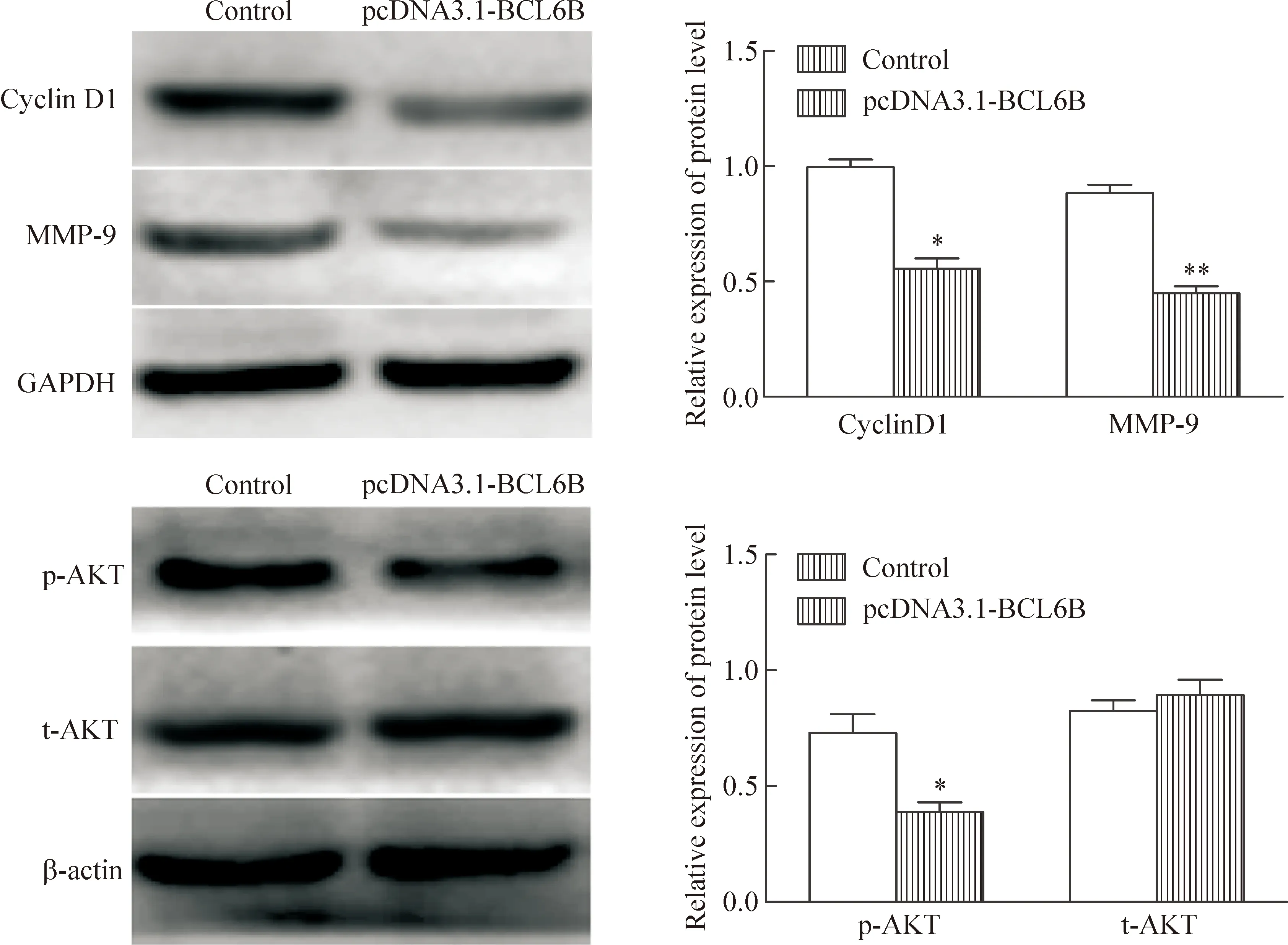
Figure 5.The effect of BCL6B on the protein levels of cyclin D1 and MMP-9 and the phosphorylation level of the AKT in LoVo cells detected by Western blot. Mean±SD.n=3.*P<0.05,**P<0.01vscontrol group.
图5 Western blot实验检测BCL6B对LoVo细胞中cyclin D1和MMP-9蛋白水平及对AKT磷酸化的影响

Figure 6.The effects of PI3K/AKT inhibitor LY294002 on the protein levels of cyclin D1, MMP-9 and p-AKT in the LoVo cells induced by BCL6B detected by Western blot. Mean±SD.n=3.*P<0.05vsDMSO group;#P<0.05vsLY294002 group;△P<0.05vsBCL6B+DMSO group.
图6 Western blot实验检测PI3K/AKT通路抑制剂LY294002对BCL6B引起的cyclin D1、MMP-9及p-AKT蛋白水平变化的影响
PI3K/AKT信号通路在结直肠癌的发生发展中发挥重要作用,其活化可促进癌细胞增殖,同时参与了结直肠癌的侵袭和转移过程[15]。文献报道,激活PI3K/AKT信号通路可增加cyclin D1表达,促进细胞周期;抑制该通路活性可抑制cyclin D1和CDK4的表达,同时可诱导细胞周期依赖性蛋白激酶抑制因子1A的表达,从而阻碍细胞周期进展[16]。结直肠癌的侵袭和转移是影响其预后的重要因素,细胞外间质降解是肿瘤侵袭和转移的重要步骤。Thant等[17]研究表明用PI3K抑制剂LY294002处理卵巢癌细胞,能强烈地抑制癌细胞中依赖纤连蛋白的MMP-9的分泌。同时,Ruhul等[18]研究发现AKT阴性表达体或LY294002均能抑制IL-1β依赖的MMP-9的分泌。另有文献报道在C6神经胶质细胞瘤细胞株中,LY294002能显著减少p-AKT介导的MMP-9的表达,从而减弱肿瘤细胞侵袭性[19]。Kim等[20]和Chen等[21]的研究表明MMP-9表达的增加是通过AKT活化NF-κB的转录活性介导的。本课题研究结果显示,BCL6B可下调LoVo细胞中AKT磷酸化水平,且用PI3K/AKT通路抑制剂LY294002处理细胞,能增加BCL6B引起的cyclin D1、MMP-9和p-AKT蛋白的下调趋势,提示BCL6B对结直肠癌LoVo细胞的抑制作用涉及PI3K/AKT通路活性的降低。本结果为BCL6B对结直肠癌的影响及机制的研究提供了实验依据,为我们下一步的研究提供了新的线索。
[1] 李道娟, 李 倩, 贺宇彤. 结直肠癌流行病学趋势[J]. 肿瘤防治研究, 2015, 42(3):305- 310.
[2] Okabe S, Fukuda T, Ishibashi K, et al. BAZF, a novel Bcl6 homolog, functions as a transcriptional repressor[J]. Mol Cell Biol, 1998, 18(7):4235-4244.
[3] Zhang H, Okada S, Hatano M, et al. A new functional domain of Bcl6 family that recruits histone deacetylases[J]. Biochim Biophys Acta, 2001, 1540(3):188-200.
[4] Sakashita C, Fukuda T, Okabe S, et al. Cloning and characterization of the humanBAZFgene,a homologue of theBCL6 oncogene[J]. Biochem Biophys Res Commun, 2002, 291(3):567-573.
[5] Xu L, Li X, Chu ES, et al. Epigenetic inactivation ofBCL6B, a novel functional tumor suppressor for gastric cancer, is associated with poor survival[J]. Gut, 2012, 61(7):977-985.
[6] Yang Q, Gao J, Xu L, et al. Promoter hypermethylation ofBCL6Bgene is a potential plasma DNA biomarker for gastric cancer[J]. Biomarkers, 2013, 18(8):721-725.
[7] Wang J, Dong L, Xu L, et al. B cell CLL/lymphoma 6 member B inhibits hepatocellular carcinoma metastasesinvitroand in mice[J]. Cancer Lett, 2014, 355(2):192-200.
[8] Hu S, Cao BP, Zhang M, et al. Epigenetic silencing BCL6B induced colorectal cancer proliferation and metastasis by inhibiting P53 signaling[J]. Am J Cancer Res, 2015, 5(2):651-662.
[9] Greipp PT, Smoley SA, Viswanatha DS, et al. Patients with chronic lymphocytic leukaemia and clonal deletion of both 17p13.1 and 11q22.3 have a very poor prognosis[J]. Br J Haematol, 2013, 163(3):326-333.
[10]Ying J, Srivastava G, Hsieh WS, et al. The stress-responsive geneGADD45Gis a functional tumor suppressor, with its response to environmental stresses frequently disrupted epigenetically in multiple tumors[J]. Clin Cancer Res, 2005, 11(18):6442- 6449.
[11]Bartek J, Lukas J. Pathways governing G1/S transition and their response to DNA damage[J].FEBS Lett, 2001, 490(3):117-122.
[12]Viallard JF, Lacombe F, Belloc F, et al. Molecular mechanisms controlling the cell cycle: fundamental aspects and implications for oncology[J]. Cancer Radiother, 2001, 5(2):109-129.
[13]高 颖, 蔡定芳. 基质金属蛋白酶-9与炎症反应研究进展[J]. 中国病理生理杂志, 2003, 19(8):1133-1136.
[14]Zeng ZS, Cohen AM, Guillem JG. Loss of basement membrane type IV collagen is associated with increased expression of metalloproteinases 2 and 9(MMP-2 and MMP-9)during human colorectal tumorigenesis[J].Carcinogenesis, 1999, 20(5):749-755.
[15]Pandurangan AK. Potential targets for prevention of colorectal cancer: a focus on PI3K/Akt/mTOR and Wnt pathways[J].Asian Pac J Cancer Prev, 2013, 14(4):2201- 2205.
[16]Wang L, Cao XX, Chen Q, et al. DIXDC1 targets p21 and cyclin D1 via PI3K pathway activation to promote colon cancer cell proliferation[J]. Cancer Sci, 2009, 100(10):1801-1808.
[17]Thant AA, Nawa A, Kikkawa F, et al. Fibronectin activates matrix metalloproteinase-9 secretion via the MEK1-MAPK and the PI3K-Akt pathways in ovarian cancer cells[J]. Clin Exp Metastasis, 2000, 18(5):423-428.
[18]Ruhul Amin AR, Senga T, Oo ML, et al. Secretion of matrix metalloproteinase-9 by the proinflammatory cytokine, IL-1β: a role for the dual signalling pathways, Akt and Erk [J]. Genes Cells, 2003, 8(6):515-523.
[19]Kubiatowski T, Jang T, Lachyankar MB, et al. Association of increase phosphatidylinositol 3-kinase signaling with increased invasiveness and gelatinase activity in malignant gliomas[J]. J Neurosurg, 2001, 95(3):480-488.
[20]Kim D, Kim S, Koh H, et al. Akt/PKB promotes cancer cell invasion via increased motility and metalloproteinase production[J]. FASEB J, 2001, 15(11):1953-1962.
[21]Chen S, Chen W, Zhang X, et al. Over-expression of KiSS-1 reduces colorectal cancer cell invasion by down-regulating MMP-9 via blocking PI3K/Akt/NF-κB signal pathway [J]. Int J Oncol, 2016, 48(4):1391-1398.
(责任编辑: 林白霜, 罗 森)
Effects of BCL6B on proliferation and migration of human colorectal carcinoma LoVo cells and its potential mechanism
GU Yue, LI Ai-fang, SUN Hui, LI Xue-ru, ZHA He, ZHAO Jia-li, XIE Jia-qing, ZHOU Lan
(KeyLaboratoryofLaboratoryMedicalDiagnosticsofMinistryofEducation,SchoolofLaboratoryMedicine,ChongqingMedicalUniversity,Chongqing400016,China.E-mail:zhoulan0111@foxmail.com)
AIM: To detect the endogenous expression of B-cell leukemia/lymphoma 6 member B (BCL6B) in FHC and LoVo cells, and to investigate the effects of BCL6B on proliferation and migration of LoVo cells for further exploring the underlying mechanism. METHODS: The endogenous expression of BCL6B in the FHC and LoVo cells was detected by RT-PCR and Western blot. The methods of MTT assay, colony formation assay, wound healing assay and Transwell chamber experiment were employed to examine the biological functions of BCL6B in the LoVo cells. The mRNA and protein levels of BCL6B, cyclin D1 and matrix metalloproteinase-9 (MMP-9) were determined by RT-PCR and Western blot, respectively. The level of phosphorylated protein kinase B (p-AKT) was detected by Western blot. RESULTS: BCL6B expression was notably repressed in the LoVo cells as compared with the FHC cells, which were significantly increased by transfection with pcDNA3.1-BCL6B. The abilities of proliferation and migration of the LoVo cells at 72 h were inhibited by 28.33%(P<0.01) and 36.11%(P<0.05) in BCL6B group. The mRNA levels of cyclin D1 and MMP-9 in the cells of BCL6B group were decreased by 39.90%(P<0.01) and 77.36% (P<0.05), and the protein levels of cyclin D1, MMP-9 and p-AKT were reduced by 44.00%(P<0.05), 47.06%(P<0.01) and 32.88% (P<0.05), respectively. CONCLUSION: BCL6B inhibits proliferation and migration of the LoVo cells, and the PI3K/AKT signaling pathway is involved in this process.
BCL6B; Colorectal cancer; Cell proliferation; Cell migration; PI3K/AKT signaling pathway
1000- 4718(2017)01- 0038- 08
2016- 08- 30
2016- 10- 27
R730.23
A
10.3969/j.issn.1000- 4718.2017.01.007
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 023-68485240; E-mail: zhoulan0111@foxmail.com
